Значение факторов прогноза при проведении термохимиолучевой терапии глиобластом головного мозга
Автор: Рябова Анастасия Игоревна, Новиков Валерий Александрович, Грибова Ольга Вячеславовна, Старцева Жанна Александровна, Григорьев Евгений Геннадьевич, Глущенко Светлана Алексеевна, Пономарева Анастасия Алексеевна, Сыркашев Владимир Анатольевич
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Клинические исследования
Статья в выпуске: 5 т.17, 2018 года.
Бесплатный доступ
Лечение глиобластом головного мозга является актуальной проблемой, поскольку сопровождается высокой инвалидизацией и низкой выживаемостью. Стандартная комбинированная терапия не позволяет излечить пациента, и в настоящее время ведется постоянный поиск новых методов лечения. материал и методы. В условиях НИИ онкологии ТНИМЦ РАН выполнено исследование, включившее 30 пациентов с впервые выявленной глиобластомой головного мозга, которым проводилось комбинированное лечение по схеме: адъювантный курс химиолучевой терапии с темозоломидом с радиосенсибилизацией локальной гипертермией. Результаты. Проведенное лечение позволило добиться высоких показателей безрецидивной и общей выживаемости - медиана составила 9,6 мес и 23 мес соответственно. Анализ полученных результатов в зависимости от клинических факторов прогноза, факторов прогноза, связанных с лечением, и молекулярно-генетических факторов показал статистически значимые результаты только при оценке сроков начала адъювантной терапии после оперативного вмешательства. Безрецидивная выживаемость пациентов, начавших курс химиолучевой терапии с радиосенсибилизацией локальной гипертермией через 6 нед и более после проведенного оперативного вмешательства, статистически значимо выше, чем у пациентов, которым адъювантное лечение начато ранее. Общая выживаемость была статистически выше только в случае специализированного лечения рецидива опухоли по сравнению с симптоматической терапией. Оценка молекулярно-генетических факторов прогноза не показала увеличения статистически значимых различий в выживаемости у пациентов с метилированным и неметилированным промотором MGMT. Наличие IDH1 мутации было выявлено только в одном случае. Исследование клинических, молекулярно-генетических факторов и факторов прогноза, связанных с лечением, не позволило выявить факторы, позволяющие персонифицировать терапию. В свою очередь, высокие показатели безрецидивной выживаемости, в том числе у пациентов с отсутствием метилирования MGMT, позволяют рекомендовать радиосенсибилизацию локальной гипертермией для лечения пациентов с впервые выявленными ГБ головного мозга.
Глиобластома, факторы прогноза, термохимиолучевая терапия, локальная гипертермия, транскраниальная гипертермия, радиосенсибилизация
Короткий адрес: https://sciup.org/140254210
IDR: 140254210 | УДК: 616-006.484-08-037:615.849.1:615.28 | DOI: 10.21294/1814-4861-2018-17-5-27-36
Текст научной статьи Значение факторов прогноза при проведении термохимиолучевой терапии глиобластом головного мозга
Глиобластома (ГБ) является наиболее частой и агрессивной первичной злокачественной опу‑ холью головного мозга с фатальным прогнозом. Медиана общей выживаемости (ОВ) пациентов не превышает двух лет, несмотря на интенсивное комбинированное лечение, включающее оператив‑ ное вмешательство, адъювантную химиолучевую терапию (ХЛТ) с последующими курсами химио‑ терапии (ХТ) [1, 2]. По данным популяционных исследований, общая двухлетняя выживаемость составляет 15 %, а пятилетняя – варьирует от 0,05 до 5,5 % [3, 4].
Факторы, влияющие на прогноз пациентов с ГБ, разделяют на несколько групп: связанные с паци‑ ентом (клинические), связанные с лечением и свя‑ занные с опухолью (молекулярно‑генетические). Среди клинических факторов прогноза наиболь‑ шее значение имеют: возраст пациента при по‑ становке диагноза и функциональный статус. К факторам прогноза, связанным с лечением, относят объем проведенного оперативного вмешательства, сроки начала адъювантной терапии и ее характер [3, 5, 6]. Наибольшее значение среди молекулярно‑ генетических факторов прогноза имеют: мутация в гене, кодирующем изоцитратдегидрогеназу (IDH1/2), и метилирование промотора гена O6‑ метилгуанин‑ДНК‑метилтрансферазы (MGMT) [3, 4, 7, 8].
Несмотря на успехи, достигнутые в диагностике и лечении в последние десятилетия, выживаемость пациентов с ГБ значительно не улучшилась. Иссле‑ дования локальной гипертермии (ЛГ) в онкологии, начавшиеся еще в начале XX века, показали, что ЛГ является идеальным радиосенсибилизатором [9, 10]. Клинические исследования пациентов со злокачественными глиомами обнаружили увели‑ чение показателей выживаемости при проведении адъювантной лучевой терапии (ЛТ) на фоне ЛГ [11–13]. Однако в настоящее время не опреде‑ лены факторы, которые могут прогнозировать чувствительность опухоли к термохимиолучевой терапии (ТХЛТ) и позволить персонифицировать лечение.
Цель исследования – оценка влияния про‑ гностических факторов на отдаленные результаты ТХЛТ больных с впервые выявленной ГБ голов‑ ного мозга.
Материал и методы
В исследование было включено 30 пациентов с впервые диагностированной ГБ головного мозга. В условиях НИИ онкологии ТНИМЦ РАН больные получили курс адъювантной ХЛТ с темозоломидом на фоне ЛГ в 2013–17 гг. На первом этапе комби‑ нированного лечения всем пациентам выполнялось оперативное вмешательство в объеме парциаль‑ ной или тотальной резекции опухоли (удаление более чем 90 % опухоли) [14]. Оценка степени резекции опухоли осуществлялась на основании данных послеоперационной МРТ головного мозга с контрастированием.
При гистологическом исследовании операци‑ онного материала глиобластома верифицирована во всех случаях на основании микроскопического и иммуногистохимического исследований. Диа‑ гноз формулировался в соответствии с патомор‑ фологической классификацией ВОЗ опухолей ЦНС 2016 г. [15]. Иммуногистохимическое ис‑ следование выполнялось при помощи непрямого метода на опухолевой ткани из парафиновых блоков. В обязательном порядке выполнялось ис‑ следование с антителом Anti‑Human IDH1 R132H. Статус метилирования промотора гена MGMT исследовался с использованием количественной метил‑специфичной полимеразной цепной реак‑ ции в режиме реального времени на материале, выделенном из парафиновых блоков.
Всем пациентам проведен курс дистанционной гамма‑терапии до СОД 60 Гр на фоне 2 курсов химиотерапии темозоломидом в разовой дозе 200 мг/м2 в режиме 5/28. Лучевая терапия прово‑ дилась на аппарате Theratron Equinox 1,25 МэВ в стандартном режиме фракционирования дозы. Со 2‑й нед ЛТ пациенты получали сеансы радио‑ сенсибилизации локальной транскраниальной радиочастотной гипертермией 2 раза в неделю (10 сеансов на курс лечения), продолжительностью до 60 мин. Интервал между сеансами ЛГ и ЛТ состав‑ лял 20–40 мин. ЛГ проводилась на системе для глу‑ бокой высокочастотной гипертермии с емкостным сопряжением Celsius TCS (частота 13,56 МГц). Нагревание производилось постепенно путем пошагового повышения мощности, ориенти‑ руясь на переносимость процедуры пациентом в соответствии с протоколом, рекомендуемым производителем приборов. Для предотвращения термических ожогов кожи и подкожной клетчатки в месте приложения электродов поверхность по‑ следних во время сеанса охлаждалась циркуляцией деионизированной воды с температурой 12–16°С. После завершения курса ТХЛТ пациенты получи‑ ли еще 4–6 курсов химиотерапии темозоломидом в разовой дозе 200 мг/м2 в режиме 5/28.
Оценка функционального статуса до адъювант‑ ной терапии проводилась с применением шкалы Карновского. Динамическое наблюдение осущест‑ влялось с использованием контрольных МРТ го‑ ловного мозга с внутривенным контрастированием через месяц после завершения ТХЛТ, затем через 3 мес в течение двух лет и впоследствии через 6–12 мес. В случае ухудшения неврологического статуса пациентам выполнялась внеочередная МРТ головного мозга. Результаты МРТ оценивались с применением критериев оценки ответа в нейро‑ онкологии (Response Assessment in Neurooncology criteria, RANO) [16].
Статистическая обработка данных проводилась с помощью компьютерной программы Statistica 10.0 (StatSoft). Для определения нормальности распределения количественных признаков исполь‑ зовался W‑критерий Шапиро – Уилка, заключение о нормальности распределения анализируемого признака делалось при р>0,05. Описание количе‑ ственных данных, не подчиняющихся нормаль‑ ному закону распределения, проводилось при помощи медианы и квартилей. Показатели выжи‑ ваемости и статистическая значимость факторов прогноза оценивались с использованием модуля Survival analysis программы Statistica 10.0. Кривые кумулятивной выживаемости строились по методу Каплана – Майера, значимость различий в вы‑ живаемости в зависимости от факторов прогноза оценивалась с применением log‑rank теста.
Исследование выполнено с соблюдением прин‑ ципов добровольности и конфиденциальности в соответствии с «Основами законодательства РФ об охране здоровья граждан» (Указ Президента РФ от 24.12.93 № 2288) на основании разрешения локаль‑ ного комитета по биомедицинской этике ФГБНУ «НИИ онкологии Томского НИМЦ». Пациенты, включенные в исследование, ранее не получали специализированного лечения. Больные с тяже‑ лыми сопутствующими заболеваниями в стадии декомпенсации из исследования исключены.
Результаты
Наиболее значимыми критериями оценки эф‑ фективности адъювантной терапии у больных ГБ головного мозга являются общая выживаемость (ОВ) и сроки возникновения рецидивов. В про‑ веденном исследовании продолжительность ди‑ намического наблюдения за пациентами составила 4–51 мес, медиана наблюдения – 12 мес (ДИ 95 % 8,5–23 мес). За этот период рецидивы зарегистри‑ рованы у 21 (70 %) пациента, в сроки от 2 до 34 мес после верификации заболевания. Медиана безреци‑ дивной выживаемости (БРВ) составила 9,6 мес (ДИ 95 % 7,2–18,2 мес). Цензурирование осуществля‑ лось в сроки от 4 до 51 мес и в двух случаях было обусловлено смертью пациентов от осложнений лечения без признаков прогрессирования в сроки 4 и 8 мес после установки диагноза. В остальных случаях цензурирование было обусловлено за‑ вершением клинического исследования. Медиана цензурирования при оценке БРВ составила 7,5 мес (ДИ 95 % 6,0–11,5 мес).
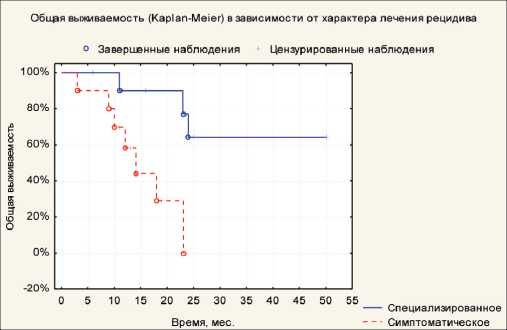
Рис. 1. Показатели общей выживаемости в зависимости от метода лечения рецидива
При выявлении рецидива специальное лечение получили 11 (52,4 %) пациентов. В этих случаях проводилась химиотерапия: бевацизумаб получили 4, ломустин – 3, повторный курс темозоломида – 2 пациента, по одному случаю – полихимиотерапия по схемам PCV и EP. В 4 случаях предварительно выполнялось оперативное вмешательство, в двух случаях операция с последующим повторным курсом ТХЛТ (в случае возникновения рецидива опухоли более чем через год после завершения курса ТХЛТ) и по одному случаю – повторный курс ТХЛТ и ЛТ. Девяти (47,6 %) больным с ре‑ цидивами ГБ специальное лечение не проводилось вследствие низкого функционального статуса и/или распространенности процесса.
Всего в исследовании летальный исход за‑ регистрирован в 12 (40 %) случаях, медиана ОВ составила 23 мес (ДИ 95 % от 11,6 мес, верхняя граница не достигнута). Цензурирование данных осуществлялось в сроки от 6 до 51 мес и во всех случаях было обусловлено завершением клини‑ ческого исследования, медиана цензурирования составила 14,5 мес (ДИ 95 % 10–25 мес). Оценка результатов в зависимости от метода лечения ре‑
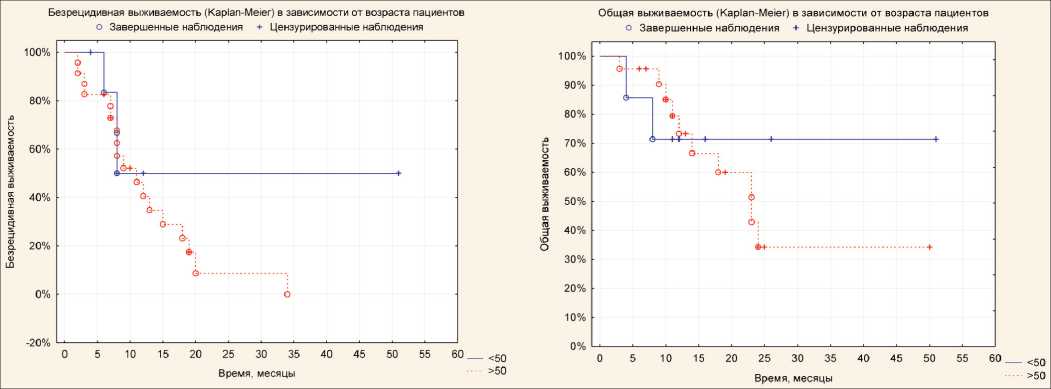
Рис. 2. Безрецидивная и общая выживаемость в зависимости от возраста пациентов
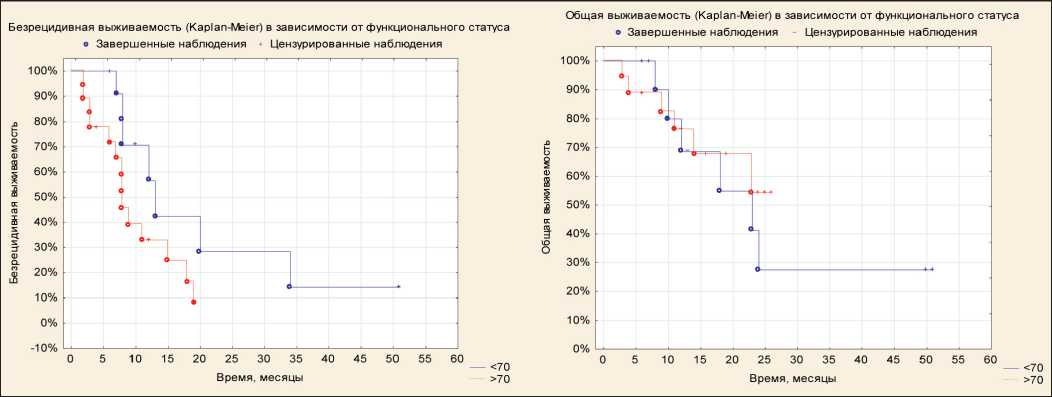
Рис. 3. Безрецидивная и общая выживаемость в зависимости от функционального статуса до начала лечения
цидива показала, что ОВ у пациентов, получивших специальное лечение, значимо выше, чем при симптоматической терапии (рис. 1).
Как уже было отмечено выше, одним из наи‑ более значимых клинических факторов прогноза является возраст пациента на момент диагностики опухоли. Возраст пациентов, включенных в иссле‑ дование, варьировал от 21 до 71 года, медиана – 56 лет (95 % ДИ 50–61 год). При распределении пациентов на группы до 50 лет и ≥50 лет значи‑ мых различий между показателями БРВ и ОВ не выявлено (рис. 2). Однако отмечалась тенденция к увеличению выживаемости в группе пациентов моложе 50 лет.
Оценка функционального статуса по шкале Карновского до начала ТХЛТ показала, что уровень активности варьировал от 40 до 90 %, в среднем – 72,7 ± 3,6 %, в целом, распределение соответство‑ вало нормальному. Значения индекса Карновского менее 70 % были обусловлены неврологическим дефицитом – выраженной пирамидной симптома‑ тикой (глубоким гемипарезом или гемиплегией) или нарушениями функций высшей нервной деятельности, требующими постоянного ухода.
Учитывая небольшое количество наблюдений, пациенты были разделены на две подгруппы – с индексом Карновского менее 70 % и 70 % и более. При оценке влияния функционального статуса на показатели БРВ и ОВ значимых различий не вы‑ явлено (рис. 3).
Объем удаленной опухоли при первичном опе‑ ративном вмешательстве был оценен как парци‑ альная резекция опухоли в 22 случаях, тотальная резекция – в 8. При оценке влияния объема опе‑ ративного вмешательства на БРВ и ОВ значимых различий не получено (рис. 4).
Молекулярно‑генетические факторы прогноза исследовались в 24 (80 %) случаях. Оценка ме‑ тилирования промотора MGMT выполнена у 23 (76,7 %) пациентов. Метилирование MGMT было обнаружено в 13 случаях, что составило 56,5 % оцененных больных. IDH‑мутация была оценена у 24 пациентов, наличие мутации выявлено только в одном случае. Частота диагностирования мети‑ лирования MGMT и мутации IDH соответствует частоте выявления в популяции. При оценке влия‑ ния метилирования MGMT на БРВ и ОВ значимых различий обнаружено не было (рис. 5). Влияние
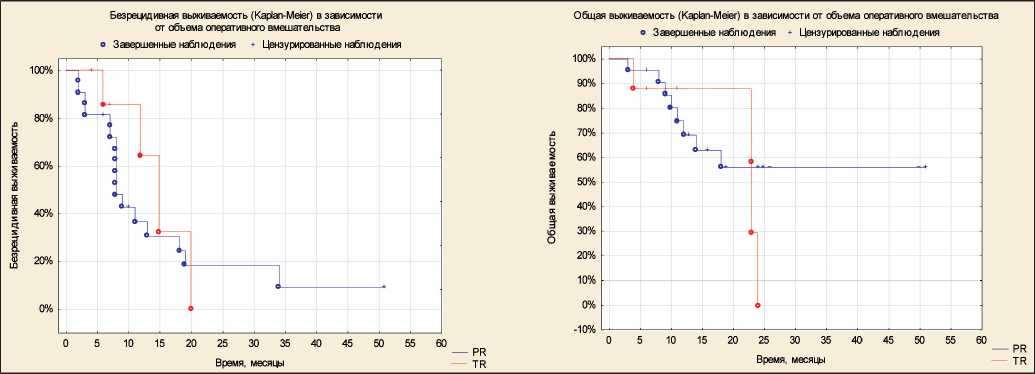
Рис. 4. Безрецидивная и общая выживаемость в зависимости от объема оперативного вмешательства
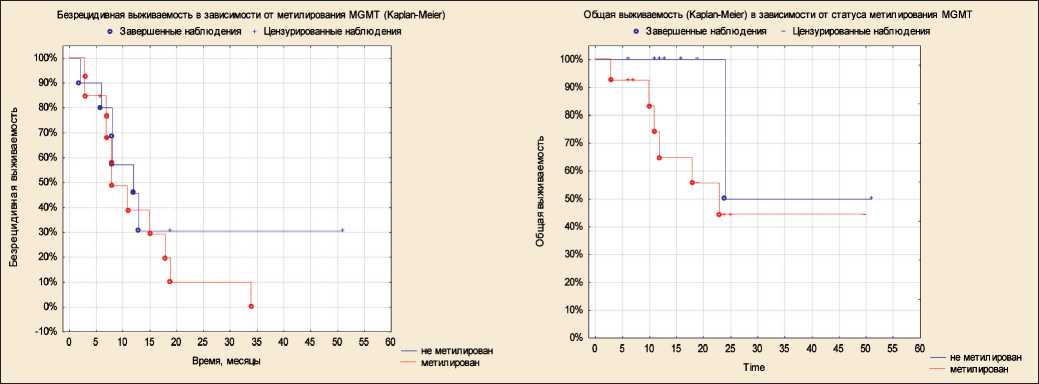
Рис. 5. Безрецидивная и общая выживаемость в зависимости от статуса метилирования промотора MGMT в опухоли
наличия мутации IDH в опухоли на выживаемость оценить не представляется возможным из‑за малого количества наблюдений.
Медиана времени начала ТХЛТ от момента опе‑ рации составила 5,4 нед (95 % ДИ 4,5–6,5 нед). При распределении пациентов на подгруппы с началом ТХЛТ менее чем через 4 нед после оперативного вмешательства, 4–8 и более 8 нед значимых раз‑ личий между показателями БРВ и ОВ не отмечено, однако имелась тенденция к увеличению выжи‑ ваемости в группе больных c началом ЛТ более чем через 8 нед. Учитывая этот фактор, пациенты в группе исследования были разделены на 2 под‑ группы – менее 6 нед и ≥6 нед после оперативного лечения. При оценке БРВ было выявлено значимое преимущество (p<0,05) у пациентов, которым луче‑ вая терапия начиналась через 6 и более нед после хирургического вмешательства (рис. 6).
Особенности проведения транскраниальной радиочастотной ЛГ с размещением охлаждаемого электрода над областью воздействия определяют необходимость оценки наличия дефекта костей черепа в качестве фактора прогноза, поскольку наличие дефекта увеличивает чувствительность мозга к температуре окружающей среды и приводит к понижению температуры мозга [17]. При операции посттрепанационный дефект костей черепа сформирован у 11 (36,7 %) больных, у одного из этих пациентов выполнялась только подвисочная декомпрессия. Во всех случаях объем вмешательства соответствовал парциальной резекции опухоли. При анализе выживаемости в зависимости от наличия или отсутствия посттрепанационного дефекта черепа значимых различий обнаружено не было (рис. 7).
Обсуждение
При оценке показателей выживаемости, полу‑ ченных в исследовании, обнаружено, что медиана БРВ у пациентов, получивших ТХЛТ, составляет 9,6 мес, при медиане наблюдения – 12 мес. Цен‑ зурирование данных при оценке выживаемости до прогрессирования осуществлялось в 30 % случаев и в основном было обусловлено завершением клинического исследования. При этом медиана цензурирования составила 7,5 мес. Сравнение
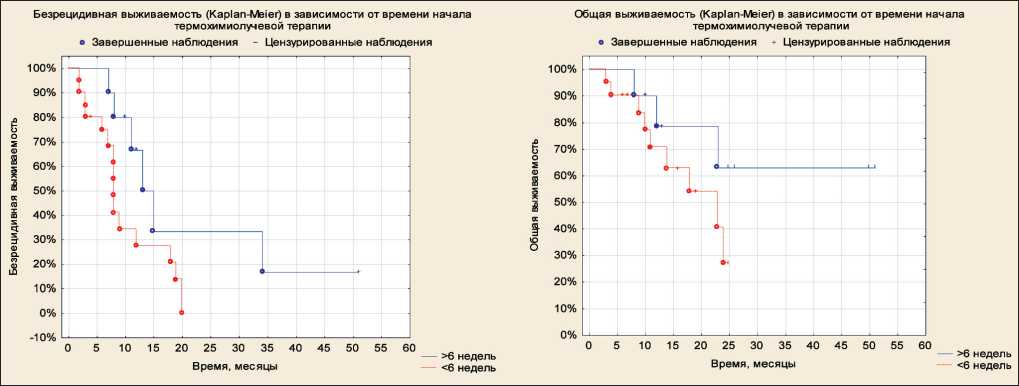
Рис. 6. Безрецидивная и общая выживаемость в зависимости от времени начала термохимиолучевой терапии
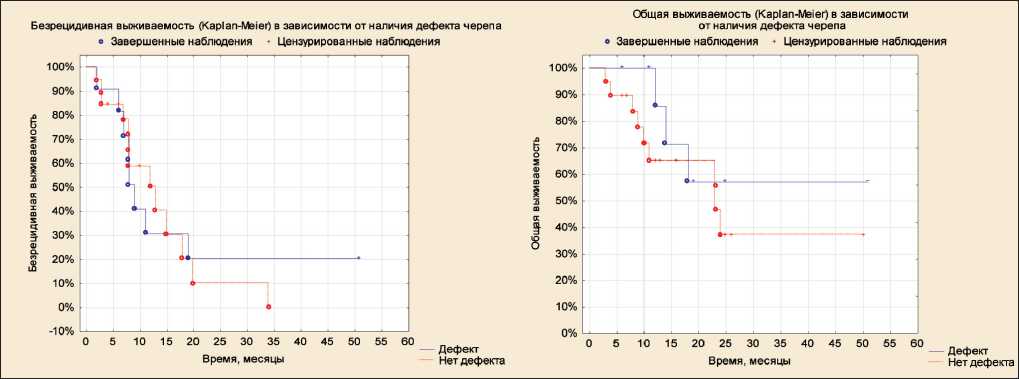
Рис. 7. Безрецидивная и общая выживаемость в зависимости от наличия или отсутствия посттрепанационного дефекта костей черепа
полученных данных с результатами проведенных ранее исследований показало, что результаты БРВ при проведении ТХЛТ превосходят показатели, достигнутые как в рандомизированном исследова‑ ния по оценке эффективности адъювантной ХЛТ с темозоломидом в режиме радиосенсибилизации (6,9 мес), так и в клиническом исследовании, по‑ священном адъювантной ХЛТ с темозоломидом в режиме 5 сут каждые 28 дней (6 мес) [18, 19]. Результаты выживаемости, полученные в нашем исследовании, не могут быть обусловлены цензу‑ рированием данных, поскольку медиана цензури‑ рования также превосходит указанные показатели. В то же время в двух крупных рандомизированных исследованиях III фазы, посвященных адъювант‑ ной ХЛТ с темозоломидом и авастином, был показан более высокий уровень безрецидивной выживаемости – 10,6 и 10,3 мес [20, 21]. Однако в этих исследованиях не получено достоверного увеличения ОВ, поэтому повышение БРВ может быть обусловлено феноменом псевдопрогрессии, характерным для антиангиогенной терапии.
Медиана ОВ, достигнутая в исследовании, составила 23 мес, что превышает результаты ран‑ домизированного исследования ХЛТ с темозоло‑ мидом в режиме радиосенсибилизации – 14,6 мес, клинического исследования ХЛТ с темозоломидом в режиме 5/28 – 13 мес, рандомизированных ис‑ следований ХЛТ с темозоломидом и авастином – 16,7 и 16,1 мес, а также при присоединении TTF‑ терапии (tumor‑treating fields) после проведения стандартного курса ХЛТ – 20,5 мес [2, 18–21]. Тем не менее высокая частота цензурирования данных в нашем исследовании при оценке ОВ не позволяет сделать вывод о достоверном увеличении общей выживаемости. Необходимо отметить, что, хотя специальное лечение при возврате заболевания значимо увеличивает ОВ, бевацизумаб получали только 4 (19 %) пациента с рецидивами ГБ. Таким образом, высокий показатель общей выживаемости не может быть обусловлен применением антиан‑ гиогенной терапии.
По результатам крупного исследования, вклю‑ чившего 34 664 пациентов с глиобластомой по результатам базы данных SEER (программа эпид‑ надзора, эпидемиологии и конечных результатов На‑ ционального института рака США), было показано значительное снижение выживаемости у больных моложе 50 лет по сравнению с группой пациентов старше 50 лет [22]. Влияние возраста на прогноз может быть связано как с использованием менее активных методов лечения из‑за сопутствующей па‑ тологии, так и с более агрессивными молекулярно‑ генетическими профилями ГБ, характерными для пациентов старше 50 лет. В проведенном исследо‑ вании не было обнаружено значимых различий БРВ и ОВ при распределении пациентов на группы до 50 лет и 50 лет и старше. Полученные результаты могут быть обусловлены малочисленностью вы‑ борки и большим количеством цензурированных наблюдений при оценке ОВ.
По данным литературы, функциональный ста‑ тус пациентов значимо влияет на выживаемость. Наиболее часто используемой шкалой для оценки функциональной активности в нейроонкологии является индекс Карновского. Пациенты с уров‑ нем активности 70 % и выше имеют значительно лучший прогноз, чем больные с более низким ин‑ дексом Карновского [3, 6, 22]. При оценке влияния функционального статуса на БРВ и ОВ пациентов в нашем исследовании значимых различий получено не было. В то же время в подгруппе пациентов с индексом Карновского менее 70 % отмечалась тен‑ денция к увеличению безрецидивной выживаемо‑ сти. Такая парадоксальная картина, вероятно, была обусловлена скрытым течением рецидивной опу‑ холи на фоне уже существующей неврологической симптоматики и не свидетельствует об истинном улучшении БРВ. Отсутствие значимых различий при оценке ОВ в зависимости от функционального статуса может быть обусловлено и большим коли‑ чеством цензурированных наблюдений.
Среди факторов прогноза, связанных с ле‑ чением ГБ, наибольшее значение имеет объем оперативного вмешательства. Тотальное удаление ГБ является благоприятным прогностическим фактором и увеличивает выживаемость пациентов при проведении адъювантной терапии [3, 23]. В то же время снижение функционального статуса вследствие агрессивной хирургической тактики в функционально значимых областях головного мозга приводит к снижению ОВ [24]. При оценке объема оперативного вмешательства в нашем ис‑ следовании была обнаружена высокая частота пар‑ циальной резекции – в 22 (73 %) случаях, которая была обусловлена отсутствием мультимодальной навигации в ходе операции, а также расположе‑ нием опухоли в функционально значимых зонах. Оценка влияния объема вмешательства на БРВ и ОВ значимых различий не показала. Эта ситуация может быть обусловлена как более агрессивным действием ТХЛТ на остаточную опухоль, так и ошибкой, связанной с большим количеством цензурированных данных при оценке общей выживаемости.
В проведенных ранее исследованиях показано, что сроки начала ЛТ после оперативного вмеша‑ тельства при ГБ головного мозга могут иметь прогностическое значение. В исследовании, вклю‑ чившем 4 584 пациентов с глиобластомой, было обнаружено, что увеличение времени начала луче‑ вой терапии до 4–6 нед после операции является безопасным и может быть умеренно выгодным [25]. При этом начало адъювантного лечения в течение 3–4 нед после операции может иметь отрицательное прогностическое значение [26]. Результаты, полученные в нашем исследовании, показали, что безрецидивная выживаемость значи‑ мо выше у пациентов, которым курс ТХЛТ начат через 6 и более недель после оперативного вмеша‑ тельства. Полученные результаты соответствуют литературным данным и могут быть обусловлены как отбором пациентов с меньшей скоростью прогрессирования опухоли, так и уменьшением послеоперационной гипоксии в перифокальной области в указанные сроки [25, 26].
В качестве еще одного фактора, связанного с лечением, в нашем исследовании оценено нали‑ чие посттрепанационного дефекта костей черепа. Анализ влияния краниэктомии на показатели БРВ и ОВ не показал значимых различий. По‑ видимому, это отражает адекватность локальной гипертермии как при сохранении костей черепа, так и при наличии посттрепанационного дефекта. Отсутствие воздействия охлаждаемого электрода на подлежащую ткань мозга может быть связано с гомеостатическим ответом, который выражается спазмом сосудов кожи и уменьшением кровотока в подкожном слое при снижении температуры кожи ниже 31–32°C [27].
Среди молекулярно‑генетических факторов прогноза в лечении ГБ наибольшую значимость имеют метилирование MGMT и IDH1/2 мутация. Наличие IDH1/2 мутации в опухоли определяет более благоприятный вариант течения. По лите‑ ратурным данным, общая выживаемость при ГБ с IDH дикого типа колеблется от 9 до 15 мес по срав‑ нению с 24–36 мес при ГБ с IDH1/2 мутациями. Пятилетняя выживаемость при ГБ с отсутствием IDH мутаций не зафиксирована, в то время как при наличии этой мутации составляет до 80 % [8, 28]. Оценить влияние IDH мутации на выживаемость пациентов не представилось возможным из‑за небольшого числа наблюдений. Однако частота ее выявления соответствовала результатам эпиде‑ миологических исследований [4], что позволяет сделать вывод о том, что увеличение общей и безрецидивной выживаемости в исследовании не обусловлено благоприятным молекулярно‑ генетическим профилем опухолей.
В рандомизированном исследовании, вклю‑ чившем 206 пациентов с впервые выявленными
Список литературы Значение факторов прогноза при проведении термохимиолучевой терапии глиобластом головного мозга
- Кобяков Г.Л., Смолин А.В., Бекяшев А.Х., Абсалямова О.В., Кобякова Е.А., Поддубский А.А., Иноземцева М.В. Лечение рецидива глиобластомы: есть ли успехи? Опухоли головы и шеи. 2014; 3: 12-20. .
- Stupp R., Taillibert S., Kanner A.A., Kesari S., Steinberg D.M., Toms S.A., Taylor L.P., Lieberman F., Silvani A., Fink K.L., Barnett G.H., Zhu J., Henson J.W., Engelhard H.H., Chen T.C., Tran D.D., Sroubek J., Tran N.D., Hottinger A.F., Landolfi J., Desai R., Caroli M., Kew Y., Honnorat J., Idbaih A., Kirson E.D., Weinberg U., Palti Y., Hegi M.E., Ram Z. Maintenance Therapy With Tumor-Treating Fields Plus Temozolomide vs Temozolomide Alone for Glioblastoma. A Randomized Clinical Trial. JAMA. 2015; 314 (23): 2535-2543. DOI: 10.1001/jama.2015.16669
- Tini P., Miracco C., Toscano M., Palumbo S., Comincini S., Gravina G.L., Pirtoli L. Clinical, Pathological, and Molecular Prognostic Parameters in Glioblastoma Patients Undergoing Chemo-and Radiotherapy. Radiobiology of Glioblastoma. Springer International Publishing. 2016; 101-120. DOI: 10.1007/978-3-319-28305-0_7
- Tamimi A.F., Juweid M. Epidemiology and Outcome of Glioblastoma. Glioblastoma. Codon Publications, Brisbane, Australia. 2017; 143-153. DOI: 10.15586/codon.glioblastoma.2017.ch8
- Осинов И.К., Мусабаева Л.И., Чойнзонов Е.Л., Нечитайло М.Н., Рябова А.И. Влияние факторов прогноза на результаты химиолучевой терапии больных злокачественными глиомами головного мозга. Медицинская радиология и радиационная безопасность. 2012; 57 (4): 13-20. .


