Значение генетических мутаций в развитии метаболических нарушений у пациентов с артериальной гипертензией
Автор: Бородулин В.Б., Шевченко О.В., Бычков Е.Н., Решетько О.В., Киселев А.Р., Посненкова О.М., Железинская Н.В., Саратцев А.В., Лосев О.Э.
Журнал: Саратовский научно-медицинский журнал @ssmj
Рубрика: Внутренние болезни
Статья в выпуске: 3 т.8, 2012 года.
Бесплатный доступ
Изучение молекулярно-генетических маркеров эссенциальной артериальной гипертензии (АГ) позволит приблизиться к пониманию патологических механизмов, лежащих в основе этого заболевания, и создать в будущем «генетический паспорт» для каждого пациента. Цель: изучение генетических маркеров 5,10-метилентетра-гидрофолатредуктазы (MTHFR), участвующей в метаболизме гомоцистеина, и 1М-ацетилтранссреразы-2 (NAT2), обеспечивающей процесс превращения ацетил-коэнзима А в ацетоацетил-коэнзим А. Материал и методы. Обследованы 160 больных эссенциальной АГ 1 -3-й стадий европеоидной расы (57,5% жен.) в возрасте 20-59 лет. Изучали полиморфизм генов MTHFR и NAT2 в ДНК лейкоцитов периферической крови с помощью набора Wizard Genomic DNA Purification Kit (Promega, США). Результаты. Показано, что среди больных АГ 1-й стадии чаще (рThe article stresses on the study of molecular markers of essential arterial hypertension providing insight into the pathological mechanisms underlying the disease and creation of «genetic passport» for every patient in the future. Objective: To study genetic markers of 5,10-methylenetetrahydrofolate reductase (MTHFR), involved in the metabolism of homocysteine, and N-acetyltransferase 2 (NAT2), ensuring the process of transformation of acetyl-CoAto acetoacetyl-coenzyme A. Methods: The study involved 160 patients with essential hypertension l-lll stages Caucasian (57.5% female.) aged 20-59 years. MTHFR gene polymorphisms and NAT2 in DNA of peripheral blood leukocytes were studied using a set of Wizard Genomic DNA Purification Kit (Promega, USA). Results: It was shown that «slow acetylators» (homozygous for a mutant version of the gene NAT2) were more frequently (p
Артериальная гипертензия, генетические маркеры, метаболические процессы
Короткий адрес: https://sciup.org/14917617
IDR: 14917617
Текст научной статьи Значение генетических мутаций в развитии метаболических нарушений у пациентов с артериальной гипертензией
Адрес: 410012, Саратов, ул. Б. Казачья, 112.
Тел.: (8452) 669840.
глубоком понимании механизмов возникновения и прогрессирования артериальной гипертензии (АГ). К патофизиологическим факторам развития АГ принадлежат: гиперактивность симпатоадреналовой системы в ответ на физический и эмоциональный стресс, гиперсекреция гуморальных медиаторов, которые задерживают экскрецию ионов Na+; длительное повышенное потребление соли, увеличение активности ренин-агиотензин-альдостероновой системы; дефект синтеза вазодилататоров (простациклины, оксид азота); изменение функционирования калликреин-кининовой системы, нарушение функции резистивных артерий мышечного типа и фильтрационной функции почек, сахарный диабет, резистентность к инсулину и ожирение [1]. Единение патогенеза эссенциальной АГ, сахарного диабета, атеросклероза, ожирения и метаболического синдрома станет более ясным, если к биохимическим параметрам данных состояний добавить молекулярно-генетические маркеры основных метаболических процессов и изучить их в комплексе.
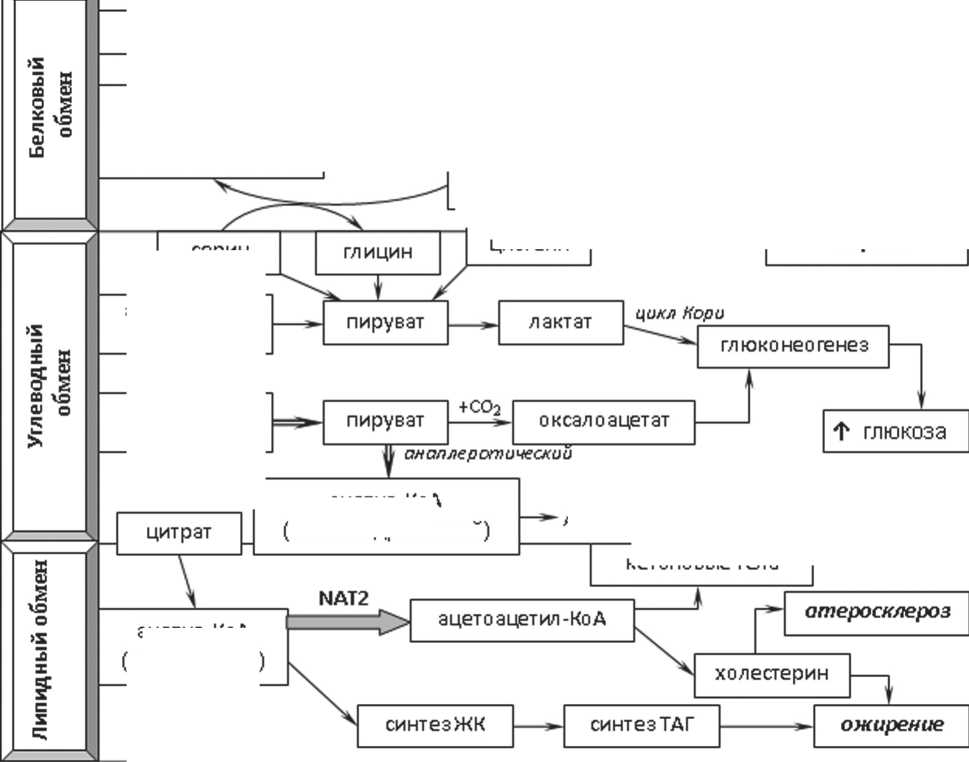
В патогенезе и развитии осложнений АГ важную роль играют биохимические процессы, которые представлены тремя основными метаболическими путями: белковым, углеводным и липидным.
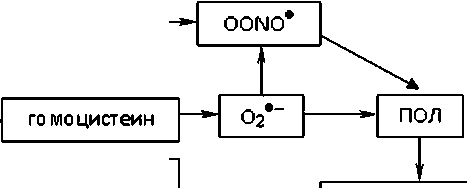
При рассмотрении белкового обмена обращает на себя внимания полиморфизм гена фермента 5,10-метилентетрагидрофолатредуктазы (MTHFR), имеющий важное значение в обмене гомоцистеина. Реакция, катализируемая MTHFR, является ключевым регулирующим звеном в метаболизме фолатов и важным звеном при образовании метионина из гомоцистеина. Гомоцистеин — метаболит, оказывающий одновременно атерогенное и тромбоваскулярное действие. Известны несколько путей участия гомоцистеина в повреждении эндотелия сосудов: усиливается пролиферация гладкомышечных клеток, в мембранах клеток накапливаются липопротеины низкой и очень низкой плотности, снижается эластичность стенки сосудов, активизируется рост атеросклеротических бляшек. Гомоцистеин, как и другие тиоловые соединения, обладает прооксидантной активностью, благодаря наличию в структуре –SH групп. Теория ок-сидативного повреждения сосудов в условиях гипер-гомоцистеинемии наиболее изучена. Антиоксиданты эффективно блокируют развитие дисфункции эндотелия при гипергомоцистеинемии, что подтверждает патогенетическую роль оксидативного повреждения гомоцистеином. Наличие оксидативного стресса проявляется увеличением концентрации малонового диальдегида, что отражает усиление процессов перекисного окисления липидов (ПОЛ) в мембранах клеток и снижение антиоксидантной способности плазмы крови. В результате окисления сульфгидрильных групп гомоцистеина образуются перекисные ионы и перекись водорода, что приводит к нарушению сосудорасширяющей функции эндотелия и образованию окисленных липопротеинов плазмы крови [2]. Перекисные радикалы О2-, образующиеся при аутоокислении гомоцистеина, могут переводить оксид азота (NO) в форму пероксинитрила ONOO•, не обладающую вазодилатирующими свойствами (рис. 1). Гомоцистеин понижает биодоступность NO двумя путями: нарушая синтез за счет ингибирования ферментов NO-синтаз и нарушая активность NO [3, 4].
Углеводный обмен осуществляется по аэробному или анаэробному пути. В результате аэробного обмена образуется пируват, принимающий участие в синтезе митохондриального ацетил-коэнзима А. Последний окисляется до углекислого газа и воды с выделением АТФ. Из цистеина образуется пируват, участвующий в процессах глюконеогенеза. Лактат, образующийся из пирувата по анаэробному пути, также участвует в процессах глюконеогенеза. Основ- ной путь метаболизма пирувата — превращение в цитозольный ацетил-коэнзим А.
Нарушения липидного обмена считаются одним из наиболее важных факторов развития атероскле роза . Обмен холестерола чрезвычайно сложен: только для его синтеза необходимо осуществление около ста последовательных реакций, основными из которых являются: превращение активного ацетата в мевалоновую кислоту, образование изопенте-нилдифосфата, образование сквалена, циклизация сквалена в холестерин. Ацетил-коэнзим А — макро-эргический продукт конденсации коэнзима А с уксусной кислотой, именно в форме ацетил-коэнзима А уксусная кислота участвует в синтезе холестерина. Кофермент А — кофермент ацетилирования; принимает участие в реакциях переноса ацильных групп .
Процесс превращения ацетил-коэнзима А в ацетоацетил-коэнзим А обеспечивается ферментом N-ацетилтрансферазой и может быть зависим от аллельных вариантов гена NAT (см. рис. 1). Существуют две разновидности N-ацетилтрансферазы: N-ацетилтрансфераза-1 (NAT1) и N-ацетилтрансфераза-2 (NAT2). NAT1 и NAT2 являются близкими по первичной структуре (79-95% гомологии аминокислотной последовательности, в зависимости от вида). Гены NAT хотя и расположены на одной хромосоме, но регулируются независимо друг от друга [5, 6].
Полиморфизм NAT2 фенотипически проявляется наличием в популяции людей с «быстрым» и «медленным» типом ацетилирования, при этом у представителей европеоидной расы частота «медленных» ацетиляторов составляет 40-60% [7]. Известно около 20 мутантных аллелей гена NAT2, все они наследуются по аутосомно-рецессивному типу и приводят к «медленному» ацетилированию. Для европеоидной популяции самыми распространенными мутантными аллелями являются NAT2*5B и NAT2*6А. Оба аллеля составляют до 70-75% всех аллелей NAT2 и около 95% всех мутантных аллелей у русских, японцев и испанцев. Частота встречаемости NAT2*5B у представителей европеоидной популяции составля-ет40-45%, NAT2*6A — 25-30% [7-9].
Цель : исследовать полиморфизм генов, ответственных за энзиматическую активность ферментов 5,10-метилентетрагидрофолатредуктазы и N-ацетилтрансферазы в популяции больных эссенциальной артериальной гипертензией.
Методы. Группу обследуемых составили 160 больных эссенциальной АГ 1-3-й стадий европеоидной расы (92 женщины и 68 мужчин) в возрасте от 20 до 59 лет, проходящих клиникоинструментальное обследование в кардиологическом стационаре. Пациенты по стадиям АГ были разделены на три группы в зависимости от стадии течения заболевания: 1-я стадия (54 человека); 2-я стадия (50 человек); 3-я стадия (56 человек).
Диагноз АГ устанавливался до включения в исследование на основании данных анамнеза, жалоб, клинической картины заболевания, факторов риска, данных клинического, лабораторного и инструментального методов обследования, согласно рекомендациям ВНОК 2010 г. Всем больным проводились следующие исследования: 12-канальная электрокардиография (цифровой электрокардиограф VSD-804 фирмы «Волжские передовые технологии», Россия), допплер-эхокардиография (Sonoline Si-450, Siemens), определение степени микроальбуминурии с помощью тест-полосок Urine Reagent Strips — IP
N0S3
аргинин
MTHFR метионин цистеин оксидат ивный стресс цистеин
атф + СО2 + HjO
Рис. 1. Метаболические процессы, указывающие на вероятность развития артериальной гипертензии
П р и м еч а н и е : NOS3 – NO-синтаза III типа; MTHFR – 5,10-метилентетрагидрофолатредуктаза, NAT2 – N-ацетилтрансфераза-2; ONOO• – пероксинитрил, ПОЛ – перекисное окисление липидов; ТАГ – триацилглицерол; ЖК – жирные кислоты; ацетил-КоА – ацетил- коэнзим А.
цистатионин
серин
анаэробный обмен
аэробный обмен
ацетил-КоА (цитозольный)

ацетил-КоА
(митохо ндриал ьный)
кетоновые тела
(США), определение глюкозы в плазме крови с помощью глюкометра, биохимический анализ крови (общий холестерин, липопротеиды высокой и низкой плотности, триглицериды, креатинин), общий анализ мочи (определение протеинурии), офтальмоскопия (для выявления гипертонической ретинопатии), суточный мониторинг артериального давления (АД), офисное измерение АД по методу Короткова.
В качестве биологического материала для генетических исследований использовалась периферическая кровь. Весь материал был собран с соблюдением процедуры информированного согласия пациентов. Забор крови у каждого из пациентов выполнялся однократно. ДНК выделяли из лейкоцитов периферической крови с помощью набора Wizard Genomic DNA Purification Kit (Promega, США) в соответствии с инструкцией производителя.
Биочипы — массивы ячеек, содержащих различные молекулярные зонды. Биочипы изготовлены методом фотоиндуцируемой совместной полимеризации олигонуклеотидов и компонентов акриламидного геля. Гелевые ячейки микрочипа полусферической формы химически пришиты к твердой поверхности, в каждой ячейке иммобилизированы молекулы зонда одного типа. Зонды нанесены на поверхность микрочипа в определенной последовательности, размер ячеек составляет 150 мкм. Проведение по- лимеразной цепной реакции осуществлялось в два этапа с добавлением праймеров, специфичных к исследуемым генам. Флуоресцентное мечение продукта полимеразной цепной реакции (ПЦР) проводили на втором этапе реакции с помощью красителя пентаметинового ряда. При этом праймер, содержащий флуоресцентную метку, добавляли в ПЦР-смесь в более высокой концентрации, чем немеченый праймер, таким образом, чтобы преимущественно нарабатывалась одна меченая цепь. В процессе дальнейшей гибридизации на биочипе происходило специфическое взаимодействие молекул-зондов и молекулы-мишени по принципу комплементарности. Гибридизационную смесь полностью денатурировали в течение 5 минут при 95°С, охлаждали во льду, наносили на биочип и инкубировали в течение 10-12 часов при 37°С. После завершения инкубации и удаления гибридизационной смеси поверхность биочипа высушивалась сжатым воздухом, проводилась регистрация флуоресцентных сигналов с помощью портативного анализатора, снабженного программным обеспечением Imagewer (Институт молекулярной биологии им. В. А. Энгельгардта РАН, Россия). Картина гибридизации представляет собой распределение сигналов флуоресценции, наиболее ярких в точках специфического связывания зонда и мишени. Метод использования ДНК-чипов высокоинформати- вен, позволяет анализировать до 50 полиморфных вариантов генов с точностью более 99%. Возможность изучения полиморфизмов генов на чипах в ходе исследования предоставлена ООО «Геночип» г. Саратов.
В процессе гибридизации происходит специфическое взаимодействие молекул-зондов и молекулы-мишени по принципу комплементарности. Для того чтобы выявить возникающие в ходе гибридизации стабильные структуры и определить, с каким зондом произошло взаимодействие, молекулы-мишени предварительно метят флуоресцентным красителем. Таким образом, картина гибридизации представляет собой картину распределения флуоресцентных сигналов, наиболее ярких в точках специфического связывания зонда и мишени.
С помощью метода ДНК-чипов в нашей работе оценивался полиморфизм генов, ответственных за энзиматическую активность ферментов 5,10-метилен-тетрагидрофолатредуктазы и N-ацетилтрансферазы.
Изучалась распространенность следующих гомозиготных мутаций гена NAT2, приводящих к «медленному» ацетилированию: NAT2*5A, 341T→C; NAT2*5B 481C→T; NAT2*6A, 282C→T; NAT2*6B 590G→A; NAT2*7B, 857G→A.
К увеличению концентрации гомоцистеина в плазме крови ведет мутация гена 5,10-метиленте-трагидрофолатредуктазы (MTHFR). Это приводит к структурным изменениям фермента метилентетра-гидрофолатредуктазы: аланин замещается валином, изменяются каталитические свойства фермента. При гетерозиготной мутации этого гена происходит замена цитозина на тимин в 677-м нуклеотиде (мутация С677Т). Генотип ТТ является мутантным, СС — немутантным («дикий» тип), СТ — гетерозиготным (рис. 2).
Статистическая обработка данных выполнялась с использованием программного пакета Statistica 6.1. Сравнение частот встречаемости признаков выполняли на основе критерия Хи-квадрат. Зависимости показателей оценивали на основе корреляции R Спирмена.
Результаты. С помощью «фармакогенетического» биочипа определен полиморфизм генов, ответствен-
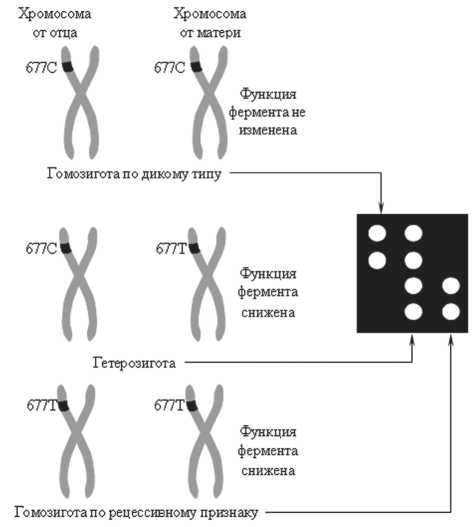
Рис. 2. Полиморфизмы 677-го нуклеотида гена MTHFR на родительских хромосомах: С677С – «дикий» тип, С677Т – гетерозигота, Т677Т – гомозигота по рецессивному признаку ных за метаболические превращения гомоцистеина и ацетил-коэнзима А (MTHFR, NAT2*5A, NAT2*5B, NAT2*6А, NAT2*6B, NAT2*7B). Приведено распределение генетического полиморфизма по стадиям заболевания в популяции больных АГ (табл. 1, 2).
В исследовании оценивались мутации гена NAT2 (341T→C, 481C→T, 282C→T, 590G→A, 857G→A), приводящие к «медленному» ацетилированию (см. табл. 1). Среди больных АГ 1-й стадии достоверно чаще, относительно пациентов с 2-й и 3-й стадиями заболевания, встречались «медленные ацетиляторы» (гомозиготы по мутантному варианту гена NAT2), об-
Таблица 1
Распределение гомозиготных мутаций наиболее распространенных аллелей NAT2, приводящих к «медленному» ацетилированию, у больных АГ 1-3-й стадий
|
Стадии АГ |
NAT2*5A 341T→C |
NAT2*5B 481C→T |
NAT2*6A 282C→T |
NAT2*6B 590G→A |
NAT2*7B 857G→A |
|
1-я (n=54) |
14 (25,9%) |
17 (31,5%) |
23 (42,6%) |
26 (48,1%) |
11 (20,4%) |
|
2-я (n=50) |
8 (16,0%) |
10 (20,0%) |
11 (22,0%)* |
8 (16,0%)* |
2 (4,0%)* |
|
3-я (n=56) |
6 (10,7%)* |
10 (17,9%) |
3 (5,4%)*+ |
7 (12,5%)* |
2 (3,6%)* |
П р и м еч а н и е : данные представлены в виде n (%). Частота встречаемости генотипов (%) рассчитана от общего числа наблюдений в каждой из групп пациентов; * – статистически значимые (р<0,05) различия с группой больных АГ 1-й стадии; + – статистически значимые (р<0,05) различия с группой больных АГ 2-й стадии.
Таблица 2
Распределение полиморфных вариантов 677-го нуклеотида гена MTHFR у больных АГ 1-3-й стадий
|
Вариант генотипа |
Общая группа (n=160) |
АГ 1-я стадии (n=54) |
АГ 2-я стадии (n=50) |
АГ 3-я стадии (n=56) |
|
СС, n (%) |
62 (38,8%) |
34 (63,0%) |
18 (36,0%)* |
10 (17,9%)*+ |
|
СТ, n (%) |
51 (31,9%) |
14 (25,9%) |
16 (32,0%) |
21 (37,5%) |
|
ТТ, n (%) |
57 (35,6%) |
6 (11,1%) |
16 (32,0%)* |
25 (44,6%)* |
П р и м еч а н и е : Частота встречаемости генотипов в процентах (%) рассчитана от общего числа наблюдений в каждой из групп пациентов; СС – гомозиготное носительство аллеля С полиморфизма 677-го нуклеотида гена MTHFR; СТ – гетерозиготное носительство аллеля Т; ТТ – гомозиготное носительство аллеля Т; * – статистически значимые (р<0,05) различия с группой больных АГ 1-й стадии; + – статистически значимые (р<0,05) различия с группой больных АГ 2-й стадии.
условленные практически всеми изучаемыми типами мутаций гена, кроме [NAT2*5B, 481C→T] (см. табл. 2):
— NAT2*5A, 341T→C (р=0,22 и р=0,041 соответственно; обращаем внимание, что различия по данной мутации с больными АГ 2-й стадии статистически незначимы);
— NAT2*6A, 282C→T (р=0,027 и р<0,0001 соответственно);
— NAT2*6B, 590G→A (р=0,0007 и р=0,0001 соответственно);
— NAT2*7B, 857G→A (р=0,013 и р=0,008 соответственно).
Сравнивая группы пациентов с АГ 2-й и 3-й стадий, удалось выявить статистически значимые различия по частоте встречаемости [NAT2*6A, 282C→T] мутации гена NAT2 (р=0,013), обусловливающей «медленное» ацетилирование (см. табл. 1).
Анализ полиморфизма в 677 нуклеотиде гена MTHFR показал, что в 57 образцах (35,6% образцов ДНК в общей группе) определен мутантный генотип ТТ. Гетерозиготы и гомозиготы по немутантному аллелю С распределились следующим образом: гомозиготное носительство (генотип СС) присутствовало у 62 пациентов (38,8% от общей группы); гетерозиготное носительство (генотип СТ) — у 51 пациента (31,9% от общей группы) (см. табл. 2). Выявлено, что группы больных АГ 2-й и 3-й стадии сопоставимы по частоте встречаемости у них генотипа ТТ (р=0,19), тогда как при 1-й стадии АГ частота встречаемости данного генотипа статистически значимо ниже (р=0,01 и p=0,0002 соотвественно) (см. табл. 2). Частота встречаемости генотипа СТ была сопоставима (р>0,05) во всех исследуемых группах больных АГ. Генотип СС достоверно чаще наблюдался у больных АГ 1-й стадии (р=0,007 и p<0,0001 при сравнении с АГ 2-й и 3-й степени соотвественно). Отметим, что различия в частоте встречаемости генотипа СС между больными АГ 2-й и 3-й стадий также статистически значимы (р=0,037), при этом наиболее редко встречается данный генотип при 3-й стадии АГ (см. табл. 2).
Установлена статистически значимая средней силы зависимость стадии АГ от наличия мутантных аллелей Т (гетеро- и гомозиготный варианты) в 677-м нуклеотиде гена MTHFR (r=0,40, р<0,001).
Обсуждение. В нашем исследовании показано, что среди больных АГ 1-й стадии достоверно чаще встречаются индивиды с аллелями гена NAT2, обусловливающими «медленный вариант ацетилирования». Наиболее часто встречаются гомозиготные варианты генотипа 282С→Т аллельного варианта NAT2*6A и 590 G→A аллельного варианта NAT2*6B. Исходя из полученных результатов, можно предположить, что «медленные» аллельные варианты гена NAT2 способствуют снижению уровня фермента N-ацетилтрансферазы, замедляя тем самым реакцию превращения ацетил-коэнзима А в ацетоацетил- коэнзим А и нарушая всю многоэтапную цепь синтеза холестерола.
В результате мутации в 677-м нуклеотиде (мутация С677Т) фермент MTHFR становится термолабильным, снижается его удельная активность, нарушается реметилирование гомоцистеина в метионин. По нашим данным, не выявлено статистически значимых различий по частоте встречаемости типа С677Т мутации гена MTHFR у больных АГ разных стадий, однако можно отметить недостоверную тенденцию к увеличению частоты встречаемости по мере повышения стадии течения заболевания (см. табл. 2).
Кроме того, нами показана высокая распространенность гомозиготного носительства мутантного аллеля Т гена MTHFR (генотип ТТ), детерминирующего сниженную энзиматическую активность 5,10-мети-лентетрагидрофолатредуктазы у больных АГ, что свидетельствует о нарушении обмена метионина у данной категории пациентов. В работах последних лет рядом авторов было показано, что у пациентов с мутацией гена MTHFR (особенно гомозигот с генотипом ТТ) уровень гомоцистеина в крови, как правило, на 25% выше, чем у лиц с генотипом СС. Выявлено, что у людей с такой мутацией повышен риск развития сердечно-сосудистых заболеваний, сахарного диабета, атеросклероза, поздних осложнений беременности и др. [10].
Мы полагаем, что наличие того или иного полиморфного варианта гена MTHFR по 677-му нуклеотиду оказывает непосредственное влияние на тяжесть течения АГ. В частности, отсутствие мутаций на уровне данного нуклеотида (генотип СС) у большинства пациентов способствует более «мягкому» течению заболевания с отсутствием поражений органов-мишеней и ассоциированных клинических состояний, появление которых в той или иной мере ассоциируется с выявлением мутантного аллеля Т данного гена (генотипы СТ и ТТ).
Необходимо отметить, что методика изучения генетического полиморфизма на основе ДНК-биочипов предполагает в перспективе внедрение на матрицу биочипа новых зондов для определения малоизученных генетических маркеров, участвующих в основных метаболических процессах, что облегчит понимание многих патогенетических процессов при АГ.
Заключение. Описанные в работе молекулярногенетические маркеры метаболических процессов вовлечены в регуляцию артериального давления. В популяции больных АГ имеется закономерность распределения полиморфизмов генов, ответственных за активность ферментов 5,10-метилентетраги-дрофолатредуктазы, участвующей в метаболизме гомоцистеина, и N-ацетилтрансферазы, обеспечивающей процесс превращения ацетил-коэнзима А в ацетоацетил-коэнзим А . Мутации этих генов при определенных условиях могут влиять на течение АГ. Дальнейшее изучение генетических маркеров белкового, углеводного и жирового обменов существенно облегчит понимание патогенеза заболевания и подбор фармакологических препаратов для лечения артериальной гипертензии.
Список литературы Значение генетических мутаций в развитии метаболических нарушений у пациентов с артериальной гипертензией
- Oparil S., Zaman A., Calhoun D.A. Pathogenesis of hypertension//Ann. Intern. Med. 2003. T. 139. C. 761 -176
- Cattaneo M. Hyperhomocysteinemia, Atherosclerosis and Thrombosis//Thromb. Haemost. 1999. T. 81. C. 165-176
- Loscalzo J. The oxidant stress of hyperhomocysteinemia//J. Clin. Invest. 1996. № 98. P. 5-6
- Хубутия М.Ш., Шевченко О. П. Гомоцистеин при коронарной болезни сердца и сердечного трансплантата. М.: Ре-афарм, 2004. 272 с.
- Hein D.W., Doll М. A, Fretland A. J. Molecular genetics and epidemiology of the NAT1 and NAT2 acetylation polymorphisms.//Cancer Epidemiol. Biomarkers Prev. 2000. T. 1, № 9. P. 29-42
- Vatsis K. P., Weber W.W., Bell D.A. Nomenclature for N-acetyltransferases//Pharmacogenetics. 1995. T. 1, № 5. С 1-17
- Сулейманов С. Ш. Особенности функционирования системы биотрансформации ксенобиотиков в адаптивных реакциях и патологии малочисленных народов Крайнего Севера: автореф. дис.... д-ра мед. наук. 1997. 47 с.
- Evans D.A. P. N-acetyltransferase//Pharm. Therap. 1989. Т. 42. С. 157-234
- Сравнительный анализ результатов фенотипирования и генотипирования по полиморфизму N-ацетилирования у человека/И.В. Голденкова-Павлова, С. А. Брускин, P.M. Аб-деев [и др.]//Генетика: журнал Российской академии наук. 2006. Т. 42, №8. С. 1143-1150
- Heux S.,Morin F., Lea R.A. The methylentetrahydrofolate reductase gene variant (C677T) as a risk factor for essential hypertension in Caucasians//Hypertens. Res. 2004. Vol. 27, № 9. P. 663-667


