Значение норадренергических структур фастигиального ядра мозжечка в регуляции дыхания у крыс
Автор: Беляков Владимир Иванович
Журнал: Ульяновский медико-биологический журнал @medbio-ulsu
Рубрика: Физиология
Статья в выпуске: 4, 2016 года.
Бесплатный доступ
Цель исследования - изучить специфику участия норадренергических структур фастигиального ядра (ФЯ) мозжечка в регуляции различных параметров паттерна дыхания и биоэлектрической активности инспираторных мышц. Материалы и методы. Опыты проводились на 22 половозрелых спонтанно дышавших крысах под уретановым наркозом. В первой серии с использованием методов пневмотахографии и электромиографии анализировались реакции дыхания и биоэлектрической активности диафрагмы и наружных межреберных мышц на микроинъекции растворов норадреналина в различной концентрации в ФЯ мозжечка. Во второй серии наблюдений осуществлялось электрическое раздражение ФЯ мозжечка импульсным током различной силы и частоты до и в условиях активации норадре-нергических структур исследуемого ядра. Результаты. Основным эффектом активации норадренцептивных структур ФЯ мозжечка является увеличение частоты дыхания и минутной вентиляции легких. Данные изменения соответствуют перестройкам параметров электромиограмм инспираторных мышц. Предварительные локальные введения норадреналина в ФЯ обеспечивают усиление регулирующих влияний исследуемого ядра на дыхание и активность инспираторных мышц в условиях его электрического раздражения. Заключение. Особенности модулирующих влияний ФЯ мозжечка на дыхание определяются функциональным состоянием его норадренергических структур.
Дыхание, мозжечок, фастигиальное ядро, норадреналин, адренорецепторы
Короткий адрес: https://sciup.org/14113225
IDR: 14113225 | УДК: 612.217
Текст научной статьи Значение норадренергических структур фастигиального ядра мозжечка в регуляции дыхания у крыс
Введение. Одним из важных механизмов оптимизации функции дыхания является включение в деятельность ритм- и паттерн-формирующих структур дыхательного центра (ДЦ) регулирующих влияний от различных супрабульбарных отделов мозга, в т.ч. от мозжечка [1, 2].
Известно, что работа нейронного аппарата мозжечка контролируется со стороны различных афферентных входов (мшистых, лазающих, моноаминоергических), отличающихся по источнику формирования, функциональному значению и нейрохимической специфике [3–5]. В отношении норадренергических волокон установлено, что они берут начало в голубом пятне ( locus coeruleus ) и распределяются в различных участках коры мозжечка, а также во всех его ядрах [5, 6].
При этом плотность норадренергических терминалей наиболее значительна в структурах архи- и палеоцеребеллума [6]. Имеются данные о модулирующем влиянии норадреналина на структуры мозжечка при выполнении двигательных навыков, фиксации новых двигательных программ [7–10]. Напротив, дисфункция норадренергического контроля над деятельностью мозжечковых образований сопряжена с нарушениями двигательной координации и всей архитектуры движения. Показано, что разрушение голубого пятна или блокада норадренергического входа в мозжечок усиливают проявления судорожной активности у крыс [11, 12]. Противоположным эффектом (снижение выраженности тремора передних конечностей) обладают стимуляция голубого пятна и центральное введение предшественников норадреналина. Описано снижение плотности бета-адренорецепторов в коре и ядрах мозжечка при старении мозга, сопровождающемся снижением качества выполнения двигательных задач [9, 13].
Цель исследования. Анализ участия норадренергических структур фастигиального ядра мозжечка в механизме регуляции параметров внешнего дыхания и биоэлектрической активности инспираторных мышц.
Материалы и методы. Исследования выполнены в острых опытах на 22 крысах обоего пола массой 240–280 г под уретановым наркозом (1,4 г/кг; Sigma-Aldrith Rus.). Методика проведения экспериментов соответствовала нормам и правилам биомедицинской этики (European Community Council Directives 86/609/EEC) и утверждена комитетом по биоэтике Самарского университета. По окончании экспериментов эвтаназия животных осуществлялась за счет введения летальной дозы наркозного средства. Операционная подготовка включала трахеостомию, осуществление доступа к наружным межреберным мышцам и диафрагме с левой половины тела и высверливание трепанационного отверстия над областью залегания левостороннего фастигиального ядра (ФЯ) мозжечка согласно стереотаксическим координатам атласа мозга крысы [14]. По окончании хирургических процедур животное помещалось в стереотаксическую установку СЭЖ-3 (Россия), его голова фиксировалась в дорсальном положении. Ректальная температура поддерживалась на уровне 37,0 °С при помощи электронного термометра Checktemp C (Hanna Instruments, Германия).
Пневмотахограмма регистрировалась с использованием электронного спирографа для мелких животных (ИМЦ «Новые приборы», Россия), трубка которого подключалась к трахеостомической канюле. Выходные сигналы через аналогово-цифровой преобразователь подавались на персональный компьютер и записывались в программе PowerGraf 3.2 Profeesional (ООО «Интероптика-С»). Производилось интегрирование кривой пневмотахограммы с получением записи внешнего дыхания. На спирограммах оценивались следующие показатели: время инспира- ции (с), время экспирации (с), время дыхательного цикла (с) и дыхательный объем (мл). Дополнительно по формулам рассчитывались частота дыхания (мин-1) и минутный объем дыхания (мл/мин). Параллельно записи дыхания с использованием электромиографа (ИМЦ «Новые приборы», Россия) осуществлялась регистрация биоэлектрической активности наружных межреберных мышц и диафрагмы при помощи биполярных стальных игольчатых электродов с межэлектродным расстоянием 2–3 мм. На получаемых электромиограммах (ЭМГ) рассчитывались: продолжительность залповой активности (с), продолжительность межзалповых интервалов (с), максимальная амплитуда осцилляций в залпах (отн. ед.).
В первой серии экспериментов (n=12) записи дыхания и биоэлектрической активности дыхательных мышц осуществлялись непрерывно в исходном состоянии и на протяжении 60 мин от начала введения норадреналина хлорида (Sigma-Aldrith) в ФЯ мозжечка. Растворы норадреналина хлорида в концентрациях 10-5 и 10-3 М готовились ex tempore с использованием искусственной цереброспинальной жидкости. Микроинъекции исследуемых растворов в объеме 0,3 мкл осуществлялись при помощи микрошприца МШ-1, оснащенного стеклянной микроканюлей с диаметром кончика порядка 20–30 мкм, согласно стереотаксическим координатам. В контрольных наблюдениях по аналогичной схеме в ФЯ мозжечка инъецировалась искусственная цереброспинальная жидкость.
С целью дальнейшего обоснования роли норадренцептивных структур ФЯ мозжечка в механизме реализации его модулирующего влияния на дыхание во второй серии экспериментов (n=10) осуществлялась электростимуляция ФЯ до и в условиях локального воздействия норадреналина на исследуемое ядро. Далее сопоставлялись респираторные эффекты влияния одиночной электростимуляции и электростимуляции в условиях повышения функциональной активности адренорецепторов ФЯ. Электрическое раздражение ФЯ мозжечка производилось при помощи концентрического биполярного электрода с диаметром кончика порядка 50 мкм (модель
NE-100, Rhodes Medical Instruments) сериями прямоугольных импульсов тока (длительность – 0,5 мс, частота – 20, 30, 50 и 100 Гц, сила – 100 и 200 мкА).
Статистическая обработка результатов производилась в программе SigmaStat 12.5 (Jandel Scientific, USA) с использованием тестов ANOVA, парного t-теста Стьюдента. Результаты исследования представлены как средние значения ± стандартные ошибки. Статистически значимыми считались различия при р<0,05.
Результаты и обсуждение. В исходном состоянии дыхание крыс характеризовалось достаточной глубиной и ритмичностью: в среднем частота дыхания составляла 75,0±4,7 вдоха в мин, объем дыхания – 0,93±0,12 мл, минутный объем дыхания – 71,0±5,9 мл/мин. Сложившиеся в условиях наркотизации паттерн дыхания и биоэлектрическая активность инспираторных мышц не претерпевали статистически значимых изменений при микроинъекциях искусственной цереброспинальной жидкости в ФЯ мозжечка в контрольных наблюдениях.
Микроинъекции растворов норадреналина в ФЯ мозжечка обеспечивали перестройку функционирования ДЦ, о чем свидетельствовали изменения параметров паттерна дыхания и электрической активности дыхательных мышц. Характер респираторных ответов определялся действующей концентрацией вещества и временем его экспозиции. Воздействия норадреналина в низкой концентрации (10-5 М) обеспечивали слабо выраженную тенденцию к увеличению частоты дыхания к 15–20-й мин наблюдений, однако эти изменения не являлись статистически значимыми. Увеличение действующей концентрации норадреналина до 10-3 М вызывало постепенно нарастающую активацию внешнего дыхания в течение 15 мин от начала экспозиции нейроактивного вещества (рис. 1, табл. 1).
Основополагающую роль в интенсификации респираторной функции играли перестройки частотно-временных составляющих паттерна дыхания и биоэлектрической активности инспираторной мускулатуры. К 10-й мин действия норадреналина время дыхательного цикла сокращалось в среднем на 9 % (р>0,05), следствием чего являлось незначительное повышение частоты дыхания на 7 % (р>0,05).
В дальнейшем изменения данных показателей носили более выраженный характер, и к 15-й мин наблюдения регистрировалось статистически значимое увеличение дыхательного ритма с 75,2±4,7 (исходный уровень) до 84,4±4,9 вдоха в мин, что соответствовало повышению данного показателя на 12 % (р<0,05). Анализ фазовой структуры дыхательного цикла в этих условиях показал, что основной причиной прироста частоты дыхания являлось сокращение времени экспирации с 0,46±0,07 до 0,36±0,04 с, или на 19 % (р<0,05). Вызываемые активацией норадренергических структур ФЯ мозжечка отклонения продолжительности фазы инспирации не носили статистически значимого характера и поддерживались на стабильном уровне на протяжении всего периода регистрации дыхания.
В полном соответствии с описанными изменениями показателей дыхания происходили перестройки временных параметров на ЭМГ инспираторных мышц. Максимально выраженные эффекты также проявлялись на 15-й мин от момента локального введения норадреналина в ФЯ мозжечка. В случае наружных межреберных мышц продолжительность межзалповых интервалов сокращалась на 16 % (р<0,05), для диафрагмы уменьшение данного показателя составило 14 % (р<0,05). Продолжительность залпов на ЭМГ инспираторных мышц изменялась незначительным образом.
Проведенный анализ изменений объема внешнего дыхания и амплитудной составляющей электрической активности инспираторных мышц не выявил их статистически значимых перестроек. Что касается интегрального показателя дыхания – минутной вентиляции легких, то его изменения обеспечивались увеличением частоты дыхания. В исходном состоянии минутный объем дыхания находился на уровне 71,0±5,9 мл/мин. Микроинъекции норадреналина в ФЯ вызывали увеличение данного показателя к 15-й мин наблюдения до 81,8±5,4 мл/мин, т.е. на 15 % (р<0,05).
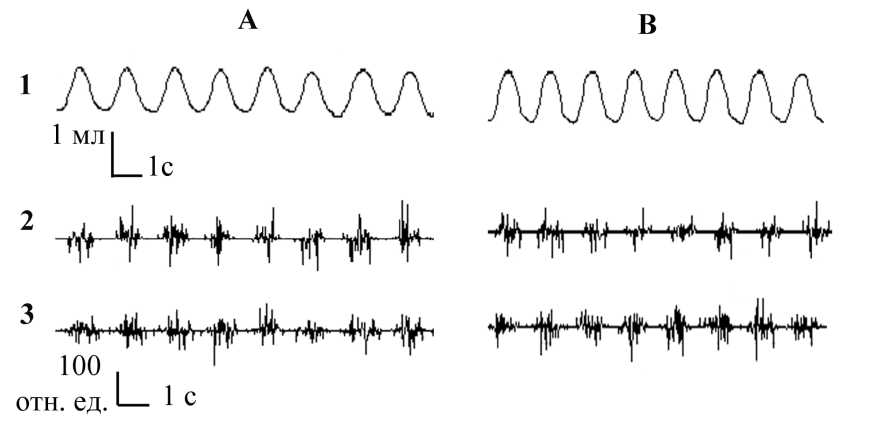
Рис. 1. Респираторные реакции на микроинъекции норадреналина в ФЯ мозжечка: А – исходное состояние, В – при микроинъекции норадреналина,
1 – спирограмма, 2 – ЭМГ наружных межреберных мышц, 3 – ЭМГ диафрагмы
Таблица 1
Изменения объемно-временных параметров дыхания и биоэлектрической активности инспираторных мышц на микроинъекции норадреналина в ФЯ мозжечка
|
Параметр |
Исходные значения |
5-я мин |
10-я мин |
15-я мин |
30-я мин |
|
Т i , с |
0,34±0,06 |
0,34±0,08 |
0,33±0,03 |
0,32±0,04 |
0,31±0,09 |
|
T e , с |
0,46±0,04 |
0,44±0,06 |
0,40±0,07 |
0,38±0,04* |
0,49±0,06 |
|
Т Т , с |
0,82±0,08 |
0,77±0,12 |
0,72±0,14 |
0,67±0,07* |
0,74±0,15 |
|
ЧД, мин-1 |
75,0±4,7 |
78,3±3,9 |
80,4±5,1 |
84,8±4,6* |
81,3±5,3 |
|
ДО, мл |
0,93±0,12 |
0,91±0,14 |
0,94±0,16 |
0,95±0,11 |
0,94±0,12 |
|
МОД, мл/мин |
71,0±5,9 |
70,2±6,4 |
75,4±5,7 |
81,8±5,4* |
77,7±6,9 |
Примечание. Т i – время инспирации, Т e – время экспирации, Т Т – время дыхательного цикла, * – статистически значимые различия с исходными значениями при р<0,05.
Таким образом, на основании вышеотме-ченных данных можно говорить о включении норадренергических структур ФЯ мозжечка в механизм реализации его регулирующих влияний на дыхание. Данное заключение подтверждается наличием норадренергических проекций к ФЯ и адренорецепторов в исследуемом ядре [4, 6, 15, 16]. Согласно данным литературы, в церебеллярных ядрах преобладают популяции альфа-2- и бета-адренорецепторов [16–18]. Как показывают исследования [4, 5], альфа-2-адренорецепторы, расположенные на пресинаптической мембране аксонов клеток Пуркинье коры мозжечка, обеспечивают снижение эффективности ГАМКергических сигналов к нейронам ФЯ мозжечка. При передаче норадренергических влияний от голубого пятна к ядрам мозжечка задействуются преимущественно бета-адренорецепторы. Их активация обеспечивает внутриклеточное повышение уровня цАМФ и развитие деполяризации нейронов [17]. По всей видимости, нивелирование тормозного контроля со стороны клеток Пурки- нье в сочетании с возбуждением самих нейронов ядер мозжечка в случае активации норадренергической системы может обеспечивать более эффективную передачу регулирующих влияний ядерного аппарата мозжечка к ДЦ. Что касается типа таких влияний, то с учетом данных о доминировании в ФЯ глутамат- и аспартатергических нейронов [3, 15] допустимо констатировать их возбуждающий характер. С подобным заключением согласуется установленная в настоящем исследовании активация дыхания в ответ на микроинъекции норадреналина в ФЯ.
Во второй серии экспериментов установлена способность норадреналина модулировать респираторные реакции, вызываемые электрической стимуляцией ФЯ. Было показано, что предварительная активация норадренергических структур исследуемого ядра усиливает выраженность регулирующих влияний данного ядра на ритмогенерирующую функцию ДЦ. На рис. 2 сопоставлены оригинальные записи дыхания и биоэлектрической активности инспираторной мускулатуры в условиях одиночной электростимуляции ФЯ и электростимуляции на фоне активации норадренчувствительных структур исследуемого ядра.
Одиночная электростимуляция исследуемого ядра обеспечивала различные по направленности и выраженности респираторные ответы в зависимости от параметров тока. Наиболее выраженные респираторные реакции регистрировались при действии тока с частотой 100 Гц и силой 200 мкА (рис. 3). В подавляющем большинстве случаев (87 % от числа всех наблюдений) отмечалась активация дыхания и усиление биоэлектрической активности инспираторных мышц. Основной вклад в перестройку дыхания вносили изменения частотно-временных параметров: выраженное сокращение времени экспирации на 29 % (р<0,01) и увеличение частоты дыхания на 27 % (р<0,05). Данным изменениям соответствовало увеличение частоты генерации залповой активности на ЭМГ диафрагмы и наружных межреберных мышц.
Что касается дыхательного объема, то данный показатель не претерпевал сколько-нибудь значительных изменений. При этом амплитуда залповой активности в большей степени изменялась у наружных межреберных мышц, чем у диафрагмы (увеличение на 19 и 10 % соответственно). Отмеченная специфика, по всей видимости, может объясняться большей устойчивостью центральных механизмов, обеспечивающих контроль над деятельностью основной инспираторной мышцы – диафрагмы. Как известно, наружные межреберные мышцы, кроме дыхательной функции, активно вовлекаются в реализацию различных двигательных программ, и спинальные центры этих мышц обладают большей способностью интегрировать различные модулирующие влияния (в т.ч. от ФЯ мозжечка).
Таким образом, основным эффектом электрической стимуляции ФЯ мозжечка являлось усиление ритмогенерирующей функции ДЦ, которое закономерно обеспечивало возрастание минутной вентиляции легких. Пороговые значения тока (30 Гц, 100 мкА) обеспечивали увеличение данного интегрального показателя функции дыхания на 19 % (р<0,05) от исходного уровня. Наиболее выраженный прирост минутного объема дыхания достигался в случае стимуляции током частотой 100 Гц и силой 200 мкА (увеличение на 31 %; р<0,01).
Предварительная активация норадрено-цептивных структур ФЯ мозжечка усиливала респираторные реакции на его электростимуляцию. Так, раздражение ФЯ через 15 мин после локального введения норадреналина током низкой интенсивности (30 Гц, 100 мкА) обеспечивало повышение частоты дыхания на 24 % (р<0,05), минутного объема дыхания – на 28 % (р<0,05). Максимально выраженная интенсификация дыхания и биоэлектрической активности инспираторных мышц прослеживалась при действии сверхпороговых значений тока (100 Гц, 200 мкА), когда прирост частоты дыхания составил 36 % (р<0,01), а минутного объема дыхания – 40 % (р<0,01).
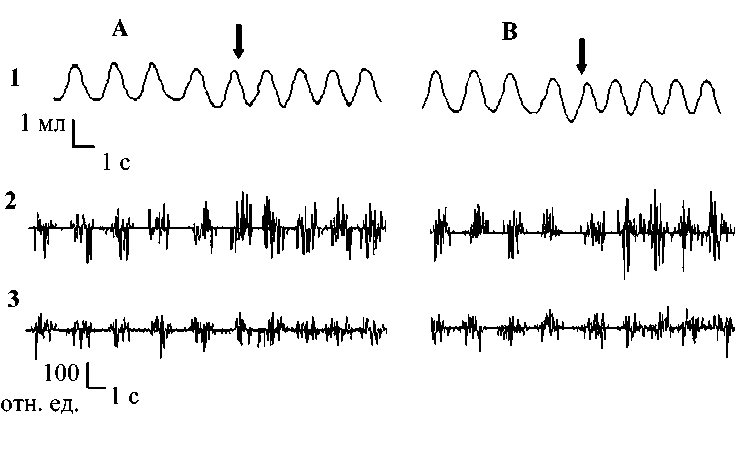
Рис. 2. Респираторные реакции на электростимуляцию (100 Гц, 200 мкА)
ФЯ мозжечка до (А) и в условиях активации норадренергических структур исследуемого ядра (В).
Стрелками обозначен момент начала электростимуляции, остальные обозначения те же, что на рис. 1
Время
Время
Частота
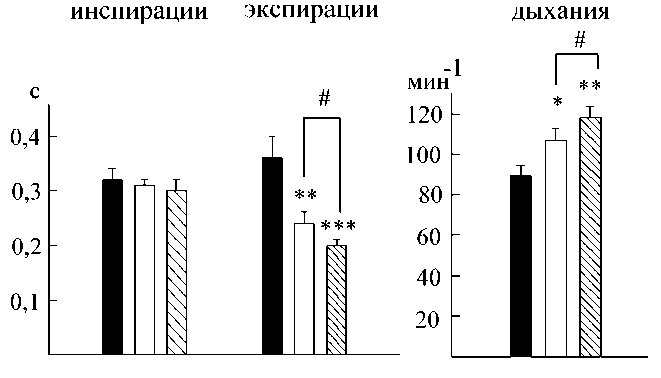
Рис. 3. Изменения частотно-временных показателей дыхания на электростимуляцию (100 Гц, 200 мкА) ФЯ мозжечка до и в условиях активации норадренергических структур исследуемого ядра. Черные столбики – исходные значения, белые столбики – электростимуляция до активации норадренергических структур, столбики со штриховкой – электростимуляция в условиях активации норадренергических структур. *, **, *** – статистически значимые различия с исходными значениями при р<0,05, р<0,01 и р<0,01 соответственно;
# – статистически значимые различия между эффектами одиночной электростимуляции и сочетания электростимуляции с активацией норадренергических структур при р<0,05
Заключение. Результаты проведенного исследования дают основания полагать, что эффективность участия ФЯ мозжечка в контроле респираторной функции зависит от функционального состояния норадренергиче- ских механизмов обеспечения его деятельности. Вероятно, в реальных условиях существования организма усиление норадренергических влияний на структуры мозжечка обеспечивает модуляцию паттерна их актив- ности при функциональной мобилизации организма (например, при стрессах), что может обеспечивать перестройку регулирующих влияний мозжечковых ядер на различные функции организма, включая дыхание. В соответствии с концепцией Л.А. Орбели о мозжечке как универсальном регуляторе и его тесной связи с симпатическими центрами при реализации адаптационно-трофической функции [19] можно заключить, что норадренергические структуры ФЯ мозжечка являются значимыми элементами для обеспечения оптимальных функциональных взаимодействий в системе «мозжечок – бульбарный ДЦ».
Список литературы Значение норадренергических структур фастигиального ядра мозжечка в регуляции дыхания у крыс
- Меркулова Н.А., Инюшкин А.Н., Беляков В.И., Зайнулин Р.А., Инюшкина Е.М. Дыхательный центр и регуляция его деятельности супрабульбарными структурами. Самара: Самарский университет; 2007. 170.
- Xu F., Frazier D. T. Modulation of respiratory motor output by cerebellar deep nuclei in the rat. J. Appl. Physiol. 2000; 9 (3): 996-1004.
- Бархатова В.П. Нейротрансмиттерная организация и функциональное значение мозжечка. Анналы клинической и экспериментальной неврологии. 2010; 4 (3): 44-49.
- Di Mauro M., Li Volsi G., Licata F. Noradrenergic Control of Neuronal Firing in Cerebellar Nuclei: Modulation of GABA Responses. Cerebellum. 2013; 12 (3): 350-361.
- Di Mauro M., Fretto G., Caldera M., Li Volsi G., Licata F., Ciranna L., Santangelo F. Noradrenaline and 5-hydroxytryptamine in cerebellar nuclei of the rat: functional effects on neuronal firing. Neurosci. Lett. 2003; 347 (2): 101-105.
- Dietrichs E. Cerebellar cortical and nuclear afferents from the feline locus coeruleus complex. Neuroscience. 1988; 27 (1): 77-91.
- Nedelescu H., Chowdhury T.G., Wable G.S., Arbuthnott G., Aoki C. Cerebellar sub-divisions differ in exercise-induced plasticity of noradrenergic axons and in their association with resilience to activity-based anorexia. Brain Struct. Funct. 2016; 221: 1-23.
- Samuels E.R., Szabadi E. Functional neuroanatomy of the noradrenergic locus coeruleus: its roles in the regulation of arousal and autonomic function part I; principles of functional organization. Curr. Neuro-pharmacol. 2008; 6 (3): 235-253.
- Hoffer B.J., Rose G., Parfitt K., Freedman R., Bickford-Wimer P.C. Age-related changes in cerebellar noradrenergic function. Ann. N.Y. Acad. Sci. 1988; 515: 269-286.
- Licata F., Li Volsi G., Maugeri G., Ciranna L., Santangelo F. Effects of noradrenaline on the firing rate of vestibular neurons. Neuroscience. 1993; 53 (1): 149-158.
- Kolasiewicz W., Kuter K., Nowak P., Pastuszka A., Ossowska K. Cerebellar Noradrenergic Innervation Enhances the Harmaline-Induced Tremor in Rats. Cerebellum. 2011; 10 (2): 267-280.
- Marin-Lahoz J., Gironell A. Linking Essential Tremor to the Cerebellum: Neurochemical Evidence. Cerebellum. 2016; 15 (3): 243-252.
- Di Mauro M., Bronzi D., Li Volsi G., Licata F., Lombardo P., Santangelo F. Noradrenaline modulates neuronal responses to GABA in vestibular nuclei. Neuroscience. 2008; 153 (4): 1320-1331.
- Paxinos G., Watson C. The rat brain in stereotaxic coordinates. Sydney: Academic; 2007.
- Zhang X.Y., Wang J.J., Zhu J.N. Cerebellar fastigial nucleus: from anatomic construction to physiological functions. Cerebellum & Ataxias. 2016; 3 (9): 1-10.
- Gould T. J., Adams C.E., Bickford P.C. Beta-adrenergic modulation of GABAergic inhibition in the deep cerebellar nuclei of F344 rats. Neuropharmacology.1997; 36 (1): 75-81.
- Nicholas A.P., Pieribone V.A., Hokfelt T. Cellular localization of messenger RNA for beta-1 and beta-2 adrenergic receptors in rat brain: an in situ hybridization study. Neuroscience.1993; 56 (4): 1023-1039.
- Phan J.A., Landau A.M., Wong D.F., Jakobsen S., Nahimi A., Doudet D.J., Gjedde A. Quantification of yohimbine binding to a2 adrenoceptors in rat brain in vivo. J. Cereb. Blood. Flow. Metab. 2015; 35 (3): 501-511.
- Григорьев А.И., Григорьян Н.А. Трудные годы лидера физиологии. К 125-летию со дня рождения академика Л.А. Орбели. Вестник российской академии наук. 2007; 77 (5): 426-444


