Значение Pr012Ala полиморфизма гена PPARГ при артериальной гипертонии и метаболическом синдроме
Автор: Курбанов Равшанбек Давлатович, Срожидинова Нигора Зайнутдиновна
Журнал: Евразийский кардиологический журнал @eurasian-cardiology-journal
Рубрика: Оригинальные статьи
Статья в выпуске: 2, 2012 года.
Бесплатный доступ
Цель исследования. Изучение Pro12А1а полиморфизма гена PPARγ среди здоровых лиц и больных АГ узбекской популяции и оценка ассоциации Рrо12А1а полиморфизма гена PPARγ с уровнем АД и процессами сердечно-сосудистого ремоделирования. Материалы и методы. Обследованы 163 больных АГ и 50 здоровых лиц мужского пола узбекской национальности. Метаболический синдром (МС) устанавливали согласно классификации IDF, 2005 г. Проводились исследования: пероральный тест толерантности к глюкозе, ЭхоКГ с допплерографией, тест с реактивной гиперемией, определение толщины КИМ общей сонной артерии, липидный спектр крови и микроальбуминурии. Рrо12А1а полиморфизм гена PPARγ определялся с помощью ПЦР с применением специфических праймеров и рестриктазы. Результаты. Изучение распространенности Рrо12А1а полиморфизма гена PPARγ показало достоверно большее накопление Pro-аллеля как среди больных с АГ (89,9%), так и среди здоровых лиц (83%). У больных с АГ и МС не выявлено связи между Рrо12А1а полиморфизм гена PPARγ и уровнем АД, ММЛЖ, липидов и гликемии. При этом у больных с АГ и MC-носителей Рrо-аллеля гена PPARγ обнаружены более высокая ЧСС и МАУ по сравнению с носителеями Аlа-аллеля гена PPARγ. Расчет генетического риска развития МС с использованием мультипликативной модели наследования показал, что наличие Pro-аллеля гена PPARγ было связано с повышенным риском (ОШ 1,73 при 95% ДИ 0,89-3,37), а наличие АІа-аллеля -со сниженным риском развития МС (ОШ 0,58 при 95% ДИ 0,30-1,13). Заключение. Выявлена высокая частота Рrо12 аллеля и Pro/Pro генотипа Рrо12А1а полиморфного маркера PPARγ как у больных АГ с наличием и отсутствием МС, так и у здоровых лиц узбекской национальности. У больных АГ с МС - носителей Pro-аллеля Рrо12А1а полиморфного маркера PPARγ - вероятность развития МС выше по сравнению с носителями АІа-аллеля.
Рrо12а1а полиморфизм гена pparγ, артериальная гипертония, метаболический синдром
Короткий адрес: https://sciup.org/14342714
IDR: 14342714
Текст научной статьи Значение Pr012Ala полиморфизма гена PPARГ при артериальной гипертонии и метаболическом синдроме
|
Курбанов Равшанбек Давлатович |
Республиканский Специализированный Центр Кардиологии М3 РУз, директор. Тел.: +998-71-237-38-1 б(приемная) |
|
Срожидинова НигораЗайнутдиновна |
Республиканский Специализирова нный Центр Кардиологии М3 РУз, старший научный сотрудник. Лаборатория Артериальной гипертонии и молекулярно-генетических исследований. 100052, Ташкент, Республика Узбекистан, Ул. Осиё, 4 Тел.: +998-97-804-01-12 Факс: +998-71-234-16-67 E-mail: nigora_s@bcc.com.uz |
В настоящее время широко обсуждается вопрос о роли генетических факторов в развитии метаболического синдрома (МС) и его компонентов, таких как ожирение, дислипидемия и нарушение углеводного обмена, способствующих увеличению риска развития сердечно-сосудистых осложнений. Одну из центральных ролей в регуляции метаболизма липидов и углеводов играют транскрипционные регуляторы липидной природы - ядерные рецепторы, активируемые про-лифератором пероксисом (Peroxisome Proliferator Activated Receptor - PPAR, NR1Cs) - представляющие собой один из классов лиганд-активируемых факторов транскрипции [1]. После связывания лигандов малой молекулярной массы они активируют транскрипцию генов, контролирующих жировой и углеводный метаболизм.
-
У животных и человека определены три вида
рецепторов, PPARs: PPARa, PPAR|3/6 и PPARy. PPARa экспрессируется, главным образом, в тканях с высоким уровнем катаболизма ЖК (печень, мозг, бурый жир, почки, сердце, скелетные мышцы). PPARy - в белой и бурой жировой ткани, и, в незначительной степени, в сердце и скелетных мышцах. Оба типа рецепторов экспрессируются в сосудистом эндотелии, гладкомышечных клетках сосудов и в макрофагальных пенистых клетках. PPAR6 экспрессируются в большинстве тканей [2]. PPARy является основным фактором регуляции дифференцировки адипоцитов, а также способствует экспрессии белка, транспортирующего жирные кислоты, повышает экспрессию и активность ацетил-КоА-синтазы, фосфатидилинозитол-3-киназы, увеличивает экспрессию гена адипо-нектина, транспортера глюкозы (GLUT-4), SIR-1 и 2, подавляет экспрессию гена лептина, участвует
Таблица 1. Биологические эффекты изоформ рецепторов PPAR [3]
|
PPAR |
Экспрессия в тканях |
Лиганды |
Функции |
|
PPARa |
Печень, сердце, почки, скелетные мышцы |
ЖК (фибраты) |
Окисление СЖК, противовоспалительный |
|
PPARp/б |
Различные ткани |
ЖК |
Органогенез (пренатальный период), окисление СЖК |
|
PPARy |
Адипоциты,макрофаги, сердце, мышцы |
ПНЖК (глитазоны) |
Адипогенез, липогенез, регуляция инсулиночувствительности, антипролиферативный |
в регуляции белков, разобщающих окислительное фосфорилирование, ингибирует экспрессию в жировой ткани ФНО-альфа, что сопровождается снижением инсулиновой сопротивляемости и улучшением секреции инсулина бета-клетками.
Известны три изоформы продукта гена PPARy (табл. 1), наиболее изученного рецептора, играющего ключевую роль в дифференцировке адипоцитов, распределении жировой ткани, балансе энергии, метаболизме липидов и гомеостазе глюкозы [4]. Так, PPARy 1 экспрессируется в организме практически повсеместно, PPARy2 - в жировой ткани, PPARy3 - в адипоцитах, макрофагах, эпителии толстого кишечника.
Человеческий ген PPARy расположен на хромосоме 3 и охватывает геномный сегмент более 150 kb. Он состоит из 9 экзонов (А1, А2, В и 1-6), среди которых две различные изоформы мРНК PPARy и протеин, PPARy 1 и PPARy2, образуются с использованием отдельных промоторов и 5 экзонов. мРНК PPARy 1 состоят из экзонов А1, А2 и 1-6 и транслируются из промотора Р2, тогда как мРНК PPARy2 являются комбинацией экзонов В и 1-6 и транслируются из промотора Р2. Два протеина отличаются присутствием добавочных 28 МН2-терминальных аминокислот PPARy2 [5].
Ген PPARy кодирует гамма-рецептор, который в основном продуцируется в жировой ткани, и индуцирует пролиферацию пероксисом, отвечающих за окисление жирных кислот. Также данный рецептор регулирует дифференцировку адипоцитов и гомеостаз глюкозы (определяет потребность мышечной ткани в глюкозе и ее чувствительность к инсулину), стимулирует синтез и выброс печенью параоксоназы, связывает гипо-липидемические препараты и жирные кислоты, участвует в регуляции костного метаболизма.
Наиболее изученным полиморфизмом гена PPARy, является Рго12А1а-полиморфизм (rs1801282), представляющий собой замену нуклеотида цитозина - С на гуанин - G в 34 положении экзона В, что приводит к замещению про лина на аланин в аминокислотном положении 12 изоформы PPARy2. Тип наследования мутации аутосомно-доминантный, частота гетерозигот в популяциях европейского типа достигает 20%, гомозигот, носителей генотипа GG (что соответствует Ala/Ala) - до 2%. Молекулярные эффекты мутации: при варианте 12А1а активность рецептора понижена, что приводит к угнетению вышеуказанных процессов, повышению уровня общего холестерина и ЛПВП, снижению уровня триглицеридов и повышению чувствительности тканей к инсулину.
В ряде работ продемонстрирована роль Рго12А1а полиморфного маркера гена PPARy в развитии инсулинорезистентности (ИР), сахарного диабета и атеросклероза. Однако роль Pro 12 Al а полиморфизма гена PPARy в развитии нарушений углеводного и липидного обмена у пациентов АГ и МС узбекской национальности до настоящего момента не изучено.
Цель исследования: изучить распределение частот генотипов и аллелей Рго12А1а полиморфизма генаPPARyсреди здоровых лиц и больных АГ узбекской популяции и оценить ассоциацию Pro 12 Al а полиморфизма гена PPARy с уровнем АД и процессами сердечно-сосудистого ремоделирования.
В исследование были включены 163 больных АГ и 50 здоровых лиц мужского пола узбекской национальности. Средний возраст больных составил 45,4±11,0 лет, длительность АГ - 4,9±4,3 лет. МС устанавливали согласно классификации IDF, 2005г. Всем больным проводились: пероральный тест толерантности к глюкозе, определение липидного спектра крови и микроальбуминурии. Для оценки параметров внутрисердечной гемодинамики проводилось ЭхоКГ с допплерографией. Эндотелийзависимая вазодилятация (ЭЗВД) оценивалась с помощью теста реактивной ги-
Таблица 2. Частота генотипов и аллелей Pro12Ala полиморфизма гена PPARγ у здоровых и больных АГ
|
Все больные АГ (n=163) |
Больные АГ с МС (n=118) |
Больные АГ без МС (n=45) |
Здоровые лица (n=50) |
|
|
Генотипы |
||||
|
Pro/Pro |
80,4% |
79,7% |
82,2% |
66% |
|
Pro/Ala |
19,0% |
19,5% |
17,8% |
34% |
|
Ala/Ala |
0,6% |
0,8% |
0% |
0% |
|
χ2=255,82, df=2, р=0,000 |
χ2=180,187, df=2, р=0,000 |
χ2= 118,42; df=1; р=0,000 |
χ2= 84,50; df=1; р=0,000 |
|
|
Аллели |
||||
|
Pro12 |
89,9% |
89,4% |
91,1% |
83% |
|
Ala12 |
10,1% |
10,6% |
8,9% |
17% |
|
χ2=411,54, df=1, р=0,000 |
χ2=290,04, df=1, р=0,000 |
χ2=75,8; df=2; p=0,000 |
χ2=49,02; df=2; p=0,000 |
перемии. Толщину КИМ общей сонной артерии (ОСА) определяли с помощью ультразвука высокого разрешения.
Геномную ДНК выделяли из лимфоцитов периферической крови по стандартному протоколу с использованием набора реагентов Diatom TM DNA Prep 200 (производство ООО «Лаборатория ИзоГен»). Путем ПЦР-амплификации изучали распределение Pro12Ala полиморфного маркера гена PPARγ. ПЦР анализ проводили с использованием набора реагентов для ПЦР амплификации ДНК GenePak TM PCR Core (производство ООО «Лаборатория ИзоГен»). Для проведения ПЦР амплификации использовали GeneAmp® ПЦР система 9700 с золотым 96-ячеечным блоком (Applied Biosystems). Для генотипирования Pro12Ala полиморфного маркера гена PPARγ использовалась следующая последовательность праймеров:
-
• Forward primer 5’- TCT GGG AGA TTC TCC TAT TGGC-3’ • Reverse primer 5’- CTG GAA GAC AAC TAC AAG AG-3’
Амплификацию полиморфных участков гена
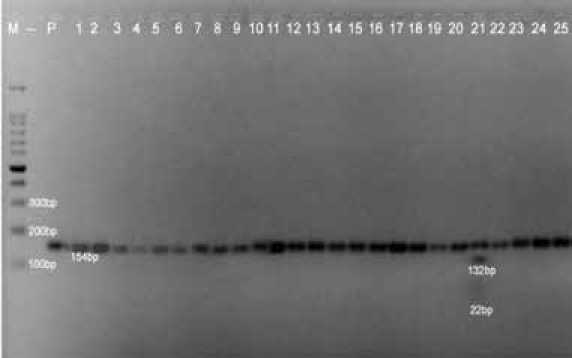
Рис. 1. Результаты RLFP-анализа Pro12Ala полиморфизма гена PPARγ.
I 50 I
PPARγ проводили по следующей программе: первый цикл – 94ºС/5мин, 35 циклов – 94ºС/30сек, 52ºС/30сек, 72ºС/30сек, последний цикл – 72ºС/5мин. ПЦР продукт для Pro12Ala полиморфного маркера гена PPARγ имел 154 п.н.
Для идентификации аллелей применялись рестриктаза BstSFI. Пробы выдерживались в течение 2-х часов при температуре 60ºС. Конечные продукты расщепления фракционировали с помощью электрофореза в 4% агарозном геле с последующей окраской в растворе бромистого этидия (0,01%) и визуализацией под ультрафиолетовым светом [6].
В результате амплификации фрагмент, состоявший из 154 п.н., соответствовал широко распространенному Pro12 аллелю, а наличие двух фрагментов из 132 п.н. и 22 п.н. – Ala12 аллелю, наличие трех фрагментов: 154 п.н., 132 п.н. и 22 п.н. оценивалось как гетерозиготное состояние Pro12/ Ala12 (рис. 1).
Статистическая обработка полученных резуль-
Таблица 3. Сравнительная характеристика больных АГ и МС с учетом носительства Pro12Ala полиморфного маркера гена PPARγ
|
Параметры |
Pro-аллель (n=188) |
Р |
Ala-аллель (n=48) |
|
САД, мм рт. ст. |
159,9±16,1 |
0,71 |
157,3±14,5 |
|
ДАД, мм рт. ст. |
102,4±9,6 |
0,31 |
100,8±9,6 |
|
ЧСС, уд/мин. |
79,9±9,3 |
0,034* |
76,5±7,8 |
|
иММЛЖ, г/м2 |
167,3±40,3 |
0,37 |
161,8±28,9 |
|
ΔD, % |
4,3±6,0 |
0,05 |
6,3±7,5 |
|
КИМ, мм |
0,99±0,24 |
0,32 |
0,95±0,20 |
|
МАУ, мг/л |
25,1±31,5 |
0,020* |
13,9±15,5 |
|
ОХС, мг/дл |
222,0±34,8 |
0,48 |
217,7±48,1 |
|
ТГ, мг/дл |
206,0±111,9 |
0,78 |
212,0±207,0 |
|
ХСЛВП, мг/дл |
39,7±6,4 |
0,18 |
38,4±6,0 |
|
ХСЛНП, мг/дл |
142,0±30,7 |
0,34 |
137,0±39,1 |
|
Глюкоза натощак, ммоль/л |
4,9±0,9 |
0,32 |
4,7±0,5 |
татов проводилась по стандартным программам из пакета Statistica 6.0. Оценивалось соответствие числовых данных нормальному закону распределения. Определяли: выборочное среднее арифметическое X; выборочное среднее квадратичное (стандартное) отклонение – SD; результаты представлены Χ±SD. Для оценки различий между сравниваемыми средними значениями независимых использовали t- критерий Стьюдента. Для анализа достоверности различий между качественными признаками использовали критерий χ2. Рассчитывали относительный риск (OШ) с использованием мультипликативной генетической модели. Статистически значимыми считали различия при р<0,05.
Среди обследованных больных частота встречаемости Pro12 аллеля гена PPARγ составила 89,9%, а Ala12 аллеля – 10,1%, χ2=411,54, df=1, р=0,000. У больных АГ Pro/Pro генотип встречался в 80,4% случаев, Pro/Ala генотип – в 19,0%, Ala/Ala генотип – в 0,6% случаях, χ2=255,82, df=2, р=0,000.
Распределение Pro12Ala полиморфного маркера гена PPARγ у здоровых лиц было несколько иным, в частности, отмечено отсутствие Ala/Ala гомозигот, преобладание Pro/Pro генотипа (66%) против Pro/Ala генотипа (33%), χ2=49,02; df=2; p=0,000, а частоты Pro12 и Ala12 – аллелей составили 83% и 17%, соответственно (χ2= 84,50; df=1; р=0,000).
Среди обследованных больных с АГ МС диагностирован у 118 больных (72,4%). Частота распределения аллелей и генотипов Pro12Ala полиморфизма гена PPARγ у больных АГ с МС следующей: носительство Pro12 аллеля встречалось в 89,4% случаев, а носительство Ala12 аллеля – в 10,6% случаев, χ2=290,04, df=1, р=0,000. Pro/Pro генотип встречался в 79,7% случаев, Pro/Ala генотип – в 19,5%, Ala/Ala генотип – в 0,8% случаях, χ2=180,187, df=2, р=0,000.
У больных с АГ без МС соотношение Pro/ Pro:Pro/Ala:Ala/Ala-генотипов было 82,2%:17,8%:0 (χ2=75,8; df=2; p=0,000), а частоты Pro12 и Ala12 – аллелей 91,1%:8,9% (χ2= 118,42; df=1; р=0,000), таблица 2.
Следует отметить, что распределение частот генотипов среди больных и здоровых лиц соответствовало равновесию Харди-Вайнберга.
Таким образом, выявлено накопление Pro12 аллеля и Pro/Pro генотипа как у больных АГ с и без МС, так и у здоровых лиц узбекской национальности.
В дальнейшем анализ ассоциации Pro12Ala полиморфизма гена PPARγ с показателями системной и центральной гемодинамики, маркерами сосудистого ремоделирования проводился в зависимости от носительства аллелей в группе больных с АГ и МС (табл. 3).
При анализе показателей уровня АД, иММЛЖ, липидов носители Pro- и Ala-аллелей между собой не различались. Уровень гликемии натощак и после нагрузки также не зависела от Pro12Ala полиморфизма гена PPARγ. Следует отметить, что у носителей Pro-аллеля гена PPARγ выявлена более высокая ЧСС: 79,9±9,3 уд/мин против 76,5±7,8 уд/мин, р=0,034. Носители Pro-аллеля
--------------------------------------------------1 51 I имели несколько выраженную нарушенную ЭЗВД по сравнению с носителями Ala-аллеля: 4,3±б,0% против б,3±7,5%, р=0,05. Уровень МАУ также был достоверно высокий в группе больных-носителей Pro-аллеля гена PPARy: 25,1±31,5мг/л против 13,9±15,5мг/л, р=0,020.
Расчет генетического риска развития МС с использованием мультипликативной модели наследования показал, что наличие Pro-аллеля гена PPARy было связано с повышенным риском (ОШ 1,73 при 95% ДИ 0,89-3,37), а наличие Ala-аллеля -со сниженным риском развития МС (ОШ 0,58 при 95% ДИ 0,30-1,13), но без статистической достоверности, р=0,1.
Частота встречаемости генотипов Рго12А1а полиморфизма гена PPARy изучена в различных популяциях. Во всех популяциях отмечено широкое распространение Pro 12-аллеля и Рго/Рго-генотипа. В исследовании G. Sanchez et al., проведенное у испанцев (п=464) распространенность Рго/Рго-генотипа составила 82,9% у мужчин, 83,1% у женщин, гетерозигот - 15,7%, 16,5%, гомозигот по А1а12-аллелю - 1,4%, 0,4%, соответственно [7]. Исследование, проведенное на датской популяции (п=2245), показало также большее накопление Рго/Рго-генотипа среди лиц с ИР, так и без ИР: 75,5% и 74,2%, соответственно. Распределение гетерозигот среди обеих групп было равномерным: 23,8% и 23%, соответственно. Отмечалось несколько большее накопление Ala/Ala генотипа у лиц без ИР (2,8%) по сравнению лиц без ИР (0,7%) [8]. В азиатских популяциях наблюдается аналогичная картина, но частота А1а12аллеля была значительно ниже. Так, в исследовании J. Yamamoto, проведенное среди японцев - больных с АГ, частота Рго/Рго-генотипа составила 95,1%, Pro/Ala-генотипа - 4,9%, Ala/Ala генотип отсутствовал [6]. Среди китайцев - больных АГ и МС распределение генотипов Рго12А1а полиморфизма гена PPARy было аналогичным: гомозиготы по Рго12-аллелю - 90,9%, гетерозиготы - 9,09%, гомозиготы по 12А1а-аллелю отсутствовали [9].
По данным Мкртумян А. М.и соавт. частота встречаемости Pro аллеля была выше частоты Ala аллеля в русской популяции. Так, определение частот аллелей Pro и Ala показало, что в группе больных с МС они составили, соответственно, 0,81 и 0,19, в группе лиц без МС - 0,69 и 0,31. При оценке распределения частот генотипов Pro 12Ala полиморфного маркёра гена PPARy отмечено, что частоты генотипов Pro/Pro, Pro/Ala и Ala/Ala в группе больных МС составили 0,65, 0,33 и 0,02, |52 |------------------------------- соответственно. В контрольной группе обнаружены следующие частоты указанных генотипов Рго12А1а полиморфного маркёра гена PPARy: 0,52, 0,33 и 0,15, соответственно [10].
По результатам нашего исследования у лиц узбекской популяции также отмечается большее накопление Рго12 аллеля и Pro/Pro генотипа каку больных АГ с и без МС, так и у здоровых лиц.
Вопрос о влиянии Рго12А1а полиморфизма гена PPARy на риск развития нарушений углеводного и липидного обмена остается открытым, т.к. полученные результаты разноречивые. По данным ряда авторов Pro 12Ala полиморфный маркер гена PPARy ассоциируется с уровнем глюкозы, инсулина, липидов, а также с риском развития сахарного диабета [11]. Так, в исследовании L. Dongxia выявлено, что 12А1а-аллель носит про-тективный характер, а носители Pro/Pro генотипа имели более высокий уровень инсулина натощак, индекса HOMA-IR [9]. У больных СД-2 выявлена связь полиморфного маркёра Рго12А1а с увеличением ИМТ [12]. Результаты исследования М. Ghoussaini также свидетельствуют об ассоциации Рго12-аллеля с повышенным уровнем инсулина, индекса HOMA-IR улиц с ожирением, и носительство данного аллеля увеличивает риск развития сахарного диабета у лиц с ожирением [13]. Схожие данные получены в исследованиях Gonzalez Sanchez [7] и L. Frederiksen [8], где носители 12А1а-аллеля имели большую инсулиночувствитель-ность и лучший липидный профиль по сравнению с носителями Pro/Pro генотипа. В исследовании на мексиканской популяции S.A. Cole и соавт., напротив, доказали явную связь генотипа Ala/Ala с развитием ожирения, что, в свою очередь, является риском развития ИР [14].
Следует отметить, в некоторых исследованиях вышеуказанные взаимосвязи не найдены. В исследовании J. Yamamoto не выявлена ассоциация между Рго12А1а полиморфизмом гена PPARy и инсулиночувствительностью [6]. При изучении различных полиморфизмов (-681 C>G, -689С.Т, Рго12А1а, 1431С>Т) улиц с МС французской популяции выявлено, что в отдельности ни один из полиморфизмов не ассоциировался с МС, но специфический гаплотип этих полиморфизмов гена PPARy ассоциировался с повышенным риском МС [15]. В исследовании, проведённом на датской популяции, S.K. Hansen и соавт. тоже не обнаружили ассоциации данного полиморфизма с СД 2 типа [16]. Мы в своем исследовании также не нашли ассоциацию с Рго12А1а полиморфизмом гена PPARy и показателями системной и центральной гемодинамики, липидов, гликемии. Но выявлена взаимосвязь между носительством Pro аллеля гена
PPARy и уровнем ЧСС, МАУ.
Согласно полученным данным Мкртумян А.М. и соавт., риск развития МС в русской популяции оказался связан с носительством Pro аллеля (OR = 2,06; Cl -1,30-3,26) и генотипа Pro/Pro (OR = 1,74; Cl = 1,01-3,06) Рго12А1а полиморфного маркёра гена PPARy [10]. В другом исследовании, проведенной Кобалавой Ж.Д. и др., у больных АГ показано, что у носителей Pro аллеля гена PPARy ИР встречался чаще, чем у пациентов-носителей Ala аллеля. Установлена связь Рго12А1а полиморфного маркёра гена PPARy со значениями ДАД [17]. По результатам нашего исследования носительство Pro аллеля также связано с риском развития МС (ОШ 1,73 при 95% ДИ 0,89-3,37), но без статистической достоверности, р=0,1.
Итак, в настоящее время активно обсуждается возможность определения генетической предрасположенности к развитию ИР. Взаимосвязь между генетическими и средовыми при формировании МС является сложной и пока еще недостаточно понятной. Несмотря на то, что окончательно неизвестны все генетические маркёры, развитие высоких технологий позволит производить массовое обследование населения для выявления генетически обусловленной предрасположенности к МС.
-
1. Впервые изучен Pro 12Ala полиморфизм гена PPARy у больных мужчин АГ с наличием и отсутствием МС и здоровых лиц узбекской популяции. Выявлено накопление Рго12 аллеля и Pro/Pro генотипа Рго12А1а полиморфного маркера PPARy как у больных АГ с наличием и отсутствием МС, так и у здоровых лиц узбекской национальности.
-
2. Рго12А1а полиморфизм гена PPARy не ассоциируется со степенью АГ, ГЛЖ, но носительство Pro-аллеля связано с выраженностью ЧСС, МАУ и дисфункцией эндотелия у больных АГ с МС узбекской национальности.
-
3. У больных АГ с МС - носителей Рго-аллеля Рго12А1а полиморфного маркера PPARy вероятность развития МС выше (ОШ 1,73 при 95% ДИ 0,89-3,37), в то время как у носителей Ala-аллеля она существенно ниже (ОШ 0,58 при 95% ДИ 0,30-1,13), но без статистической достоверности, р=0,1, что требует дальнейших исследований с включением большой выборки больных.
-
1. Desvergne В., Michalik L, Wahli И4 Transcriptional Regulation of Metabolism //Physiol. Rev. - 2006. -Vol. 86. - P. 465-514.
-
2. Desvergne B., Wahli И4 Peroxisome proliferator-activated receptors: nuclear control of Metabolism //Endocr. Rev. - 1999. -V.20.-P. 649-688.
-
3. Kie-Wilk B., Dembinska-Kie A., Olszanecka A., et al. The selected pahtophysiological aspects of PPARs activation. //J. of Physiology and pharmacology -2005; 56 (2):p. 149.162.
-
4. Semple R.K. Chatterjee V.K., O'Rahilly S. PPAR gamma and human metabolic disease // J. Clin. Invest. - 2006. -V. 116(3). -P. 581-585.
-
5. Cresci S. PPAR genomics and pharmacogenomics: implications for cardiovascular disease// PPAR Research.-2008. - Vol. 2008. - 11 Pages.
-
6. Yamamoto J., Kageyama S., Nemoto M. PPARg2 Pro12Ala Polymorphism and Insulin Resistance in Japanese Hypertensive Patients. // Hypertens Res 2002;25:25-29
-
7. Gonzalez Sanchez J L, Serrano Rios M., Fernandez Perez C. et al. Effect of the Pro 12Ala polymorphism of the peroxisome proliferator-activated receptor g-2 gene on adiposity, insulin sensitivity and lipid profile in the Spanish population.// European Journal of Endocrinology (2002) 147 495-501.
-
8. Frederiksen L, Brodbek K., Fenger M. et al. Studies of the Pro12Ala Polymorphism of the PPAR-Gene in the Danish MONICA Cohort: Homozygosity of the Ala Allele Confers a Decreased Risk of the Insulin Resistance Syndrome. //J Clin Endocrinol Metab 87: 3989-3992,2002.
-
9. Dongxia L, Qi H., Lisong L, Jincheng G. Association of Peroxisome Proliferator-Activated Receptor Gene Pro12Ala and C161T Polymorphisms With Metabolic Syndrome.//Circ J 2008; 72:551 -557.
-
1 1.Swarbrick М.М., Chapman C.M.L., McQuillan В.М.А. Pro12Ala polymorphism in the human peroxisome proliferator-activated receptor-g2 is associated with combined hyperlipidaemia in obesity.// European Journal of Endocrinology (2001) 144 277-282.
-
12 . Vaccaro O. et al. Prol2Ala polymorphism of the PPAR gamma 2 locus modulates the relationship between energy intake and body weight in type 2 diabetic patients // Diabetes Care. -2007. - Vol. 30, №5. p.1156-1161.
-
13 .Ghoussaini M., Meyre D., Lobbens S. et al. Implication of the Pro12Ala polimorphism of the PPAR-gamma 2 gene in type 2 diabetes and obesity in the French population. // BMC MrdicalGenetics 2005;6:11:1471-2350.
-
14 . Cole S. A. et al. The Pro12Ala variant of peroxisome proliferator-activated receptor-G2 (PPARG2) is associated with measures of obesity in Mexican Americans//Int. J. Obes. -2000. -№24.-P. 522-524.
-
15 .Meirhaeghe A., Cottel D., Amouyel P, Dallongeville J. Association Between Peroxisome Proliferator-Activated Receptor Haplotypes and the Metabolic Syndrome in French Men and Women.// Diabetes 2005;54:3043-3048.
-
16 . Hansen SK, Nielsen EM, Ek J, Andersen G. et al. Analysis of separate and combined effects of common variation in KCNJ11 and PPARG on risk of type 2 diabetes. J Clin Endocrinol Metab. 2005; 90(6)3629-3637.
-
17 .КобалаваЖ.Д., Носиков B.B., Толкачева B.B. и др. Клинико-генетические детерминанты нарушений углеводного обмена у больных с артериальной гипертонией и избыточной массой тела. //Кардиология 2005;4:37-43.
Ю.Мкртумян A.M., Бирюкова E.B., Маркина H.B. Молекулярно-генетические особенности, характер метаболизма глюкозы и функция эндотелия у больных метаболическим синдромом русской популяции.// Сахарный диабет 2008;4:26-30.
Список литературы Значение Pr012Ala полиморфизма гена PPARГ при артериальной гипертонии и метаболическом синдроме
- Desvergne В., Michalik L., Wahli W. Transcriptional Regulation of Metabolism//Physiol. Rev. -2006. -Vol. 86. -P. 465-514.
- Desvergne В., Wahli W. Peroxisome proliferator-activated receptors: nuclear control of Metabolism//Endoer. Rev. -1999. -V. 20. -P. 649-688.
- Kie-Wilk B., Dembinska-Kie A., Olszanecka A., et al. The selected pahtophysiological aspects of PPARs activation.//J. of Physiology and pharmacology -2005; 56 (2): p. 149-162.
- Semple R.K., Chatterjee V.K., O'Rahilly S. PPAR gamma and human metabolic disease//J. Clin. Invest. -2006. -V. 116(3). -P. 581-585.
- Cresci S. PPAR genomics and pharmacogenomics: implications for cardiovascular disease//PPAR Research. -2008. -Vol. 2008. -11 Pages.
- Yamamoto J., Kageyama S., Nemoto M. PPARg2 Prol2Ala Polymorphism and Insulin Resistance in Japanese Hypertensive Patients.//Hypertens Res 2002; 25: 25-29
- Gonzalez Sanchez J. L., Serrano Rios М., Fernandez Perez C. et al. Effect of the Prol2Ala polymorphism of the peroxisome proliferator-activated receptor g-2 gene on adiposity, insulin sensitivity and lipid profile in the Spanish population.//European Journal of Endocrinology (2002) 147 495-501.
- Frederiksen L., Brodbek K., Fenger M. et al. Studies of the Prol2Ala Polymorphism of the PPAR-Gene in the Danish MONICA Cohort: Homozygosity of the Ala Allele Confers a Decreased Risk of the Insulin Resistance Syndrome.//J. Clin Endocrinol Metab 87: 3989-3992, 2002.
- Dongxia L., Qi H., Lisong L., Jincheng G. Association of Peroxisome Proliferator-Activated Receptor Gene Prol2Ala and C161T Polymorphisms With Metabolic Syndrome.//Cire J. 2008; 72: 551 -557.
- Мкртумян А. М., Бирюкова E. В., Маркина Н.В. Молекулярно-генетические особенности, характер метаболизма глюкозы и функция эндотелия у больных метаболическим синдромом русской популяции.//Сахарный диабет 2008; 4: 26-30.
- Swarbrick M.M., Chapman C.M.L., McQuillan B.M.A. Prol2Ala polymorphism in the human peroxisome proliferator-activated receptor-g2 is associated with combined hyperlipidaemia in obesity.//European Journal of Endocrinology (2001) 144277-282.
- Vaccaro O. et al. Prol2Ala polymorphism of the PPAR gamma 2 locus modulates the relationship between energy intake and body weight in type 2 diabetic patients//Diabetes Care. -2007. -Vol. 30, № 5. p. 1156-1161.
- Ghoussairii M., Meyre D., Lobbens S. et al. Implication of the Prol2Ala polimorphism of the PPAR-gamma 2 gene in type 2 diabetes and obesity in the French population.//BMC MrdicalGenetics 2005: 6: 11: 1471-2350.
- Cole S. A. et al. The Pro12Ala variant of peroxisome proliferator-activated receptor-G2 (PPARG2) is associated with measures of obesity in Mexican Americans//Int. J. Obes. -2000. -№ 24. -P. 522-524.
- Meirhaeghe A., Cottel D., Amouyel P., Dallongeville J. Association Between Peroxisome Proliferator-Activated Receptor Haplotypes and the Metabolic Syndrome in French Men and Women.//Diabetes 2005; 54: 3043-3048.
- Hansen S.K., Nielsen E.M., Ek J., Andersen G. et al. Analysis of separate and combined effects of common variation in KCNJ11 and PPARG on risk of type 2 diabetes. J. Clin Endocrinol Metab. 2005; 90(6): 3629-3637.
- Кобалава Ж.Д., Носиков B.B., Толкачева В.В. и др. Клинико-генетические детерминанты нарушений углеводного обмена у больных с артериальной гипертонией и избыточной массой тела.//Кардиология 2005; 4: 37-43.


