Значимость метода селективного забора крови из надпочечниковых вен в диагностике АКТГ-независимого гиперкортицизма на фоне двусторонней гиперплазии надпочечников
Автор: Коняшина Я.С., Маргасова А.С., Пугачев М.И., Салухов В.В., Добровольская Л.М., Варнавский В.В.
Журнал: Московский хирургический журнал @mossj
Рубрика: Хирургическая эндокринология
Статья в выпуске: 2 (88), 2024 года.
Бесплатный доступ
Введение. Эндогенный гиперкортицизм - сравнительно редкое патологическое состояние, при этом по тяжести течения и трудовому прогнозу имеет весомое место среди всех эндокринопатий.Клинический случай. Представлен клинический случай АКТГ-независимого гиперкортицизма (синдрома Иценко-Кушинга), а также сложности его диагностики и дифференциального диагноза. В ходе обследования была выявлена двусторонняя гиперплазия надпочечников. Методом сравнительного селективного забора крови из надпочечниковых вен и нижней полой вены была определена латерализация гиперпродукции кортизола. Кроме того, в качестве дополнительного теста для дифференциальной диагностики первичного и вторичного гиперкортицизма была проведена оценка стероидного профиля крови и мочи методом ВЭЖХ, которая подтвердила у пациента АКТГ-независимый гиперкортизолизм (синдром Иценко-Кушинга). Благодаря применению метода ССЗВК удалось решить вопрос об объеме оперативного вмешательства и предотвратить возможную необоснованную двустороннюю адреналэктомию при гормонально-неактивном образовании правого надпочечника. При проведении сравнительного селективного забора крови из надпочечниковых вен (ССЗВК) с целью определения латерализации «эталонным гормоном» у данного пациента был выбран андростендион, что ранее в литературе не описывалось. Было проведено оперативное лечение, и представлена информация о послеоперационном периоде пациента.Выводы. Приведенный клинический случай демонстрирует алгоритм диагностики причин гиперкортицизма, возможные ошибки и применение трудоемких и высокотехнологичных методов диагностики. Также указывается важность мультидисциплинарного подхода, несмотря на изолированную эндокринную патологию.
Гиперкортицизм, синдром иценко-кушинга, гиперплазия надпочечников, селективный забор крови из надпочечниковых вен
Короткий адрес: https://sciup.org/142241734
IDR: 142241734 | УДК: 006.617-089 | DOI: 10.17238/2072-3180-2024-2-83-92
Текст научной статьи Значимость метода селективного забора крови из надпочечниковых вен в диагностике АКТГ-независимого гиперкортицизма на фоне двусторонней гиперплазии надпочечников
Эндогенный гиперкортицизм – сравнительно редкое патологическое состояние, при этом по тяжести течения и трудовому прогнозу имеет весомое место среди всех эндокринопатий. Под термином эндогенный гиперкортицизм принято понимать эндокринную патологию, проявляющуюся вследствие избыточной секреции кортизола надпочечником, вызванной его гипертрофией/гиперплазией, или за счет вторичной стимуляции неизмененной ткани надпочечника адренокортикотропным гормоном (АКТГ), обусловленной аденомой гипофиза или АКТГ-эктопией. В свою очередь в русскоязычной литературе принято разделять понятия болезнь Иценко-Кушинга и синдром Иценко-Кушинга. Болезнь Иценко-Кушинга – это нейроэндокринное заболевание, обусловленное хронической гиперпродукцией АКТГ опухолью гипофиза, что в свою очередь, приводит к повышенной выработке кортизола корой надпочечников и появлению симптомокомплекса гиперкор-тицизма. Синдром Иценко-Кушинга – термин используется для обозначения доброкачественной опухоли надпочечника, секретирующей кортизол; в англоязычной литературе объединяет как первичный, так и вторичный гиперкортицизм.
Ввиду порой неспецифической клинической картины эндогенного гиперкортицизма, его диагностика и дифференциаль- ная диагностика, а также выбор дальнейшей тактики лечения зачастую вызывает трудности и требует мультидисципли-нарного подхода, что не реализуемо в полной мере даже при тщательном обследовании пациентов диспансерной группы в многопрофильных организациях [1], а требует стационарных условий. После подтверждения эндогенной гиперпродукции кортизола по результатам ночного подавляющего теста с 1 мг дексаметазона, необходимо установить этиологию гиперкорти-цизма. Для этого проводят оценку суточного ритма секреции АКТГ, что, как правило, позволяет дифференцировать синдром Иценко-Кушинга (если уровень АКТГ стойко подавлен) и АКТГ-зависимые формы гиперкортицизма (если уровень АКТГ нормальный или повышенный при увеличенном уровне кортизола). Отсутствие подавления кортизола крови более, чем на 50 % от исходного уровня в ходе пробы с 8 мг дексаметазона указывает на АКТГ-независимую форму, т.е. является патологией надпочечников [2], которая встречается приблизительно у 10–20 % пациентов с эндогенным гиперкортицизмом. Причиной синдрома Иценко-Кушинга может быть: доброкачественное новообразование надпочечника, аденома, макро- или микро-узелковая гиперплазия как одного, так и обоих надпочечников или АКТГ-эктопия вследствие нейроэндокринной опухоли, что конечно же требует тщательной дифференциальной диагностики [2, 3]. Встречаются случаи, когда при проведении КТ надпо- чечников, определяется двустороннее поражение (например, сочетание аденомы в одном надпочечнике и гиперплазии в другом), тогда источник гиперпродукции определить не представляется возможным. В таких сложных клинических случаях целесообразно проведение катетеризации и забора крови из надпочечниковых вен. Это технически сложный, но точный метод сравнительной оценки секреторной активности надпочечников, позволяющий определить источник гиперсекреции.
Актуальность
Эндогенный гиперкортицизм встречается в 10 случаях на 1 млн. населения в год в возрасте 20–50 лет, причем у женщин чаще, чем у мужчин [2]. При этом на каждые 5 случаев болезни Иценко-Кушинга приходится 1 случай кортикостеромы [4]. Агрессивное течение заболевания влечет за собой развитие таких тяжёлых кортизол-ассоциированных состояний как: артериальная гипертензия, миокардиодистрофия, сердечная недостаточность, стероидный сахарный диабет, остеопороз, миопатия, ожирение и др. Прогрессирование данных состояний ведёт к увеличению риска развития кардиоваскулярных осложнений, инвалидизации и летальности пациентов. При своевременной диагностике и возможностях хирургического лечения, симптомы гиперкортицизма в большинстве случаев могут быть устранены. «Золотым стандартом» диагностики источника гиперсекреции при двустороннем поражении надпочечников в клинически сложных случаях можно назвать сравнительный селективный забор крови из надпочечниковых вен (ССВЗК) с определением уровня кортизола, альдостерона крови в левой, правой надпочечниковых венах и на периферии либо в нижней полой вене, с последующим расчётом коэффициентов селективности и латерализации. Методика сравнительного ССВЗК продемонстрировала высокую чувствительность (более 90 %) и специфичность – 100 % [5]. Однако методика ССВЗК представляется технически сложной: в большинстве случаев катетеризация правой надпочечниковой вены неуспешна и трактовка результатов исследования крайне затруднительна. Манипуляция селективного забора крови дорогостоящая и инвазивная, требует оснащенной рентгеноперационной, квалифицированного эндоваскулярного хирурга и госпитализации пациента [6, 7]. Тем не менее результаты селективного забора крови могут помочь быстро и правильно установить диагноз и предотвратить ненужные пациенту оперативные вмешательства. Приведенный ниже клинический случай является показательным примером важности проведения ССЗВК при двустороннем поражении надпочечников.
Клинический случай
Пациент, Ф., 1970 г.р., впервые госпитализирован в 1 клинику (терапии усовершенствования врачей) ВМедА в марте 2019 года с жалобами на общую и мышечную слабость в верхних и нижних конечностях, избыточную массу тела, вариабельность артериального давления (уровни АД от 100 и 90 мм рт. ст. до 180 и 110 мм рт. ст. в течение суток), периодическую боль в стопах, возникающую в покое, склонность к гнойничковым высыпаниям и периодический зуд кожи в области спины, умеренную сухость во рту и жажду, учащенное мочеиспускание.
Из анамнеза пациента известно, что с 2010 года отмечал повышение артериального давления до максимальных значений 160 и 100 мм рт. ст., сопровождающееся интенсивной головной болью, преимущественно в затылочной области. По данному поводу пациент амбулаторно консультирован терапевтом, впервые инициирована антигипертензивная терапия (таб. Периндоприл/Индапамид, дозировок не помнит) с умеренным положительным эффектом. В последующем при периодическом самоконтроле отмечалось кризовое течение артериальной гипертензии (максимальный уровень артериального давления 220 и 120 мм рт. ст.) на фоне психоэмоционального стресса. Проведена коррекция гипотензивной терапии (таб. Хинаприл/ Гидрохлортиазид 20/12,5 мг/сут, таб. Лерканидипин 20 мг/сут, таб. Бисопролол 10 мг/сут, таб. Моксонидин 0,4 мг/сут, таб. Торасемид 2,5 мг/сут) с положительным эффектом (уровни артериального давления находятся в целевых значениях 120–130 и 70–80 мм рт. ст.).
В июле 2017 года пациент отметил ухудшение общего состояния в виде появления центрипитального перераспределения подкожного жирового слоя с отложением жира преимущественно в области живота и груди, истончения верхних и нижних конечностей, жажды и сухости во рту. По данному поводу амбулаторно был консультирован эндокринологом. Впервые установлен сахарный диабет 2 типа, инициирована пероральная сахароснижающая терапия (таб. Метформин 2000 мг/сут) под контролем гликемического профиля (глюкоза в течение суток 6–8 ммоль/л, уровень HbA1c 6,26 %). Проведена частичная оценка гормональной функции гипофизарно-адреналовой оси: фоновый кортизол 449 нмоль/л (норма 185–624 нмоль/л), циркадность ритма секреции не определялась, подавлен АКТГ (< 5 пг/мл), ночной подавляющий тест с 1 мг дексаметазона не проводился. Выполнено ультразвуковое исследование органов брюшной полости от 12.07.2017 г.: в проекции надпочечников патологических образований выявлено не было.
В сентябре 2018 года пациент отметил ухудшение общего состояния в виде изменения цвета лица (появление багровоцианотичного оттенка), возникновения множественных гнойничковых высыпаний и подкожных кровоизлияний в области спины, подошвенных бородавок, изменения ногтей (рис. 1).
По данному поводу был консультирован неврологом, дерматологом, терапевтом, эндокринологом. Впервые при ультразвуковом исследовании органов брюшной полости от 15.02.2019 г. выявлено образование правого надпочечника: округлое, анэ-хогенное, с четкими ровными контурами, размерами 20х16х15 мм. По данным КТ надпочечников от 22.02.2019 г. получены данные за наличие узловых образований обоих надпочечни- ков, округлой формы, размерами справа до 24х54 мм, слева до 42х57 мм, нативной плотностью –18–20 HU, неравномерно накапливающие контраст до+45+65 HU, в отсроченную фазу плотность +12+35 HU, коэффициент вымывания не рассчитывался ввиду низкой плотности образований.

Рис. 1. Пациент в 2014 году Рис.2. Пациент в 2018 году Fig 1. The patient in 20142014 Fig 2. The patient in 20182014
В связи с выявленными объемными образованиями надпочечников проведена оценка гормональной активности, по результатам которого было отмечено резкое повышение кортизола слюны 35,6 нмоль/л , кортизола суточной мочи 633 мкг/сут, полное подавление АКТГ < 5 пг/мл, проба с 8 мг дексаметазона – 768 нмоль/л (отсутствие подавления кортизола).
При госпитализации в 1 клинику терапии усовершенствования врачей Военно-медицинской академии – состояние расценивалось как удовлетворительное. Телосложение гиперстеническое, питание избыточное, отложение жира в области живота, груди и VII шейного позвонка «бычий горб», истончение верхних и нижних конечностей. ИМТ – 29 кг/м2. Лицо ярко гиперемировано, преобладает багрово-цианотичный оттенок («матронизм»), отмечается экзофтальм обоих глаз. Мраморность и истончение кожных покровов нижних конечностей, множественные гнойничковые высыпания и подкожные кровоизлияния по всей поверхности спины. Стрий на момент поступления выявлено не было. Тургор кожи снижен. Частота пульса отмечена на уровне – 60 уд. в мин. (на фоне приема 10 мг бисопролола в сутки). Артериальное давление, измеренное методом Короткова 140 и 80 мм рт. ст. За период госпитализации пациенту выполнен обширный перечень исследований с целью проведения дифференциальной диагностики между болезнью и синдромом Иценко-Кушинга (табл. 1).
Таблица 1
Результаты обследования пациента Ф. за период госпитализации (с 11.03.2019 г. по 25.03.2019 г.)
Table 1
Results of the examination of patient F. for the period of hospitalization (from 11.03.2019 to 25.03.2019)
|
Показатели / Indicators |
Результаты/ Results |
|
Глюкоза, ммоль/л (референсные значения – 3,1–6,1), /Glucose, mmol/l (reference values – 3,1–6,1) |
8,09 |
|
HbA1c (менее 6,5%)/HbA1c (less than 6,5 %) |
7,1 |
|
Калий, ммоль/л (референсные значения – 3,6–5,3) / Potassium, mmol/l (reference values – 3,6–5,3) |
3,9 |
|
Креатинин, мкмоль/л (58–110), /Creatinine, mmol/l (58–110) |
113 |
|
Общий белок, г/л (64 – 83) /Total protein, g/l (64 – 83) |
67 |
|
Общий холестерин, ммоль/л (менее 4,5)/Total cholesterol, mmol/L (less than 4,5), |
3,82 |
|
ЛПНП, ммоль/л (менее 1,4)/LDL, mmol/L (less than 1,4) |
1,83 |
|
ДЭА-С, мг/дл (44,3 – 331,0)/DEA-C, mg/d (44,3 – 331,0) |
112 |
|
Кортизол в слюне, нмоль/л (менее 9,4)/Cortisol in saliva, nmol/L (less than 9.4) |
35,6 |
|
Свободный кортизол в суточной моче, нмоль/24 ч (60–413)/Free cortisol in daily urine, nmol/24 h (60–413) |
633 |
|
Кортизол в сыворотке крови утром, нмоль/л (150–690 /Morning serum cortisol, nmol/L (150–690) |
449 нмоль/л/ 449 nmol/L |
|
Ночной короткий тест с 1 мг ДМТ (менее 50 нмоль/л)/Overnight short test with 1 mg DMT (less than 50 nmol/L) |
320 нмоль/л, /320 nmol/L |
|
Уровень АКТГ в сыворотке крови утром, пг/мл (до 46) /Morning serum ACTH level, pg/ml (up to 46) |
менее 5, /less than 5 |
Продолжение Таблицы 1
|
Большой дексаметазоновый тест (8 мг)/Large Dexamethasone Test (8 mg) |
768 нмоль/л (проба отрицательная)/ 768 nmol/L (test negative) |
|
МРТ ХСО с в/в контрастированием (1,5 Т)/MRI XCO with intravenous contrast (1,5 T) |
Данных за аденому гипофиза не получено/ There are no data for pituitary adenoma. |
|
КТ забрюшинного пространства с в/в контрастированием (рис. 4)/CT scan of the retroperitoneal space with intravenous contrast (fig. 4) |
Надпочечники расположены обычно. Крупные узловые образования надпочечников, округлой формы, плотность –18 –20 HU, неравномерно накапливают контраст до +45 +65, в отсроченную фазу плотность + 12 + 35 HU, размеры образований справа до 2,4 х 5,4 см, слева до 4,2 х 5,7 см/. The adrenal glands are normally located. Large nodular formations of the adrenal glands, rounded in shape, density –18 –20 HU, unevenly accumulate contrast up to + 45 + 65, in the delayed phase density + 12 + 35 HU, the size of the formations on t he right is up to 2,4 x 5,4 cm, on the left up to 4,2 x 5,7 cm |
На основании клинико-анамнестических данных (изменение внешности по «кушингоидному» типу, неконтролируемое течение артериальной гипертензии), лабораторных (отрицательная проба с 8 мг дексаметазона, подавленный уровень АКТГ) и инструментальных исследований (по данным КТ выявлены образования обоих надпочечников, размерами справа до 24х54 мм, слева до 42х57 мм; не выявлено наличие аденомы гипофиза по результатам МРТ хиазмально-селлярной области) пациенту впервые установлен диагноз: «АКТГ-независимый синдром Иценко-Кушинга». Учитывая крупные размеры объемных образований в надпочечниках, наличие объемного образования в печени неизвестного генеза, выполнена КТ органов брюшной полости, оценен уровень дегидроэпиандростерон-сульфата (ДЭА-С) – 112 мг/дл, по результатам которых убедительных данных за злокачественный генез образований получено не было. Для оценки кортизол-ассоциированных состояний выполнены фиброгастродуоденоскопия (ФГДС), двухэнергетическая рентгеновская абсорбциометрия (dualenergy X-ray absorptiometry – DXA), оценка функции сердечно-сосудистой системы. Получены данные за формирование вторичной кардиомиопатии (по сравнению с Эхо-КГ от 2018 г. (табл. 2) – отрицательная динамика в виде увеличения размеров сердца). Пациент выписан с рекомендациями выполнения селективного забора крови из надпочечниковых вен с целью определения латерализации гормонально-активного образования и решения вопроса об объеме оперативного лечения [8].
В апреле 2019 года консультирован хирургом. Несмотря на прогрессирование клинических проявлений эндогенного гиперкортицизма, рекомендовано дообследование. В серии гормональных исследований от апреля 2019 года отмечался подавленный уровень АКТГ (менее 1,1 пмоль/л), отсутствие МР-данных за аденому гипофиза.
При дообследовании от июля 2019 по данным МР-контроля получены данные за микроаденому гипофиза размером 4,5 мм с нечеткими контурами, которая была расценена как АКТГ-секретирующая (рис. 3). Консультирован нейрохирургом, рекомендовано хирургическое лечение. 22.10.2019 г. выполнена транссфеноидальная аденомэктомия. По результатам гистологического исследования было выявлено доброкачественное новообразование гипофиза, данных за кортикотропиному не получено. Гистологическое заключение: фрагменты нейрогипофиза с очаговыми кровоизлияниями и аденомы с участками альвеолярного и фетального строения из ацидофильных и хромофобных клеток.
В послеоперационном периоде выполнена оценка функции гипофиза, по результатам которой нарушений его гормональной активности не выявлено: ТТГ – 0,43 мкМЕ/мл (норма 0,27 – 4,2), ФСГ 28,56 мМЕ/мл (норма 1,5 – 12,4), пролактин 210 мкМЕ/мл (норма 86 – 324), ЛГ 10 мМЕ/мл (норма 1,7 – 8,6), ИФР-1 174 нг/мл (норма 74 – 196). Кроме того, принимались во внимание возможные нарушения синтеза антидиуретического гормона, но клинических проявлений несахарного диабета не отмечалось, относительная плотность мочи в общем анализе сохранялась адекватной (выше 1010). Уровень АКТГ продолжал оставаться подавленным (менее 5 пг/мл) в сочетании с резким повышением уровня кортизола в слюне 46,65 нмоль/л (норма менее 9,4).
Таблица 2
Результаты эхокардиографии пациента Ф. за период наблюдения
Table 2
Echocardiography results of patient F. during the follow-up period
|
Параметры/ Options |
Май/ 2018 г. May Oct.2018 |
Март/ 2019 г. March Oct. 2019 |
Февраль/ 2020 г. February 2020 |
Март/ 2021 г. March Oct. 2021 |
Норма/ Norm |
|
Раскрытие створок АК Opening of AC flaps |
– |
23 |
– |
18,8 |
>15 мм |
|
Передне-задний размер ЛП, Anterior-posterior LP size |
– |
45 |
– |
41,2 |
19–40 мм |
|
Толщина МЖП |
12 |
10 |
12 |
10,3 |
7–11 мм |
|
Толщина задней стенки ЛЖ, MVP thickness |
11 |
13 |
14 |
11,4 |
7–11 мм |
|
Толщина свободной стенки ПЖ, Pancreatic free wall thickness |
– |
4,8 |
4,84 |
3,75 |
<5 мм |
|
КДР ЛЖ, CDR LV |
55 |
56,7 |
59,9 |
54, 2 |
35–57 мм |
|
КСР ЛЖ, CSR LV |
30 |
37,4 |
41,3 |
38,3 |
21,6–34,8 мм |
|
ФВ ЛЖ, EF LV |
71 |
62 |
– |
58,6 |
>50 % |
|
КДР ПЖ переднезадний, CDR RJ anteroposterior |
– |
29 |
28,4 |
27,1 |
<30 мм |
|
Индекс массы миокарда ЛЖ, Index mass myokarda LS |
118 |
123 |
129 |
120 |
< 115 г/м2/ g/m2 |
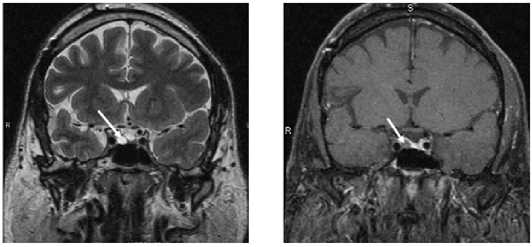
Рис. 3. МРТ хиазмально-селлярной области 2019 г. Стрелками обозначена аденома гипофиза.
Fig. 3. MRI of the chiasmal-sellar area, 2019, arrows indicate pituitary adenoma.
Пациент повторно госпитализирован в 1 клинику (терапии усовершенствования врачей) для дообследования и решения вопроса об объеме оперативного лечения АКТГ-независимого синдрома Иценко-Кушинга. Вновь проведены пробы с 2 мг и 8 мг дексаметазона – пробы отрицательные (фоновый кортизол крови в 9:00 – 441 нмоль/л). Малый дексаметазоновый тест (2 мг): кортизол на пробе – 650 нмоль/л (N <50 нмоль/л). Боль- шой дексаметазоновый тест (8 мг): кортизол – 430 нмоль/л. Повторно подтверждена АКТГ-независимая форма синдрома Иценко-Кушинга. Исключены: гиперальдостеронизм (альдостерон, ренин, альдостерон/рениновое соотношение в норме, электролитных нарушений не выявлено) и феохромоцитома (метанефрин, норметанефрин в норме).
В качестве дополнительного теста для проведения дифференциальной диагностики первичного и вторичного ги-перкортицизма на базе клиники им. Э.Э. Эйхвальда СевероЗападного медицинского Университета была использована оценка стероидного профиля крови и мочи методом ВЭЖХ. По данным (Ворохобиной Н.В., Великановой Л.И. и соавт.) у больных с СИК уровни F, B и S крови, экскреция FF и FE с мочой, а также соотношение F/E крови и FF/FE мочи достоверно выше, чем у больных с субклиническим СИК. У больных с СИК гипофизарного генеза соотношение F/E крови достоверно выше, а уровень B и S достоверно ниже, чем у больных с СИК надпочечникового генеза. Значительное увеличение F крови и экскреции FF и FE с мочой, а также увеличение соотношения F/E крови и FF/FE мочи, качественное изменение стероидного профиля являются признаками органического эндогенного гиперкортицизма по данным ВЖЭХ и могут быть использованы для его диагностики до проведения пробы с дексаметазоном. Таким образом, у нашего пациента методом ВЭЖХ подтверждено наличие АКТГ-независимого гиперкортицизма (табл. 4, 5) [9].
Таблица 4
Стероидной профиль мочи методом ВЭЖХ
Таблица 5
Стероидной профиль крови методом ВЭЖХ.
Blood steroid profile by HPLC.
Urine steroid profile by HPLC
Table 4
|
Наименование теста/ Name of the test |
Результат/ Result |
Нормы/ Norms |
Ед. изм/ Units |
|
Свободный кортизол мочи (метод ВЭЖХ) FF/ Free Urinary Cortisol (HPLC) FF |
87,0 |
10–25 |
мкг/с µg/s |
|
Свободный кортизон мочи (метод ВЭЖХ) FE/ Free Urinary Cortisone (HPLC) FE |
140,1 |
20–75 |
мкг/с µg/s |
|
Индекс свободный кор-тизон/свободный кортизол в моче/ Urinary Free Cortisone/Free Cortisol Index |
1,6 |
2–3 |
– |
|
6 в-гидроксикортизол мочи (метод ВЭЖХ), 6-Urinary v-hydroxycortisol (HPLC) |
462,5 |
40–300 |
мкг/с µg/s |
|
18 гидроксикортикостерон мочи (метод ВЭЖХ)/ 18 Urinary hydroxycorticosterone (HPLC method) |
28,4 |
< 30 |
мкг/с µg/s |
|
Индекс 6 в-гидроксикортизол мочи/свободный кортизол в моче/ Urinary Hydroxycortisol Index/ Urinary Free Cortisol 6 |
5,3 |
2–12 |
Table 5
|
Наименование теста Name of the test |
Результат Result |
Нормы Norms |
Ед. изм. Units |
|
Кортизол (метод ВЭЖХ) (F)/ Cortisol (HPLC) (F) |
176,2 |
45–140 |
нг/мл ng/mL |
|
Кортизон (метод ВЭЖХ) (Е)/ Cortisone (HPLC) (E) |
13,9 |
10–25 |
нг/мл ng/mL |
|
Кортикостерон (метод ВЭЖХ) (B)/Corticosterone (HPLC) (B) |
7,7 |
< 3,0 |
нг/мл ng/mL |
|
11-дезоксикортикостерон (метод ВЭЖХ) (DOC)/ 11-Deoxycorticosterone (HPLC) (DOC) |
<0,5 |
< 3,0 |
нг/мл ng/mL |
|
11-дезоксикортизол (метод ВЭЖХ) (S)/11-Deoxycortisol (HPLC) (S) |
5,8 |
< 2,0 |
нг/мл ng/mL |
|
Индекс кортизол/кортизон в крови/ Blood cortisol/cortisone index |
12,7 |
4–6 |
|
|
18-гидроксикортико-стерон (метод ВЭЖХ)/ 18-Hydroxycorticosterone (HPLC method) |
<0,5 |
< 1,0 |
нг/мл ng/mL |
|
11-дегидроксикортико-стерон (метод ВЭЖХ)/ 11-Dehydroxycorticosterone (HPLC method) |
<0,5 |
< 3,0 |
нг/мл ng/mL |
Установлен диагноз: АКТГ-независимый синдром Ицен-ко-Кушинга. Макронодулярная гиперплазия обоих надпочечников. Состояние после аденомэктомии гипофиза от 22.10.2019 г.
При КТ-контроле образования обоих надпочечников без динамики роста (рис. 4). По данным DXA впервые выявлена остеопения в поясничном отделе позвоночника (Т-критерий –1,9 SD). МРТ хиазмально-селлярной области (ХСО): состояние после удаления аденомы гипофиза, послеоперационные изменения, без признаков рецидива.
Таким образом, имея двустороннее симметричное поражение надпочечников, неэффективность оперативного лечения в объеме трансназальной аденомэктомии, повторно поставлен вопрос о проведении сравнительного селективного забора крови из надпочечниковых вен.
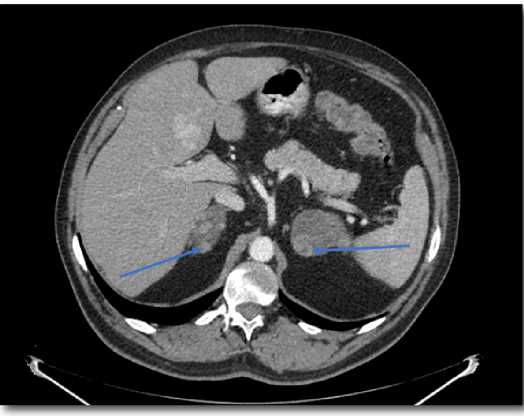
Рис 4. КТ надпочечников с контрастированием от 2020 г. Стрелками указаны объемные образования левого и правого надпочечников Fig 4. CT scan of the adrenal glands with contrast from 2020
Летом 2020 года в эндокринологическом отделении клиники им. Э.Э. Эйхвальда Северо-Западного медицинского Университета выполнен сравнительный селективный забор крови из надпочечниковых вен и нижней полой вены с целью определения доминирующей стороны продукции кортизола. Диагностические градиенты оценивались по модифицированной нами методики на основе способа оценки латерализа-ции секреции альдостерона. Так как в исходной методике для контроля успешности катетеризации надпочечниковой вены используется определение уровня кортизола [10], а в нашем случае именно этот гормон является искомым, мы видоизменили методику. Тем самым, для контроля селективности мы предложили использовать андростендион, а расчет коэффициента латерализации производился на основании соотношения кортизол/андростендион.
Формулы расчета коэффициентов селективности и латерализации
Расчет коэффициента селективности
(успешная катетеризация при коэффициенте более 3):
андростендион (ПНВ) , также рассчитываем андростендион (НПВ или периферия) и слева.
Расчет коэффициента латерализации (при наличии одностороннего поражения коэффициент более 2,5):
-
1) кортизол (ПНВ) , также рассчитываем и
андростендион (ПНВ)
слева;
-
2) Делим число с доминантной
стороны на меньшее.
Таблица 6
Результаты сравнительного селективного забора крови из надпочечниковых вен и нижней полой вены
Table 6
Results of comparative selective blood sampling from the adrenal veins and inferior vena cava
|
Вена/ Vena |
К, нмоль/л/ K, nmol/L |
АДС, пг/мл/ ADS, pg/ml |
АНС, пг/мл/ ANS, pg/ml |
ДЭА-С/ DEA-S |
К/АНС/ K/ANS |
ГС (по АНС)/ SG (according to ANS) |
ГЛ/ GL |
|
ПНВ/ RAV |
745 |
2684 |
14,2 |
1,1 |
52 |
4,8 |
2,75 |
|
ЛНВ/ LAV |
7500 |
3815 |
52,1 |
1,4 |
143 |
17,9 |
|
|
НПВ/ IVC |
483,0 |
2684 |
2,9 |
0,9 |
– |
– |
– |
Примечание: ПНВ – правая надпочечниковая вена; ЛНВ – левая надпочечниковая вена; НПВ – нижняя полая вена. К – кортизол, АДС – альдостерон, АНС – андростендион, ГС – градиент селективности, ГЛ – градиент латерализации.
Note: RAV – right adrenal vein; LAV – left adrenal vein; IVC – inferior vena cava. K – cortisol, ADS – aldosterone, ANS – androstenedione, SG – selectivity gradient, GL – lateralization gradient.
Полученный градиент селективности (по андростендиону: слева 17,9 и справа 4,8 (более 3 раз по сравнению с периферическим образцом) позволил достоверно интерпретировать андростендион-корректированный уровень кортизола с последующим определением коэффициента латерализации – 2,75 (более 2,5), что свидетельствует об односторонней гиперпродукции кортизола левым надпочечником (табл. 6). Рекомендовано проведение оперативного вмешательства в объеме левосторонней адреналэктомии [11].
В феврале 2021 г. выполнена эндоскопическая адреналэктомия слева. Микроскопическое описание препарата: ткань надпочечника с многочисленными фокусами гиперплазии клубочковой, пучковой и сетчатой зоны коркового слоя. Встречаются множественные узелки, состоящие из крупных, оксифильных, кубической или призматической формы клеток. Проведено гормональное исследование после операции, по результатам которого отмечено снижение кортизола крови (325,0®269,0 нмоль/л), уровень АКТГ <5 пг/мл.
В связи с тем, что в послеоперационном периоде убедительных данных за наличие первичной послеоперационной надпочечниковой недостаточности не получено (суточный ритм секреции кортизола сохранен: кортизол крови в 08:00 – 150,56 нмоль/л, в 23:00 – 73,58 нмоль/л. Полное подавление АКТГ 4,26 пг/мл), принято решение о наблюдении в динамике за уровнем АКТГ, суточной экскреции кортизола с мочой, электролитов. В ходе наблюдения за пациентом после хирургического лечения и подбора адекватной терапии, отмечается регрессия некоторых осложнений эндогенного гиперкортицизма: артериальная гипертензия контролируется приёмом 2-х гипотензивных препаратов в минимальных дозах (ранее их было 5), сердечно-сосудистых осложнений, таких как гипертрофия левого желудочка (выявлены признаки обратного ремоделирования миокарда), углеводный обмен компенсирован, минеральная костная плотность достигла нормальных значений.
Выводы
Особенностью данного клинического случая является сложность поиска причин эндогенного гиперкортицизма, в связи с наличием образований и гипофиза, и надпочечников, что требовало тщательной трудоемкой дифференциальной диагностики. Таким образом, пациенту длительное время не устанавливался адекватный диагноз, вследствие нераспознанного вовремя эндогенного гиперкортицизма, что повлекло за собой развитие множества осложнений этого патологического состояния. В связи с двусторонним поражением возникла необходимость определения латерализации с целью возможного сохранения одного из надпочечников. При проведении сравнительного селективного забора крови из надпочечниковых вен (ССЗВК) с целью определения латерализации «эталонным гормоном» у данного пациента был выбран андростендион, что ранее в литературе не описывалось. Необходимо отметить, что при ретроспективном анализе данной клинической ситуации мы считаем, что проведение манипуляции селективного забора крови из надпочечниковых вен рассматриваемому пациенту в 2019 году, в ближайшее время после подтверждения АКТГ-независимого синдрома Кушинга, предостерегла бы его от удаления гормонально-неактивной микроаденомы гипофиза. Кроме того, в качестве дополнительного теста для проведения дифференциальной диагностики первичного и вторичного гиперкортицизма нами была использована оценка стероидного профиля крови и мочи методом ВЭЖХ, что подтвердило у пациента АКТГ-независимый гиперкортизолизм (синдром Иценко-Кушинга). Также, благодаря применению метода ССЗВК, удалось решить вопрос объёма оперативного вмешательства и предотвратить возможную необоснованную двустороннюю адреналэктомию при гормонально-неактивном образовании правого надпочечника. Приведенный клинический случай демонстрирует алгоритм диагностики причин гиперкортицизма, возможные ошибки и применение трудоемких и высокотехнологичных методов диагностики. Также указывается важность мультидисциплинарного подхода, несмотря на изолированную эндокринную патологию.
Список литературы Значимость метода селективного забора крови из надпочечниковых вен в диагностике АКТГ-независимого гиперкортицизма на фоне двусторонней гиперплазии надпочечников
- Машков Т.Н., Крайнюков П.Е. Об оказании медицинской помощи пациентам диспансерной группы в многопрофильной военномедицинской организации. Военно-медицинский журнал, 2019. № 5. T. 340. C. 61-62.
- Функциональная и топическая диагностика в эндокринологии: руководство для врачей. Под ред. Шустов С.Б. М.: ГЭОТАР-Медиа, 2017. 272 с.
- Симоненко А.В., Крайнюков П.Е., Дулин П.А. Современные взгляды на эпидемиологию и диагностику нейроэндокринных опухолей. Военно-медицинский журнал, 2019. № 5. T. 340. C. 63.
- Эндокринология: руководство для врачей: в 2 т. Под ред. Шустова С.Б. СПб.: СпецЛит, 2011. 432 с.
- Ladurner K., Hallfeldt J., Id O. et al. Accuracy of adrenal imaging and adrenal venous sampling in diagnosing unilateral primary aldosteronism. Eur. J. Clin. Invest., 2017, № 47, рр. 372-377.
- Haase M., Riester A., Kropil P. et al. Outcome of adrenal vein sampling performed during concurrent mineralocorticoid receptor antagonist therapy. J. Clin. Endocrinol. Metab., 2014, № 99, рр. 4397-402.
- Omura K., Ota H., Takahashi Y. et al. Anatomical variations of the right adrenal vein. Hypertension, 2017, № 69, рр. 428-34.
- Волкова А.Р., Мозгунова В.С., Лискер А.В. [и др.] Опыт применения селективного забора крови из вен надпочечников у пациента с первичным гиперальдостеронизмом: клинический случай. Эндокринология: новости, мнения, обучение, 2021. Т. 10. № 1. C. 88-92.
- Великанова Л.И., Шафигуллина З.Р., Ворохобина Н.В. и др. Пробл. Эндокринол, 2005. Т. 51. № 6. С. 9-11.
- Мельниченко Г.А., Платонова Н.М., Бельцевич Д.Г. и др. Первичный гиперальдостеронизм: диагностика и лечение. Новый взгляд на проблему. По материалам Проекта клинических рекомендаций Российской ассоциации эндокринологов по диагностике и лечению первичного гиперальдостеронизма. Consilium Medicum, 2017. № 4. T. 19. C. 75-85.
- Rubinstein G., Osswald A., Braun L.T. et al. The role of adrenal venous sampling (AVS) in primary bilateral macronodular adrenocortical hyperplasia (PBMAH): a study of 16 patients. Endocrine, 2022, № 76(2), рр. 434-445.


