Значимость персональных клинико-диагностических показателей при оценке побочного радиационного воздействия для больных раком щитовидной железы, получающих радиойодтерапию
Автор: Хвостунов И.К., Крылов В.В., Родичев А.А., Шепель Н.Н., Коровчук О.Н., Кочетова Т.Ю., Пятенко В.С., Хвостунова Т.И., Жиронкина А.С.
Рубрика: Научные статьи
Статья в выпуске: 2 т.30, 2021 года.
Бесплатный доступ
Радиойодтерапия (РЙТ) представляет собой наиболее известную область терапевтического применения радионуклидов. Метод терапии препаратом на основе 131I в сочетании с хирургическим лечением является «золотым стандартом» в лечении больных дифференцированным раком щитовидной железы (ДРЩЖ), а при наличии отдалённых метастазов он не имеет альтернативы. Несмотря на адресное воздействие радиоактивного йода на патологические очаги, при РЙТ отмечается побочное внутреннее облучение здоровых органов и тканей. В связи с этим необходима надёжная оценка побочного облучения с учётом индивидуальных особенностей пациентов, поскольку известно, что величина побочной дозы значительно варьирует от пациента к пациенту. По этой причине выявление значимости персональных клинико-диагностических показателей пациентов в отношении побочного облучения всего тела является важной и актуальной задачей. В данном аспекте существенное значение приобретает цитогенетическое обследование онкологических пациентов при помощи анализа хромосомных аберраций в лимфоцитах периферической крови. Определённые виды хромосомных аберраций являются специфическими радиационными маркерами, наличие которых однозначно свидетельствует о радиационном воздействии, а по частоте их встречаемости можно достоверно оценить величину поглощённой дозы. В настоящей работе на основе цитогенетического обследования группы из 38 больных ДРЩЖ было выполнено исследование значимости влияния их клинико-диагностических показателей на индукцию радиационных маркеров в лимфоцитах крови. В результате анализ корреляционной матрицы соотношения прироста частоты стабильных и нестабильных маркеров после однократного курса РЙТ и исследованных показателей не показал значимой зависимости на уровне R>0,3 ни от одного из них. Вместе с тем, между частотой радиационных маркеров как до, так и после РЙТ была обнаружена высокая степень зависимости от суммарной введённой пациенту активности 131I за все предшествующие курсы РЙТ на уровне R>0,7 для нестабильных и на уровне R>0,8 для стабильных маркеров.
Ядерная медицина, рак щитовидной железы, радиофармпрепарат, радиойодтерапия, побочное облучение, радиационный маркер, цитогенетика, биодозиметрия, хромосомные аберрации, лимфоциты
Короткий адрес: https://sciup.org/170179209
IDR: 170179209 | УДК: 616.441-006.6-085.849.2:546.15.02.131 | DOI: 10.21870/0131-3878-2021-30-2-101-112
Текст научной статьи Значимость персональных клинико-диагностических показателей при оценке побочного радиационного воздействия для больных раком щитовидной железы, получающих радиойодтерапию
Как в России, так и в большинстве стран мира отмечается рост заболеваемости раком щитовидной железы (ЩЖ). Так, за последние 10 лет этот показатель вырос более, чем в 1,6 раза [1]. «Золотым стандартом» лечения больных дифференцированным раком щитовидной железы (ДРЩЖ), который составляет около 90% всех случаев рака ЩЖ, является хирургическое удаление ЩЖ с последующей радиойодтерапией (РЙТ). Терапия препаратами на основе 131I является важной составляющей в данной схеме, а при наличии отдалённых метастазов РЙТ является безальтернативным методом для больных ДРЩЖ [2]. Исследования радиационного воздействия на тканевом и клеточном уровнях являются основой для повышения эффективности существующих схем РЙТ, включая разработку новых подходов и обоснование ограничительных мер [3-5]. В ряде случаев у пациентов с осложняющими факторами может потребоваться дополнительное
Хвостунов И.К.* – зав. лаб., д.б.н.; Крылов В.В. – зав. отдел., д.м.н.; Родичев А.А. – врач-радиолог, к.м.н.; Шепель Н.Н. – ст. науч. сотр., к.б.н.; Коровчук О.Н. – науч. сотр.; Кочетова Т.Ю. – науч. сотр.; Хвостунова Т.И. – науч. сотр.; Жиронкина А.С. – науч. сотр. МРНЦ им. А.Ф. Цыба – филиал ФГБУ «НМИЦ радиологии» Минздрава России. Пятенко В.С. – вед. науч. сотр., к.б.н. МРНЦ им. А.Ф. Цыба – филиал ФГБУ «НМИЦ радиологии» Минздрава России, ФГБУН ИБФ им. Н.М. Эмануэля РАН.
обоснование или изменение принятых норм дозировки радиофармпрепарата (РФП), что означает использование персонализированного подхода при назначении радионуклидной терапии. Персонализированный подход особенно актуален для больных ДРЩЖ, получающих многократные курсы РЙТ [6], для детей и подростков [7], а также для пациентов с почечной недостаточностью.
Несмотря на адресное воздействие радиоактивного йода на патологические очаги, РЙТ может приводить к побочному внутреннему облучению здоровых органов и тканей [8, 9]. В этой связи необходима надёжная оценка побочного внутреннего облучения с учётом индивидуальных особенностей пациентов, поскольку известно, что величина побочной дозы облучения варьирует от пациента к пациенту. По этой причине выявление значимости клинико-диагностических показателей пациентов в отношении общего побочного облучения, особенно при воздействии на клетки костного мозга, является важной и актуальной задачей [10, 11].
В проведённых ранее исследованиях клинических последствий РЙТ было показано, что для прогноза результатов терапии доза на кровь является более надёжным показателем по сравнению с величиной введённой активности РФП [12]. Сравнительные исследования побочной дозы на кровь и костный мозг по методике MIRD (Medical Internal Radiation Dose Committee) для больных ДРЩЖ показали, что доза на кровь может быть использована в качестве модельной оценки дозы на костный мозг в рамках гипотезы о равномерном распределении радионуклидов йода, которые не депонировались в метастазах или остатках ЩЖ [13, 14]. Таким образом, последствия облучения лимфоцитов крови при РЙТ можно использовать для оценки воздействия и на клетки костного мозга.
Процесс побочного радиационного воздействия при РЙТ у больных ДРЩЖ после радикальной тиреоидэктомии имеет особенности по сравнению с традиционной оценкой радиационной безопасности радиоактивного йода [15]. У таких пациентов после выполнения хирургического этапа лечения практически полностью отсутствует ЩЖ, которая является критическим органом-мишенью. Для здоровых людей с нормально функционирующей ЩЖ уже через сутки после поступления радионуклидов 131I, 25-30% всей активности концентрируется в ЩЖ, формируя основную дозовую нагрузку на этот орган за время распада радионуклидов [15]. В случае больных ДРЩЖ основную роль в формировании дозы общего внутреннего облучения играет не период полураспада радионуклида, а скорость его выведения из организма. Обследование больных ДРЩЖ показали, что эффективный период полувыведения составляет в среднем 12 ч [16], что существенно меньше 8-суточного периода полураспада 131I. Поскольку скорость выведения РФП из организма пациентов существенно варьирует от пациента к пациенту, то и побочные дозы значительно различаются.
Прямым экспериментальным методом оценки побочной дозы у больных ДРЩЖ при РЙТ является регулярная радиометрия пациента в процессе РЙТ от момента введения РФП до выписки из стационара (выписка становится возможной при снижении мощности дозы от пациента до уровня 20 мЗв/ч на расстоянии 1 м). Такой метод позволяет изучить динамику концентрации 131I в теле пациента и рассчитать поглощённую дозу. Радиометрические исследования являются важной составляющей проведения РЙТ, особенно в отношении радиационной безопасности как пациента, так и персонала [8, 12]. Однако данный метод является достаточно трудоёмким для широкого применения в регулярной клинической практике. Кроме того, он требует соблюдения дополнительных мер радиационной безопасности персонала. Наконец, радиометрия оценивает лишь процесс «накопления-выведения», но не отражает особенности биологической реакции организма пациента на облучение.
Цитогенетическая биологическая дозиметрия является признанным стандартом, который рекомендован МАГАТЭ для широкого использования [17]. Данный метод основан на исследовании лимфоцитов периферической крови. Он абсолютно безопасен для пациентов, поскольку требует забора порядка 10 мл крови, а сам анализ производится в лаборатории in vitro . Прирост аберраций хромосом в результате РЙТ позволяет оценить не только побочную дозу, но и индивидуальную радиочувствительность пациента, поскольку является следствием как индукции, так и способности клеток восстанавливать радиационные повреждения ДНК. Таким образом, цитогенетическая биодозиметрия даёт возможность учесть особенности индивидуальной реакций пациента на РЙТ. Повышенный уровень аберраций может стать предупредительным сигналом о возможных негативных последствиях и свидетельствовать о необходимости внесения изменений в схему лечения.
Цель настоящей работы состояла в исследовании побочного радиационного эффекта РЙТ путём статистического анализа значимости индивидуальных клинико-диагностических показателей пациентов при использовании цитогенетической биодозиметрии для совершенствования персонализированного подхода применения РЙТ.
Материалы и методы
Цитогенетическое обследование представляло собой анализ двух образцов крови, взятых у пациента до введения радиойода и перед его выпиской из стационара. В обследованную группу вошли 7 пациентов мужского пола и 31 – женского, возраст которых на момент обследования варьировал в пределах 1,6-71,9 лет. Из числа обследованных пациентов первое введение РФП получали 18 человек, два и более введений – 20. Суммарное число курсов РЙТ на одного обследованного пациента варьировало в пределах от 1 до 21 раза. В исследуемой группе отдалённые метастазы были диагностированы у 22 пациентов. У большинства из них были метастазы в лёгкие – 13 человек, а также в лёгкие и средостение, в лёгкие и шейные лимфоузлы, в лёгкие и в кости – 8 человек и у одной пациентки имелись костные метастазы. У остальных 16 пациентов опухолевый процесс был локализован только в области шеи (щитовидная железа и регионарные лимфоузлы).
Для цитогенетического анализа применялся стандартный и FISH-метод. Было проведено 60 анализов стандартным и 23 исследования FISH-методом. Поскольку динамика накопления и выведения РФП у пациентов различалась, то различными были и сроки снижения уровня мощности дозы до значений, приемлемых для выхода из специализированного стационара. Среди обследованных пациентов выход из стационара происходил после первых суток один раз, после вторых суток – 5 раз, после третьих суток – 37 раз и после четвёртых суток – 17 раз.
Для цитогенетического анализа использовали образцы крови, которые брались у всех обследованных лиц в соответствии с действующим законодательством РФ и нормами медицинской этики после получения информированного согласия. Хромосомные аберрации изучали метафаз-ным методом в клетках первого митоза в соответствии с рекомендациями МАГАТЭ [17]. При анализе идентифицировали дицентрики (dic), центрические кольца (rc), полные транслокации (tc) и неполные транслокации (ti). Результаты анализа методом FISH были представлены в виде частоты на число геном-эквивалентных (GE) метафаз [17]. Детали методики цитогенетического анализа были опубликованы ранее [4, 5]. Число проанализированных метафаз на одного пациента варьировало в пределах от 250 до 1186 при стандартном обследовании и в пределах от 312 до 1202 – при FISH-методе. Всего было проанализировано 63 638 метафаз стандартным методом и 43 703 – методом FISH.
При проведении статистического анализа зависимости частоты хромосомных аберраций от клинико-диагностических показателей пациентов были исследованы следующие показатели: однократно введённая активность РФП (Act, мКи); однократная удельная активность РФП (ActU, мКи/кг); введённая суммарно за все курсы активность РФП (Σact, мКи); пол пациента (Sex, 1 – муж., 2 – жен.); время пребывания в специализированном стационаре (∆T, ч); фактор первичного или повторного введения РФП (Rate, 1 – первичный, 2 – более одного); возраст пациента (Age, лет) и наличие отдалённых метастазов (mts, 0 – нет, 1 – есть). При выполнении исследования применялся метод множественной корреляции и регрессионный анализ при помощи компьютерных программ Excel и Origin 6.0.
Результаты исследования
В табл. 1 представлена статистическая оценка частоты радиационных маркеров в лимфоцитах крови обследованных пациентов. Приведены средние значения с ошибкой среднего, вариация показателя и размер выборки. Частоты радиационных маркеров оценивались по совокупности выполненных цитогенетических анализов. Прирост частоты аберраций означает разницу между частотами после и до однократной РЙТ с учётом статистической погрешности.
Таблица 1
Статистическая оценка результатов цитогенетического обследования пациентов
|
Показатель |
Среднее ±SE |
Вариация |
Размер выборки |
|
Возраст пациентов, лет |
29,2±3,1 |
1,6 – 71,9 |
60 |
|
Введённая разовая активность 131I, мКи |
79,6±4,4 |
15 – 135 |
60 |
|
Удельная введённая активность 131I, мКи/кг |
1,46±0,05 |
0,83 – 2,45 |
60 |
|
Частота (dic+rc)/100 клеток до РЙТ |
3,09±0,36 |
0 – 9,41 |
60 |
|
Частота (dic+rc)/100 клеток после РЙТ |
5,71±0,46 |
0,80 – 17,4 |
60 |
|
Частота (tc+ti)/100 GE-клеток до РЙТ |
7,18±0,93 |
0,32 – 17,3 |
23 |
|
Частота (tc+ti)/100 GE-клеток после РЙТ |
10,7±1,1 |
3,19 – 20,1 |
23 |
|
Прирост частоты (dic+rc)/100 клеток от РЙТ |
2,62±0,25 |
0,10 – 11,4 |
60 |
|
Прирост частоты (tc+ti)/100 GE-клеток от РЙТ |
3,48±0,52 |
-1,10* – 9,53 |
23 |
* в одном случае прирост частоты стабильных маркеров был отрицательным, т.е. до РЙТ частота транслокаций была выше, чем после РЙТ.
В табл. 2 и 3 приведены результаты анализа методом множественной корреляции зависимости прироста частоты нестабильных (dic+rc) и стабильных (tc+ti) радиационных маркеров, выявленных у обследованных пациентов, в зависимости от их индивидуальных показателей. Для этого был использован стандартный формат таблиц в виде корреляционной матрицы.
В табл. 4 и 5 приведены результаты анализа методом множественной корреляции зависимости частоты нестабильных (dic+rc) и стабильных (tc+ti) радиационных маркеров, выявленных у обследованных пациентов до и после однократной РЙТ, в зависимости от их индивидуальных показателей нарастающим итогом. Это означает, что исследовалась зависимость накопления аберраций от предшествующей истории назначений РЙТ.
Таблица 2
Корреляционная матрица зависимости прироста частоты AY [(dic+rc)/100 кл.] от клинико-диагностических показателей при однократном курсе РЙТ
|
∆Y |
Act |
ActU |
∆T |
Age |
Rate |
Sex |
mts |
|
|
∆Y |
1,0 |
|||||||
|
Act |
0,263 |
1,0 |
||||||
|
ActU |
0,026 |
-0,008 |
1,0 |
|||||
|
∆T |
-0,016 |
-0,197 |
-0,051 |
1,0 |
||||
|
Age |
0,070 |
0,741 |
-0,110 |
-0,192 |
1,0 |
|||
|
Rate |
0,273 |
0,449 |
0,156 |
-0,286 |
0,261 |
1,0 |
||
|
Sex |
0,027 |
0,004 |
-0,034 |
-0,094 |
0,177 |
-0,098 |
1,0 |
|
|
mts |
0,032 |
-0,211 |
0,124 |
0,000 |
-0,123 |
0,365 |
-0,195 |
1,0 |
Таблица 3
Корреляционная матрица зависимости прироста частоты AY [(tc+ti)/100 GE-кл.] от персональных клинико-диагностических показателей при однократном курсе РЙТ
|
∆Y |
Act |
ActU |
∆T |
Age |
Rate |
Sex |
mts |
|
|
∆Y |
1,0 |
|||||||
|
Act |
0,128 |
1,0 |
||||||
|
ActU |
0,137 |
-0,093 |
1,0 |
|||||
|
∆T |
0,148 |
-0,164 |
0,197 |
1,0 |
||||
|
Age |
0,165 |
0,742 |
-0,014 |
-0,299 |
1,0 |
|||
|
Rate |
-0,091 |
0,207 |
-0,191 |
-0,154 |
0,210 |
1,0 |
||
|
Sex |
0,221 |
-0,081 |
0,112 |
-0,106 |
0,160 |
-0,120 |
1,0 |
|
|
mts |
0,262 |
-0,211 |
0,057 |
0,236 |
0,053 |
0,265 |
-0,178 |
1,0 |
Таблица 4
Корреляционные матрицы зависимости частоты аберраций от клинико-диагностических показателей при анализе назначений РЙТ нарастающим итогом
|
Y 1 =(dic+rc)/100 кл. до РЙТ |
Y 2 =(dic+rc)/100 кл. |
после РЙТ |
||||||||||||
|
Y 1 |
Σact |
Age |
Rate |
Sex |
mts |
Y 2 |
Σact |
Age |
Rate |
Sex |
mts |
|||
|
Y 1 |
1,0 |
Y 2 |
1,0 |
|||||||||||
|
Σact |
0,740 |
1,0 |
Σact |
0,647 |
1,0 |
|||||||||
|
Age |
0,416 |
0,621 |
1,0 |
Age |
0,366 |
0,643 |
1,0 |
|||||||
|
Rate |
0,683 |
0,633 |
0,261 |
1,0 |
Rate |
0,687 |
0,633 |
0,261 |
1,0 |
|||||
|
Sex |
0,144 |
0,056 |
0,177 |
-0,10 |
1,0 |
Sex |
0,128 |
0,054 |
0,177 |
-0,10 |
1,0 |
|||
|
mts |
0,122 |
0,189 |
-0,123 |
0,365 |
-0,20 |
1,0 |
mts |
0,114 |
0,162 |
-0,123 |
0,365 |
-0,20 |
1,0 |
|
Таблица 5
Корреляционные матрицы зависимости частоты аберраций от клинико-диагностических показателей при анализе назначений РЙТ нарастающим итогом
|
Y 1 =(tc+ti)/100 GE-кл. до РЙТ |
Y 2 =(tc+ti)/100 GE-кл |
. после РЙТ |
|||||||||||
|
Y 1 |
Σact |
Age |
Rate |
Sex |
mts |
Y 2 |
Σact |
Age |
Rate |
Sex |
mts |
||
|
Y 1 |
1,0 |
Y 2 |
1,0 |
||||||||||
|
Σact |
0,841 |
1,0 |
Σact |
0,822 |
1,0 |
||||||||
|
Age |
0,628 |
0,717 |
1,0 |
Age |
0,630 |
0,735 |
1,0 |
||||||
|
Rate |
0,472 |
0,378 |
0,210 |
1,0 |
Rate |
0,361 |
0,374 |
0,210 |
1,0 |
||||
|
Sex |
-0,11 |
-0,083 |
0,160 |
-0,120 |
1,0 |
Sex |
0,015 |
-0,085 |
0,160 |
-0,120 |
1,0 |
||
|
mts |
0,244 |
0,290 |
0,053 |
0,265 |
-0,18 |
1,0 |
mts |
0,337 |
0,259 |
0,053 |
0,265 |
-0,18 |
1,0 |
На рис. 1 представлены соотношения частоты нестабильных и стабильных маркеров у обследованных пациентов до и после РЙТ в зависимости от суммарной введённой активности 131I за все предшествующие курсы РЙТ. Точками показаны индивидуальные результаты, сплошными линиями – регрессионные соотношения. Регрессионные соотношения на обоих рисунках были получены методом корреляционного анализа, результаты которого приведены в табл. 6. При выполнении анализа учитывались погрешности индивидуальных результатов цитогенетического обследования пациентов. Погрешности данных не показаны на рис. 1, чтобы его не перегружать.
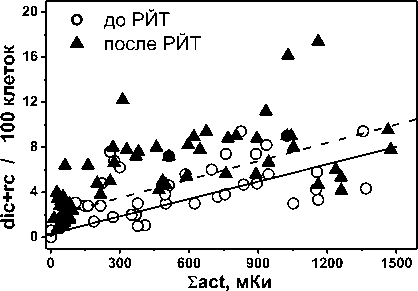
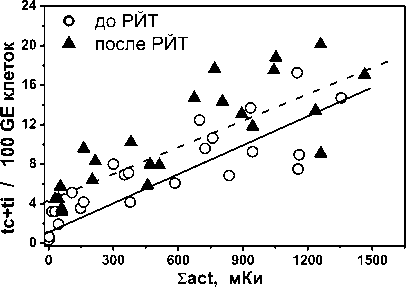
Рис. 1. Регрессионные соотношения частоты нестабильных (слева) и стабильных (справа) радиационных маркеров до и после РЙТ и суммарной назначенной активностью 131I, мКи, на дату выполнения цитогенетического анализа. Точки – персональные данные, линии – регрессионные соотношения по формулам, приведённым в табл. 6 (сплошная линия – до РЙТ, пунктир – после РЙТ).
В табл. 6 представлены результаты регрессионного анализа зависимости частоты радиационных маркеров от суммарной введённой активности 131I за все предшествующие курсы РЙТ. Была использована линейная зависимость со стандартной оценкой статистических параметров. При выполнении анализа учитывались статистические погрешности исходных данных (M±SE) со стандартной оценкой коэффициента корреляции (R), среднеквадратичной ошибки оценки (Sd), размер выборки (N) и уровень значимости (p).
Таблица 6
Параметры регрессионной зависимости частоты аберраций хромосом (Y, абер./100 кл.) от суммарной введённой активности 131I (Σact, мКи) за все предшествующие курсы РЙТ: Y=c+α Σact
|
Время анализа |
c±SE |
α, мКи-1±SE |
R |
Sd |
N |
p |
|
Дицентрики + центрические кольца |
||||||
|
до РЙТ |
0,319±0,061 |
(0,514±0,023) 10-2 |
0,818 |
2,06 |
60 |
<0,0001 |
|
после РЙТ |
1,88±0,12 |
(0,542±0,027) 10-2 |
0,726 |
2,46 |
60 |
<0,0001 |
|
Полные + неполные транслокации |
||||||
|
до РЙТ |
1,11±0,22 |
(0,978±0,062) 10-2 |
0,893 |
1,74 |
23 |
<0,0001 |
|
после РЙТ |
4,32±0,47 |
(0,896±0,084) 10-2 |
0,839 |
1,52 |
23 |
<0,0001 |
Обсуждение
В данном исследовании в список исследованных показателей была включена информация о персональных данных обследованных пациентов, параметры однократного курса РЙТ и данные о многократных курсах лечения. Выбор показателей был связан с тем, что при планировании схемы РЙТ существенное значение имеет оценка факторов, способных повлиять на побочное радиационное воздействие при ожидаемой эффективности РЙТ, особенно в случае необходимости повышения однократно назначаемой активности РФП. Полученные результаты позволяют проанализировать и обосновать значимость отдельных клинико-диагностических показателей пациентов в процессе назначения и проведения РЙТ.
Результаты анализа значимости показателей при однократном курсе РЙТ (табл. 2 и 3) свидетельствуют о том, что ни один из исследованных показателей не имел значимого влияния на прирост частоты аберраций по критерию R>0,3. Вместе с тем, следует отметить, что для нестабильных маркеров близкая к указанному критерию положительная корреляция была выявлена для однократной активности «Act» (R=0,263) и кратности назначений «Rate» (R=0,273, табл. 2). Отсутствие значимой связи между приростом частоты аберраций и введённой разовой активностью («Act», «ActU», табл. 2 и 3) требует отдельного рассмотрения, поскольку удельная активность обычно является определяющим параметром при оценке внутреннего облучения [15]. Как было отмечено выше, для больных ДРЩЖ после удаления ЩЖ основную роль в формировании дозы общего внутреннего облучения играет скорость выведения РФП из организма, которая существенно варьирует от пациента к пациенту. Кроме того, дополнительным депо фиксации РФП могут быть остатки ЩЖ, а также метастатические очаги. Поэтому величина назначенной разовой активности определяет лишь начальную величину концентрации РФП в организме. Итоговое общее облучение будет зависеть как от введённой активности, так и от динамики её выведения. Следует также отметить, что по критерию R<0,3 оцененная зависимость прироста частоты аберраций от «ActU» оказалась еще ниже, чем от «Act» (табл. 2 и 3). Причина в том, что вариация активности «Act» была шире (19-170% от среднего) по сравнению с «ActU» (57-169% от среднего). Данный факт связан с тем, что при назначении разовой активности учитываются не только клинические показатели, но и вес, возраст пациента (R=0,74, табл. 2 и 3). Таким образом, удельная активность может быть более адекватным показателем.
Тенденция к повышению прироста частоты аберраций при повторных курсах РЙТ может быть связана со снижением способности к восстановлению повреждений ДНК в лимфоцитах крови пациентов по мере увеличения суммарной радиационной нагрузки. При анализе прироста стабильных аберраций была обнаружена тенденция к её повышению для пациентов с отдалёнными метастазами «mts» (R=0,262, табл. 3). Данный факт может объясняться тем, что при наличии метастазов 131I накапливается и фиксируется в них, что обеспечивает дополнительное облучение, которое приводит к повышению прироста частоты аберраций, в то время как в здоровых тканях этого накопления практически не происходит.
В итоге, согласно проведённому множественному корреляционному анализу (табл. 2 и 3) значимая связь всех перечисленных выше показателей с приростом частоты аберраций не была выявлена. По этой причине нет оснований ожидать, что путём контроля исследованных параметров можно в каждом отдельном случае достоверно прогнозировать общее побочное облучение при разовой РЙТ.
Анализ частоты аберраций до и после РЙT в зависимости от суммарной введённой активности (табл. 4 и 5) показал, что частота как нестабильных, так и стабильных аберраций имеет высокую степень зависимости (R>0,7) от суммарной активности, введённой пациенту за все предшествующие курсы РЙТ. В случае нестабильных аберраций проявилась также высокая степень зависимости частоты аберраций как до, так и после РЙT от повторности курсов «Rate» (R>0,6, табл. 4). Для стабильных аберраций проявилась высокая степень зависимости частоты аберраций (как до, так и после РЙT) от возраста пациентов «Age» (R>0,6, табл. 5).
Высокая и средняя степень зависимости частоты нестабильных маркеров от суммарной активности как до, так и после РЙT (R=0,74 и 0,647, табл. 4) может объясняться следующим обстоятельством. Нестабильные аберрации не успевают элиминироваться вместе с облучёнными лимфоцитами за промежуток времени между последовательными курсами РЙТ ~6 мес., который значительно меньше по сравнению с характерным временем элиминации нестабильных маркеров ~3 лет [17]. Поэтому при повторных курсах РЙТ нестабильные маркеры продолжают накапливаться в лимфоцитах крови пациента. Поскольку известно, что индукция нестабильных маркеров практически не зависит от возраста человека [17], то данное обстоятельство может объяснять слабую связь их частоты как до, так и после РЙT с возрастом пациентов (R=0,416 и 0,366, табл. 4). Высокая степень зависимости частоты стабильных маркеров от суммарной активности как до, так и после РЙT (R=0,841 и 0,822, табл. 5) имеет объяснение, аналогичное случаю нестабильных маркеров. Более высокий уровень зависимости может объясняться дополнительным источником стабильных маркеров, которые способны продуцироваться из облучённых клеток костного мозга. В отличие от нестабильных аберраций, стабильные аберрации способны проходить ряд клеточных циклов в процессе пролиферации [17, 18] и увеличивать, таким образом, частоту транслокаций в лимфоцитах крови пациентов.
В отличие от закономерностей формирования нестабильных хромосомных маркеров, возраст пациента играет значимую роль в процессе образования стабильных маркеров – транслокаций [17]. В проведённых исследованиях было показано, что даже спонтанный уровень транслокаций увеличивается с возрастом человека. Кроме того, за счёт дополнительного источника в виде пролиферирующих стволовых клеток частота транслокаций увеличивается с течением времени, если происходит хроническое или повторное облучение. В частности, по этой причине частоту транслокаций принято использовать для ретроспективной биодозиметрии [17, 18]. Перечисленные обстоятельства могут быть причиной средней зависимости частоты транслокаций как до, так и после РЙT от возраста пациента (R=0,628 и 0,63, табл. 5).
При анализе стабильных маркеров не удалось выявить зависимость их частоты как до, так и после РЙT от повторности курсов «Rate» (R=0,472 и 0,361, табл. 5). Возможная причина данного артефакта заключалась в том, что практически вся подгруппа (91,3%), для которой проводился анализ стабильных маркеров методом FISH, состояла из пациентов, получавших повторные курсы РЙТ.
Прирост частоты как стабильных, так и нестабильных маркеров после однократного курса РЙТ не показал значимой зависимости на уровне R>0,3 ни от одного из исследованных показателей. Это означает, в частности, что необходимо обратить внимание на дополнительные показатели, такие как способность организма пациента, у которого удалена ЩЖ, выводить РФП. Стандартной количественной характеристикой такой способности является эффективный период полувыведения (T eff ), величина которого варьирует в широких пределах [16]. Персональная оценка периода полувыведения могла бы стать одним из основных значимых показателей в будущих биодозиметрических исследованиях пациентов с ДРЩЖ после РЙТ.
Заключение и выводы
На основании результатов цитогенетического обследования группы из 38 больных ДРЩЖ был выполнен статистический анализ значимости различных клинико-диагностических показателей в отношении формирования побочного радиационного воздействия на организм пациентов, получающих РЙТ. Воздействие оценивалось по частоте радиационно-индуцированных хромосомных аберраций в лимфоцитах крови. Анализ стандартной корреляционной матрицы прироста частоты стабильных и нестабильных маркеров после однократного курса РЙТ не выявил значимой зависимости на уровне R>0,3 ни от одного из исследованных показателей. Однако была обнаружена высокая степень связи частоты радиационных маркеров как до, так и после РЙТ с суммарной введённой активностью 131I за все предшествующие курсы РЙТ, а именно: на уровне R>0,7 для нестабильных и на уровне R>0,8 для стабильных маркеров. Выполненный регрессионный анализ позволил с высоким уровнем значимости (p<0,0001) оценить параметры линейной регрессионной зависимости (коэффициенты «c» и «α») частоты радиационных маркеров (Y) от суммарной введённой активности 131I (Σact) за все предшествующие курсы РЙТ: Y=c+α Σact.
Таким образом, было показано, что радиационно-индуцированные риски возрастают по мере увеличения накопленной активности введённого 131I. При назначении повторных курсов РЙТ и выборе оптимальной тактики лечения необходимо учитывать соотношение польза-риск для каждого конкретного пациента. Однако пороговые значения предельно допустимой накопленной активности всё ещё не определены, что является задачей дальнейших исследований.
Список литературы Значимость персональных клинико-диагностических показателей при оценке побочного радиационного воздействия для больных раком щитовидной железы, получающих радиойодтерапию
- Злокачественные новообразования в России в 2018 году (заболеваемость и смертность) /под ред.
- A.Д. Каприна, В.В. Старинского, Г.В. Петровой. М.: МНИОИ им. П.А. Герцена - филиал ФГБУ «НМИЦ радиологии» Минздрава России, 2019. 250 с.
- Крылов В.В., Гарбузов П.И., Кочетова Т.Ю., Шуринов А.Ю., Бородавина Е.В. Терапевтическая радиология: национальное руководство. Глава 34. Радионуклидная терапия /под ред. А.Д. Каприна, Ю.С. Мардынского. М.: ГЭОТАР-Медиа, 2018. С. 637-665.
- Silberstein E.B. Radioiodine: the classic theranostic agent //Semin. Nucl. Med. 2012. V. 42, N 3. P. 164-170.
- Khvostunov I.K., Saenko V.A., Krylov V.V., Rodichev A.A., Yamashita S. Cytogenetic biodosimetry and dose-rate effect after radioiodine therapy for thyroid cancer //Radiat. Environ. Biophys. 2017. V. 56, N 3. P. 213-226.
- Хвостунов И.К., Крылов В.В., Родичев А.А., Шепель Н.Н., Коровчук О.Н., Пятенко В.С., Хвосту-нова Т.И. Доза общего облучения при лечении дифференцированного рака щитовидной железы радиоактивным йодом //Радиационная биология. Радиоэкология. 2017. Т. 57, № 5. С. 471-485.
- Robbins R.J., Schlumberger M.J. The evolving role of 131I for the treatment of differentiated thyroid carcinoma //J. Nucl. Med. 2005. V. 46, N 1. P. 28S-37S.
- Хвостунов И.К., Крылов В.В., Родичев А.А., Шепель Н.Н., Коровчук О.Н., Кочетова Т.Ю., Пятенко B.С., Хвостунова Т.И. Оценка побочного радиационного эффекта радиойодтерапии для детей и подростков на основе цитогенетического обследования //Достижения и перспективы детской онкологии: Тезисы VII съезда детских онкологов России с международным участием, Москва, 25-26 октября 2018 г. //Онкопедиатрия. 2018. Т. 5, № 3 (Приложение). С. 15.
- Brill A.B., Stabin M., Bouville A., Ron E. Normal organ radiation dosimetry and associated uncertainties in nuclear medicine, with emphasis on Iodine-131 //Radiat. Res. 2006. V. 166, N 1. P. 128-140.
- Van Nostrand D. The benefits and risks of I-131 therapy in patients with well-differentiated thyroid cancer //Thyroid. 2009. V. 19, N 12. P. 1381-1391.
- Kulkarni K., Van Nostrand D., Atkins F., Aiken M., Burman K., Wartofsky L. The frequency with which empiric amounts of radioiodine "over-" or "under-" treat patients with metastatic well-differentiated thyroid cancer //Thyroid. 2006. V. 16, N 1. P. 1-5.
- Stabin M.G., Sharkey R.M., Siegel J.A. RADAR commentary: evolution and current status of dosimetry in nuclear medicine //J. Nucl. Med. 2011. V. 52, N 7. P. 1156-1161.
- Verburg F.A., Lassmann M., Mader U., Luster M., Reiners C., Hanschei H. The absorbed dose to the blood is a better predictor of ablation success than the administered 131-I activity in thyroid cancer patients //Eur. J. Nucl. Med. Mol. Imaging. 2011. V. 38, N 4. P. 673-680.
- Benua R.S., Leeper R.D. A method and rationale for treating thyroid carcinoma with the largest safe dose of I-131 //Frontiers of thyroidology /Eds.: G.A. Meideros-Neto, E. Gaitan. V. II. New York: Plenum, 1986. P. 1317-1321.
- De Keizer B., Hoekstra A., Konijnenberg M.W. Bone marrow dosimetry and safety of high 131I activities given after recombinant human thyroid-stimulating hormone to treat metastatic differentiated thyroid cancer //J. Nucl. Med. 2004. V. 45, N 9. P. 1549-1554.
- Калистратова В.С., Беляев И.К., Жорова Е.С., Нисимов П.Г., Парфенова И.М., Тищенко Г.С., Цапков М.М. Радиобиология инкорпорированных радионуклидов /под ред. В.С. Калистратовой. М.: ФМБЦ им. А.И. Бурназяна ФМБА России, 2012. 464 с.
- Willegaignon J., Malvestiti L.F., Guimaraes M.I.C., Sapienza M.T., Endo I.S., Neto G.C., Marone M., Sordi G.-M.A.A. 131-I effective half-life (Teff) for patients with thyroid cancer //Health Phys. 2006. V. 91, N 2. P. 119-122.
- Cytogenetic analysis for radiation dose assessment: a manual. Technical Reports Series IAEA N 405. Vienna: IAEA, 2001. 127 p.
- Herate C., Sabatier L. Retrospective biodosimetry techniques: focus on cytogenetics assays for individuals exposed to ionizing radiation //Mutat. Res. 2020. V. 783. P. 108287. DOI: 10.1016/j.mrrev.2019.108287.


