Аблация ганглионарных сплетений легочной артерии при хирургическом лечении пороков митрального клапана у пациентов с высокой легочной гипертензией
Автор: Богачев-прокофьев А.В., Железнев С.И., Афанасьев А.В., Фоменко М.С., Демидов Денис Петрович, Шарифулин Р.М., Пивкин А.Н., Астапов Д.А., Семенова Е.И., Иванов С.Н., Караськов А.М.
Журнал: Патология кровообращения и кардиохирургия @journal-meshalkin
Рубрика: Приобретенные пороки сердца
Статья в выпуске: 4 т.19, 2015 года.
Бесплатный доступ
Оценить безопасность и эффективность аблации ганглионарных сплетений легочной артерии у пациентов с пороком митрального клапана и высокой легочной гипертензией. Материал и методы Включение в исследование основано на катетеризации правых отделов сердца и эхокардиографическом скрининге. Основными критериями являются среднее давление в легочной артерии >40 мм рт. ст. в покое и положительный реактивный тест ингаляции оксида азота. С января 2014 г. по май 2015 г. 14 пациентам, которым планировали операцию на митральном клапане, дополнительно выполнили аблацию легочной артерии. Средний возраст пациентов составил 53,4±7,8 года, 57,1% пациентов были женского пола. Результаты Среднее время искусственного кровообращения составило 116±12 мин, окклюзии аорты - 95±13, аблации - 9,5±3,1. Давление в легочной артерии значительно снизилось сразу после операции в среднем с 56,5±9,8 до 32,0±7,3 мм рт. ст. (р
Артериальная гипертензия, пороки митрального клапана, аблация ганглионарных сплетений легочной артерии
Короткий адрес: https://sciup.org/142140699
IDR: 142140699
Текст научной статьи Аблация ганглионарных сплетений легочной артерии при хирургическом лечении пороков митрального клапана у пациентов с высокой легочной гипертензией
роль активации симпатической иннервации [10]. Предыдущие исследования показали, что растяжение ствола легочной артерии (ЛА) стимулирует барорецепторы, расположенные в пределах или вблизи области ее бифуркации. Этот процесс приводит к рефлекторному повышению ЛАД и увеличению легочного сосудистого сопротивления посредством преимущественно симпатических эфферентных и, вероятно, афферентных путей [11]. В клиническом исследовании Chen и коллеги показали, что чрескожная катетерная денервация легочной артерии с помощью радиочастотной аблации в районе бифуркации ствола может разобщить барорецепторы и симпатические нервные волокна ЛА и тем самым снизить ЛАД [12]. Таким образом, мы инициировали исследование, чтобы оценить безопасность и эффективность сопутствующей аблации ганглионарных сплетений ЛА у пациентов с патологией митрального клапана и высокой легочной гипертензией.
Материал и методы
В соответствии с протоколом исследования, каждому пациенту разъяснили необходимость медицинского вмешательства и риск процедуры. Экспертный совет и локальный этический комитет Института одобрили протокол исследования. Все пациенты подписали форму информированного согласия до участия с возможностью отказаться на любом этапе. С января 2014 г. по май 2015 г. исследовали 14 пациентов с патологией митрального клапана и высокой ЛГ. Включение пациентов в анализ основывали на катетеризации правых отделов сердца с инвазивным мониторингом, при этом скрининговый отбор выполняли на основании данных эхокардиографии. Патология митрального клапана – основное показание к оперативному вмешательству в соответствии с руководством Европейского общества кардиологов и Европейской ассоциации кардиоторакальных хирургов по ведению пациентов с клапанными пороками сердца 2012 г. [3]. Критериями выполнения сопутствующей аблации ганглионарных сплетений ЛА были среднее ЛАД ≥ 40 мм рт. ст. в покое и положительный реактивный тест ингаляции оксида азота (уменьшение среднего ЛАД на 10–15% без снижения сердечного выброса). Хроническая обструктивная болезнь легких и тромбоэмболический анамнез – критерии исключения в протоколе регистрации исследования. Анализу подвергли 6 мужчин и 8 женщин (средний возраст 53,4±7,8 года), которым выполняли сопутствующую аблацию ганглионарных сплетений ЛА во время кардиохирургического вмешательства на атриовентрикулярных клапанах. Детальная характеристика пациентов приведена в табл. 1.
Таблица 1 Исходная характеристика пациентов
|
Характеристика |
n = 14 |
|
Возраст, среднее ± SD |
53,4±7,8 |
|
Женщины, n (%) |
8 (57,1) |
|
Функциональный класс сердечной недостаточности по NYHA, n (%) |
|
|
II |
2 (14,3) |
|
III |
9 (64,3) |
|
IV |
3 (21,4) |
|
Среднее давление в артерии |
58,5±4,9 |
|
(среднее ± SD) по ЭхоКГ, мм рт. ст. |
|
|
Фибрилляция предсердий, n (%) |
|
|
пароксизмальная |
3 (21,4) |
|
персистирующая |
6 (42,9) |
|
Морфология митрального порока, n (%) |
|
|
недостаточность |
9 (64,3) |
|
стеноз |
5 (35,7) |
|
Этиология митрального порока, n (%) |
|
|
хронические ревматические болезни сердца |
8 (57,1) |
|
дегенеративный |
6 (42,9) |
|
Трикуспидальная недостаточность ≥ 2, n (%) |
9 (64,3) |
До операции пациентам выполняли трансторакальную эхокардиографию, мультиспиральную компьютерную томографию с целью исключения тромбоэмболии легочной артерии и инвазивный мониторинг давления правых отделов сердца катетером Swan-Ganz в палате реанимации.
Катетеризацию правых отделов сердца выполнили с использованием катетера Swan-Ganz 7.5 Fr, установленного под местной анестезией, через внутреннюю яремную вену. До и после операции измерили систолическое, диастолическое и среднее давление ЛА, давление заклинивания легочных капилляров, сердечный индекс, легочное сосудистое сопротивление, транспульмональный градиент давления. Повторяли эти измерения в палате реанимации на первые и третьи сутки после операции (табл. 2).
Статистический анализ
Результаты выражали в виде среднего ± SD для непрерывных переменных и в пропорциях для категориальных переменных на протяжении анализа. Статистическую значимость считали при р<0,05. Представленные значения p являются двусторонними. Все статистические расчеты выполнили с помощью программного пакета SPSS 18.0 (SPSS Inc., Чикаго, США).
Всем пациентам вмешательство осуществляли из срединного стернотомного доступа в условиях стандартного искусственного кровообращения с бикавальной канюляцией и умеренной гипотермии (33–34 о C). В условиях параллельного искусственного кровообращения пересе-
Таблица 2 Данные катетеризации правых отделов сердца
|
Период измерения |
Систолическое легочное артериальное давление, мм рт. ст. |
Диастолическое легочное артериальное давление, мм рт. ст. |
Среднее легочное артериальное давление, мм рт. ст. |
Давление заклинивания легочных капилляров, мм рт. ст. |
Сердечный индекс, л/мин*м2 |
Легочное сосудистое сопротивление, ед. Вуда |
Транспульмональный градиент давления, мм рт. ст. |
|
Исходно |
92,6±18,4 |
44,1±14,9 |
59,5±9,8 |
33,6±9,7 |
2,4±0,9 |
10,8±3,6 |
25,9±7,8 |
|
После 15 мин ингаляции оксида азота |
85,3±20,4 |
36,5±11,6 |
52,1±8,7 |
29,2±6,7 |
2,6±1,0 |
8,5±2,4 |
22,3±6,9 |
|
Непосредственно после основного этапа операции |
54,2±17,2* |
25,4±7,8* |
32,0±7,3* |
15,9±5,2* |
2,4±1,2 |
6,9±2,3* |
15,8±8,8* |
|
В палате отделения реанимации и интенсивной терапии, сутки 1-е 3-и |
47,3±12,1* 46,4±13,3* |
21,6±8,3* 22,4±6,7* |
28,4±5,2* 29,7±4,4* |
15,2±4,9* 14,6±5,2* |
2,4±1,1 2,4±1,0 |
5,4±1,7* 6,1±2,2* |
13,4±6,6* 14,6±7,4* |
* значимое снижение от исходного уровня (p<0,05)
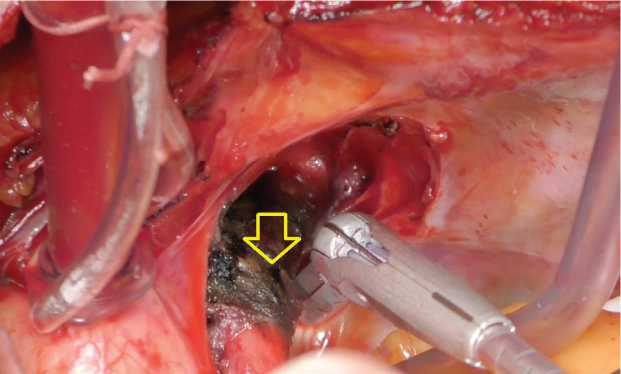
кали артериальную связку с последующей диссекцией и мобилизацией бифуркации и начальных участков главных ветвей ЛА. Процедуру аблации проводили с использованием многофункционального радиочастотного электрода-ручки MLP (AtriCure® Inc., West Chester, США) у всех пациентов. Воздействие выполняли эпикардиально в области бифуркации ствола ЛА и 10 мм дистальнее правой и левой ветвей (рис. 1). Аблацию ткани проводили с постоянным давлением устройства на эпикардиальную жировую ткань без движения. Воздействие продолжалось 60 с в каждой точке (рис. 2). Среднее время аблации ганглионарных сплетений легочной артерии составило 9,5±3,1 мин. После в процедуры аблации выполняли антеградную (в корень аорты) кардиоплегическую остановку сердца с использованием холодного кристаллоидного раствора Кустодиол (Custodiol® HTK Solution,
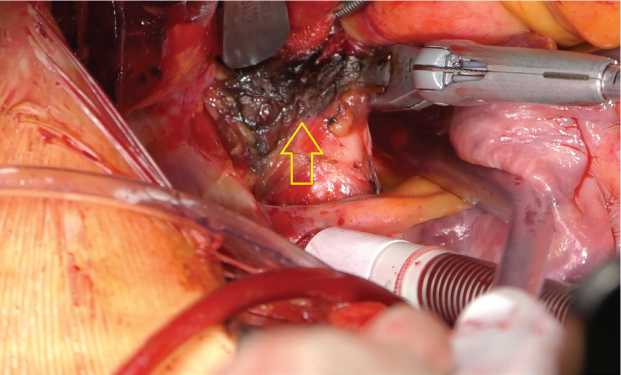
Рис. 1. Эпикардиальная радиочастотная аблация ствола и зоны дистальнее бифуркации легочной артерии на 1 см
Dr Franz K o hler Chemie, Alsbach-Hahnlein, Германия). Вмешательства на атриовентрикулярных клапанах стандартны: реконструкцию митрального клапана выполнили в 64,3% случаев, протезирование клапана – в 35,7%, анну-лопластику трикуспидального клапана с использованием опорного кольца – в 100%. В 9 (64,3%) случаях по поводу сопутствующей фибрилляции предсердий провели процедуру Cox-Maze IV. Среднее время искусственного кровообращения составило 116±12 мин, окклюзии аорты – 95±13 мин.
Результаты
Не было ни одного летального исхода на этапе госпитального периода. Одному пациенту выполняли рестернотомию по поводу кровотечения. Мы наблюдали значительное снижение систолического, диастолического и среднего давления в легочной артерии сразу после операции, на первые и третьи сутки после операции в палате отделения реанимации и интенсивной терапии по сравнению с исходными данными (табл. 2). Среднее время пребывания пациента в палате отделения реанимации и интенсивной терапии составило 3,1±1,2 дня после операции. Осложнений, непосредственно связанных с процедурой аблации ганглионарных сплетений легочной артерии (перфорации; диссекции; тромбоза, подтвержденного мультиспиральной компьютерной томографией), не наблюдали. Частота ранних пароксизмов фибрилляции предсердий составила 28,0%, электрическая кардиоверсия требовалась в 1 (7,1%) случае. Постоянный кардиостимулятор имплантировали вследствие дисфун- кции синусового узла одному пациенту. Всех остальных пациентов выписали со стабильным синусовым ритмом. Плевральный выпот наблюдали у 2 пациентов (14,3%). Не было ни одного случая транзиторной ишемической атаки или инсульта и глубокой стернальной инфекции. Средняя продолжительность пребывания в стационаре составила 14,2±3,1 дня.
Обсуждение
Мы представили результаты конкомитантной аблации ганглионарных сплетений легочной артерии у пациентов с пороками митрального клапана, осложненными высокой легочной гипертензией при операциях на открытом сердце. Это первое исследование по изучению сопутствующей эпикардиальной денервации легочной артерии, выполненной человеку.
В течение последних трех десятилетий ЛГ считается фактором риска неблагоприятных исходов у пациентов, перенесших вмешательство на митральном клапане, с операционной летальностью до 15–31% [3]. В недавнем исследовании китайские коллеги показали успешные результаты хирургического лечения в этой группе пациентов высокого риска, где операционная летальность составила всего 3,1% [13]. Тем не менее ЛГ остается тяжелым краткосрочным неблагоприятным прогностическим фактором для пациентов с патологией митрального клапана, которым планируется операция [14]. Кроме того, ЛГ сопряжена с более тяжелыми симптомами и худшей толерантностью к физической нагрузке и негативно влияет на результаты лечения [15–17].
Новых доказано эффективных специфических препаратов для лечения ЛГ у пациентов с заболеваниями левых отделов сердца пока не существует [9, 18]. Согласно руководству по ведению пациентов с ЛГ, у больных с патологией митрального клапана оптимальным лечением являются гемодинамическая коррекция клапанного порока левых отделов сердца и медикаментозная терапия сердечной недостаточности. Резидуальное высокое давление в легочной артерии после успешного кардиохирургического вмешательства остается актуальной проблемой, особенно у больных с исходно высокой легочной гипертензией.
Несколько экспериментальных и начальных клинических исследований продемонстрировали роль симпатической нервной системы в регуляции легочного артериального давления. По данным Juratsch и коллег, растяжение и окклюзия баллоном из одной из главных ветвей ЛА приводит к увеличению ЛАД и легочного сосудистого сопротивления [11, 19]. Эти результаты подтверждают предположение, что наблюдаемая ЛГ реализуется с помощью нейронного рефлекса, как следствие активации рецепторов растяжения. Также авторы показали, что такие барорецепторы располагаются близко к бифуркации ствола легочной артерии [11]. В эксперименте in vivo индуцированную ЛГ полностью устранили хирургически путем диссекции ствола ЛА и выполнили химическую симпатэктомию с помощью адренергических медиаторов [11, 19]. Анатомические исследования показали, что наибольшая плотность симпатических норадренергических сплетений характерна для магистральных внелегочных и воротных сосудов (артерий и вен) и значительно уменьшается к периферии [20]. Другие патологоанатомические и пато-гистологические исследования у пациентов с ЛГ показали очевидную гипертрофию мышечного слоя ЛА [21, 22], которая в свою очередь, вероятно, приводит к значительной вазоконстрикции, как ответ на симпатические нервные импульсы.
Chen с соавторами воспроизвели ЛГ в эксперименте, который описали ранее Juratsch и соавторы, но использовали вместо химической и хирургической денервации ЛА радиочастотный катетер [23]. Кроме того, исследования на животных показали, что ЛГ может возникнуть вторично в ответ на растяжение ствола легочной артерии с помощью возбуждения рецепторов барорецепторов, расположенных в ее стволе, и изолированная денервация ЛА может способствовать долгосрочному уменьшению ЛГ [23]. Chen и коллеги впервые опубликовали данные пациентов с идиопатической легочной гипертензией, которых подвергли радиочастотной катетерной аблации ствола ЛА и бифуркации [12]. Представленные данные показали, что радиочастотная катетерная аблация легочной артерии является безопасной и эффективной.
В нашем исследовании, основанном на катетеризации правых отделов сердца и предварительной эхокардиографии, сочетанная легочная денервация влияет на среднее давление в легочной артерии и легочное сосудистое сопротивление в послеоперационном периоде. Мы наблюдали, что уровень среднего давления в легочной артерии значительно снизился по сравнению с предоперационными значениями. Эти данные можно объяснить только изменениями гемодинамики в результате успешной коррекции митрального порока [1, 2]. Однако не было ни одного пациента, которому потребовалась бы продленная искусственная вентиляция легких или неинвазивная масочная вентиляция положительным давлением, а также отсутствовали случаи реинтубации. В нашей группе пациентов с сочетанной аблацией ганглионарных сплетений ЛА не было необходимости ингаляции оксида азота, что требуется рутинно пациентам с высокой ЛГ для предотвращения и лечения послеоперационных легочных гипертензивных кризов.
У всех пациентов систолическое давление в легочной артерии было ниже 50 мм рт. ст. после коррекции митрального порока и сопутствующей аблации ганглионарных сплетений ЛА. Figuero S.B. с соавторами показали, что более тяжелая степень легочной гипертензии до операции была достоверно ассоциирована с наличием стойкой ЛГ после вмешательства на митральном клапане (OR 1,761; p = 0,03). Авторы показали, что 22,2% пациентов имели систолическое давление в легочной артерии выше 70 мм рт. ст. среди тех, кто имел такой уровень ЛГ до операции [24]. Таким образом, продемонстрированы преимущества сопутствующей денервации легочной артерии в лечении легочной гипертензии.
Результаты представленного исследования показали безопасность и техническую воспроизводимость аблации ганглионарных сплетений легочной артерии у пациентов, которым планируется хирургическая коррекция митрального порока. Описанные методы продляют искусственное кровообращение на основном этапе операции приблизительно на 15 мин. Преимуществом нашей техники является прямая эпикардиальная аблация, где располагаются ганглионарные сплетения. В настоящем исследовании не было осложнений, связанных с процедурой, и летальных исходов. Мы не разрабатывали специального устройства для процедуры, а использовали официально утверж- денное в клинической практике для радиочастотной аблации ганглионарных сплетений левого предсердия, применяемое на этапе конкомитантного лечения фибрилляции предсердий.
Исследование ограничено небольшой группой пациентов (n = 14), однако результаты показывают, что эпикардиальная конкомитантная аблация ганглионарных сплетений легочной артерии является достаточно безопасной процедурой, позволяя использовать данную технологию на более крупных группах пациентов. Таким образом, мы начали проспективное рандомизированное исследование для дальнейшей оценки процедуры. Мы планируем рандомизировать 30 пациентов с высокой легочной гипертензией, подготовленных к операции на митральном клапане, на группы со стандартной клапанной процедурой (n = 15) и в сочетании с легочной денервацией (n = 15).
Работа поддержана грантом Президента Российской Федерации [МД-5046.2015.7]. Авторы заявляют об отсутствии конфликта интересов.
Список литературы Аблация ганглионарных сплетений легочной артерии при хирургическом лечении пороков митрального клапана у пациентов с высокой легочной гипертензией
- Астапов Д.А., Караськов А.М., Семенова Е.И., Демидов Д.П. Протезирование митрального клапана биологическими протезами: непосредственные и отдаленные результаты II Хирургия. Журнал им. Н.И. Пирогова. 2013. № 9. С 18-23.
- Тулеутаев Р.М., Богачев-Прокофьев АВ., Железнев С.И, Афанасьев А.В., Караськов AM. Обратное ремоделирование левых камер сердца после реконструкции митрального клапана при мезенхимальной дисплазии Патология кровообращения и кардиохирургия. 2015. T. 19. №1.С. 66-71.
- Vincens J.J., Temizer D., Post J.R., Edmunds L.H.J., Herrmann H.C. Longterm Outcome of Cardiac Surgery in Patients With Mitral Stenosis and Severe Pulmonary Hypertension//Circulation. 1995. Vol. 92. P. 137-142.
- Salomon N.W., Stinson E.B., Griepp R.B., Shumway N.E. Mitral valve replacement: long-term evaluation of prosthesis-related mortality and morbidity//Circulation. 1977. Vol. 56. P. N94-11101.
- Vahanian A, Alfieri O., Andreotti F., Antunes M.J., Baron-Esquivias G., Baumgartner H.,, Borger M.A, Carrel T.P., De Bonis M., Evangelista A., Falk V., lung B., Lancellotti P., Pierard L., Price S., Schafers H.J., Schuler G., Stepinska J., Swedberg K., Takkenberg J., Von Oppell U. O., Windecker S., Zamorano J.L., Zembala M. Guidelines on the management of valvular heart disease (version 2012): the Joint Task Force on the Management of Valvular Heart Disease of the European Society of Cardiology (ESC) and the European Association for Cardio-Thoracic Surgery (EACTS)//Eur. Heart J. 2012. Vol. 33. P. 2451-2496.
- Li M., Dumesnil J.G., Mathieu P., Pibarot P. Impact of valve prosthesis-patient mismatch on pulmonary arterial pressure after mitral valve replacement 11 J. Am. Coll. Cardiol. 2005. Vol. 45. P. 1034-1040.
- Crawford F.A. Residual pulmonary artery hypertension after mitral valve replacement: size matters!//J. Am. Coll. Cardiol. 2005. Vol. 45. P.1041-1042.
- Dev V., Shrivastava S. Time course of changes in pulmonary vascular resistance and the mechanism of regression of pulmonary arterial hypertension after balloon mitral valvuloplasty//Am. J. Cardiol. 1991. Vol. 67. P. 439-442.
- Badesch B.D., Champion H.C., Gomez-Sanchez МА, Hoeper M., Loyd J., Manes A., Hoeper M.M., Loyd J.E., Manes A., McGoon M., Naeije R., Olschewski H., Oudiz R.J., Torbicki A. Diagnosis and assessment of pulmonary arterial hypertension//J. Am. Coll. Cardiol. 2009. Vol. 54. P. S55-S56.
- Humbert M., Morrell N.W., Archer S.L., Stenmark K.R., MacLean M.R., Lang I.M., Christman B.W., Weir E.K., Eickelberg O., Voelkel N.F., Rabinovitch M. Cellular and molecular pathobiology of pulmonary arterial hypertension//J. Am. Coll. Cardiol. 2004. Vol. 43. P. 13S-24S.
- Laks M.M., Juratsch C.E., Garner D., Beazell J., Criley J.M. Acute pulmonary artery hypertension produced by distension of the main pulmonary artery in the conscious dog//Chest 1975. Vol. 68. P. 807-13.
- Chen S.L., Zhang F.F., Xu J., Xie D.J., Zhou L., Nguyen T., Stone G.W. Pulmonary Artery Denervation to Treat Pulmonary Arterial Hypertension The Single-Center, Prospective, First-in-Man PADN-1 Study (First-in-Man Pulmonary Artery Denervation for Treatment of Pulmonary Artery Hypertension)//J. Am. Coll. Cardiol. 2013. Vol. 62. P. 1092-1100.
- Song X., Zhang C, Chen X., Chen Y., Shi Q., Niu Y., Xiao J., Mu X. An excellent result of surgical treatment in patients with severe pulmonary arterial hypertension following mitral valve disease//Journal of Cardiothoracic Surgery. 2015. Vol. 10. P. 70.
- Cordova F.C., Corciova C, Georgescu C.A., Enache M., Anghel D., Bartos O., Tinica G. Echocardiographic predictors of adverse shortterm outcomes after heart surgery in patients with mitral regurgitation and pulmonary hypertension//Heart Surg. Forum. 2012. P. E127-32.
- Fang J.C., DeMarco T., Givertz M.M., Borlaug B.A., Lewis G.D., Rame J.R., Gomberg-Maitland M., Murali S., Frantz R.P., McGlothlin D. World Health Organization Pulmonary Hypertension Group 2: Pulmonary hypertension due to left heart disease in the adult da summary statement from the Pulmonary Hypertension Council of the International Society for Heart and Lung Transplantation//J. Heart Lung Transplant 2012. Vol. 31. P.913-33.
- Guazzi M., Borlaug B.A. Pulmonary hypertension due to left heart disease//Circulation. 2012. Vol. 126. P. 975-90.
- Ghio S., Gavazzi А., Сатрапа C, Inserra C, Klersy C, Sebastiani R., Arbustini E., Recusani F., Tavazzi L. Independent and additive prognostic value of right ventricular systolic function and pulmonary artery pressure in patients with chronic heart failure//J. Am. Coll. Cardiol. 2001. Vol. 37. P.183-8.
- Vachiery J-L., Adir Y., Barbera J.A., Champion H., Coghlan J.G., Cottin V., De Marco T., Galie N., Ghio S., Gibbs J.S., Martinez F., Semigran M., Simonneau G13., Wells A., Seeger W. Pulmonary hypertension due to left heart diseases//J. Am. Coll. Cardiol. 2013. Vol. 62. P. D100-8.
- Juratsch C.E., Jengo J.A., Castagna J., Laks M.M. Experimental pulmonary hypertension produced by surgical and chemical denervation of the pulmonary vasculature//Chest 1980. Vol. 77. P. 525-30.
- Cech S. Adrenergic innervation of blood vessels in the lung of some mammals//Acta Anat (Basel). 1969. Vol. 74. P. 169-182.
- Rubin L.J. Primary pulmonary hypertension//N. Engl. J. Med. 1997. Vol. 336. P.111-7.
- Galie N. Manes A, Negro L., Palazzini M., Bacchi-Reggiani M.L., Branzi A A meta-analysis of randomized controlled trials in pulmonary arterial hypertension//Eur. Heart. J. 2009. Vol. 30. P. 394-403.
- Chen S.-L., Zhang Y.-J., Zhou L., Xie D.-J., Zhang F.-F., Jia H.-B., Wong S.S., Kwan T.W. Percutaneous pulmonary artery denervation completely abolishes experimental pulmonary arterial hypertension in vivo//Eurointervention. 2013. Vol. 9. № 2. P. 269-76.
- Figuero S.B., Moya Mur J.L., Garcia-Lledo A, Centella T., Salido L., Navarro A.A., Garcia Martin A., Garcia-Andrade I., Oliva E., Zamorano J.L. Predictors of persistent pulmonary hypertension after mitral valve replacement//Heart vessels. 2015. .


