Аблация у пациентов с фибрилляцией предсердий и сниженной фракцией выброса левого желудочка: только улучшение гемодинамики или влияние на прогноз? (Систематический обзор)
Автор: Канорский С.Г., Новиков Д.С.
Журнал: Патология кровообращения и кардиохирургия @journal-meshalkin
Рубрика: Обзоры
Статья в выпуске: 3 т.27, 2023 года.
Бесплатный доступ
Цель. Критически оценить результаты исследований аблации фибрилляции предсердий в отношении влияния на гемодинамику и прогноз у пациентов с сердечной недостаточностью со сниженной фракцией выброса левого желудочка. Методы. В базах данных PubMed, Embase, Cochrane Library и Web of Science по ключевым словам отбирали наиболее цитируемые исследования, содержащие данные о лечении больных фибрилляцией предсердий и сердечной недостаточностью со сниженной фракцией выброса с помощью аблации, включая показатели фракции выброса левого желудочка, смертности, других конечных точек терапии. Анализировали влияние аблации в сравнении с медикаментозной терапией на динамику фракции выброса левого желудочка и клинические исходы у пациентов с фибрилляцией предсердий. Результаты. Провели скрининг 4 581 источника литературы, 48 из них отобрали для цитирования в обзоре. После эндокардиальной катетерной аблации, торакоскопической или гибридной аблации фибрилляции предсердий наблюдается в 4 раза большее (p
Катетерная аблация, сердечная недостаточность, сниженная фракция выброса левого желудочка, торакоскопическая аблация, фибрилляция предсердий
Короткий адрес: https://sciup.org/142239088
IDR: 142239088 | DOI: 10.21688/1681-3472-2023-3-7-18
Текст обзорной статьи Аблация у пациентов с фибрилляцией предсердий и сниженной фракцией выброса левого желудочка: только улучшение гемодинамики или влияние на прогноз? (Систематический обзор)
Цитировать: Канорский С.Г., Новиков Д.С. Аблация у пациентов с фибрилляцией предсердий и сниженной фракцией выброса левого желудочка: только улучшение гемодинамики или влияние на прогноз? (систематический обзор). Патология кровообращения и кардиохирургия. 2023;27(3):7-18.
Фибрилляция предсердий (ФП) и сердечная недостаточность со сниженной фракцией выброса (СНнФВ) левого желудочка (ЛЖ) часто сосуществуют, осложняя течение и затрудняя лечение друг друга, повышая заболеваемость и смертность пациентов [1]. Фармакотерапия ФП с целью поддержания синусового ритма у больных СН имеет ограниченную эффективность, может сопровождаться серьезными побочными эффектами, включая желудочковую проаритмию, обесценивая преимущества синусового ритма, что объясняет возрастающий интерес клиницистов к применению катетерной аблации (КА) ФП [2]. КА, по-видимому, превосходит терапию антиаритмическими препаратами в способности уменьшать вероятность рецидива ФП [3; 4], но ее результативность в снижении риска инсульта и смерти не доказана. Технология КА быстро совершенствуется, что приводит к уменьшению частоты осложнений процедуры [5]. В исследованиях последних лет у больных ФП и СНнФВ отмечают позитивные гемодинамические и клинические эффекты КА [6]. Однако неясно, насколько убедительны появившиеся данные о прогностическом преимуществе КА в сравнении с антиаритмическими препаратами, какие пациенты с СНнФВ получат явную пользу от КА ФП, какой метод аблации предпочтителен в этой популяции.
Цель обзора — критически оценить результаты исследований аблации ФП в отношении влияния на гемодинамику и прогноз у пациентов с сердечной недостаточностью со сниженной фракцией выброса.
Методы
Для поиска литературы использовали базы данных PubMed, Embase, Cochrane Library и Web of Science, содержащие информацию о катетерных и торакоскопических аблациях у пациентов с ФП и СН. Статьи отбирали в соответствии с принципами составления систематического обзора PRISMA ( рисунок ). Проанализировали работы до 8 марта 2023 г. по ключевым словам atrial fibrillation and heart failure, atrial fibrillation catheter ablation in heart failure и atrial fibrillation thoracoscopic ablation in heart failure. Главные критерии включения: участие в исследованиях пациентов в возрасте от 18 лет с ФП и СН; сравнение КА ФП с медикаментозной терапией; сообщения о динамике показателей визуализирующих и клинических методов исследования в результате лечения; публикации на английском языке. Критерии исключения: повторяющиеся отчеты, отчеты без публикации полного текста, описания клинических случаев, доклады на конференциях, экспертные мнения, неанглоязычные тексты. Выбор и обработку подходящих статей независимо осу-

Методика обработки информации
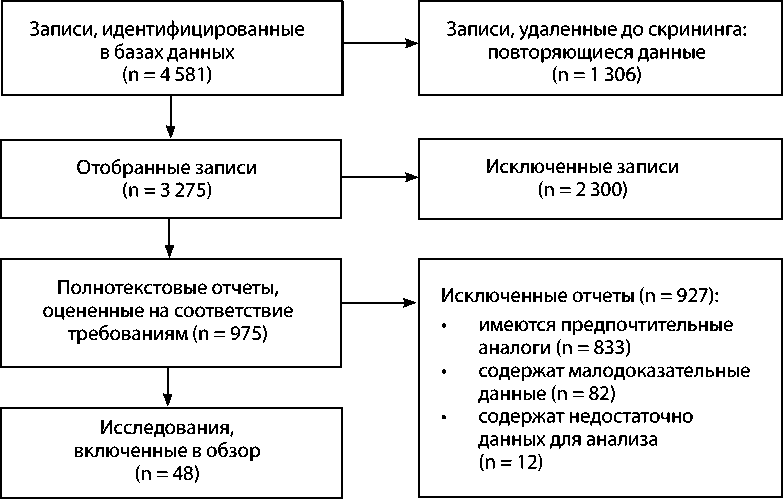
ществляли два исследователя, разногласия устраняли путем обсуждения с достижением консенсуса. Для цитирования в обзоре отобрали 48 источников литературы.
Результаты
В обзор вошли наиболее цитируемые исследования, которые опубликованы в ведущих кардиологических журналах и содержат данные о лечении больных ФП и СНнФВ с помощью аблации, включая динамику показателей ФВ ЛЖ, смертность, другие клинические эффекты терапии.
Исследования катетерной аблации против медикаментозного лечения пациентов с фибрилляцией предсердий и сниженной фракцией выброса левого желудочка
Существует достаточно данных об эффективности и безопасности выполнения КА ФП у пациентов с дисфункцией ЛЖ. M.R. MacDonald и соавт. в раннем клиническом исследовании наблюдали больных персистирующей формой ФП со значительно сниженной ФВ ЛЖ (< 20 %). Оценивали ФВ ЛЖ с помощью магнитно-резонансной томографии и радионуклидной вентрикулографии. Исходно пациенты в группе медикаментозного контроля ритма имели среднюю ФВ ЛЖ 19,6 ± 5,5 %, в группе КА — 16,1 ± 7,1 %. По данным магнитно-резонансной томографии, абсолютный прирост показателя в течение 6 мес. составил 2,8 ± 6,7 и 4,5 ± 11,1 % соответственно (p = 0,6). По данным радионуклидной вентрикулографии, ФВ ЛЖ существенно больше увеличилась в группе КА (8,2 ± 12,0 %) по сравнению с группой медикаментозной терапии (1,4 ± 5,9 %; p = 0,032). Однако в работе достаточно часто встречались осложнения КА (в 15 % случаев) и аблация не обеспечивала превосходства во влиянии на качество жизни, результаты теста 6-минутной ходьбы [7].
В первом рандомизированном исследовании сравнения КА и медикаментозного контроля частоты желудочковых сокращений у 52 пациентов с ФП и СН с ФВ ЛЖ ≤ 35 % D.G. Jones и соавт. отмечали большее улучшение переносимости физической нагрузки, уменьшение симптомов и улучшение нейрогормонального статуса в группе катетерной аблации [8].
В последующем у больных ФП при сравнении гемодинамических последствий медикаментозной терапии и КА обычно приоритет также оставался за последней ( таблица ). Отмечалось в среднем в 4 раза большее (p < 0,001) абсолютное увеличение показателя ФВ ЛЖ в сравнении с медикаментозным лечением аналогичных пациентов с ФП и сердечной недостаточностью.
В исследовании CAMTAF показатель ФВ ЛЖ составлял исходно 32 ± 8 % в группе КА и 34 ± 12 % в группе медикаментозного контроля частоты желудочковых сокращений при ФП, через 6 мес. — 40 ± 12 и 31 ± 13 % соответственно (р = 0,015). Под влиянием КА уменьшались симптомы СН, повышались работоспособность и качество жизни пациентов [9].
Выбор антиаритмических препаратов при СН резко ограничен и практически сводится к назначению амиодарона либо, с осторожностью, соталола. В исследовании AATAC оценивали эффект КА и амиодарона у больных персистирующей ФП с ФВ ЛЖ менее 40 %. Первичной конечной точкой был рецидив ФП, вторичными конечными точками — смерть от любой причины и незапланированная госпитализация. В период наблюдения не менее 24 мес. не имели рецидива аритмии 70 % пациентов в группе КА против 34 % в группе амиодарона (р < 0,001). Смертность в группе амиодарона составляла 18 %, в группе аблации — 8 % (р = 0,037). В группе КА отмечали более выраженное увеличение ФВ ЛЖ (8,1 ± 4,0 %) по сравнению с группой амиодарона (6,2 ± 5,0 %; р = 0,02) [10].
Прирост фракции выброса левого желудочка в группах аблации и медикаментозной терапии в основных исследованиях у пациентов с фибрилляцией предсердий и сердечной недостаточностью
|
Авторы, год публикации |
Абсолютный прирост фракции выброса левого желудочка, % |
p |
|
|
Аблация |
Медикаментозная терапия |
||
|
Parkash R. и соавт., 2022 [15] |
10,1 ± 1,2 |
3,8 ± 1,2 |
0,017 |
|
Marrouche N.F. и соавт., 2018 [12] |
8,0 |
0,2 |
0,005 |
|
Prabhu S. и соавт., 2017 [11] |
18,3 ± 13,0 |
4,4 ± 13,0 |
0,0001 |
|
Di Biase L. и соавт., 2016 [10] |
8,1 ± 4,0 |
6,2 ± 5,0 |
0,02 |
|
Hunter R.J. и соавт., 2014 [9] |
8,1 ± 12,5 |
-3,6 ± 9,7 |
0,001 |
|
Jones D.G. и соавт., 2013 [8] |
10,9 ± 11,5 |
5,4 ± 8,5 |
0,055 |
|
MacDonald M.R. и соавт., 2011 [7] |
8,2 ± 12,0 |
1,4 ± 5,9 |
0,032 |
В исследовании CAMERA-MRI участвовали пациенты с персистирующей ФП и идиопатической кардиомиопатией (ФВ ЛЖ ≤ 45 %), которым после оптимизации контроля частоты желудочковых сокращений выполняли магнитно-резонансную томографию сердца для оценки ФВ ЛЖ и позднего усиления гадолиния, указывавшего на фиброз желудочков, перед рандомизацией в группу КА ФП либо в группу продолжения обычного лечения. В группе медикаментозной терапии всего 24 % больных принимали антиаритмические препараты, и дизайн исследования предусматривал у них только контроль частоты желудочковых сокращений. Через 6 мес. в группе КА абсолютное увеличение ФВ ЛЖ составляло 18 ± 13 %, а в группе медикаментозного контроля частоты — 4,4 ± 13,0 % (p < 0,0001), и ФВ ЛЖ нормализовалась (≥ 50 %) у 58 против 9 % пациентов (p = 0,0002) соответственно. У перенесших КА отсутствие позднего усиления гадолиния предсказывало больший прирост абсолютной величины ФВ ЛЖ (10,7 %; p = 0,0069) и нормализацию данного показателя через 6 мес. (73 против 29 %; р = 0,0093) [11]. В этой работе подтвердилась идея о предпочтительности восстановления синусового ритма у больных ФП и СНнФВ, которая еще больше укрепилась по результатам исследования CASTLE-AF.
В рандомизированном исследовании CASTLE-AF участвовали 363 пациента с пароксизмальной либо персистирующей формой ФП и ФВ ЛЖ ≤ 35 %: в группе КА в среднем 32,5 %, в группе медикаментозной терапии — 31,5 % [12]. Средний абсолютный прирост ФВ ЛЖ в течение 60 мес. наблюдения составлял 8 % (7,3 % при пароксизмальной и 10,1 % при персистирующей форме ФП). В группе КА комбинированная конечная точка (смерть от любой причины либо госпитализация по поводу СН) встречалась на 38 % реже (р = 0,007), а смерть от любой причины — на 47 % реже (р = 0,01), чем в группе медикаментозного контроля частоты желудочковых сокращений или синусового ритма. В подгруппах с ФВ ЛЖ 20–35 % и < 20 % после КА отмечали значительный прирост этого показателя, превышавший таковой в группе медикаментозного лечения. При этом наибольшее улучшение клинических исходов (первичная конечная точка, смертность) в группе КА наблюдали у пациентов с исходно меньшей выраженностью клинических симптомов СН [13]. P.A. Noseworthy и соавт. проанализировали, в какой степени строгие критерии включения в исследование СASTLE-AF, включая наличие у больного имплантированного дефибриллятора, подходят общей выборке пациентов с ФП и СН, а также оценили эффективность КА в реаль- ной клинической практике. Согласно ретроспективным данным выборки из 289 831 больного ФП и СН, 91 % из них не соответствовали критериям включения в исследование, а 15,5 % отвечали критериям исключения. КА значимо снижала суммарную частоту смерти от любой причины либо госпитализации по поводу СН в сравнении с медикаментозным лечением ФП, однако менее выраженно, чем в исследовании CASTLE-AF. В то же время преимущества КА распространялись и на подгруппы пациентов с ФП и СН, не подходящих под критерии участия в CASTLE-AF [14].
В исследовании RAFT-AF также показано существенно большее увеличение ФВ ЛЖ в группе КА (абсолютный прирост 10,1 ± 1,2 %) по сравнению с группой медикаментозного контроля частоты желудочковых сокращений (абсолютный прирост 3,8 ± 1,2 %; р = 0,017), однако различие в смертности между группами не достигло статистической значимости (р = 0,066) [15]. В исследовании KiCS-AF Y. Shiraishi и соавт. провели ретроспективный анализ данных пациентов с ФП и СН со сниженной или сохраненной ФВ ЛЖ и показали уменьшение риска комбинированной конечной точки (смерть от всех причин, инсульт или госпитализация с СН) на 73 % (р = 0,027) в группе КА против группы без аблации [16].
По данным Шведского регистра СН, при использовании статистического метода псевдорандомизации (англ. propensity score matching) проведение КА ФП ассоциировалось со снижением на 22 % риска первичной конечной точки (смертность от всех причин или первая госпитализация с СН) по сравнению с группой медикаментозного лечения. При этом аналогичные результаты прослеживались в подгруппах больных СН с сохраненной (≥ 50 %), умеренно сниженной (40–49 %) и сниженной (< 40 %) ФВ ЛЖ, что может указывать на роль восстановления синусового ритма в улучшении прогноза пациентов с ФП и сердечной недостаточностью [17].
Преимущества КА у больных ФП и СН подтверждены в нескольких метаанализах. S.A. Virk и со-авт. в метаанализе 6 рандомизированных контролируемых исследований сравнили результаты КА и медикаментозной терапии ФП у 772 пациентов со средним показателем ФВ ЛЖ 30 ± 9 %. КА, по сравнению с медикаментозным лечением, сопровождалась большим улучшением ФВ ЛЖ (среднее различие абсолютного прироста показателя между группами 5,67 %; p < 0,001), превосходством в снижении смертности на 48 % (p = 0,001), улучшении результатов теста 6-минутной ходьбы и качества жизни [18]. В метаанализе 9 рандоми- зированных исследований (n = 2 155, средний исходный показатель ФВ ЛЖ 38 %) M. Magnocavallo и соавт. отмечали большее, на 4,76 %, абсолютное повышение ФВ ЛЖ (р = 0,0001), снижение смертности от всех причин на 35 % (р = 0,0005), госпитализации с СН на 33 % (р = 0,0001), рецидива ФП на 64 % (p < 0,0001), сердечно-сосудистой смерти на 42 % (р = 0,007), увеличение дистанции в тесте 6-минутной ходьбы (р = 0,0001) и улучшение показателя качества жизни (p = 0,007) при сравнении КА и медикаментозного лечения для контроля частоты желудочковых сокращений [19]. F.A. Simader и со-авт. в метаанализе 8 рандомизированных исследований (n = 1 390, средний исходный показатель ФВ ЛЖ 28 %) показали значимое снижение смертности (на 39 %; р = 0,003) и количества госпитализаций с СН (на 40 %; р < 0,001) после КА ФП по сравнению с медикаментозной терапией [20]. Z. Yu и соавт. также включили в свой метаанализ 8 рандомизированных исследований (n = 1 693), согласно результатам которых КА, по сравнению с медикаментозной терапией, снижала риск смерти от всех причин на 40 % (р < 0,001) и госпитализации по поводу СН на 42 % (р < 0,001), больше повышала ФВ ЛЖ (среднее абсолютное различие 5,25 %; р < 0,001), увеличивала дистанцию в тесте 6-минутной ходьбы (р = 0,005) и улучшала качество жизни (р = 0,03) [21]. J. Romero и соавт. в метаанализе 8 рандомизированных исследований (n = 2 121) продемонстрировали снижение смертности от всех причин на 35 % (р = 0,0005) при одновременном превосходстве в увеличении ФВ ЛЖ (среднее абсолютное различие 6,2 %; p < 0,00001) у пациентов, перенесших КА, по сравнению с традиционным лечением [22]. Наконец, F. Şaylık и соавт. в метаанализе 10 исследований (n = 2 187) установили снижение риска смерти от всех причин на 36 % (р < 0,01), на 5,38 % больший (p < 0,01) абсолютный прирост ФВ ЛЖ, удлинение дистанции 6-минутной ходьбы (p < 0,01) и улучшение качества жизни (p < 0,01) в группе КА по сравнению с группой медикаментозной терапии [23].
Авторитетные эксперты в обзорных статьях также указывают на перспективность КА в качестве лучшего, по сравнению с фармакотерапией, средства восстановления синусового ритма у больных ФП и СН при условии тщательного отбора пациентов для проведения вмешательства [24–26].
КА, скорее всего, принесет пользу пациентам, у которых можно ожидать длительного сохранения синусового ритма и продолжительность жизни которых значительно не ограничена другой патологией и/или возрастом. У больных с низкими шансами на сохранение синусового ритма можно рассматривать вмешательство pace-and-ablate, особенно с физиологической стимуляцией, для контроля частоты желудочковых сокращений при ФП. Оба указанных инвазивных метода лечения обычно превосходят фармакотерапию, но необходим индивидуальный подход к каждому пациенту с совместным принятием решений [24].
Хирургическая, торакоскопическая аблация и гибридные операции у пациентов с фибрилляцией предсердий и сниженной фракцией выброса левого желудочка
В настоящее время не существует радикального метода лечения ФП. Наиболее близко к желаемой идеальной эффективности приближалась операция Coх Maze («лабиринт»), в том числе модификация Cox Maze III, после которой до 96 % пациентов оставались свободны от ФП в течение более 5 лет и до 92 % — в течение 14 лет наблюдения [27]. Однако высокая эффективность этого вмешательства сочетается со значительной травматичностью и высоким риском осложнений. В поисках оптимального соотношения эффективности и безопасности предложено много хирургических методик, в будущем возможно появление новых вариантов хирургического лечения ФП. Открытый вариант операции Cox Maze с использованием воздействия радиочастотной либо криоэнергии (вариант Cox Maze IV) выполняют во многих специализированных клиниках как сопутствующую операцию у 50–60 % больных ФП, подвергающихся открытым хирургическим вмешательствам на сердце [28].
Ограниченный размер выборки типичен для сравнительно немногочисленных отчетов о результатах хирургической аблации у пациентов с органической патологией сердца, требующей сердечно-сосудистой хирургии. N. Ad и соавт. сообщили о 42 больных с ФВ ЛЖ < 40 %, подвергавшихся хирургической аблации ФП (модификации Coх Maze III/IV). В динамике через 1,5 ± 11,3 мес. после операции ФВ ЛЖ у обследованных возрастала с 30,0 ± 5,0 до 45,0 ± 13,0 %, что подтверждает целесообразность дополнительного вмешательства и позволяет надеяться на его потенциальные долгосрочные клинические преимущества [29].
Основные варианты операций у пациентов с ФП без необходимости открытой хирургии сердца, широко применяемые в практике, — эндокардиальная КА (преимущественно радиочастотная либо, реже, криоаблация), торакоскопическая аблация ФП и гибридные операции. Наиболее широко используется эндокардиальная КА ФП, которую можно применять как альтернативу приему антиаритмических препаратов и в качестве лечения первой линии. КА ФП имеет ряд преимуществ перед часто выполнявшейся ранее аблацией атриовентрикулярного соединения с имплантацией электрокардиостимулятора. М.N. Khan и соавт. в рандомизированном исследовании сравнили КА ФП и аблацию атриовентрикулярного соединения с имплантацией трехкамерного электрокардиостимулятора у пациентов со сниженной ФВ ЛЖ. Через 6 мес. в группе КА ФП наблюдались большие прирост ФВ ЛЖ (р < 0,001), дистанции 6-минутной ходьбы (р < 0,001) и улучшение качества жизни (р < 0,001) по сравнению с группой аблации/электрокардиостимуляции [30].
Торакоскопическая аблация ФП показана пациентам с пароксизмальной, персистирующей или длительно персистирующей формами ФП, рефрактерными к антиаритмической терапии после неудачной КА или без предварительной КА при наличии факторов риска рецидива аритмии [31]. Эффективность торакоскопической аблации обычно выше, чем КА, но уравновешивается повышенным риском нефатальных осложнений (гидроторакс, гемоторакс, пневмоторакс) [32]. Однако в рандомизированном исследовании СASA-AF S. Haldar и соавт. не наблюдали преимуществ в удержании синусового ритма после торакоскопической аблации в сравнении с эндокардиальной КА у пациентов с длительно персистирующей формой ФП. Контроль ритма в этом исследовании осуществляли имплантируемыми петлевыми регистраторами электрокардиограммы в течение 12 мес. [33]
Результаты торакоскопической аблации ФП согласуются с результатами КА, однако в первом случае количество проведенных исследований и их участников значительно меньше. H.R. Kim и соавт. описали выборку из 31 пациента со сниженной ФВ ЛЖ (28– 49 %), подвергавшихся торакоскопической аблации длительно персистирующей (45,2 %), персистирующей (51,6 %) и пароксизмальной (3,2 %) форм ФП. Средний исходный показатель ФВ ЛЖ 39,7 ± 6,1 % через 3 мес. увеличивался до 53,6 ± 9,3 % (р < 0,001), а через 25 мес. — до 58,1 ± 7,5 % (р < 0,001) [34]. L.M. Vos и соавт. провели ретроспективный анализ безопасности торакоскопической аблации в группе из 558 пациентов с ФП. В течение 30 дней после вмешательства серьезные и незначительные осложнения регистрировали у 3,2 и 8,1 % больных соответственно, один пациент умер от ишемического инсульта. Единственными подгруппами больных с избыточным риском осложнений являлись жен- щины в возрасте не менее 70 лет и пациенты с застойной СН в анамнезе [35].
Выборки больных для выполнения катетерной и торакоскопической аблаций обычно различались соотношением форм ФП участников. Торакоскопическое вмешательство чаще выполняли у пациентов с персистирующей и длительно персистирующей формами ФП, значительно реже — при пароксизмальной форме. Торакоскопическую аблацию часто проводили больным с неэффективной КА ФП. После аблации ФП, независимо от ее методики (катетерная либо торакоскопическая), систолическая дисфункция ЛЖ оказывалась частично обратимой на фоне восстановления синусового ритма либо снижения бремени фибрилляции предсердий.
Гибридные операции (малоинвазивная хирургическая и эндокардиальная КА) обычно более эффективны, чем только эндокардиальные, но риск осложнений при них в 2,0–3,6 раза выше [36]. A. Kiankhooy и соавт. ретроспективно проанализировали результаты гибридной аблации у 40 пациентов с персистирующей или длительно персистирующей формами ФП и ФВ ЛЖ ≤ 40 %. В течение 30 дней не было смертельных исходов или инсультов. В 7,5 % случаев устанавливали новые постоянные кардиостимуляторы. Успешного восстановления синусового ритма достигли почти у 2/3 пациентов при среднем периоде наблюдения 3,5 ± 1,9 года. Абсолютное увеличение ФВ ЛЖ в среднем составляло 12,0 ± 12,5 % (р < 0,0001), а средний показатель конечного диастолического размера ЛЖ уменьшился на 0,40 ± 0,85 см (р < 0,01), что сопровождалось уменьшением тяжести сердечной недостаточности [37].
Гибридные вмешательства сложны, поэтому должны выполняться в центрах с большим опытом у отдельных пациентов с персистирующей или длительно персистирующей формами фибрилляции предсердий.
Обсуждение
В течение двух последних десятилетий стратегию контроля синусового ритма у больных ФП рассматривали лишь как способ улучшения качества жизни. Однако сейчас наблюдается возврат к признанию доминирующей роли контроля ритма, что связано в том числе с публикацией позитивных результатов исследований аблации ФП, представленных в настоящем обзоре [38]. Широкий резонанс получили данные рандомизированного многоцентрового исследования EAST-AFNET 4, в котором участвовали 2 789 пациентов с ФП, диагностированной в среднем за 36 сут. до включения в работу. Ранний контроль ритма обеспечивал значимое различие (р = 0,005) частоты возникновения событий комбинированной первичной конечной точки (инсульт, сердечно-сосудистая смерть или госпитализация по поводу острого коронарного синдрома либо прогрессирования СН) в сравнении с обычным лечением [39]. Только у 123 участников EAST-AFNET 4 имелась ФВ ЛЖ < 40 %, и явная тенденция к снижению частоты событий первичной конечной точки в группе контроля ритма не достигала статистической значимости (р = 0,12) [40]. Несмотря на различия в частоте событий первичной конечной точки, динамика дисфункции ЛЖ между сравнивавшимися группами в данном исследовании оказалась сопоставимой.
Положения действующих клинических рекомендаций отражают различные позиции групп экспертов в отношении роли и задач аблации у больных ФП и СН. В фокусном обновлении текста Американской кардиологической ассоциации (англ. American Heart Association) / Американской коллегии кардиологов (англ. American College of Cardiology) / Общества сердечного ритма (англ. Heart Rhythm Society) по ведению больных ФП при симптомной ФП и СНнФВ предлагается выбрать КА для отдельных пациентов, чтобы потенциально снизить уровень смертности и сократить количество госпитализаций по поводу СН (класс IIb) [41]. В рекомендациях Европейского общества кардиологов (англ. European Society of Cardiology) по диагностике и лечению ФП указано, что КА следует рассматривать у больных СНнФВ, которые были выбраны для лечения с целью контроля ритма, чтобы улучшить качество жизни и функцию ЛЖ, а также снизить риск госпитализации по поводу СН и, возможно, смерти (класс IIa) [31]. В документе Европейского общества кардиологов по диагностике и лечению хронической СН КА рекомендуется для поддержания синусового ритма у пациентов с ФП и СН (класс IIa) [42]. В документе Американской кардиологической ассоциации / Американской коллегии кардиологов / Американского общества по сердечной недостаточности (англ. Heart Failure Society of America) по ведению больных СН лицам с симптом-ной ФП или СН рекомендована аблация аритмии для уменьшения симптомов и улучшения качества жизни (класс IIa) [43].
Доказательная база перечисленных положений клинических рекомендаций сводится к результатам сравнительно небольших исследований AATAC (n = 203) [10] и CASTLE-AF (n = 363) [12]. В AATAC в группе КА удалось снизить риск смерти от любой причины и незапланированной госпитализации, являвшихся не первичной, а вторичными конечными точками исследования, и количество зарегистрированных исходов было совсем небольшим. В CASTLE-AF включали только 1 из 8–9 пациентов, прошедших скрининг, что ограничивает распространение результатов на всех больных ФП в реальной клинической практике. В этой работе не удалось достичь целевого размера выборки, что снизило статистическую мощность исследования (всего 133 первичных исхода). Кроме того, 73 % исходов в группе КА и 55 % в группе без КА не вошли в анализ событий первичной конечной точки по неизвестным причинам, а также из-за потери больных при длительном наблюдении, что делает результаты CASTLE-AF ненадежными [44]. Таким образом, в совокупности эти исследования следует интерпретировать как представление скромных доказательств положительного влияния аблации ФП на клинические исходы, как это отражено в рекомендациях.
В исследовании RAFT-AF не был достигнут запланированный размер выборки, после набора 411 больных ФП и СН проект остановили досрочно из-за представления о его бесполезности по результатам промежуточного анализа [15]. Исследование AMICA не показало статистически значимого превосходства КА во влиянии на ФВ ЛЖ в группе аблации ФП у наиболее тяжелых пациентов с СН (среднее значение ФВ ЛЖ 27,6 %, симптомы СН III и IV функциональных классов по классификации Нью-Йоркской кардиологической ассоциации (англ. New York Heart Association) у 60 % участников по сравнению с 31 % в CASTLE-AF) [45].
Представленные в настоящем обзоре позитивные для аблации исследования проводили с участием малых групп больных ФП и СНнФВ. В таких случаях представляют научный и практический интерес их метаанализы, в том числе процитированные в обзоре [18–23]. Практически все они продемонстрировали превосходство КА над фармакологической антиаритмической терапией в поддержании синусового ритма, снижении риска рецидива ФП, смертности от всех причин и госпитализации при обострении СН, улучшении ФВ ЛЖ, дистанции в тесте 6-минутной ходьбы и качества жизни. Между тем эти благоприятные данные необходимо рассматривать с учетом ограничений исследований, которые привели к выводам метаанализов. Возможно влияние предвзятости при отборе, из-за чего в рандомизированные исследования аблации включали более молодых пациентов и в лучшем клиническом состоянии, чем в реальном мире [46]. В отличие от исследований лекарственных препаратов, аблацию ФП проводили открытым для врача и пациента способом — без ее имитации в контрольной группе.
В отсутствие окончательных доказательств значительной клинической пользы для большинства больных ФП и СН баланс риска и пользы аблации необходимо обсуждать с пациентом. При этом аблацию следует рассматривать для больных с состояниями, которые ассоциируются с большей перспективой положительных клинических результатов процедуры. Например, пациенты с кардиомиопатией, ассоциированной с тахикардией на фоне ФП, по-видимому, получат большую выгоду от аблации. Напротив, ее преимущество может оказаться меньше или отсутствовать у пациентов в возрасте старше 65 лет при ФВ ЛЖ < 25 % и симптомах СН III/IV функционального класса по классификации Нью-Йоркской кардиологической ассоциации [13; 45], наличии выраженного фиброза желудочков по данным магнитно-резонансной томографии [47]. Следовательно, аблация ФП с большей вероятностью принесет пользу сравнительно молодым и менее ко-морбидным пациентам с СНнФВ в виде улучшения систолической функции после восстановления синусового ритма и, возможно, улучшения клинических исходов при более мягких симптомах СН, ФВ ЛЖ > 25 %, отсутствии фиброза желудочков и выраженной дилатации предсердий. Можно думать, что в основе наступающего улучшения будет восстановление систолы предсердий и устранение тахикардии из-за ФП, уменьшение нейрогормональной активации и ремоделирования миокарда.
Технологии аблации ФП активно развиваются, уже доступны первые результаты клинического исследования изоляции легочных вен с помощью аблации импульсным полем (создание нетепловой необратимой электропорации, то есть отверстий в клетках, которые приводят к их гибели в результате апоптоза, а не некроза). В исследовании PULSED AF через 12 мес. после процедуры ФП продолжительностью более 30 с отсутствовала у 66,2 % пациентов с пароксизмальной и у 55,1 % — с персистирующей ее формой. Аблация импульсным полем требовала значительно меньше затрат времени и отличалась высокой безопасностью: риск осложнений процедуры составлял всего 0,7 %, не наблюдалось стеноза легочных вен, повреждения диафрагмального нерва или пищевода [48]. Использование импульсного электрического поля при КА ФП, в том числе у пациентов с СН, может стать хорошей альтернативой широко используемым видам энергии (радиочастотный ток и воздействие холодовым агентом при криоаблации). Приоритет дан- ного вида энергии в безопасности и длительности операции требует дальнейшей проверки в исследованиях и клинической практике.
Ограничения
Включенные в обзор исследования аблации ФП у пациентов с СНнФВ предполагали использование в контрольной группе как медикаментозного контроля частоты желудочковых сокращений, так и антиаритмических препаратов для поддержания синусового ритма. Авторы применяли не строго стандартизированные методики аблации, различную медикаментозную терапию СН, разные методы документирования рецидивов аритмии в ходе наблюдения за пациентами. Некоторые исследования КА прекращены досрочно из-за представлений наблюдательной комиссии о бесполезности процедуры, от проведения которой ожидался быстрый благоприятный эффект.
Выборки перенесших КА чаще включали больных пароксизмальной, а в случае торакоскопической аблации — длительно персистирующей формами ФП, а также с неэффективностью ранее выполнявшейся КА, что влияет на результативность аблации. Нередко в опубликованных отчетах об исследованиях отсутствовали уточнения причин СН у пациентов, которые способны влиять на динамику ФВ ЛЖ после аблации фибрилляции предсердий.
Больных, которых включали в исследования аблации, традиционно отбирали на основе предполагаемой высокой вероятности успешности процедуры, поэтому характеристики участвовавших в рандомизированных исследованиях пациентов с ФП и СН существенно отличались от типичных для рутинной клинической практики.
Результаты аблации, выполненной в центрах с лучшим оснащением и специалистами с большим опытом, не смогут широко воспроизводиться в реальном мире. Поэтому вполне обоснованным представляется направление пациентов для аблации ФП в центры, имеющие более низкие показатели осложнений и смертности в связи с этой процедурой.
Заключение
Несмотря на ограничения доступных исследований, очевидна смена тактики лечения ФП: от доминировавшей два последних десятилетия идеи достаточности урежения частоты желудочковых сокращений к восстановлению синусового ритма. Устранение ФП либо снижение ее бремени лучше достигается аблацией в сравнении с применением антиаритмических препаратов. Технологии аблации быстро развиваются, что контрастирует с длительным отсутствием появления новых эффективных и безопасных антиаритмических препаратов. При этом разумным представляется сочетание аблации и медикаментозной терапии для достижения лучших результатов.
После аблации ФП у пациентов с СНнФВ при длительном наблюдении отмечается статистически значимое улучшение систолической функции. Эта динамика характерна для перенесших эндокардиальную КА, торакоскопическую или гибридную аблацию ФП и, вероятно, обусловлена снижением бремени аритмии. КА ассоциируется с более значительным повышением ФВ ЛЖ в сравнении с медикаментозным лечением аналогичных пациентов с ФП и СН. Возможно увеличение ФВ ЛЖ после аблации ФП даже при исходном снижении < 20 %, но в данной группе больных повышен риск осложнений процедуры. Он возрастает также в случае выполнения торакоскопической аблации ФП при наличии застойной СН в анамнезе. У отобранных пациентов с ФП и СН КА, вероятно, способна снижать смертность и частоту госпитализации по поводу СН. Необходимы дополнительные исследования для уточнения характеристик больных ФП и СН, которым аблация аритмии принесет наибольшую пользу.
Список литературы Аблация у пациентов с фибрилляцией предсердий и сниженной фракцией выброса левого желудочка: только улучшение гемодинамики или влияние на прогноз? (Систематический обзор)
- Chiocchini A., Terricabras M., Verma A. Atrial fibrillation ablation in heart failure: What do we know? What can we do? Europace. 2021;23(3):353-361. PMID: 33083820. https://doi. org/10.1093/europace/euaa217
- Capucci A., Stronati G., Guerra F. Anti-arrhythmic drugs in atrial fibrillation: tailor-made treatments. Eur Heart JSuppl. 2023;25(Suppl C):C12-C14. PMID: 37125269; PMCID: PMC10132592. https://doi.org/10.1093/eurheartjsupp/suad033
- Wazni O.M., Dandamudi G., Sood N., Hoyt R., Tyler J., Durrani S., Niebauer M., Makati K., Halperin B., Gauri A., Morales G., Shao M., Cerkvenik J., Kaplon R.E., Nissen S.E.; STOP AF First Trial Investigators. Cryoballoon ablation as initial therapy for atrial fibrillation. N Engl J Med. 2021;384(4):316-324. PMID: 33197158. https://doi.org/10.1056/NEJMoa2029554
- Andrade J.G., Wells G.A., Deyell M.W., Bennett M., Essebag V., Champagne J., Roux J.-F., Yung D., Skanes A., Khaykin Y., Morillo C., Jolly U., Novak P., Lockwood E., Amit G., Angaran P., Sapp J., Wardell S., Lauck S., Macle L., Verma A.; EARLY-AF Investigators. Cryoablation or drug therapy for initial treatment of atrial fibrillation. N Engl J Med. 2021;384(4):305-315. PMID: 33197159. https://doi.org/10.1056/NEJMoa2029980
- Hsu J.C., Darden D., Du C., Marine J.E., Nichols S., Marcus G.M., Natale A., Noseworthy P.A., Selzman K.A., Varosy P., Masoudi F., Freeman J., Curtis J., Akar J., Kowey P.R. Initial findings from the National Cardiovascular Data Registry of Atrial Fibrillation Ablation Procedures. J Am Coll Cardiol. 2023;81(9):867-878. PMID: 36858707. https://doi.org/10.1016/j.jacc.2022.11.060
- Younes H., Noujaim C., Mekhael M., Chouman N., Assaf A., Kreidieh O., Lim C., Marrouche N., Donnellan E. Atrial fibrillation ablation as first-line therapy for patients with heart failure with reduced ejection fraction (HFrEF): evaluating the impact on patient survival. Expert Rev Cardiovasc Ther. 2023;21(2):111-121. PMID: 36680789. https://doi.org/10.1080 /14779072.2023.2172402
- MacDonald M.R., Connelly D.T., Hawkins N.M., Steedman T., Payne J., Shaw M., Denvir M., Bhagra S., Small S., Martin W., McMurray J.J.V., Petrie M.C. Radiofrequency ablation for persistent atrial fibrillation in patients with advanced heart failure and severe left ventricular systolic dysfunction: a randomised controlled trial. Heart. 2011;97(9):740-747. PMID: 21051458. https://doi.org/10.1136/hrt.2010.207340
- Jones D.G., Haldar S.K., Hussain W., Sharma R., Francis D.P., Rahman-Haley S.L., McDonagh T.A., Underwood S.R., Markides V., Wong T. A randomized trial to assess catheter ablation versus rate control in the management of persistent atrial fibrillation in heart failure. J Am Coll Cardiol. 2013;61(18):1894-1903. PMID: 23500267. https://doi. org/10.1016/j.jacc.2013.01.069
- Hunter R.J., Berriman T.J., Diab I., Kamdar R., Richmond L., Baker V., Goromonzi F., Sawhney V., Duncan E., Page S.P., Ullah W., Unsworth B., Mayet J., Dhinoja M., Earley M.J., Sporton S., Schilling R.J. A randomized controlled trial of catheter ablation versus medical treatment of atrial fibrillation in heart failure (the CAMTAF trial). Circ Arrhythm Electrophysiol. 2014;7(1 ):31-38. PMID: 24382410. https://doi. org/10.1161/CIRCEP.113.000806
- Di Biase L., Mohanty P., Mohanty S., Santangeli P., Trivedi C., Lakkireddy D., Reddy M., Jais P., Themistoclakis S., Dello Russo A., Casella M., Pelargonio G., Narducci M.L., Schweikert R., Neuzil P., Sanchez J., Horton R., Beheiry S., Hongo R., Hao S., Rossillo A., Forleo G., Tondo C., Burkhardt J.D., Haissaguerre M., Natale A. Ablation versus amiodarone for treatment of persistent atrial fibrillation in patients with congestive heart failure and an implanted device: results from the AATAC multicenter randomized trial. Circulation. 2016;133(17):1637-1644. PMID: 27029350. https:// doi.org/10.1161/CIRCULATI0NAHA.115.019406
- Prabhu S., Taylor A.J., Costello B.T., Kaye D.M., McLellan A.J.A., Voskoboinik A., Sugumar H., Lockwood S.M., Stokes M.B., Pathik B., Nalliah CJ., Wong G.R., Azzopardi S.M., Gutman S.J., Lee G., Layland J., Mariani J.A., Ling L.-H., Kalman J.M., Kistler P.M. Catheter ablation versus medical rate control in atrial fibrillation and systolic dysfunction: the CAMERA-MRI study. J Am Coll Cardiol. 2017;70(16):1949-1961. PMID: 28855115. https://doi.org/10.1016/_i.jacc.2017.08.041
- Marrouche N.F., Brachmann J., Andresen D., Siebels J., Boersma L., Jordaens L., Merkely B., Pokushalov E., Sanders P., Proff J., Schunkert H., Christ H., Vogt J., Bänsch D.; CASTLE-AF Investigators. Catheter ablation for atrial fibrillation with heart failure. N Engl J Med. 2018;378(5):417-427. PMID: 29385358. https://doi.org/10.1056/NEJMoa1707855
- Sohns C., Zintl K., Zhao Y., Dagher L., Andresen D., Siebels J., Wegscheider K., Sehner S., Boersma L., Merkely B., Pokushalov E., Sanders P., Schunkert H., Bänsch D., Mahnkopf C., Brachmann J., Marrouche N.F. Impact of left ventricular function and heart failure symptoms on outcomes post ablation of atrial fibrillation in heart failure: CASTLE-AF trial. Circ Arrhythm Electrophysiol. 2020;13(10):e008461. PMID: 32903044. https://doi.org/10.1161/CIRCEP.120.008461
- Noseworthy P.A., Van Houten H.K., Gersh B.J., Packer D.L., Friedman P.A., Shah N.D., Dunlay S.M., Siontis K.C., Piccini J.P., Yao X. Generalizability of the CASTLE-AF trial: catheter ablation for patients with atrial fibrillation and heart failure in routine practice. Heart Rhythm. 2020;17(7):1057-1065. PMID: 32145348; PMCID: PMC7648571. https://doi.org/10.1016XI. hrthm.2020.02.030
- Parkash R., Wells G.A., Rouleau J., Talajic M., Essebag V., Skanes A., Wilton S.B., Verma A., Healey J.S., Sterns L., Bennett M., Roux J.-F., Rivard L., Leong-Sit P., Jensen-Urstad M., Jolly U., Philippon F., Sapp J.L., Tang A.S.L. Randomized ablation-based rhythm-control versus rate-control trial in patients with heart failure and atrial fibrillation: results from the RAFT-AF trial. Circulation. 2022;145(23):1693-1704. PMID: 35313733. https://doi. org/10.1161/CIRCULATI0NAHA.121.057095
- Shiraishi Y., Kohsaka S., Ikemura N., Kimura T., Katsumata Y., Tanimoto K., Suzuki M., Ueda I., Fukuda K., Takatsuki S. Catheter ablation for patients with atrial fibrillation and heart failure with reduced and preserved ejection fraction: insights from the KiCS-AF multicentre cohort study. Europace. 2023;25(1):83-91. PMID: 35851807; PMCID: PMC10103568. https://doi.org/10.1093/europace/euac108
- von Olshausen G., Benson L., Dahlstrom U., Lund L.H., Savarese G., Braunschweig F. Catheter ablation for patients with atrial fibrillation and heart failure: insights from the Swedish Heart Failure Registry. Eur J Heart Fail. 2022;24(9):1636-1646. PMID: 35779270. https://doi. org/10.1002/ejhf.2604
- Virk S.A., Bennett R.G., Chow C., Sanders P., Kalman J.M., Thomas S., Kumar S. Catheter ablation versus medical therapy for atrial fibrillation in patients with heart failure: a meta-analysis of randomised controlled trials. Heart Lung Circ. 2019;28(5):707-718. PMID: 30509786. https://doi. org/10.1016/j.hlc.2018.10.022
- Magnocavallo M., Parlavecchio A., Vetta G., Gianni C., Polselli M., De Vuono F., Pannone L., Mohanty S., Cauti F.M., Caminiti R., Miraglia V., Monaco C., Chierchia G.-B., Rossi P., Di Biase L., Bianchi S., de Asmundis C., Natale A., Della Rocca D.G. Catheter ablation versus medical therapy of atrial fibrillation in patients with heart failure: an updated systematic review and meta-analysis of randomized controlled trials. J Clin Med. 2022;11(19):5530. PMID: 36233407; PMCID: PMC9572511. https://doi.org/10.3390/jcm11195530
- Simader F.A., Howard J.P., Ahmad Y., Saleh K., Naraen A., Samways J.W., Mohal J., Reddy R.K., Kaza N., Keene D., Shun-Shin M.J., Francis D.P., Whinnett Z.I., Arnold A.D. Catheter ablation improves cardiovascular outcomes in patients with atrial fibrillation and heart failure: a meta-analysis of randomized controlled trials. Europace. 2023;25(2):341-350. PMID: 36305545; PMCID: PMC9934993. https://doi. org/10.1093/europace/euac173
- Yu Z., Xing Y., Peng J., Xu B., Qi Y., Zheng Z., Qiu Y., Qiu F., Peng F. Catheter ablation versus medical therapy for atrial fibrillation in patients with heart failure: a meta-analysis of randomized controlled trials. Anatol J Cardiol. 2022;26(9):685-695. PMID: 35949135; PMCID: PMC9524201. https://doi.org/10.5152/ AnatolJCardiol.2022.1826
- Romero J., Gabr M., Alviz I., Briceno D., Diaz J.C., Rodriguez D., Patel K., Polanco D., Trivedi C., Mohanty S., Della Rocca D., Lakkireddy D., Natale A., Di Biase L. Improved survival in patients with atrial fibrillation and heart failure undergoing catheter ablation compared to medical treatment: A systematic review and meta-analysis of randomized controlled trials. JCardiovascElectrophysiol. 2022;33(11):2356-2366. PMID: 35842804. https://doi.org/10.1111/jce.15622
- Jaylik F., Qnar T., Akbulut T., Hayiroglu M.i. Comparison of catheter ablation and medical therapy for atrial fibrillation in heart failure patients: A meta-analysis of randomized controlled trials. Heart Lung. 2023;57:69-74. PMID: 36084398. https://doi.org/10.1016/j.hrtlng.2022.08.012
- Calvert P., Farinha J.M., Gupta D., Kahn M., Proietti R., Lip G.Y.H. A comparison of medical therapy and ablation for atrial fibrillation in patients with heart failure. Expert Rev Cardiovasc Ther. 2022;20(3):169-183. PMID: 35255780. https://doi.org/10. 1080/14779072.2022.2050695
- Mulder B.A., Rienstra M., Van Gelder I.C., Blaauw Y. Update on management of atrial fibrillation in heart failure: a focus on ablation. Heart. 2022;108(6):422-428. PMID: 34088767; PMCID: PMC8899490. https://doi.org/10.1136/heartjnl-2020-318081
- Reddy Y.N.V., Borlaug B.A., Gersh B.J. Management of atrial fibrillation across the spectrum of heart failure with preserved and reduced ejection fraction. Circulation. 2022;146(4):339-357. PMID: 35877831. https://doi.org/10.1161/ CIRCULATI0NAHA.122.057444
- Cox J.L., Churyla A., Malaisrie S.C., Kruse J., Pham D.T., Kislitsina O.N., McCarthy P.M. When is a Maze procedure a Maze procedure? Can J Cardiol. 2018;34(11):1482-1491. PMID: 30121148. https://doi.org/10.1016/j.cjca.2018.05.008
- Khiabani A.J., MacGregor R.M., Bakir N.H., Manghelli J.L., Sinn L.A., Maniar H.S., Moon M.R., Schuessler R.B., Melby S.J., Damiano R.J. Jr. The long-term outcomes and durability of the Cox-Maze IV procedure for atrial fibrillation. J Thorac Cardiovasc Surg. 2022;163(2):629-641.e7. PMID: 32563577; PMCID: PMC9810144. https://doi.org/10.1016/j. jtcvs.2020.04.100
- Ad N., Henry L., Hunt S. The impact of surgical ablation in patients with low ejection fraction, heart failure, and atrial fibrillation. Eur J Cardiothorac Surg. 2011;40(1):70-76. PMID: 21169029. https://doi.org/10.1016/j.ejcts.2010.11.016
- Khan M.N., Ja'i's P., Cummings J., Di Biase L., Sanders P., Martin D.O., Kautzner J., Hao S., Themistoclakis S., Fanelli R., Potenza D., Massaro R., Wazni O., Schweikert R., Saliba W., Wang P., Al-Ahmad A., Beheiry S., Santarelli P., Starling R.C., Dello Russo A., Pelargonio G., Brachmann J., Schibgilla V., Bonso A., Casella M., Raviele A., Ha'ssaguerre M., Natale A.; PABA-CHF Investigators. Pulmonary-vein isolation for atrial fibrillation in patients with heart failure. N Engl J Med. 2008;359(17):1778-1785. PMID: 18946063. https://doi. org/10.1056/NEJMoa0708234
- Hindricks G., PotparaT., Dagres N., Arbelo E., Bax J.J., Blomström-Lundqvist C., Boriani G., Castella M., Dan G.-A., Dilaveris P.E., Fauchier L., Filippatos G., Kalman J.M., La Meir M., Lane D.A., Lebeau J.-P., Lettino M., Lip G.Y.H., Pinto F.J., Thomas G.N., Valgimigli M., Van Gelder I.C., Van Putte B.P., Watkins C.L.; ESC Scientific Document Group. 2020 ESC Guidelines for the diagnosis and management of atrial fibrillation developed in collaboration with the European Association for Cardio-Thoracic Surgery (EACTS): the Task Force for the diagnosis and management of atrial fibrillation of the European Society of Cardiology (ESC) developed with the special contribution of the European Heart Rhythm Association (EHRA) of the ESC. Eur Heart J. 2021;42(5):373-498. PMID: 32860505. https://doi. org/10.1093/eurheartj/ehaa612
- Phan K., Phan S., Thiagalingam A., Medi C., Yan T.D. Thoracoscopic surgical ablation versus catheter ablation for atrial fibrillation. Eur J Cardiothorac Surg. 2016;49(4):1044-1051. PMID: 26003961. https://doi.org/10.1093/ejcts/ ezv180
- Haldar S., Khan H.R., Boyalla V., Kralj-Hans I., Jones S., Lord J., Onyimadu O., Satishkumar A., Bahrami T., De Souza A., Clague J.R., Francis D.P., Hussain W., Jarman J.W., Jones D.G., Chen Z., Mediratta N., Hyde J., Lewis M., Mohiaddin R., SalukheT.V., Murphy C., Kelly J., Khattar R.S., Toff W.D., Markides V., McCready J., Gupta D., Wong T. Catheter ablation vs. thoracoscopic surgical ablation in longstanding persistent atrial fibrillation: CASA-AF randomized controlled trial. Eur Heart J. 2020;41(47):4471-4480. PMID: 32860414; PMCID: PMC7767634. https://doi.org/10.1093/ eurheartj/ehaa658
- Kim H.R., Jeong D.-S., Kwon H.-J., Park S.-J., Park K.-M., Kim J.S., On Y.K. Total thoracoscopic ablation in patients with atrial fibrillation and left ventricular dysfunction. JTCVS Tech. 2021;8:60-66. PMID: 34401814; PMCID: PMC8350785. https:// doi.org/10.1016/Mtc.2021.04.006
- Vos L.M., Kotecha D., Geuzebroek G.S.C., Hofman F.N., van Boven W.J.P., Kelder J., de Mol B.A.J.M., van Putte B.P. Totally thoracoscopic ablation for atrial fibrillation: a systematic safety analysis. Europace. 2018;20(11 ):1790-1797. PMID: 29361045; PMCID: PMC6212776. https://doi.org/10.1093/ europace/eux385
- Bisleri G., Pandey A.K., Verma S., Ali Hassan S.M., Yanagawa B., Khandaker M., Gaudino M., Russo A.M., Verma A., Bhatt D.L., Ha A.C.T. Combined minimally invasive surgical and percutaneous catheter ablation of atrial fibrillation: JACC review topic of the week. J Am Coll Cardiol. 2023;81(6):606-619. PMID: 36754519. https://doi.org/10.1016/j.jacc.2022.11.039
- Kiankhooy A., Pierce C., Burk S., Phillips A., Eisenberg S., Dunnington G. Hybrid ablation of persistent and longstanding persistent atrial fibrillation with depressed ejection fraction: A single-center observational study. JTCVS Open. 2022;12:137-146. PMID: 36590727; PMCID: PMC9801285. https://doi.org/10.1016/j.xjon.2022.08.014
- Camm A.J., Naccarelli G.V., Mittal S., Crijns H.J.G.M., Hohnloser S.H., Ma C.-S., Natale A., Turakhia M.P., Kirchhof P. The increasing role of rhythm control in patients with atrial fibrillation: JACC state-of-the-art review. J Am Coll Cardiol. 2022;79(19):1932-1948. PMID: 35550691. https://doi. org/10.1016/j.jacc.2022.03.337
- Kirchhof P., Camm A.J., Goette A., Brandes A., Eckardt L., Elvan A., Fetsch T., van Gelder I.C., Haase D., Haegeli L.M., Hamann F., Heidbüchel H., Hindricks G., Kautzner J., Kuck K.-H., Mont L., Ng G.A., Rekosz J., Schoen N., Schotten U., Suling A., Taggeselle J., Themistoclakis S., Vettorazzi E., Vardas P., Wegscheider K., Willems S., Crijns H.J.G.M., Breithardt G.; EAST-AFNET 4 Trial Investigators. Early rhythm-control therapy in patients with atrial fibrillation. N Engl J Med. 2020;383(14):1305-1316. PMID: 32865375. https://doi. org/10.1056/NEJMoa2019422
- Rillig A., Magnussen C., Ozga A.-K., Suling A., Brandes A., Breithardt G., Camm A.J., Crijns H.J.G.M., Eckardt L., Elvan A., Goette A., Gulizia M., Haegeli L., Heidbuchel H., Kuck K.-H., Ng A., Szumowski L., van Gelder I., Wegscheider K., Kirchhof P. Early rhythm control therapy in patients with atrial fibrillation and heart failure. Circulation. 2021;144(11):845-858. PMID: 34328366; PMCID: PMC8456351. https://doi.org/10.1161/ CIRCULATI0NAHA.121.056323
- January C.T., Wann L.S., Calkins H., Chen L.Y., Cigarroa J.E., Cleveland J.C. Jr, Ellinor P.T., Ezekowitz M.D., Field M.E., Furie K.L., Heidenreich P.A., Murray K.T., Shea J.B., Tracy C.M., Yancy C.W. 2019 AHA/ACC/HRS focused update of the 2014 AHA/ACC/HRS Guideline for the management of patients with atrial fibrillation: a report of the American College of Cardiology/American Heart Association Task Force on Clinical Practice Guidelines and the Heart Rhythm Society in collaboration with the Society of Thoracic Surgeons. Circulation. 2019;140(2):e125-e151. PMID: 30686041. https:// doi.org/10.1161/CIR.0000000000000665
- McDonagh T.A., Metra M., Adamo M., Gardner R.S., Baumbach A., Böhm M., Burri H., Butler J., Celutkienè J., Chioncel O., Cleland J.G.F., Coats A.J.S., Crespo-Leiro M.G., Farmakis D., Gilard M., Heymans S., Hoes A.W., Jaarsma T., Jankowska E.A., Lainscak M., Lam C.S.P., Lyon A.R., McMurray J.J.V., Mebazaa A., Mindham R., Muneretto C., Francesco Piepoli M., Price S., Rosano G.M.C., Ruschitzka F., Kathrine Skibelund A.; ESC Scientific Document Group. 2021 ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure. Eur Heart J. 2021;42(36):3599-3726. PMID: 34447992. https://doi.org/10.1093/eurheartj/ehab368
- Heidenreich P.A., Bozkurt B., Aguilar D., Allen L.A., Byun JJ., Colvin M.M., Deswal A., Drazner M.H., Dunlay S.M., Evers L.R., Fang J.C., Fedson S.E., Fonarow G.C., Hayek S.S., Hernandez A.F., Khazanie P., Kittleson M.M., Lee C.S., Link M.S., Milano C.A., Nnacheta L.C., Sandhu A.T., Stevenson L.W., Vardeny O., Vest A.R., Yancy C.W. 2022 AHA/ACC/HFSA Guideline for the management of heart failure: executive summary: a report of the American College of Cardiology/American Heart Association Joint Committee on Clinical Practice Guidelines. Circulation. 2022;145(18):e876-e894. PMID: 35363500. https:// doi.org/10.1161/CIR.0000000000001062
- Packer M., Kowey P.R. Building castles in the sky: catheter ablation in patients with atrial fibrillation and chronic heart failure. Circulation. 2018;138(8):751-753. PMID: 29848750. https://doi.org/10.1161/CIRCULATI0NAHA.118.034583
- Kuck K.-H., Merkely B., Zahn R., Arentz T., Seidl K., Schlüter M., Tilz R.R., Piorkowski C., Gellér L., Kleemann T., Hindricks G. Catheter ablation versus best medical therapy in patients with persistent atrial fibrillation and congestive heart failure: the randomized AMICA trial. Circ Arrhythm Electrophysiol. 2019;12(12):e007731. PMID: 31760819. https://doi. org/10.1161/CIRCEP.119.007731
- Palmas F., Noviello C., Bo M. Atrial fibrillation in heart failure: drugs or ablation? Eur Heart J Suppl. 2023;25(Suppl B):B28-B30. PMID: 37091661; PMCID: PMC10120957. https://doi. org/10.1093/eurheartjsupp/suad063
- Sugumar H., Prabhu S., Costello B., Chieng D., Azzopardi S., Voskoboinik A., Parameswaran R., Wong G.R., Anderson R., Al-Kaisey A.M., Ling L.-H., Kotschet E., Taylor A.J., Kalman J.M., Kistler P.M. Catheter ablation versus medication in atrial fibrillation and systolic dysfunction: late outcomes of CAMERA-MRI study. JACC Clin Electrophysiol. 2020;6(13):1721-1731. PMID: 33334453. https://doi.org/10.1016/j.jacep.2020.08.019
- Verma A., Haines D.E., Boersma L.V., Sood N., Natale A., Marchlinski F.E., Calkins H., Sanders P., Packer D.L., Kuck K.-H., Hindricks G., Onal B., Cerkvenik J., Tada H., DeLurgio D.B.; PULSED AF Investigators. Pulsed field ablation for the treatment of atrial fibrillation: PULSED AF pivotal trial. Circulation. 2023;147(19):1422-1432. PMID: 36877118; PMCID: PMC10158608. https://doi.org/10.1161/ CIRCULATI0NAHA.123.063988


