Адаптация растений-регенерантов пшеницы к условиям ex vitro: работа устьиц
Автор: Мартыненко Елена Викторовна, Круглова Наталья Николаевна, Дубровная Оксана Васильевна
Журнал: Известия Самарского научного центра Российской академии наук @izvestiya-ssc
Рубрика: Биотехнология
Статья в выпуске: 5-3 т.13, 2011 года.
Бесплатный доступ
Исследован устьичный аппарат листьев регенерантов пшеницы, полученных в условиях высокой влажности и низкой освещенности in vitro, в процессе их постепенной адаптации к условиям пониженной влажности воздуха и высокой освещенности ex vitro. Установлено, что к концу эксперимента регенеранты ex vitro и интактные растения имели сходные значения устьичной проводимости. Сравнительный цитологический анализ устьиц адаптированных ex vitro регенерантов и интактных растений in vivo продемонстрировал их морфологическое сходство при меньших размерах устьиц регенерантов. Предложенный способ постепенной адаптации к условиям ex vitro позволяет добиваться высокой выживаемости регенерантов.
Выживаемость регенерантов, устьичная проводимость, яровая мягкая пшеница triticum aestivum l, адаптация
Короткий адрес: https://sciup.org/148200434
IDR: 148200434 | УДК: 576.5/.7.085.23:581.1
Текст научной статьи Адаптация растений-регенерантов пшеницы к условиям ex vitro: работа устьиц
Большинство биотехнологических методов культуры in vitro направлено на получение в конечном этапе полноценных фертильных растений-регенерантов. Основная проблема в этой области исследований – низкая выживаемость растений-регенерантов при переносе их из условий культуры in vitro, характеризующихся высокой влажностью воздуха и низкой освещенностью, в посткультуральные условия ex vitro , характеризующиеся пониженной влажностью воздуха и высокой освещенностью.
Разработка эффективной системы получения полноценных, с качественными семенами, растений-регенерантов остается актуальной и до настоящего времени. Несмотря на то, что накоплен значительный фактический материал, касающийся различных аспектов исследования выживаемости растений-регенерантов, многие вопросы остаются открытыми. Так, слабо изучена работа устьичного аппарата в процессе развития регенерантов in vitro и ex vitro и особенно в критический момент переноса регенерантов из условий in vitro в условия ex vitro . Согласно литературным данным, регенеранты, полученные in vitro , имеют низкую выживаемость при переносе в условия ex vitro из-за формирования у них аномального устьичного аппарата [15]. Однако в литературе отсутствуют данные детальных физиологических и цитологических исследований устьиц растений-регенерантов, адаптируемых к условиям ex vitro .
В связи с этим цель данной работы заключалась в физиологической и цитологической оценке устьиц растений-регенерантов пшеницы в процессе развития in vitro , в критический момент переноса из условий in vitro в условия ex vitro и в процессе адаптации к условиям ex vitro.
МАТЕРИАЛ И МЕТОДЫ
Объектом исследования послужила яровая мягкая пшеница сорта Башкирская 26, перспективная для климатической зоны Южного Урала,[6] семена которой были любезно предоставлены к.с.-х.н. В.И. Никоновым, заведующим лабораторией селекции и семеноводства Башкирского НИИ СХ РАСХН (г. Уфа).
Предварительно было выявлено, что незрелые зародыши этого сорта пшеницы c высокой отзывчивостью формируют морфогенные каллусы в условиях культуры in vitro. Для данного эксперимента использовали растения-регенеранты в фенофазе кущения, полученные in vitro из морфогенных каллусов зародышевого происхождения, и интактные растения в той же фенофазе. Растения-регенеранты до 7-х сут фенофазы кущения выращивали in vitro в пробирках в климатической камере MLR-351H (Sanyo, Japan) при 16-часовом фотопериоде, освещенности 25000 лк. Затем их переносили в почвенную смесь и в течение 5-ти сут содержали в той же климатической камере при относительной влажности воздуха (ОВВ) 90 % и щадящем световом режиме (освещенность 16000 лк). На следующем этапе эксперимента ОВВ в климатической камере снижали до 60 %. На 8-е сут эксперимента растения-регенеранты переносили на воздух на светоплощадку при освещенности 16000 лк и 16часовом фотопериоде. С 13-х сут и до конца эксперимента освещенность составляла 25000 лк.
Интактные растения до 7-х сут фенофазы кущения и далее выращивали на светоплощадке при 16часовом фотопериоде и освещенности 25000 лк.
Для физиологической оценки реакции устьиц растений обеих групп использовали показатель устьичной проводимости, характеризующий степень открытости устьиц, что позволяет оценить интенсивность транспирации и сдвиги в водном обмене.интенсивность транспирации и сдвиги в водном обмене. Показатель устьичной проводимо- сти измеряли с помощью автоматического поро-метра (MK Delta-T, UK). Временные цитологические препараты, полученные согласно общепринятой методике [7] просматривали на микроскопе проходящего света Axio Imager A1 (Carl Zeiss, Jena). Статистическую обработку полученных результатов проводили, используя программы Excel с учетом основных статистических параметров.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
В качестве точки отсчета использовали показатель устьичной проводимости «пробирочных» растений-регенерантов на 7-е сут фенофазы кущения, находящихся в климатической камере (освещенность 25000 лк), перед их высадкой в почвенную смесь. Устьичная проводимость таких растений-регенерантов составила 151 мМоль/м2с, что в 1,7 раза превышало устьичную проводимость интактных растений того же возраста (90 мМоль/м2с), растущих в почвенной смеси на светоплощадке при той же освещенности (рис. 1А). Возможно, это обусловлено более высокой относительной влажностью воздуха в пробирках.
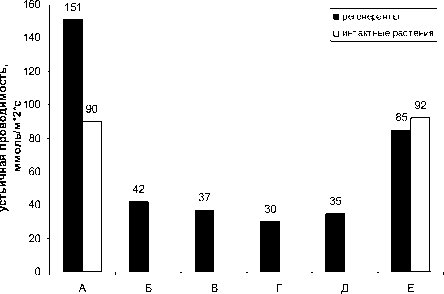
Рис. 1 . Устьичная проводимость растений-регенерантов в процессе адаптации к условиям ex vitro в сравнении с аналогичными показателями интактных растений : А – растения-регенеранты в пробирках перед высадкой в почвенную смесь и интактные растения в почвенной смеси (освещенность 25000 лк); Б – 1-е сут эксперимента, растения-регенеранты в почвенной смеси (ОВВ 90 %, освещенность 16000 лк); В - 5-е сут эксперимента, растения-регенеранты в почвенной смеси (ОВВ 90 %, освещенность 16000 лк); Г – 7-е сут эксперимента, растения-регенеранты в почвенной смеси (ОВВ 60 %, освещенность 16000 лк); Д – 10-е сут эксперимента, растения-регенеранты в почвенной смеси (воздух, освещенность 16000 лк); Е – 15-е сут эксперимента, адаптированные растения-регенеранты и интактные растения в почвенной смеси (воздух, освещенность 25000 лк)
В критический момент переноса регенерантов в условия ex vitro показатель устьичной проводимости резко снижался (до 42 мМоль/м2с) по сравнению с «пробирочными» растениями (рис. 1Б). На 5-е сут эксперимента его значение составило 37 мМоль/м2с (рис. 1В). Уменьшение устьичной проводимости в данном случае можно расценивать как следствие фотоактивной реакции устьиц на понижение освещенности.
На следующем этапе эксперимента ОВВ в климатической камере уменьшали до 60 %. Показатель устьичной проводимости продолжал падать и на 7-е сут эксперимента достиг 30 мМоль/м2с (рис. 1Г).
На 8-е сут опыта устьичная проводимость перенесенных на светоплощадку растений-регенерантов (освещенность 16000 лк и 16-часовой фотопериод) начинала повышаться и на 10-е сут эксперимента достигла 35 мМоль/м2с (рис. 1Д), что свидетельствует о начале адаптации растений-регенерантов к изменившимся условиям.
Повышение освещенности светоплощадки до 25000 лк на 13-е сут эксперимента привело к резкому повышению показателя устьичной проводимости адаптируемых растений-регенерантов, и на 15-е сут эксперимента этот показатель (85 мМоль/м2с) был сопоставим с аналогичным показателям интактных растений (92 мМоль/м2с) (рис. 1Е). Возможно, такое резкое повышение обусловлено увеличением степени открытости устьиц под действием света. С другой стороны, оно свидетельствует о нормализации функционирования устьиц у растений-регенерантов. Степень выживаемости растений-регенерантов, по имеющимся в литературе сведениям [8,9], в среднем, составляет 50-60 %. При предложенном нами варианте постепенной адаптации растений-регенерантов к условиям ex vitro отмечена высокая выживаемость растений-регенерантов – 83 %.
Проведенный морфометрический анализ выявил, что устьица растений-регенерантов, адаптированных к условиям ex vitro (на 15-е сут эксперимента), морфологически не отличаются от устьиц интактных растений в той же фазе развития (рис. 2). В то же время устьица регенерантов имеют меньшие размеры. Так, длина устьиц растений-регенерантов составляла, в среднем, 55.04±1.45 мкм, тогда как у интактных растений она была равна 67.71±1.49 мкм.
Согласно литературным данным, уменьшение размеров устьиц характерно для растений-регенерантов и других представителей цветковых растений, причем авторы также отмечают нормальное функционирование устьиц растений-регенеранов [10-15].
Таким образом, данные по устьичной проводимости растений-регенерантов яровой мягкой пшеницы, полученных in vitro и адаптированных к условиям ex vitro, свидетельствуют о нормальном функционировании устьиц при их меньших размерах. Предложенный нами вариант постепенной адаптации к условиям ex vitro позволит добиваться высокой выживаемости растений-регенерантов.
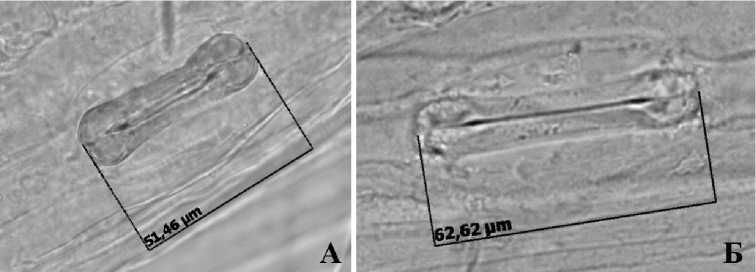
Рис. 2 . Морфология устьиц адаптированных растений-регенерантов (А) и интактных растений (Б) в фенофазе кущения на 15-е сут эксперимента.
Авторы благодарны к.б.н. Веселовой С.В. и к.б.н. Зайцеву Д.Ю. за помощь в проведении части экспериментальной работы.
Работа выполнена при поддержке РФФИ-Поволжье (грант № 08-04-97045), а также по программе «Ведущие научные школы РФ» (грант № НШ 7637.2010.4).
Список литературы Адаптация растений-регенерантов пшеницы к условиям ex vitro: работа устьиц
- Sallanon H., Tort M., Coudret A. The ultrastructure of micropropagated and greenhouse rose plant stomata//Plant Cell, Tissue and Organ Culture. 1993. V. 32 P. 227-233.
- Pospisilova J. Effect of air humidity on the development of functional stomatal apparatus//Biologia Plantarum. 1996. V. 38. № 2. P. 197-204.
- Noe N., Bonini L. Leaf anatomy of highbush blueberry grown in vitro and during acclimatization to ex vitro conditions//Biologia Plantarum. 1996. V. 38. № 1. P. 19-25.
- Fordham M.C., Harrison-Murray R., Knight L. Effects of leaf wetting and high humidity on stomatal function in leafy cutting and intact plants of Corylus maxima//Physiologia Plantarum. 2001. V. 113. P. 233-240.
- Joshi P., Joshi N., Purohit S.D. Stomatal characteristics during micropropagation of Wrightia tomentosa//Biologia Plantarum. 2006. V. 50. № 2. P. 275-278.
- Характеристика сортов сельскохозяйственных культур, включенных в Госреестр по Республике Башкортостан. Пособие для агрономов/[под ред. Д.Б. Гареева]. Уфа, 1997. 96 с.
- Паушева З.П. Практикум по цитологии растений. М.: Колос, 1988. 170 с.
- Plant biotechnology and molecular markers/[Eds Srivastava S., Narula A., Srivastava S.]. New Delhi: Anamaya Publishers, 2004. P. 325.
- Plant cell and tissue culture -a tool in biotechnology. Basics and application/[Eds Neumann K.-H., Kumar A., Imani J.]. Berlin, Heidelberg: Springer-Verlag, 2009. P. 333.
- Gribble K., Sarafis K., Nailon J., Holford P., Uwins P. Environmental scanning electron microscopy of the surface of normal and leaves of Gypsophila paniculata (Babies, Breath) cultured in vitro//Plant Cell Reports. 1996. V. 15 P. 771-776.
- Ali-Ahmad M., Hughes G.H., Safadi F. Studies on stomatal function, epicuticular wax and stem-root transition region of polyethylene glycol-treated and nontreated in vitro grape plantlets//In vitro Cellular and Developmental Biology Plant. 1998. V. 34. P. 1-7.
- Estrada-Luna A.A., Davies Jr F.T., Egilla J.N. Physiological changes and growth of micropropagated chille ancho pepper plantlets during acclimatization and post-acclimatization//Plant Cell, Tissue and Organ Culture. 2001. V. 66. P. 17-24.
- Brutti C.B., Rubio E.J., Llorente B.E., Apostolo N.M. Artichoke leaf morphology and surface features in different micropropagation stages//Biologia Plantarum. 2002. V. 45. № 2. P. 197-204.
- Jo E.-A., Tewari R.K., Hahn E.-J., Paek K.-Y. In vitro sucrose concentration affects growth and acclimatization of Alocasia amazonica plantlets//Plant Cell, Tissue and Organ Culture. 2009. V. 96. P. 307-315.


