Адаптивная изменчивость листовых пластин некоторых древесно-кустарниковых видов в условиях осмотического стресса in vitro
Автор: Жолобова О.О., Терещенко Т.В.
Журнал: Вестник Красноярского государственного аграрного университета @vestnik-kgau
Рубрика: Агрономия
Статья в выпуске: 4, 2025 года.
Бесплатный доступ
Цель исследований – оценка влияния моделируемого осмотического стресса в культуре in vitro на морфофизиологические и анатомические показатели листового аппарата отобранных генотипов древеснокустарниковых растений. Исследования проводились на базе лаборатории биотехнологий ФНЦ агроэкологии РАН в 2023–2024 гг. Объекты исследований – три вида древеснокустарниковых растений, перспективных в условиях засушливого климата: Cotinus coggygria Scop. (Скумпия кожевенная), карликовый подвой для косточковых Prunus VSL 2, Caragana pygmaea L. (карагана карликовая). Условия засухи смоделированы с использованием неионного осмотика полиэтиленгликоля с молекулярной массой 6000 (ПЭГ). Осмотический стресс в питательной среде оказывал ингибирующее действие на ростовые процессы всех исследуемых видов. Однако характер изменений носил видоспецифичные реакции. Общие изменения в листовых пластинах проявлялись в уменьшении размеров устьичных клеток, полном или частичном смыкании устьичной щели и более высокой плотности устьиц. После культивирования на среде с ПЭГ 60 г/л у C. coggygria площадь листовых пластин уменьшилась в 3,8 раза, для листьев Prunus VSL 2 – в 1,2 раза по сравнению с контролем. При культивировании на питательных средах, дополненных ПЭГ 60 г/л, выжили только способные к ризогенезу регенеранты C. pygmaea. Одним из критериев отбора более засухоустойчивых генотипов является показатель содержания хлорофилла в листовых пластинах, отражающий стабильную работу фотосинтетического аппарата. Для C. pygmaea этот показатель был ниже контроля в 2,5 раза. У адаптированных к водному дефициту Prunus VSL 2 и Cotinus coggygria содержание общего хлорофилла в листовых пластинах было больше.
Засухоустойчивость древесно-кустарниковых видов, полиэтиленгликоль, осмотический стресс, in vitro, устьица, хлорофилл
Короткий адрес: https://sciup.org/140309726
IDR: 140309726 | УДК: 631.529:581.143.6 | DOI: 10.36718/1819-4036-2025-4-47-54
Текст научной статьи Адаптивная изменчивость листовых пластин некоторых древесно-кустарниковых видов в условиях осмотического стресса in vitro
Введение. Проблемы опустынивания территорий, деградации и разрушения почв требуют ответных мер реагирования, и в первую очередь это необходимость вовлечения в защитные лесонасаждения новых, адаптированных к экстремальным почвенно-климатическим условиям генотипов древесно-кустарниковых видов.
Древесные растения реализуют свой адаптивный потенциал через изменения, происходящие на разных уровнях организации. Высокая степень чувствительности и изменчивости морфологических и анатомических признаков отмечается в листовых пластинах, которая отражает приспособительные механизмы отдельных генотипов к лимитирующим факторам окружающей среды [1, 2].
Исследования параметров листьев в популяциях Betula pendula Roth. показали, что с усилением аридности климата увеличивались толщина и плотность листа, что способствовало функциональным изменениям листового аппарата. Данные параметры предложили использовать как маркерные признаки, отражающие адаптацию фотосинтетического аппарата к изменению климатических условий [3]. Содержание хлорофилла в листьях также зависит от величины влагообеспеченности и используется как показатель отзывчивости на увлажнение и устойчивость к засухе [4, 5]. Достоверное снижение фотосинтетической активности под влиянием засухи и засоления было отмечено у гено-
типов пшеницы [6]. Сравнение реакции сортов овса на почвенную засуху также проводили с учетом изменения хлорофиллового индекса [7].
Использование современных технологий и лабораторных методов скрининга стрессоустойчивых генотипов в последнее время становится альтернативным и эффективным способом получения потенциально улучшенного селекционного материала. Многие исследования подтверждают сопоставимость результатов тестирования растительных тканей in vivo и in vitro, которые позволяют определить критерии отбора устойчивых растений и ускорить реализацию селекционных программ [8]. Скрининг растений, культивируемых in vitro , на засухоустойчивость с применением различных стресс-индуцирующих агентов описан во многих исследованиях [9].
Цель исследований – оценка влияния моделируемого осмотического стресса в культуре in vitro на морфофизиологические и анатомические показатели листового аппарата отобранных генотипов древесно-кустарниковых растений.
Объекты и методы. Работа проводилась на базе лаборатории биотехнологий ФНЦ агроэкологии РАН в 2023–2024 гг. Объектами исследований были выбраны три вида древесно-кустарниковых растений, перспективных в условиях засушливого климата: Cotinus coggygria Scop. (скумпия кожевенная) – небольшое лиственное дерево или крупный кустарник; карликовый подвой для косточковых Prunus fruticosa × Prunus
serrulata var. Lannesiana (cv. Prunus VSL 2); Caragana pygmaea L. (карагана карликовая) – кустарник 0,5–1 м, чаще всего встречается на песчаных участках и каменистых склонах.
Условия засухи смоделированы с использованием неионного осмотика полиэтиленгликоля с молекулярной массой 6000 (ПЭГ). Лабораторные испытания показали, что критической концентрацией ПЭГ в питательной среде являлась 60 г/л, что подтверждается и на других объектах [10]. Для культивирования микропобегов исследуемых растений использовали питательную среду по протоколу Мурасиге и Скуга (MS) без добавления гормонов. После 45 дней анализировали морфометрические показатели листовых пластин (площадь, масса, наличие увядания, скручивания или хлороза). Для оценки устьичного аппарата листьев проводили микроскопирование отделенной от мезофилла нижней эпидермы листа. Содержание пигментов в листьях (хлорофилла и каротиноидов) у регенерантов на культуральной среде с ПЭГ 60 г/л по сравнению с контролем (среда MS без ПЭГ) определяли при помощи спектрофотометра SPECTROstarNANO по ранее апробированной методике [11].
Обработку полученных результатов проводили при помощи пакета MS Excel. Достоверность различий определяли с помощью критерия Манна-Уитни (p < 0,05).
Результаты и их обсуждение. ПЭГ-инду-цированный водный дефицит в питательной среде оказывал ингибирующее действие на ростовые процессы всех исследуемых видов. Однако характер изменений носил видоспецифичные реакции. Все экспланты C. coggygria и Prunus VSL 2 после 8 недель культивирования на среде с ПЭГ 60 г/л были жизнеспособны, несмотря на отсутствие процессов ризогенеза. Для регенерантов C. pygmaea отличительной чертой являлось наличие слаборазвитой корневой системы у 45 % микропобегов в условиях осмотического стресса, которые оставались жизнеспособными, неукорененные экспланты погибли. На 7–14-е сутки у эксплантов C. coggygria и C. pygmaea наблюдался хлороз листовых пластин и в некоторых случаях их опадение, при этом происходило формирование новых листочков (рис. 1). У регенерантов C. coggygria они имели более темную окраску и плотность, для C. pygmaea листочки сильно сближенные, на концах черешков отличались признаками витрификации.

Рис. 1. Микропобеги исследуемых видов после 7 недель культивирования:
A – Prunus VSL 2 на среде MS, контроль; B – Cotinus coggygria на среде MS, C – Caragana pygmaea на среде MS, контроль; D – Prunus VSL 2, ПЭГ 60 г/л;
E – Cotinus coggygria, ПЭГ 60 г/л; контроль; F – Caragana pygmaea, ПЭГ 60 г/л
Micro shoots of the studied species after 7 weeks of cultivation:
A – Prunus VSL 2 on MS environment, control; B – Cotinus coggygria on MS environment, C – Caragana pygmaea on MS medium, control; D – Prunus VSL 2, PEG 60 g/l;
E – Cotinus coggygria, PEG 60 g/l; control; F – Caragana pygmaea, PEG 60 g/l
Таблица 1
|
Показатель |
Cotinus coggygria |
Prunus VSL-2 |
||
|
Контроль |
ПЭГ 60 г/л |
Контроль |
ПЭГ 60 г/л |
|
|
Площадь листовой пластины, мм2 |
37,53±3,34 a |
9,79±1,11 b |
43,25±4,06 a |
35,56±3,65 b |
|
Масса листовой пластины, мг |
5,64±0,35 a |
1,25±0,09 b |
6,46±0,55 a |
4,17±0,59 b |
|
Кол-во устьичных клеток, шт/0,1 мм2 |
36,24±2,55 b |
46,04±2,58 a |
21,79±1,39 b |
26,99±1,57 a |
Примечание . В таблице представлены средние значения ± ошибка среднего, различные буквы (здесь и далее) между контролем и ПЭГ 60 г/л означают статистические различия, согласно критерию Манна-Уитни, при p < 0,05.
A
B
C
D
E
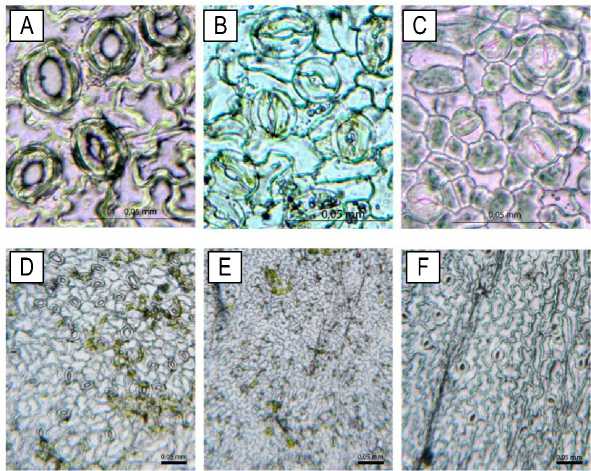
Рис. 2. Устьичные клетки при микроскопировании нижней эпидермы листьев:
A–C – смыкание устьичной щели у Prunus VSL 2 на контроле (A), через 4 недели культивирования на ПЭГ 60 г/л (B), через 8 недель культивирования на ПЭГ 60 г/л (C); D – устьичные клетки Prunus VSL 2, контроль; E – устьичные клетки Cotinus coggygria, контроль; F – устьичные клетки Caragana pygmaea, контроль
Stomatal cells during microscopy of the lower epidermis of leaves:
A–C – closure of the stomatal fissure in Prunus VSL 2 on control (A), after 4 weeks of cultivation on PEG 60 g/l (B), after 8 weeks of cultivation on PEG 60 g/l (C); D – stomatal cells of Prunus VSL 2, control; E – stomatal cells of Cotinus coggygria, control; F – stomatal cells of Caragana pygmaea, control
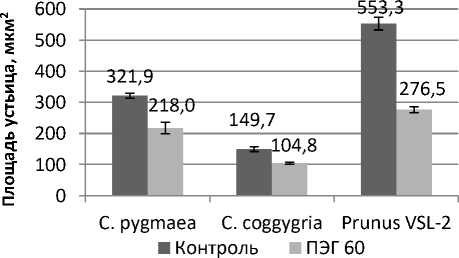
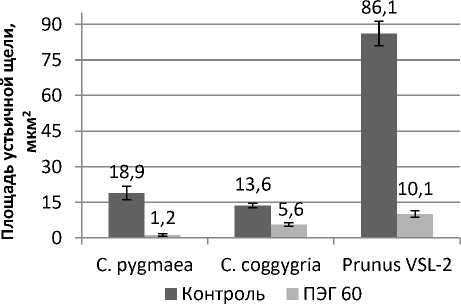
Рис. 3. Характеристика устьичных клеток при моделировании осмотического стресса в культуре in vitro
Characterization of stomatal cells during osmotic stress modeling in in vitro culture
Таблица 2
|
Вид |
Концентрация ПЭГ в среде |
Общий хлорофилл, мкг/см2 |
Каротиноиды, мкг/см2 |
|
Caragana pygmaea |
Контроль, 0 г/л |
13,80±2,72 a |
3,13±0,60 a |
|
ПЭГ 60 г/л |
5,36±1,03 b |
1,19±0,20 b |
|
|
Cotinus coggygria |
Контроль, 0 г/л |
12,14±0,55 b |
1,59±0,12 a |
|
ПЭГ 60 г/л |
22,85±1,90 a |
3,78±0,39 a |
|
|
Prunus VSL-2 |
Контроль, 0 г/л |
13,97±1,27 a |
1,89±0,22 b |
|
ПЭГ 60 г/л |
20,18±2,48 a |
3,15±0,39 a |


