Адсорбция карбонат-ионов оксигидроксидами железа(III) и алюминия
Бесплатный доступ
Изучена адсорбция углекислого газа из воздуха и карбонат-ионов из водного раствора свежеосажденными оксигидроксидами железа (III) и алюминия. Найдено, что величины адсорбции плавно возрастают с увеличением рН осаждения оксигидроксидов. Установлено, что адсорбция СО2 из воздуха достигает 0,08 моль/моль Ме(ОН)3 для обоих гидроксидов, а карбонат-ионов - 0,3 моль/моль феррогеля и 0,76 моль/моль алюмогеля. Адсорбция карбонат-ионов из раствора гелями, осажденными щелочью, отличается низкой избирательностью, изотермы адсорбции описываются уравнением Фрейндлиха и Генри. Карбонат-ионы занимают на поверхности гидрогелей 4-5 ммоль-центров/г Ме(ОН)3. Карбонат-ионы не могут конкурировать при адсорбции с фосфат- или арсенат-ионами, но имеют сродство к оксигидроксидам, близкое к сродству хлорид- или сульфат-ионов.
Короткий адрес: https://sciup.org/147158499
IDR: 147158499 | УДК: 541.182.644:541.183.24
Текст краткого сообщения Адсорбция карбонат-ионов оксигидроксидами железа(III) и алюминия
Физико-химические исследования имеют большое значение для изучения процессов, протекающих в окружающей среде. В частности, большой интерес представляет роль углекислого газа и карбонат - ионов в природных процессах сорбции и миграции микроэлементов. Активными сорбентами в природе являются обычно оксиды, оксигидроксиды, алюмосиликаты и продукты выветривания последних. Поступление в окружающую среду ионов металлов за счет техногенных факторов приводит к постоянному образованию свежеосажденных оксигидроксидов. Значительная часть токсичных микроэлементов присутствуют в природе в форме анионов (элементы V-VII групп). В условиях нашей практической деятельности мы всегда находимся в атмосфере, содержащей углекислый газ, и пользуемся водой, содержащей карбонат-ионы. Следовательно, интересно и практически важно знать влияние карбонатов на адсорбцию других анионов. В литературе же сорбции карбонат-ионов из растворов уделяется самое минимальное внимание. До сих пор нам известны только работы [1-3], посвященные этому вопросу. В одной из них [1] рассматривается адсорбция карбонат-ионов из раствора на реактивном TiO2, в другой [2] - на ZrO2 и в третьей [3] - на гетите. Между тем карбонат-ион, имеющий конфигурацию треугольника и заряд -2, является аналогом сульфит- и селенит-ионов, отличающихся высоким сродством к оксигид-роксидам[4]. Сорбция СО2 из газовой фазы, напротив, широко изучена, но в качестве сорбента обычно использовали активированные угли, а не оксигидроксиды (кроме щелочи).
В настоящей работе мы изучали адсорбцию карбонат-ионов из растворов и СО2 из воздуха аморфными оксигидроксидами (гидрогелями) алюминия и железа(Ш) с целью определить сорбируемость СО2 и сравнить закономерности сорбции карбонат-ионов и других анионов на этих высокоактивных адсорбентах.
Экспериментальная часть
В работе были использованы гидрогели оксигидроксидов Fe(III) с pH осаждения 5, 6, 7, 8, 9, 10, 11, 12, 13 (осадитель NaOH) и 5,6, 7, 8, 9, 9,5, 10, 10,5 (осадитель Na2CO3) и гидрогели оксигидроксида алюминия с pH осаждения 6, 7, 8, 9 (осадители NaOH и Na2CO3). Для получения гидрогелей использовали растворы FeCl3 (77,7 г/л) и A1(NO3)3 (37,65 г/л). Пользовались ранее описанным способом быстрого щелочного гидролиза растворов солей металлов [5]. Для получения каждого образца использовали аликвоту исходного раствора, соответствующую -0,01 моля оксигидроксида, разбавленную до -50 мл. Гидрогели осаждали при нужном pH (рН0С), прибавляя к разбавленной аликвоте раствора соли раствор NaOH или Na2CO3 до тех пор, пока заданное значение рНос не оставалось постоянным в течение -5 мин. После осаждения гель отделяли от маточного раствора и трижды промывали дистиллированной водой декантацией с помощью центрифуги с и = 2000 об/мин (угловой ротор центрифуги ОПн-8, минимальное ускорение 1400, максимальное - 4000 м/с2) каждый раз по 5 мин. Полученные таким образом гидрогели либо репульпи- ровали в воде, разбавляли в мерной колбе до 100 мл и использовали в опытах по адсорбции кар-бонат-ионов (осадитель NaOH), либо высушивали при комнатной температуре на воздухе до постоянной массы.
В первом случае 100 мл суспензии гидрогеля вносили в раствор, содержащий аликвоту исходного раствора сорбата, разбавленную до 100 мл. Суммарный объем суспензии составлял 200 мл. В качестве адсорбата служил раствор Na2CO3 (0,998 моль/л), который разбавляли до нужных концентраций (интервал от 0,05 до 0,5 моль/л, обычно 8 значений). Систему выдерживали в течение часа при постоянном перемешивании магнитной мешалкой при комнатной (18-20 °C) температуре. Предварительными опытами было установлено, что сорбционное псевдоравновесие устанавливается менее чем за 10 мин. Пробы суспензии из системы отбирали трижды, через каждые 20 мин, чтобы избежать ошибки, связанной с неправильным определением времени установления равновесия т^. Пробы фильтровали через фильтр «синяя лента» и определяли в фильтрате остаточное содержание адсорбата (равновесную концентрацию СР). Исходную и равновесную концентрации карбонат-ионов определяли титрованием 0,1М раствором НС1 по метилоранжу и фенолфталеину [6]. Величину адсорбции вычисляли по формуле
С -С
А = 0,2——----, моль/г (т -масса сорбента в г1).
т
Во всех случаях контролировали также pH исходного раствора адсорбата и суспензии. Все измерения pH проводили на pH-метре рН410 «АКВИЛОН» с комбинированным электродом ЭСК-10601/7.
Высушенные образцы подвергали анализу на содержание углерода (сжигание образца) и на содержание воды, которое определяли прокаливанием до постоянной массы при 800 °C. Считали, что при прокаливании удаляется и адсорбированный СО2, и принимали, что остаток от прокаливания имеет состав Fe2O3 или А12О3. Отсюда рассчитывали состав исходного вещества. Однако если адсорбируются молекулы соды или щелочи, то после прокаливания Fe2O3 или А12О3 содержат примесь щелочи. Чтобы определить содержание щелочи, остаток от прокаливания помещали в 50 мл дистиллированной воды, измельчали и выдерживали в течение 2 часов. За это время щелочь должна была раствориться. Затем раствор отфильтровывали и измеряли pH фильтрата. Если pH было не выше 9-10, то считали, что примесь щелочи пренебрежимо мала (так было для феррогелей). Если же pH было >11 (для алюмогелей), то фильтрат титровали кислотой и вычисляли содержание щелочи в образце. Из формул, приведенных в табл. 1, видно, что алюмогель сорбирует и карбонат и щелочь, тогда как феррогель - только карбонат (углекислый газ). Таким образом определяли, сколько СО2 адсорбируется из воздуха при сушке образцов, осажденных щелочью, и сколько карбонат-ионов адсорбируется на поверхности гидрогеля из раствора, когда осадителем является сода.
Пример расчета; Образец - Al-гель, осажденный Na2CO3, высушенный на воздухе, с рНоС = 6. Образец содержит 1,12% С, следовательно, исходя из М.в. СО2, содержание его равно: 1,12 х 44/12 = 4,1 %. Потеря массы при прокаливании приходится на Н2О+СО2 и равна 42,25 %, тогда содержание Н2О = 42,25 - 4,1 = 3 8,15 %.
После обработки остатка от прокаливания водой pH фильтрата был равен 10,83 для навески 0,1115 г и 11,26 для навески 0,1144 г. По результатам титрования фильтратов нашли среднее содержание в образце NaOH 4,4 мас.%, отсюда в исходной навеске было 53,37 % А12О3. Далее известным способом находим формулу исходного соединения: 53,37/102 : 4,1/44 : 38,15/18 : 4,4/40 = = 0,523 : 0,0932 : 2,119 : 0,11 = 1 : 0,178 : 4,036 : 0,21, т.е. Al2O3'4H2O-0,178CO2 0,21NaOH = = Al(OH)3-0,5H20 0,089NaHC03-0,0115NaOH
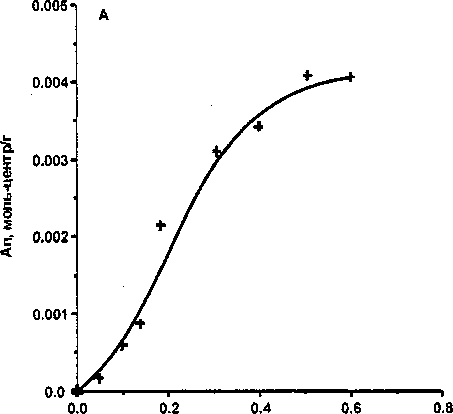
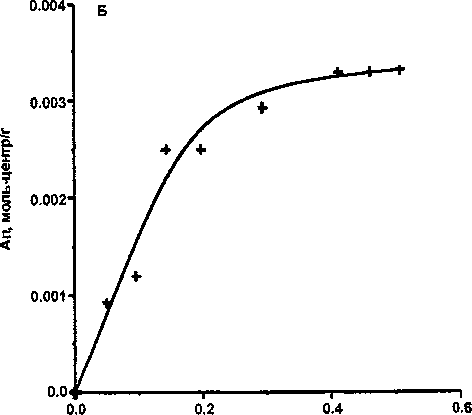
Полученные данные приведены в табл. 1. Данные, полученные для сорбции карбонат-ионов из растворов, приведены в табл. 2 и 3 и на рисунке.
Результаты и обсуждение
Приведенные в табл. 1 данные о составе высушенных гелей согласуются с данными капельного титрования растворов FeCl3 щелочью и содой [7]. Было найдено [7], что как при титровании щелочью, так и содой образующийся гидроксид поглощает сверхстехиометрические количества
Таблица 1
Состав высушенных на воздухе ферро- и алюмогелей
При обработке экспериментальных данных по адсорбции карбонат-ионов из раствора мы исходили из предположения, что однозарядный ион занимает 1 сорбционный центр, двухзарядный - 2 и т.д. Тогда адсорбцию лучше выражать не в моль/г, а в моль-центрах/г2, что было введено в практику в работе [8] для образцов, величины удельной поверхности которых плохо поддаются определению традиционным методом БЭТ, поскольку изменяются при пробоподготовке, что характерно для гелеобразных оксигидроксидов металлов. Для того, чтобы экспериментально полученные величины адсорбции выразить в моль-центрах/г, нужно экспериментальную величину адсорбции А умножить на заряд иона. Анионы угольной кислоты за счет реакций диссоциации и гидролиза в водном растворе легко превращаются друг в друга. Пользуясь величинами констант диссоциации угольной кислоты [9], и экспериментальными значениями pH суспензии, рассчитали для каждой экспериментальной точки с карбонат-ионами содержание каждой из форм, которые могут существовать при данном значении pH, как показано, например, в табл. 2.
Пример расчетах заменяя активности концентрациями, получаем:
Н2СО3 НСО3" + Н+; Кд1 = 4 10"7 = [НСОз1РЛ/[Н2СО3], отсюда [НСО3"]/[ Н2СО3]= 41O'’/[tf]
НСОз" СОз2" + Н*; Кди = [СОз^рГИНСОз"] = 4,69 Ю’п,
Отсюда [СОз2"]/[НСО3"] = КдцЛрГ];
Если pH суспензии составляет 6, то [НСО3"]/[Н2СОз] = 4 10-7/10-6 = 0,4, следовательно, в растворе существует смесь 29 % бикарбонат-ионов и 71 % молекул Н2СО3. При pH = 11 отношение СО32"]/[НСОз"] = 4,69, следовательно, в смеси будет содержаться 83.4 % СОз2" и 17.6 % НСО3" и т.д. Далее приняли, что ионный состав адсорбата в фазе адсорбента соответствует ионному составу адсорбата в равновесном растворе. Основываясь на этих допущениях, рассчитали приведенные к моль-центрам/г величины сорбции, которые обозначили как Ап- Пример такого расчета вместе с экспериментальными величинами А представлен в табл. 2.
Адсорбция карбонат-ионов из раствора происходит так же быстро, как и для большинства неорганических ионов. Адсорбируются карбонат-ионы как на положительно, так и на отрицательно заряженных поверхностях, так же, как, например, фосфат- и арсенат-ионы [10,11]. Адсорбция карбонат-ионов на ферро- и алюмогелях отличается крайне низкой избирательностью: при всех исходных концентрациях степень извлечения не превышает 2-3 % (см. табл. 2). Однако за счет большого избытка адсорбата практически все адсорбционные центры гидрогелей заняты, и Ап достигает 4-5 ммоль-центров/г, т.е даже несколько больше, чем в случае фосфат-ионов[11]. Изотермы адсорбции карбонат-ионов из растворов ферро- и алюмогелями приближенно описываются уравнением изотермы Фрейндлиха, которое очень близко к уравнению Генри вида
А = КСр, поскольку величины 1/и во всех случаях близки к 1 (см. табл. 3). Формы изотерм сорбции показаны на рисунке. Таким образом, изотермы адсорбции карбонат-ионов из растворов на гидрогелях Fe и А1 не являются изотермами высокого сродства, в отличие от адсорбции СОг на диоксиде циркония [2]. ,
Таблица 2
Ср, моль/л
Ср, мопь/л
Пример расчета изотермы сорбции карбонат-ионов из раствора (феррогель с pH осаждения 7)
|
Сисх> моль/л |
Ср, моль/л |
pHcycn |
АЮ3, моль/г |
[СОз2-]/ [НСОз1 |
АпТО3, моль-центров/г |
|
0,047 |
0,045 |
10,53 |
0,40 |
1,63 |
0,76 |
|
0,092 |
0,090 |
10,62 |
0,40 |
1,70 |
0,68 |
|
0,136 |
0,132 |
10,65 |
0,80 |
1,94 |
1,08 |
|
0,182 |
0,177 |
10,66 |
1.00 |
2,03 |
1,39 . |
|
0,309 |
0,300 |
10,63 |
1,80 |
1,71 |
3,00 |
|
0,328 |
0,317 |
10,63 |
2,20 |
1,71 |
3,50 |
|
0,499 |
0,487 |
10,62 |
2,40 |
1,70 |
3,91 |
|
0,505 |
0,493 |
10,60 |
2,40 |
1,67 |
4,00 |
Таблица 3 Параметры уравнения Фрейндлиха, описывающего сорбцию карбонат-ионовиз растворов ферро- и алюмогелями
|
pH осаждения |
К, л/г |
1/п |
|
Феррогели . |
||
|
6 |
6,00 |
0,60 |
|
7 |
9,60 |
1,08 |
|
8 |
10,70 |
0,99 |
|
9 |
13,46 |
1,36 |
|
11 |
8,46 |
1,07 |
|
Алюмогели |
||
|
6 |
2,56 |
0,96 |
|
7 |
5,80 |
0,81 |
|
8 |
5,11 |
0,64 |
|
9 |
5,84 |
0,62 |
Изотермы адсорбции СОз^-ионов из водных растворов Na2CO3 на оксигидроксидах железа(Ш) (А) и алюминия (Б) с pH осаждения 9
Работа показала, что карбонат-ионы не могут составить конкуренции адсорбции таких ионов, как фосфат, арсенат, селенит и даже хромат, (последнее следует из работы [3]), но сравнимз по своей адсорбируемости с сульфат- и хлорид-ионами. Поэтому при изучении сорбции анионов с высоким сродством к оксигидроксидам присутствием карбонат-ионов в воде и СО2 в воздухе можно пренебречь, но при изучении сорбции сульфат-, хлорид-, селенат- и подобных анионов желательна инертная атмосфера.
При высушивании же гидрогелей нужно считаться с появлением в материале значительной примеси СОг. При этом на феррогелях сорбированный углекислый газ превращается в карбонат-или бикарбонат-ионы за счет взаимодействия с водой гидрогеля, что не сопровождается сорбцией катионов натрия. Алюмогели же, очевидно, в процессе осаждения поглощают щелочь, которая затем, за счет сорбции СО2 превращается в карбонат или бикарбонат натрия. При осаждении содой алюмогель поглощает из раствора не только молекулы карбоната натрия, но и щелочь.
Список литературы Адсорбция карбонат-ионов оксигидроксидами железа(III) и алюминия
- Schulthess C.P., Belek J.Z. Proton adsorption on a titanium oxide in the presence of bicarbonate//J.Am.Soil Sci. Soc. -1998. -V. 62. -P. 348-353.
- Bachiller-Baeza В., Rodriguez-Ramos I., Guerrero-Ruiz A. Interaction of carbon dioxide with the surface of zirconia polymorphs//Langmuir. -1998. -V. 14. -P. 3556-3564.
- Geen A.van, Robertson A.P., Leckie J.O. Complexation of carbonate species at the goethite surface: Implications for adsorption of metal ions in natural waters//Geochim. Cosmochim. Acta. -1994. -V.58.-P. 2073-2086.
- Hayes K.F., Roe A.L., Brown G.E. a.o. In situ X-ray absorption study of surface complexes: selenium oxyanions on α-FeOOH//Science. -1987. -V. 238. -P. 783-785.
- Оксигидраты, полученные быстрым гидролизом концентрированных растворов солей Fe(III)/С.И. Печенюк, Д.Л. Рогачев, А.Г. Касиков и др.//Журн. неорган. химии. -1985. -Т.30. -№2. -С.311-316.
- Фритц Д., Шенк Г. Количественный анализ. -М.: Мир, 1978. -558 с.
- Печенюк С.И. Сорбционно-гидролитическое осаждение платиновых металлов на не органических сорбентах. -Л.: Наука, 1991. -236 с.
- Davis J.A. and Leckie J.O. Surface ionisation and complexation at the oxide/water interface/II. Surface propertiesof amorphous iron oxyhydroxide and adsorption of metal ions//J.Colloid Interface Sci.-1978.-V.67.-№1.-P.90-107.
- Добош Д. Электрохимические константы. -М.: Мир, 1980.
- Печенюк С.И., Семушина Ю.П., Иванов Ю.В. Сравнительные данные о свойствах гидро-и ксерогелей оксигидроксидов железа(Ш) и хрома(Ш)//Изв. Челяб. науч. центра. Химия и биоэкология. -2004. -№ 3(24). -С 62-66.
- Печенюк С.И., Семушина Ю.П., Кузьмич Л.Ф. Оценка удельного содержания сорбционных центров оксигидроксидов железа (III) и циркония (IV)//Изв. РАН. Серия хим. -2005. -№8.-С. 1736-1741.


