Адсорбция метилмеркаптана молекулярным ситом NaX в широком интервале равновесных давлений и температур
Автор: Эргашев О. К., Азимов О., Мухитдинов Д.
Журнал: Экономика и социум @ekonomika-socium
Рубрика: Современные науки и образование
Статья в выпуске: 8 (63), 2019 года.
Бесплатный доступ
Изотермы адсорбции метилмеркаптана в цеолите NaХ измерены объемным методом при температурах 273, 298, 333 и 373 К. Рассчитаны изостерические теплоты и энтропии адсорбции метилмеркаптана в цеолите NaХ. Выявлен механизм адсорбции метилмеркаптана в цеолите NaХ. Изотермы адсорбции полностью описаны одно- и двухчленным уравнением ТОЗМ.
Молекулярное сито nax, метилмеркаптан, ион-молекулярные комплексы, изотерма, дифференциальные теплоты и энтропия адсорбции, теория объемного заполнения микропор (тозм)
Короткий адрес: https://sciup.org/140242151
IDR: 140242151 | УДК: 541.183:536.6
Текст научной статьи Адсорбция метилмеркаптана молекулярным ситом NaX в широком интервале равновесных давлений и температур
Помимо сероводорода в природном газе, газоконденсате и нефтепродуктах могут присутствовать сероорганические соединения, например, метилмеркаптан. Для очистки сероорганических соединений целеобразно применить цеолиты.
Цеолиты NaX целесообразно применять для очистки природного газа от следовых количеств метилмеркаптана. Применение цеолитов, содержащих одинаковое количество катионов Са2+ и Na+, нецелесообразно из-за способности его катализировать процесс разложения метилмеркаптана на метан и элементную серу, забивающий поры адсорбента и выводящий его из строя. Широкое использование молекулярных сит для очистки нефтепродуктов от различных примесей обусловлено их необычными свойствами: способностью цеолитов обратимо сорбировать метилмеркаптан или различные вещества в газообразном состоянии, катионы цеолитов легко обмениваются на любой другой положительный ион.
В связи с этим мы поставили цель измерить изотермы адсорбции ( а ) метилмеркаптана в цеолите NaХ в интервале температур от 273 до 373 и на основе изотерм, измеренных при разных температурах, рассчитать изостерические теплоты ( Q d) и энтропии (∆ S d) адсорбции и выявить механизм адсорбции. Полученная информация может быть использована для подбора эффективного адсорбента очистки природного газа и нефтепродуктов от серосодержащих соединений.
Химический состав полностью дегидратированного NaХ (Na 86 (AlO 2 ) 86 (SiO 2 ) 106 был определен элементным анализом. Для этого был разработан метод разложения образцов синтетических цеолитов с одновременным определением содержания влаги и органических примесей и атомно-абсорбционным определением (Perkin - Elmer 3030B) содержания обменных катионов Na [1]. Данный подход исключает влияние структурообразующих элементов (Al, Si) и колебания влажности проб на результаты анализа.
Исследования проводились на универсальной высоковакуумной объемной установке, позволяющей проводить дозировку адсорбата как газо-объемным, так и объемно-жидкостным методами, с точностью 0,1% [2, 3]. Адсорбционная установка представляет собой вакуумную стеклянную аппаратуру с капиллярной микробюреткой и ртутными затворами. Установка состоит из ампулы с адсорбентом, измерительной части, системы хранения, заготовки жидкости и газов и системы откачки (цеолитовый и форвакуумный насосы). При помощи катетометра В-630 с точностью 0,01 мм измеряли уровень ртути в U-образном манометре с внутренним диаметром 12 мм. Низкие давления определялись манометром Мак-Леода.
Перед впуском метилмеркаптана образец прогревался и подвергался высоковакуумной откачке при 350º C в течение 10 часов.
Результаты и их обсуждение. Цеолиты типа фожазита имеют кубическую гранецентрированную решетку типа алмаза [2]. В больших полостях цеолита NaX (фожазит) катионы располагаются в позициях SIII’ (у 12-членных кислородных колец) и SII (в центре шестичленных кислородных колец), а в малых полостях – в позиции SI’. Катионы в этих позициях слегка выдвинуты из шестичленных колец в сторону центра малых полостей [4]. Катионы в позиции
SI находятся в центрах
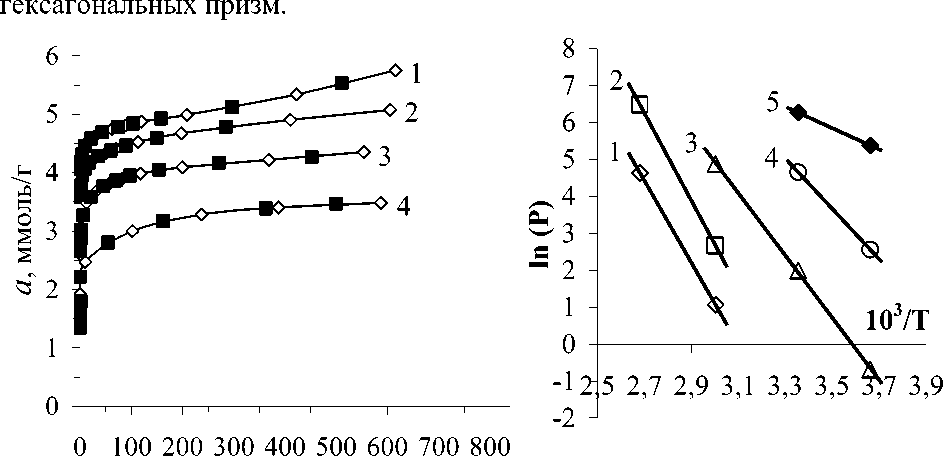
Р, мм.рт.ст.
Риc.1. Зависимость адсорбции ( а ) СH 3 SH в цеолите NaX от давления (Р): 1 – 273 К; 2 – 298 К; 3 – 333 К; 4 – 373 К. Черные точки рассчитаны с помощью уравнения ТОЗМ.
Рис.2. Зависимость логарифма давления (ln P) CH3SH в цеолите NaX от обратной температуры (103/Т), соответствующая различным количествам адсорбированного вещества (ммоль/г): 1 - 3,0; 2 – 3,5; 3 - 4,0; 4 - 4,5; 5 - 5,0.
На рис.1 представлены изотермы адсорбции CH3SH в NaX при различных температурах (273, 298, 333 и 373 К). Адсорбционная способность NaX по CH3SH выше, чем в цеолитах типа А. Изотермы адсорбции CH3SH в цеолитах удовлетворительно описываются одно- и двухчленными уравнениями ТОЗМ [5, 6]. Ниже приведены уравнения изотерм адсорбции, измеренных при температурах 273, 298, 333 и 373 К:
273 К a = 4,699exp[-(A/40,09)2] +0,676exp[-(A/3,62)2];
278 К a = 4,605exp[-(A/35,91)2] +0,457exp[-(A/5,27)2];
333 К a = 4,338exp[-(A/33,3)2] +0,2exp[-(A/6,66)4];
373 К a = 3,65exp[-(A/25,0)3].
На основе изотерм адсорбции рассчитали изостеры - линии зависимости равновесных давлений от температуры при постоянных значениях адсорбции. Изостеры в координатах lgP - T-1 линейны, наклон их к оси температур меняется с ростом заполнения поверхности адсорбента (рис.2). По наклону изостер рассчитаны изостерические теплоты адсорбции (рис.3). Из данных теплот и зависимости максимальной работы адсорбции от количества адсорбированного метилмеркаптана рассчитали мольную энтропию адсорбции (рис.4).
Элементарная ячейка цеолита NaX содержит 86 катионов Na+. В пересчете на 1/8 э.я. – 10,7 Na+. Катионы распределены следующим образом: по 4 в SII и SI’ в большой и малой полостях, остальные 2,7 в большой полости в позиции SIII' [4].
Кривая изостерических теплот адсорбции СН 3 SН в NaX имеет волнообразный вид. Первая волна простирается до 4 ммоль/г с энергией, меняющейся от 91,58 до 98,52 кДж/моль и падающей до 69,39 кДж/моль. Вторая снижается от 69,39 до 24,1 кДж/моль в интервале от 4 до 5 ммоль/г. 4 ммоль/г соответствуют 6,7 СН 3 SH э.я. Это столько, сколько катионов в
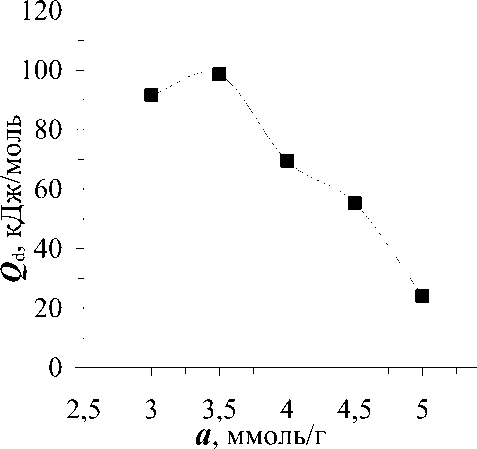
Рис.3. Зависимость дифференциальных изостерических теплот (Q d ) адсорбции CH3SH в цеолите NaX от адсорбции ( а ).
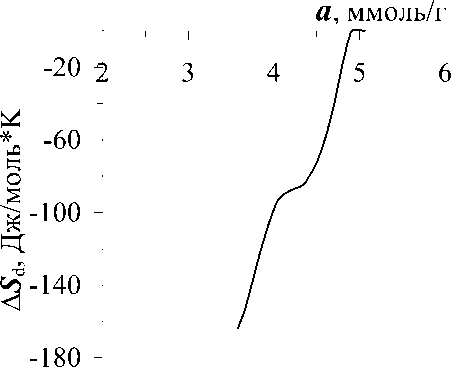
Рис.4.Зависимость дифференциальной энтропии ( Δ S d) адсорбции CH 3 SH в цеолите NaX от адсорбции ( а ). Энтропия жидкого СH 3 SH принята за ноль.
позициях SIII' и SII (2,7 + 4 = 6,7), расположенных в суперполости. Отсюда следует, что на первом этапе метилмеркаптан адсорбируется на катионах в позициях SIII' и SII в соотношении 1:1. На втором этапе (а от 4 до 5ммоль/г) адсорбируется 1 ммоль/г метилмеркаптана или 1,68 СН3SH/э.я. Дальнейшая адсорбция, по-видимому, протекает на катионах SIII', как на наиболее доступных катионах, находящихся в открытой позиции. Из-за ограниченности объема цеолита не все катионы SIII' (2,7) формируют бинарный комплекс с метилмеркаптаном, а только их часть (1,7). Таким образом, цеолит NaX вмещает 8,4 молекулы метилмеркаптана на 1/8 э.я., из которых 4,4 адсорбируются на катионах SIII', при этом 1,7 катиона формируют бинарные комплексы, а 1- мономерные комплексы. Остальные 4 молекулы метилмеркаптана адсорбируются на катионах SII.
Мольную дифференциальную энтропию адсорбции СН 3 SН в NaX (рис.4) рассчитали из данных теплот и свободной энергии адсорбции. Энтропия адсорбции отложена от энтропии жидкого метилмеркаптана. В целом энтропия располагается в отрицательной области, достигая низких значений -160 Дж/моль*К, что указывает на то, что состояние метилмеркаптана в цеолитовой матрице сильно заторможено. Энтропия стремительно растет с заполнением, но не пересекает нулевую линию – энтропию жидкого метилмеркаптана.
Проведены адсорбционные и термодинамические исследования адсорбции паров метилмеркаптана в цеолите NaX при температурах 273, 298, 333 и 373 К. Рассчитаны мольные дифференциальные величины энтальпии, свободной энергии и энтропии адсорбции, которые послужили основой для молекулярно-структурных и термодинамических корреляций адсорбционных свойств NaX.
Установлено, что центрами адсорбции в цеолите NaX являются катионы Na+ в позиции SIII’ и SII, с которыми молекулы метилмеркаптана образуют 6,7 мономерных комплексов СН3SH/Na+ на каждую суперполость. Оставшийся незаполненным объем цеолита заполняется еще 1,7 молекулами метилмеркаптана, которые, по-видимому, присоединяются к катионам натрия в позиции SIII’ образуя бинарные комплексы (СН 3 SH) 2 /Na+, располагающиеся у 12-членных кислородных колец каждой суперполости. Таким образом, каждая суперполость вмещает 8,4 комплексов метилмеркаптана с катионом Na+. Подвижность молекул метилмеркаптана в цеолитовой матрице сильно заторможена.
Список литературы Адсорбция метилмеркаптана молекулярным ситом NaX в широком интервале равновесных давлений и температур
- Lyapin, S. B., Rakhmatkarieva, F. G., Rakhmatkariev, G. U. Atomic - Absorption determination of ion - exchange cations in zeolites // Chem. Journal. Kz. 2015. №3. P. 304 - 310.
- Mentzen B.F., Rakhmatkariev G.U. Host-guest Interactions in Zeolitic Nanostructured MFI Type Materials: Complementarity of X-ray Powder Diffraction, NMR Spectroscopy, Adsorption Calorimetry and Computer Simulations // Узб. хим. журн. -2007. -№ 6. -С. 10-31.
- Rakhmatkariev U. Mechanism of Adsorption of Water Vapor by Muscovite: A Model Based on Adsorption Calorimetry // Clays and Clay Minerals. -2006. -V. 54. -P. 423-430.
- Mortier W. J., Bosman H. J., Location of Univalent Cations in Synthetic Zeolites of the Y and X Type with varying Silicon to Aluminium Ratio//J. Phys. Chem. 1971, V. 75, P. 3327.
- Dubinin M.M. Progress in Surface Membrane Science // New York -1975. -V. 9. -P. 1-70.
- Рахматкариев Г.У., Исирикян А.А. Полное описание изотермы адсорбции уравнениями теории объемного заполнения микропор // Изв. АН СССР, Сер. хим. -1988. -№ 11. -С. 2644-2645.


