Активация антиоксидантной системы у байкальского литорального вида Eulimnogammarus verrucosus
Автор: Тимофеев М.А.
Журнал: Известия Самарского научного центра Российской академии наук @izvestiya-ssc
Рубрика: Водные экосистемы
Статья в выпуске: 1-1 т.11, 2009 года.
Бесплатный доступ
В представленной работе у байкальского эндемика Eulimnogammarus verrucosus (Gerstf.) оценивали характер активации антиоксидантных ферментов при окислительном стрессе. Для исследования были выбраны следующие ферменты: пероксидаза, каталаза и глутатион-S-трансфераза.. Как показали проведенные эксперименты, экспозиция E. verrucosus в растворах гуминсодержащего препарата приводит к достоверным изменениям в показателях активности антиоксидантных ферментов каталазы и пероксидазы, тогда как активность глутатион-S-трансферазы остается стабильной.
Активации антиоксидантных ферментов, эндемик, байкал
Короткий адрес: https://sciup.org/148198232
IDR: 148198232 | УДК: 574.5:591.05+592
Текст научной статьи Активация антиоксидантной системы у байкальского литорального вида Eulimnogammarus verrucosus
Наличие кислорода в окружающей среде, помимо общеизвестной положительной роли, несет и ряд деструктивных функций. Использование кислорода в процессах дыхания необходимо для существования аэробов. Однако из-за высокой окислительной способности кислорода на клеточном уровне активируется цепь реакций свободнорадикального окисления, сопровождающих процессы кислородного метаболизма [2, 10, 13]. Основным продуктом этих реакций являются активные формы кислорода (АФК) [3, 15, 17], на борьбу с которыми направлена деятельность антиоксидантной системы (АОС) организма [1, 4, 8, 28]. Образование АФК может носить как эндогенный (внутриклеточный), так и экзогенный (внеклеточный) характер. Чувствительность организмов к действию той или иной группы АФК может существенно отличаться [18, 22, 23]. Особенно это актуально для гидробионтов, поскольку вероятность образования, а также длительность существования экзогенных АФК, во многом связаны с температурными и гидрохимическими характеристиками среды [9, 12, 16, 21].
Предположено, что у видов, обитающих в различных условиях, могут наблюдаться и различия в механизмах активации защиты от АФК экзогенного происхождения. С целью проверки данного предположения был проведен ряд исследований на видах, относящихся
Михаил Александрович Тимофеев, научный сотрудник.
к одной таксономической группе, однако отличающихся по своим адаптивным способностям. В качестве исследуемой группы были выбраны пресноводные амфиподы (Amphi-poda, Crustacea).
Ранее нами были опубликованы материалы изучения механизмов активизации АОС при оксидативном стрессе, выполненные на представителях палеарктической фауны амфипод Gammarus lacustris Sars и G. tigrinus [26]. Целью данной работы являлось проведение аналогичного исследования на представителе эндемичной фауны амфипод из оз. Байкал.
ОБЪЕКТ И МЕТОДЫ ИССЛЕДОВАНИЯ
В работе использовали байкальский эндемичный вид Eulimnogammarus verrucosus (Gerstf.). Вид широко распространен по всему Байкалу и встречается повсеместно (под камнями) начиная с глубины в несколько сантиметров, вплоть до глубин в 10-15 м. Обладает высокой чувствительностью к изменениям температуры среды. В проведенных исследованиях гибель 50% и 100% особей данного вида при 25°С наблюдалась через 1,8 и 9 часов соответственно [26]. Термо-преферендум данного вида установлен в температурной зоне 5-6°С; минимальный порог переносимого содержания кислорода, полученный экспериментальным путем, 1 (±0,2) мгО2 • л-1 [6, 26].
Рачков отлавливали на урезе воды в районе пос. Большие Коты (Южный Байкал). Перед экспериментами амфипод выдерживали 2-3 дня в аэрируемых аквариумах с бай- кальской водой при температуре 6°-8°С. Окислительное воздействие индуцировали экспонированием амфипод в растворах лабо раторного гуминсодержащего препарата «Schwarzer See» (IGB, Germany), любезно предоставленного
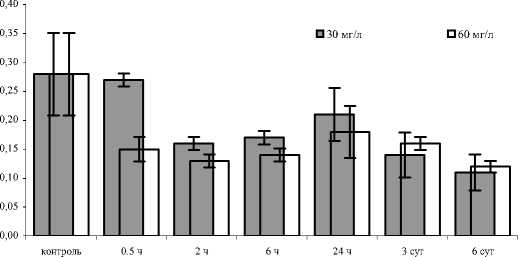
Рис. 1. Активность пероксидазы у E. verrucosus, экспонированного в растворе гуминсодержащего препарата разных концентраций
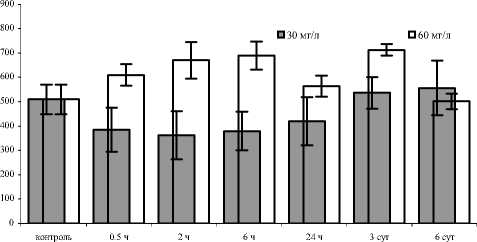
Рис. 2. Активность каталазы у E. verrucosus, экспонированного в растворе гуминсодержащего препарата разных концентраций
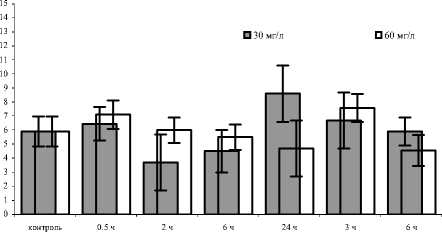
Рис. 3. Активность глутатион S-трансферазы у E. verrucosus, экспонированного в растворе гуминсодержащего препарата разных концентраций
проф. C.E.W. Steinberg (IGB). Известно, что препараты гуминовых веществ в растворах являются продуцентами широкого спектра активных форм кислорода [9, 19, 20, 24].
Была проведена серия экспериментов, в которых рачков экспонировали в растворах препарата с концентрациями 30 и 60 мг/л, приготовленных на байкальской воде. Длительность экспозиции составляла от 30 минут до 6 сут. Для всех экспериментов отбирали здоровых и активных рачков.
Для исследования были выбраны следующие ферменты: пероксидаза, каталаза и глу-татион-З-трансфераза. Приготовление образцов для измерения активности ферментов проводили согласно методике [27]. Замороженных рачков гомогенизировали при 4°С с добавлением натрий-фосфатного буфера 0,1 М рН 6,5 и центрифугировали. В отобранном супернатанте определяли активность ферментов с использованием спектрофотометра UVIKON XS. Активность выражали в нкат/мг белка (катал — единица активности фермента, необходимая для преобразования 1 моля субстрата за 1 сек). Активность пероксидазы измеряли в соответствии с методикой [11], используя в качестве субстрата гваякол при длине волны 436 нм, рН 5; активность каталазы — по методике [7] c добавлением гидроперекиси при длине волны 240 нм, рН 7; активность глутатион-S-трансферазы — в соответствии с методикой [14], используя в качестве субстрата 1-хлор-2,4-динитробензол при длине волны 340 нм, рН 6,5. Содержание белка в пробе определяли по методу Бредфорда при длине волны 595 нм. Все полученные данные обработаны статистически с использованием пакета программ «Statistica 5.0».
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
На рис. 1 показаны материалы измерения уровней активности пероксидазы у E. verrucosus , экспонированных в растворах гумин-содержащего препарата с концентрациями 30 и 60 мг/л. Из полученных данных видно, что экспозиция амфипод ведет к снижению показателей активности фермента. В растворах с меньшей концентрацией препарата наблюдается достоверное снижение активности пероксидазы начиная с 2 часов экспозиции. В растворах с большей концентрацией ингибирование пероксидазы отмечено уже к 30 мин. экспозиции, при этом показатель активности снижен в 3 раза относительно контроля. Затем к периоду 24-часовой экспозиции уровень активности фермента в растворах обеих концентраций незначительно повышается, приближаясь к контрольному. Далее активность пероксидазы вновь снижается и держится на пониженном уровне вплоть до окончания эксперимента.
На рис. 2 представлены материалы измерения активности каталазы у рачков, экспо нированных в растворах гуминсодержащего препарата с концентрациями 30 и 60 мг/л. Как видно из представленных диаграмм, показатели активности каталазы в ходе экспозиции в основном остаются близкими к контрольному уровню. В экспериментах с растворами большей концентрации отмечали повышение уровня активности каталазы при 2часовом периоде экспонирования.
На рис. 3 показаны материалы измерения активности глутатион-S-трансферазы у E. verrucosus . Из представленных данных видно, что в растворах с меньшей концентрацией отмечали неравномерную активность фермента в ходе всего эксперимента. Однако изменений активности статистически достоверных от контрольного уровня, не отмечено.
Таким образом, как показали проведенные эксперименты, экспозиция E. verrucosus в растворах гуминсодержащего препарата «Schwarzer See» приводит к достоверным изменениям в показателях активности антиоксидантных ферментов каталазы и пероксидазы, тогда как активность глутатион-S-трансферазы остается стабильной. Картина изменения характеристик активности основных антиоксидантных ферментов у байкальского E. verrucosus показывает обратную картину, чем у палеарктических видов С. ishnus , G. tigrinus и G. lacustris . Так, в условиях ранее проведенных аналогичных экспериментов у палеарктических видов отмечали многократный всплеск активности пероксидазы [26]. При этом наблюдали повышение активности глутатион-S-трансферазы и снижение активности каталазы. У байкальского вида происходит ингибирование пероксидазы, активность каталазы повышается, а глу-татион-S-трансферазы остается стабильной. По-видимому, следует говорить о том, что у изученных эндемичных байкальских амфипод наблюдается механизм активации антиоксидантной системы, отличный от такового у палеарктических видов.
Исследование проведено при поддержке грантов РФФИ ( 05-04-97239 Байкал и 06-04-48099-а).
Список литературы Активация антиоксидантной системы у байкальского литорального вида Eulimnogammarus verrucosus
- Андреева В.А. Фермент пероксидаза (участие в защитном механизме растений). М., 1988.
- Владимиров Ю.А. Свободные радикалы в биологических системах//Сорос. образоват. журн. 2000. № 6(12).
- Кулинский В.И. Активные формы кислорода и оксидативная модификация макромолекул: польза, вред и защита//Cорос. образоват. журн. 1999. № 1.
- Рогожин В.В. Пероксидаза как компонент антиоксидантной системы живых организмов. СПб., 2004.
- Тимофеев М., Шатилина Ж., Колесниченко А., Побежимова Т., Грабельных О. Оксидативное влияние растворов гуминовых веществ на европейских и байкальских амфипод; эволюционный взгляд на причины резистентных различий//Сиб. экол. журн. 2003. №5.
- Тимофеев М.А., Кириченко К.А. Экспериментальная оценка роли абиотических факторов в ограничении распространения эндемиков за пределы оз. Байкал, на примере амфипод//Сибирский экологический журнал. 2004. №1.
- Aebi H. Catalase in vitro//Methods Enzymol. 1984. V. 105.
- Blokhina O., Virolainen E., Fagerstedt K. Antioxidants oxidative damage and oxygen deprivation stress: a review//Antioxidants. Ann. Bot. 2003. V. 91, № 2.
- Cooper J. Aquatic humic substances: Influence on fate and treatment of pollutants//Adv. Chem. Series. 1989. 219.
- Davies K.J. Oxidative stress: the paradox of aerobic life//Biochem Soc. Symp. 1995. № 61.
- Drotar A., Phelps P. Evidence for glutathione peroxidase activities in cultured plant cells//Plant Sci. 1985. V. 42.
- Finkel T., Holbrook N. Oxidants, oxidative stress and the biology of ageing//Nature. 2000. № 408.
- Fridovich I. Oxygen toxicity: a radical explanation//J. Exp. Biol. 1998. V. 201, № 8.
- Habig W., Pabst M., Jakoby W. Glutathione S-Transferases. The first enzymatic step in mercapturic acid formation//J. Biol. Chem. 1974. V. 249.
- Hensley R., Floyd R., Reactive oxygen species and protein oxidation in aging: A look back, a look ahead//Arch. Biochem. Bioph. 2002. V. 397.
- Livingstone D.R. Oxidative stress in aquatic organisms in relation to pollution and aquaculture//Rev. de Medecine Veterinaire. 2003. V. 154, № 6.
- Mensack S., Murtaugh R. Oxygen toxicity//Comp. Cont. Educat. Pract. Vet. 1999. V. 21, № 4.
- Missirlis F., Phillips J., Jackle H. Cooperative action of antioxidant defense systems in Drosophila//Current Biology. 2001. V. 11.
- Pflugmacher S., Spangenberg M., Steinberg C. Dissolved organic matter (DOM) and effects on the aquatic macrophyte Ceratophyllum demersum in relation to photosynthesis, pigmentpattern and activity of detoxication enzymes//J. Appl. Botany. 1999. V. 73.
- Pflugmacher S., Tidwell F., Steinberg C. Dissolved humic substances can directly affect freshwater organisms//Acta Hydrochim. Hydrobiol. 2001. V. 29.
- Pinto E., Sigaud-Kutner T., Leitao M. et al. Heavy metal-induced oxidative stress in algae//J. Phycol. 2003. V. 39, № 6.
- Riley R. Free-Radicals in Biology -Oxidative Stress and the Effects of Ionizing-Radiation//Intern. J. of Radiation Biol. 1994. V. 65.
- Siraki G., Pourahmad J., Chan T., Khan S., O'Brien P. Endogenous and endobiotic induced reactive oxygen species formation by isolated hepatocytes//Free Radical Biology and Medicine. 2002. V. 32.
- Steinberg C. Ecology of humic substances in freshwaters. Springer, 2003.
- Timofeyev M.A. On the role of adaptive abilities in distribution of endemic amphipods from Lake Baikal//Verhandlungen Intern. Vereinigung Limnol. 2002. V. 28.
- Timofeyev M., Shatilina Z., Kolesnichenko A. et al. Natural organic matter (NOM) promotes oxidative stress in freshwater amphipods Gammarus lacustris Sars and G. tigrinus (Sexton)//Sc. of The Total Environment. 2006., № 2.
- Wiegand C., Pflugmacher S., Oberemm A. et al. Uptake and effects of microcystin-LR on detoxication enzymes of early life stages of the zebra fish (Danio rerio)//Environ. Toxicol. 1999. V. 14.
- Winston G. Oxidants and antioxidants in aquatic animals//Comp. Biochem. Physiol. 1991. V. 100.


