Активация микроорганизмов хлебопекарных заквасокэкстрактами биомассы мицелия грибов Cordyceps militaris и Lentinula edodes
Автор: Козубаева Л.А., Кузьмина С.С., Минаков Д.В., Егорова Е.Ю.
Журнал: Вестник Мурманского государственного технического университета @vestnik-mstu
Рубрика: Биотехнология пищевых продуктов и биологически активных веществ
Статья в выпуске: 4-2 т.28, 2025 года.
Бесплатный доступ
Своевременная и правильно организованная активация хлебопекарных заквасок является одним из важных технологических приемов, позволяющих обеспечить стабильное качество готовой продукции, сократить продолжительность созревания теста и повлиять на эффективность хлебопекарного производства в целом. Высшие грибы содержат ряд компонентов, способствующих биохимической активации бактерий и дрожжей. Цель работы – исследование влияния экстрактов грибов видов C. militaris и L. edodes на основных представителей микробиома хлебопекарных заквасок. Объектами исследования выступали водно-спиртовые и глицериновые экстракты, полученные из мицелия штаммов грибов C. militaris SRG4 и L. edodes 3790; прессованные хлебопекарные дрожжи Saccharomyces cerevisia "Люкс Экстра"; "Лактобактерин+" – жидкий концентрат живых активных бактерий гомо- и гетероферментативных штаммов Lactobacillus plantarum, L. fermentum и L. casei; "Бифидумбактерин" – лиофилизированный препарат бифидобактерий. В работе использованы стандартные приемы микробиологического анализа и отраслевые методы контроля сырья и полуфабрикатов хлебопекарного производства. Установлено, что внесение водно-спиртовых экстрактов мицелия грибов шиитаке и кордицепс позволяет регулировать активность бродильной микрофлоры: для ускорения почкования дрожжей достаточно внести в закваску 0,5 % экстрактов мицелия шиитаке и кордицепс, но этих количеств не достаточно для заметной активации молочнокислых бактерий. При внесении 3–4 % экстрактов (к массе закваски) обеспечивается активация молочнокислых бактерий, более интенсивное нарастание кислотности и повышение интенсивности газообразования в закваске, однако это тормозит активность развития хлебопекарных дрожжей. При внесении в закваски экстрактов мицелия грибов кордицепс отмечено незначительное подавляющее действие в отношении бифидобактерий. Полученные данные могут быть использованы для регуляции активности дрожжевого и молочнокислого брожения и изменения продолжительности операций созревания закваски и теста.
Пищевые биотехнологии, закваски, тесто, Saccharomyces cerevisiae, Lactobacillus, Bifidobacterium, активация, экстракты, Cordyceps militaris, Lentinula edodes
Короткий адрес: https://sciup.org/142246579
IDR: 142246579 | УДК: 60.44:664.64 | DOI: 10.21443/1560-9278-2025-28-4/2-614-626
Текст научной статьи Активация микроорганизмов хлебопекарных заквасокэкстрактами биомассы мицелия грибов Cordyceps militaris и Lentinula edodes
e-mail: , ORCID:
Многие продукты пищевых биотехнологий представляют собой результат комбинированного бактериального и дрожжевого брожения, основной целью использования которого является обеспечение быстрого и прогнозируемого хода процессов брожения, нивелирование непостоянства биохимических и технологических свойств основного сырья, стабилизация реологических свойств полуфабрикатов, предотвращение возможной микробиологической порчи и стабильное достижение гармоничных вкуса и запаха готовых продуктов и напитков. Ключевым моментом в большинстве таких технологий является способность некоторых кислотообразующих бактерий сбраживать сахара растительного и молочного сырья, тем самым наращивая активную кислотность пищевых систем и определяя как дальнейшее течение микробиологических и биохимических процессов, так и угнетение кислотонеустойчивых микроорганизмов (включая патогенные и микроорганизмы порчи). Эти задачи решаются путем внесения в рецептурную массу заквасок или стартовых культур ( Bezie et al., 2019; García-Díez et al., 2021 ).
В хлебопекарном производстве закваской называется производственный полуфабрикат, используемый на начальном этапе многофазных способов тестоприготовления и получаемый сбраживанием подготовленной питательной смеси или порции муки специально подобранным симбиозом молочнокислых бактерий или молочнокислых бактерий и хлебопекарных дрожжей ( Жаркова и др., 2023; Pérez-Alvarado et al., 2022 ). Промышленно вырабатываемые закваски для производства хлебобулочных изделий имеют ограниченный состав микрофлоры, включающий дрожжи Saccharomyces cerevisia и бактерии родов Lactobacillus и Bifidobacterium . Бактерии в них являются активными кислотообразователями, а гетероферментативные виды Lactobacillus отвечают также за синтез многих аромат- и вкусоформирующих веществ выпечки ( Litwinek et al., 2022 ). Непосредственное назначение закваски – перевод специфической бродильной микрофлоры теста в активное состояние, утверждение доминирующей микрофлоры ( Романов и др., 2016 ).
Молочнокислые бактерии считаются штаммозависимыми, привередливыми бактериями в отношении питательных веществ и требований к условиям окружающей среды ( Manzoor et al., 2017 ), но в пищевых системах молочнокислые бактерии успешно выживают и конкурируют с другими видами микрофлоры. Так, большинство видов молочнокислых бактерий способны выдерживать повышенные концентрации вырабатываемого дрожжами спирта, а дрожжи, в свою очередь, устойчивы к молочной кислоте – основному продукту жизнедеятельности Lactobacillus . Поэтому в пищевых системах с внесением заквасок и численность дрожжей может быть на порядок ниже по сравнению с численностью молочнокислых бактерий (что дает бактериям конкурентное преимущество над дрожжами и приводит к опережению их роста), и рост дрожжей может существенно опережать рост бактерий ( Горина, 2000 ). Преобладание дрожжей в микробиоме заквасок подавляет развитие необходимых для закваски лактобактерий и влияет на выработку ими молочной кислоты и других метаболитов ( Paramithiotis et al., 2006 ), а увеличение производимых лактобактериями метаболитов, в свою очередь, может привести к подавлению роста клеток S. cerevisiae ( Narendranath et al., 2004 ).
Для предотвращения нежелательных "перекосов" в составе микрофлоры пищевых систем одной из приоритетных задач исследований, направленных на повышение эффективности использования как чистых, так и стартовых культур микроорганизмов, является их активация. Ключевыми технологическими параметрами, наиболее часто применяемыми с целью воздействия на активность микробиома закваски, являются температура, рН и достаточность питательных веществ ( Bolarinwa et al., 2019; Manzoor et al., 2017 ). В тесте с более активными клетками микроорганизмов более интенсивно протекают процессы осахаривания и газообразования, что обеспечивает возможность укороченного цикла тестоведения ( Соболева и др., 2011 ). Правильно организованная активация позволяет снизить дозу закваски, сократить общую продолжительность ферментативных процессов, быстрее достичь необходимого значения кислотности и подавить нежелательную микрофлору ( Хатко и др., 2017; Nesterenko et al., 2012 ).
К настоящему времени апробированы физические, химические и физико-химические условия активации микроорганизмов. К физическим факторам активации относят осмотический шок, воздействие пульсирующим давлением и электромагнитными полями – ультразвуком, лазерным излучением или низко-и сверхвысокочастотными излучениями (Данилова и др., 2017; Карикурубу и др., 2015; Лукина, 2013; Gančytė et al., 2023; Karpenko et al., 2023; Nesterenko et al., 2012). Воздействие разных типов электромагнитных полей рассматривается как один из доступных приемов управления метаболизмом микроорганизмов. Вместе с тем основным участником реакции микроорганизмов на внешние эффекты является клеточная мембрана, и чрезмерно интенсивное физическое или физико-химическое воздействие может вызывать ингибирующее действие на рост и размножение, повреждение мембран, выраженные нарушения гомеостаза и даже гибель клеток (Gančytė et al., 2023; Sladicekova et al., 2021). Однако пограничное состояние стресса при воздействии электромагнитными полями способно настолько перестроить направление и скорость метаболических процессов, протекающих в клетках микроорганизмов, что его следствием будут не только изменение морфологических характеристик клеток и колоний, но и новый тип обмена веществ после адаптации к подобным стрессовым условиям (Al-hadedee et al., 2019; Hall et al., 2021). Например, обработка импульсным электрическим полем вызывает повышение проницаемости плазматических мембран микроорганизмов -электропорацию. Манипулирование параметрами электрического поля может привести к обратимым или необратимым изменениям жизнеспособности клеток, скорости регенерации плазматической мембраны и ее пор. При обратимой электропорации клетки остаются жизнеспособными даже после воздействия электрического импульса, но их метаболизм в результате адаптации подвергается изменениям (Gancyte et al., 2023). Как правило, при сравнении способности к адаптации разных групп микроорганизмов отмечаются более высокие адаптационные возможности хлебопекарных дрожжей (Randez-Gil et al., 2013).
К химической активации хлебопекарных дрожжей и молочнокислых бактерий обычно относят влияние повышенных концентраций веществ - стресс-провокаторов: этанола, кислот, кислорода, некоторых консервантов ( Baez et al., 2014; van Bokhorst-van de Veen et al., 2011; Heunis et al., 2014; Ribeiro et al., 2021 ). Биохимическими способами активации микроорганизмов считаются введение ферментов и дополнительных веществ, необходимых для питания стартовой микрофлоры на начальном этапе роста ( Попова и др., 2020; Резниченко и др., 2022; Хатко и др., 2017) . В частности, рост бактерий Lactobacillus plantarum стимулируется внесением в закваску дополнительных источников азота - таких, как дрожжевые экстракты и гидролизаты, кукурузный экстракт с добавлением бисульфата аммония, подсырная сыворотка, солодовые экстракты зерновых культур, наиболее дефицитные аминокислоты, минеральные соли и др. ( Byakika et al., 2020; Manzoor et al., 2017; Paliy et al., 2020 ). Маннаны и азот отмирающих дрожжевых клеток также оказывают ростостимулирующее действие в отношении разных штаммов Lactobacillus ( Wang et al., 2021 ). Активация дрожжей наиболее часто реализуется внесением не содержащихся в муке сахаров (например, в составе мучной заварки) или дополнительным внесением осахаривающих крахмал ферментов, либо дополнительным внесением дефицитных в питании дрожжей веществ, веществ-биостимуляторов типа янтарной кислоты, витаминно-аминокислотных смесей и веществ-антиоксидантов ( Маслов и др., 2020; Ermakova et al., 2018; Karpenko et al., 2023 ).
Поскольку слабый рост микроорганизмов заквасок ведет к неэффективной работе внесенной микрофлоры, а при слишком быстром росте может происходить закисление пищевых масс, для каждого вида микроорганизмов закваски необходимо определять технологические параметры предлагаемого варианта стимуляции - режимы физического воздействия или дозировки веществ-активаторов.
Ранее в экспериментальных условиях изучена возможность активации хлебопекарных дрожжей S. cerevisia питательными компонентами измельченных плодовых тел вешенки обыкновенной. Подтверждено положительное влияние грибного порошка на подъемную силу и активность ферментов зимазного комплекса и мальтазы дрожжей ( Маслов и др., 2020 ). В отношении заквасочных бактерий показано, что грибные полисахариды стимулируют рост штаммов Lactobacillus сильнее, чем коммерчески доступные пребиотики, такие как инулин или фруктоолигосахариды ( Nowak et al., 2018 ). Биомассу мицелия некоторых грибов можно использовать в хлебопекарном производстве как дополнительный источник ферментов гидролитического и протеолитического действия, определяющих направление и скорость процессов созревания теста и формирования потребительских свойств хлебобулочных изделий ( Козубаева и др., 2021; Минаков и др., 2022а; Минаков и др., 2022б; Yuan et al., 2017) . Однако для некоторых видов грибов рыночная стоимость может быть настолько велика, что экономически более целесообразной становится их глубокая переработка с получением максимальной выгоды. В качестве подобных примеров можно привести возможность комплексной переработки биомассы мицелия высших грибов кордицепса ( Cordyceps militaris ) и шиитаке ( Lentinula edodes ), с экстракционным извлечением растворимых биологически активных компонентов и последующим выделением из отработанной биомассы ценных грибных полисахаридов - глюканов и хитозана ( Минаков и др., 2023 ). При такой схеме переработки ценного грибного сырья в качестве компонента, используемого в целях биохимической активации микробиома хлебопекарных заквасок, можно было бы вносить в закваски получаемые экстракты. В частности, имеются данные о том, что экстракт грибов шиитаке при внесении его в молочные продукты повышал жизнеспособность и стимулировал ферментативную активность бактерий Lactobacillus и Bifidobacterium ( Hassan et al., 2014 ).
Целью работы стало исследование возможности применения экстрактов из биомассы мицелия грибов кордицепс и шиитаке для активации роста клеток хлебопекарных дрожжей и молочнокислых бактерий, составляющих основу микробиома заквасок в условиях хлебопекарного производства.
Материалы и методы
Объектами исследований на разных этапах работы выступали:
-
- штаммы грибов Cordyceps militaris SRG4 и Lentinula edodes 3790 из коллекции кафедры органической химии Алтайского государственного университета;
-
- биомасса мицелия грибов C. militaris , выращенная на зерне красного риса, и биомасса мицелия грибов L. edodes , выращенная на зерне мягкой пшеницы. Биомассу мицелия грибов C. militaris и L. edodes выращивали, сушили и размалывали до дисперсности 0,02-0,10 мм в условиях, отработанных и описанных ранее ( Минаков и др., 2022б) ;
-
– экстракты водно-спиртовый (концентрация водного раствора спирта 50 об.%) и глицериновый, полученные при гидромодуле 1 : 10 из биомассы мицелия C. militaris и L. edodes . Экстракты готовили методом мацерации с периодическим перемешиванием при 22±2 °С в течение 5 сут с отделением жидкого экстракта декантацией и последующей очисткой водно-спиртовых экстрактов от взвеси частиц мицелия фильтрованием (глицериновые экстракты не фильтровали вследствие повышенной вязкости) через бумажный фильтр марки ФБ-I по ГОСТ 12026-761;
-
– прессованные хлебопекарные дрожжи "Люкс Экстра" производства ООО "САФ-НЕВА" – биомасса живых клеток дрожжей S. cerevisiae (от 8 до 12×109 в 1 г);
-
– "Лактобактерин+" производства ООО "Био Лонг Лайф" – жидкий концентрат, симбиотический комплекс трех штаммов лактобактерий (биомасса живых активных бактерий гомо- и гетероферментативных штаммов L. plantarum , L. fermentum и L. casei , выращенных на питательной среде на основе гидролизата пищевого коллагена; общая концентрация живых клеток в 1 см3 – 108;
-
– "Бифидумбактерин" производства ЗАО "Экополис" – лиофилизированный препарат бифидобактерий (биомасса живых бактерий штамма B. bifidum 791; не менее 107 КОЕ в одной дозе/0,2 флакона);
-
– образцы жидкой ржаной закваски, приготовленные из обдирной ржаной муки, прессованных хлебопекарных дрожжей и молочнокислых или бифидобактерий, с добавлением водно-спиртового или глицеринового экстракта биомассы мицелия C. militaris и L. edodes . В контрольных вариантах жидкие ржаные закваски готовили без добавления экстрактов биомассы мицелия.
Выбор экстрагентов для получения экстрактов мицелия высших грибов – глицерина и водных растворов этилового спирта – обусловлен тем, что этанол относится к числу доказанных стресс-факторов, способствующих активации микроорганизмов, а глицерин является одним из веществ, участвующих в осморегуляции S. сerevisiae , и может быть использован дрожжевыми клетками и некоторыми видами лактобактерий в качестве дополнительных источников углерода ( Jodłowski et al., 2021; Klein et al., 2017 ) .
Выбор в качестве объектов исследования перечисленных микроорганизмов связан с тем, что хлебопекарные дрожжи S. cerevisia являются компонентом ржаных заквасок, штаммы лактобактерий L. plantarum , L. fermentum и L. casei используются при выведении заквасок на основе пшеничной и ржаной муки и их смесей, а штаммы B. bifidum используются как одна из стартерных культур для приготовления заквасок на пшеничной муке ( Романов и др., 2016 ). В зависимости от формы препарата возможно использование B. bifidum как без предварительной подготовки (жидкие препараты бактерий), так и в условиях регидратации и активизации (если используются лиофилизованные препараты).
Закваски для исследования готовили из 20 г ржаной обдирной муки, 40 мл воды температурой 30 °С, 2 г прессованных хлебопекарных дрожжей и 3 мл лактобактерина или бифидумбактерина. При температуре, приближенной к 30–40 °С, закваска получается более кислой, с большим количеством молочнокислых бактерий и меньшим количеством дрожжей, при 20–22 °С в ней будет больше дрожжей. В жидкой закваске больше дрожжей, но молочнокислых бактерий – примерно столько же либо чуть меньше, чем в густой. С учетом вышесказанного, для брожения приготовленную закваску выдерживали в термостате при температуре 35±1 °С, имитируя 1-ю фазу созревания жидкой закваски.
Используемые в работе варианты приготовления заквасок: К СП – закваска с добавлением 3 мл водноспиртового экстракта биомассы мицелия C. militaris ; К ГЛ – закваска с добавлением 3 мл глицеринового экстракта биомассы мицелия C. militaris ; Ш СП – закваска с добавлением 3 мл водно-спиртового экстракта биомассы мицелия L. edodes ; Ш ГЛ – закваска с добавлением 3 мл глицеринового экстракта биомассы мицелия L. edodes (табл. 2, 3). При меньших количествах экстрактов в составе закваски не выявлено заметных изменений в динамике нарастания кислотности и объема закваски. Поэтому на этом этапе исследований применили повышенные дозировки экстрактов с целью усиления визуального эффекта их воздействия на объем заквасок.
Влияние экстрактов мицелия грибов на бродильную активность дрожжей и бактерий оценивали по динамике изменения объема и кислотности закваски. Кислотность закваски устанавливали по ГОСТ ISO 750-20132 потенциометрическим титрованием с расчетно-графической обработкой результатов. С целью изучения динамики изменения объема закваску помещали в мерный цилиндр, который оставляли в термостате в течение 180 мин. При этом через каждые 60 мин фиксировали объем закваски, производили перемешивание закваски и отбор проб.
В ходе экспериментальных исследований также изучали реакцию клеток микроорганизмов на внесение глицеринового или водно-спиртового экстракта биомассы мицелия C. militaris и L. edodes. Общее количество клеток в дрожжевых суспензиях (100 мл воды, 0,1 г дрожжей, 1 г сахара и 0,5 мл [0,5 %] или 1 мл [1,0 %] соответствующего экстракта, табл. 4) определяли подсчетом в 2-сеточной счетной камере Горяева (ООО "МиниМед", Россия), дрожжевую клетку с почкой считали за одну особь. Статистический лабораторный анализ дрожжевых суспензий осуществляли на лабораторном микроскопе Микромед 1. Фотографии препаратов клеток микроорганизмов выполнены на микроскопе модели ZEISS PrimoStar (Carl Zeiss, Германия) с планахроматическим объективом и окуляром с микрометрической шкалой с использованием цифровой камеры Zeiss Axiocam 105 color (Carl Zeiss, Германия). Фотографии обработаны с использованием компьютерной программы Scope Fhoto/×86/Scope.exe.
Все исследования реализованы в 3-кратной повторности, результаты обработаны с использованием программного приложения Microsoft Office Excel.
Результаты и обсуждение
Лактобактерии, в частности, вид L. plantarum , являются естественным представителем микробиома некоторых высших грибов ( Basyul et al., 2014 ). Данное явление свидетельствует о том, что в составе таких видов грибов нет компонентов, угнетающих лактобактерии или подавляющих их рост. Отмечено также, что природные штаммы бактерий Lactobacillus , выделенные из плодовых тел съедобных грибов, могут обладать высокой и средней антагонистической активностью по отношению к условно патогенным бактериям ( Basyul et al., 2014 ). Рядом исследований было показано, что водно-спиртовые экстракты мицелия C. militaris не только проявляют высокую антиоксидантную активность, но могут проявлять и ингибирующую активность в отношении некоторых видов патогенных и условно-патогенных бактерий ( Deshmukh et al., 2023; Eiamthaworn et al., 2022 ). Что касается глицериновых экстрактов, то подобных исследований не проводилось. Как нет и данных о возможном стимулирующем влиянии водно-спиртовых и глицериновых экстрактов C. militaris и L. edodes в отношении к технологически значимым видам микрофлоры хлебопекарных заквасок.
Скорость накопления кислот считается одним из наиболее характеристичных показателей активности микробиоты закваски ( Teleky et al., 2020 ). Согласно результатам исследования, титруемая кислотность полученных экстрактов биомассы мицелия C. militaris и L. edodes варьировала в пределах от 0,6 до 3,2 град (табл. 1), в глицериновый экстракт извлекалось меньше кислореагирующих веществ. Однако на исходных значениях кислотности приготавливаемых заквасок внесение экстрактов мицелия грибов не отразилось: вне зависимости от варианта приготовления закваски все образцы заквасок характеризовались одинаковой начальной кислотностью – 1,6 град (табл. 2). Следовательно, в формировании общей (титруемой) кислотности заквасок до начала брожения присутствие в экстрактах кислореагирующих веществ значимой роли не играет.
Таблица 1. Кислотность водно-спиртовых и глицериновых экстрактов биомассы мицелия грибов C. militaris и L. Edodes Table 1. Acidity of aqueous alcohol and glycerine extracts of C. militaris and L. edodes mushrooms mycelium biomass
|
Вариант растворителя |
Кислотность полученных экстрактов, град |
|
|
из мицелия C. militaris |
из мицелия L. edodes |
|
|
Водный раствор этанола 50 об.% |
2,0 |
2,8 |
|
Глицерин 100 % |
0,8 |
0,6 |
Вместе с тем добавление экстрактов оказало влияние на процесс созревания заквасок. Более заметное стимулирующее влияние на лактобактерии зафиксировано в вариантах созревания заквасок с внесением водно-спиртовых экстрактов шиитаке. Это проявилось как в опережающем контроль росте кислотности, так и в увеличении интенсивности газообразования, а впоследствии – на объеме закваски (особенно в начальный период брожения).
Стимуляции деятельности бифидобактерий при добавлении экстрактов не замечено, но следует отметить незначительное подавляющее действие в отношении бифидобактерий при внесении в закваски экстрактов C. militaris . В первый час экспозиции бактерии проявили свою активность, за счет чего титруемая кислотность подросла. Однако затем стало заметно ингибирующее действие компонентов экстрактов, что отразилось в снижении скорости накопления кислореагирующих веществ (табл. 2).
Таблица 2. Влияние вида экстракта и продолжительности брожения на кислотность закваски Table 2. The effect of the extract type and the fermentation duration on the starter acidity
|
Вариант опыта |
Кислотность закваски, град / Продолжительность брожения, мин |
|||||||
|
Закваски с препаратом "Лактобактерин+" |
Закваски с препаратом "Бифидумбактерин" |
|||||||
|
0 |
60 |
120 |
180 |
0 |
60 |
120 |
180 |
|
|
К СП |
1,6 |
3,8 |
4,0 |
4,4 |
1,6 |
4,2 |
4,2 |
4,4 |
|
К ГЛ |
1,6 |
3,6 |
3,8 |
4,6 |
1,6 |
4,2 |
4,2 |
4,2 |
|
Ш СП |
1,6 |
4,0 |
4,0 |
4,6 |
1,6 |
4,4 |
4,4 |
4,6 |
|
Ш ГЛ |
1,6 |
3,8 |
4,2 |
4,8 |
1,6 |
4,0 |
4,2 |
4,4 |
|
Контроль |
1,6 |
3,8 |
4,0 |
4,2 |
1,6 |
4,4 |
4,4 |
4,6 |
Считается, что в "молодых" заквасках недостаточно хорошо адаптировавшихся микроорганизмов не сформирован характерный комплекс вкусо-ароматических компонентов, к тому же такие закваски не способны выступить в качестве активного разрыхлителя. В активной закваске, напротив, отмечается повышенное газообразование, а также кисло-сладкий вкус и аромат, которые проявляются именно в результате брожения. Зрелой считается достигшая пика брожения закваска, что выражается в избыточно кислом вкусе и меньшем количестве пузырьков газа или, в целом, в разрушенной структуре.
Нарастание кислотности закваски характеризует, прежде всего, активность молочнокислых бактерий, в то время как за наращивание объема закваски ответственны, главным образом, дрожжевые клетки. Особенно заметное увеличение объема закваски отмечено через 60 мин от начала брожения при добавлении спиртового экстракта L. edodes (табл. 3). Стимулирующее действие этого экстракта сохранялось в течение всей продолжительности эксперимента.
Таблица 3. Влияние вида экстракта и продолжительности брожения на объем закваски Table 3. The effect of the extract type and the fermentation duration on the starter volume
|
Вариант опыта |
Объем закваски, см3 / Продолжительность брожения, мин |
|||||||
|
Закваски с препаратом "Лактобактерин+" |
Закваски с препаратом "Бифидумбактерин" |
|||||||
|
0 |
60 |
120 |
180 |
0 |
60 |
120 |
180 |
|
|
К СП |
67 |
158 |
126 |
73 |
67 |
185 |
110 |
80 |
|
К ГЛ |
67 |
132 |
120 |
62 |
67 |
174 |
110 |
66 |
|
Ш СП |
67 |
175 |
110 |
70 |
67 |
190 |
110 |
76 |
|
Ш ГЛ |
67 |
150 |
115 |
70 |
67 |
162 |
92 |
58 |
|
Контроль |
67 |
150 |
100 |
62 |
67 |
178 |
110 |
76 |
Водно-спиртовые экстракты L. edodes , в целом, обеспечивали более быстрое и активное газообразование. Стимулирующее действие водно-спиртовых экстрактов C. militaris в отношении симбиоза дрожжей и молочнокислых бактерий проявилось на более поздних стадиях брожения заквасок. Аналогичное стимулирующее действие грибные экстракты оказывали и в отношении симбиоза дрожжей с B. bifidum .
Глицериновые экстракты каждого из двух исследуемых видов грибов оказывали видимое ингибирующее действие на симбиоз хлебопекарных дрожжей как с Lactobacillus , так и с B. bifidum . Прежде всего, внесение глицериновых экстрактов шиитаке и кордицепса в закваски с бифидобактериями приводило к снижению активности газообразования (о чем свидетельствует уменьшение объема заквасок, табл. 3).
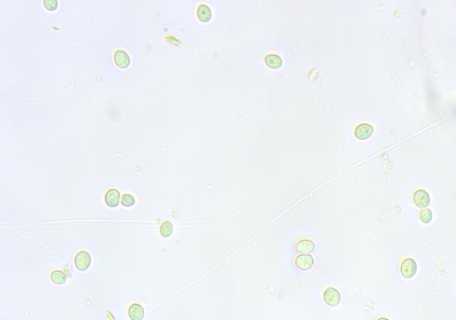
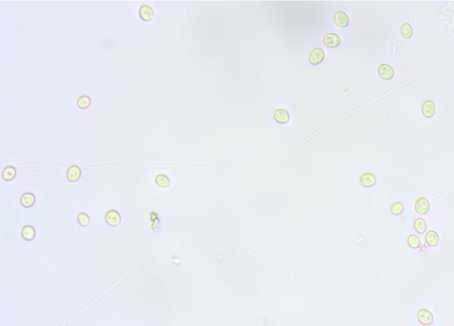
Скорость наращивания закваской биомассы активных клеток имеет значение как при введении в производственный цикл, так и в разводочном цикле при использовании чистых культур микроорганизмов. Скорость почкования клеток дрожжей определяет скорость и качество созревания полуфабрикатов хлебопекарного производства ( Кузьмина и др., 2021 ). При подсчете количества дрожжевых клеток в суспензиях с внесением 0,5%-х водно-спиртовых экстрактов мицелия кордицепс и шиитаке обнаружено более активное их почкование с сохранением нормальной формы и размеров клеток, особенно через 120–180 мин экспозиции (табл. 4, рис.).
Таблица 4. Влияние вида и дозировки экстракта на почкование клеток S. cerevisiae Table 4. The effect of the type and dosage of the extract on growth rate of S. cerevisiae cells
|
Вариант опыта / дозировка экстракта |
Количество дрожжевых клеток в 1 см3, ×106, при продолжительности экспозиции, мин |
||||
|
0 |
60 |
120 |
150 |
||
|
К СП |
0,5 % |
13,3 |
14,3 |
16,0 |
17,0 |
|
1,0 % |
13,3 |
11,0 |
12,3 |
13,8 |
|
|
К ГЛ |
0,5 % |
13,3 |
13,8 |
14,0 |
14,3 |
|
1,0 % |
13,3 |
12,5 |
13,3 |
15,0 |
|
|
Ш СП |
0,5 % |
13,3 |
18,0 |
19,5 |
20,0 |
|
1,0 % |
13,3 |
10,3 |
11,8 |
12,5 |
|
|
Ш ГЛ |
0,5 % |
13,3 |
10,3 |
10,5 |
11,5 |
|
1,0 % |
13,3 |
10,8 |
10,8 |
11,9 |
|
|
Контроль |
13,3 |
13,3 |
13,8 |
15,3 |
|
В то же время внесение глицериновых экстрактов КГЛ и ШГЛ приводило к конгломерации и появлению скоплений клеток, существенно затрудняющих подсчет.
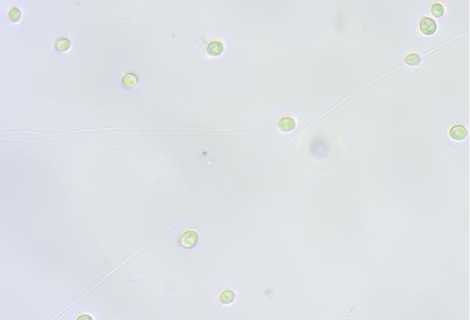
0 минут (начало экспозиции)
через 60 мин экспозиции
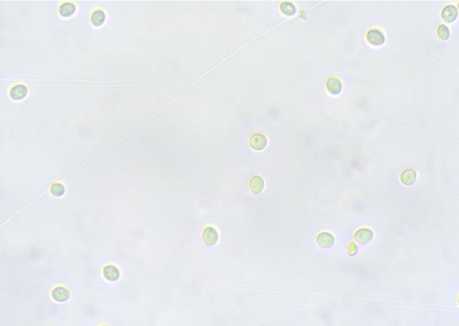
через 120 мин экспозиции через 180 мин экспозиции
Рис. Фото клеток S. cerevisiae (400×) в суспензиях с внесением 0,5%-го водно-спиртового экстракта мицелия C. militaris
Fig. Photos of S. cerevisiae cells (400×) in suspensions with 0.5 % aqueous-alcohol extract of mycelium C. militaris
Заключение
Таким образом, внесение водно-спиртовых экстрактов мицелия грибов шиитаке и кордицепс позволяет регулировать активность бродильной микрофлоры. Для ускорения почкования дрожжей достаточно внести в закваску 0,5 % рассматриваемых экстрактов, но этого количества будет не достаточно для заметной активации молочнокислых бактерий. При внесении 3–4 % экстрактов (к массе закваски) обеспечивается активация молочнокислых бактерий, и, как следствие, более интенсивное нарастание кислотности и повышение интенсивности газообразования в закваске. Результаты проведенного исследования могут быть использованы в практической деятельности хлебопекарных предприятий с целью регуляции активности дрожжевого и молочнокислого брожения и продолжительности созревания закваски и теста.
Конфликт интересов


