Активность антиоксидантных ферментов полиэкстремофильных дрожжей Yarrowia lipolytica при развитии окислительного стресса в ходе продолжительного культивирования
Автор: Секова Варвара Юрьевна, Боброва Екатерина Алексеевна, Исакова Елена Павловна, Дерябина Юлия Ивановна
Журнал: Бюллетень науки и практики @bulletennauki
Рубрика: Биологические науки
Статья в выпуске: 12 т.6, 2020 года.
Бесплатный доступ
Перекись водорода является одной из наиболее распространенных активных форм кислорода, способной свободно диффундировать через клеточные мембраны, вызывая изменения редокс-статуса клеток и развитие окислительного стресса. В работе показано, что эффекты, вызываемые перекисью водорода, дозозависимы и могут вызывать как повреждение клеток, так и усиление их устойчивости к окислительному стрессу. В данной работе изучалось влияние различных доз H2O2 на редокс-статус клеток дрожжей Yarrowia lipolytica в процессе долговременного культивирования. Было показано, что введение оксиданта в логарифмической стадии роста имеет отсроченный эффект на уровень АФК в поздней стационарной стадии роста. При этом зависимость окислительно-восстановительного статуса от вводимой концентрации не линейна, что позволяет предположить инициацию различных сигнальных механизмов разными концентрациями оксиданта.
Дрожжи, окислительный стресс, каталаза, супероксиддисмутаза, активные формы кислорода
Короткий адрес: https://sciup.org/14117721
IDR: 14117721 | УДК: 579.222 | DOI: 10.33619/2414-2948/61/02
Текст научной статьи Активность антиоксидантных ферментов полиэкстремофильных дрожжей Yarrowia lipolytica при развитии окислительного стресса в ходе продолжительного культивирования
Бюллетень науки и практики / Bulletin of Science and Practice
УДК 579.222
Активные формы кислорода (АФК), в частности, H 2 O 2 играют неоднозначную роль в биологических системах [1–2] Высокие концентрации H 2 O 2 вызывают окислительный стресс, в то время как при низких концентрациях это соединение является триггером многочисленных сигнальных путей клетки [3]. При низких концентрациях H 2 O 2 также играет решающую роль в индукции т. н. гормезиса – явления, заключающегося в приобретении устойчивости к неблагоприятным воздействиям при мягком воздействии другого стрессового фактора. При этом потенциальный эффект Н 2 О 2 зависит не только от концентрации, но и от физиологического состояния клетки [4].
Продолжительное культивирование дрожжей приводит к накоплению в клетках повреждений, связанных с (1) накоплением мутаций и последующей утратой репродуктивной способности; (2) появлению повреждений дыхательной цепи, вызывающих развитие окислительного стресса по механизму с положительной обратной связью [5]. В этой связи фундаментальный и практический интерес представляет изучение гормезиса, вызываемого различными неблагоприятными воздействиями, как фактора защиты клеток против старения. Исследования, проведенные на модели дрожжей Saccharomyces сerevisiae , показали, что умеренный окислительный стресс, вызванный как варьированием источников углерода, так и предобработкой низкими дозами H 2 O 2 , способствует развитию устойчивости к сильному окислительному стрессу [4, 6], а инициируемые повышением АФК сигнальные события в логарифмической стадии роста дрожжевой культуры приводят к увеличению метаболической активности клеток в поздней стационарной стадии роста [7].
Несмотря на широкое практическое и фундаментальное применение S. сerevisiae в качестве модели окислительно-восстановительных процессов в клетках млекопитающих, этот объект имеет ряд недостатков. Во-первых, S. сerevisiae являются факультативным аэробом, способным к утилизации преимущественно субстратов бродильного типа. Во-вторых, этот вид дрожжей не имеет комплекса I дыхательной цепи митохондрий, а также содержит убихинон вида Q6, который значительно отличается по своей структуре от убихинона «животного типа» Q9-Q10. По этой причине в качестве модели для изучения гормезиса, обусловленного H2O2, мы выбрали лишенные этих недостатков полиэкстремофильные дрожжи Yarrowia lipolytica, которые являются строго аэробным микроорганизмом с полностью компетентной дыхательной цепью митохондрий, и, в отличие от S. cerevisiae, содержат убихинон вида Q9, с девятью единичными изопреноидными боковыми цепями и, таким образом, обнаруживают высокую степень гомологии с убихиноном Q9-Q10 [8], обнаруженным у млекопитающих. Более того, девятнадцать из 23 вспомогательных субъединиц митохондриального комплекса I Y. lipolytica имеют явные ортологи в I комплексе млекопитающих [9].
Предлагаемый модельный организм — полиэкстремофильные дрожжи Y. lipolytica — устойчив к ряду неблагоприятных воздействий и обладает гибкой системой редокс-адаптации, позволяющей эффективно переносить повышение уровней генерации АФК в клетках без заметных изменений параметров роста культуры [10–13]. Несмотря на множество проведенных ранее работ по изучению стрессовых воздействий на клетки дрожжей Y. lipolytica , ключевая сигнальная роль АФК в регуляции метаболизма этого организма остается неясной.
В данной работе изучалось влияние различных концентраций перекиси водорода на окислительно-восстановительный статус в процессе продолжительного культивирования дрожжей Y. lipolytica .
Материал и методы исследования
Объект исследования и условия культивирования . В работе использован штамм Y. lipolytica W29 (дикий тип), полученный из коллекции типовых штаммов CIRM-Levures (Франция). Культивирование штамма проводили как описано в работе [14]. Культуры инкубировали в 750 мл колбах Эрленмейера, содержащих 100 мл среды, на шейкере при температуре 28°С и скорости аэрации 180 об./мин. Оптическую плотность (ОП) культуры оценивали спектрофотометрическим методом при длине волны 590 нм. При достижении культурой стационарной стадии роста (18 ч, ОП 590нм = 7,5–8,0) в культуральную жидкость вносили перекись водорода в конечной концентрации 10, 15 и 25 мМ, после чего различные физиолого-биохимические параметры оценивались во временных точках 24, 40 и 120 ч роста культуры, что соответствовало поздней экспоненциальной, ранней и поздней стационарным стадиям роста культуры, соответственно.
Приготовление клеточных гомогенатов. Для изучения активности антиоксидантных ферментов возникла необходимость разработки метода приготовления клеточных экстрактов из очень небольшого (20–80 мг) количества влажной биомассы из-за необходимости производить отбор проб в течение продолжительного культивирования без значительного нарушения параметров аэрации. Для этого из каждой колбы отбирали по 5 мг клеточной суспензии, для поддержания постоянного объема после отбора проб в колбы вносили по 5 мл стерильной дистиллированной воды. Клеточные суспензии центрифугировали в пластиковых пробирках при 6 000 g , после чего осажденную биомассу переносили на фильтр “Milli Q”, промывали дистиллированной водой и отжимали вручную. Полученные таким образом пеллеты взвешивали и помещали в стеклянный притертый гомогенизатор, где растирали на льду в течение 60 с. Полученный гомогенат разводили в соотношении 1:10 в среде следующего состава: MES — 10 мМ, сорбит — 0.5 М, маннит — 0.5 М, ЭДТА — 5 мМ, фенилметилсульфонилфторид, ФМСО — 0,5 мг/мл; pH 6,5. Полученную суспензию переносили в микроцентрифужные пробирки объемом 1,5 мл и осаждали клеточный дебрис при 15 000 g в течение 20 мин при температуре 0–4°С. Клеточные экстракты использовали для исследования активности ферментов первой линии защиты — СОД и каталазы.
Уровень АФК. Для оценки уровня АФК в клетках использовали флуоресцентный краситель эфир дигидро-2',7'-дихлорофлуоресцеина диацетата (ДХФДА). В клеточную суспензию дрожжей, разведенную буфером PBS в соотношении 1:2, добавляли 4 мМ раствор ДХФДА (Sigma, США) в ДМСО до конечной концентрации 40 мкМ и экспонировали в течение 30 мин в темноте, после чего дважды промывали буфером того же состава. В качестве «положительного контроля» использовались клетки дрожжей, обработанные 600 мкМ 2,2'-азобис(2-метилпропионамидин) дигидрохлоридом (АМПА). Измерение флуоресценции полученной суспензии проводили в 96-луночном планшете для измерения флуоресценции при длине волны возбуждения 485 нм и длине волны эмиссии 528 нм каждые 10 мин на микропланшетном фотофлуориметре Synergy 2 Bio Teck, США) при чувствительности 60% [15].
Измерение активности СОД. Активность СОД оценивали непрямым методом, по ингибированию автоокисления кверцетина [16]. Кверцетин автоокисляется в щелочных условиях (рН 10,0) в присутствии 0,8 мМ тетраметилэтилендиамина (ТМДА) с выделением в качестве побочного продукта реакции супероксид-анион-радикала·и разрушением хромофора с максимумом поглощения при 406 нм. Исследование проводили в 20 мМ К-фосфатном буфере, содержащем 0,1 мМ ЭДТА, и 0,8 мМ ТМДА, рН 7,8 В реакционную смесь вносили 10 мкл гомогената, разведенного 1:50. Реакцию запускали добавлением кверцетина (0,36 мМ). За единицу ферментативной активности СОД принимали 50%-е ингибирование автоокисления кверцетина [16].
Определение каталазной активности. Суммарную каталазную активность определяли по скорости расщепления пероксида водорода. Концентрацию H 2 O 2 измеряли в режиме реального времени фотометрическим методом по поглощению УФ-излучения с длиной волны 240 нм. Активность выражали в милимолях расщепленной H 2 O 2 в мин на 1 мг белка [16].
Статистическая обработка результатов . Каждое измерение было проведено не менее, чем в 4-х физических повторностях и в 3–5 биологических. Достоверными были признаны значения, СКО для которых составило ≤10% от среднего.
Результаты и обсуждение
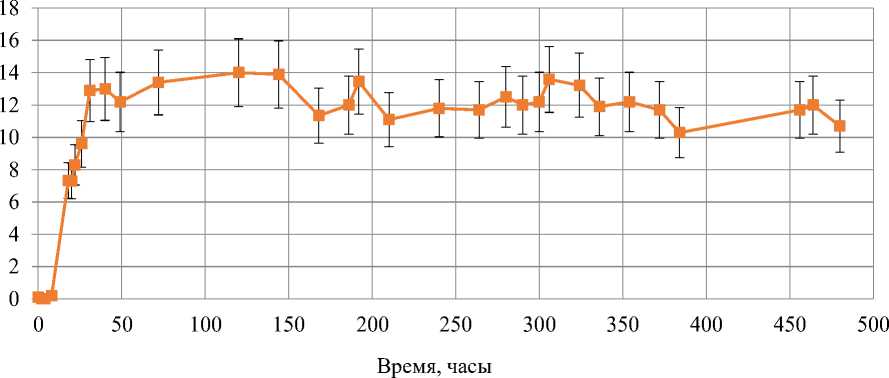
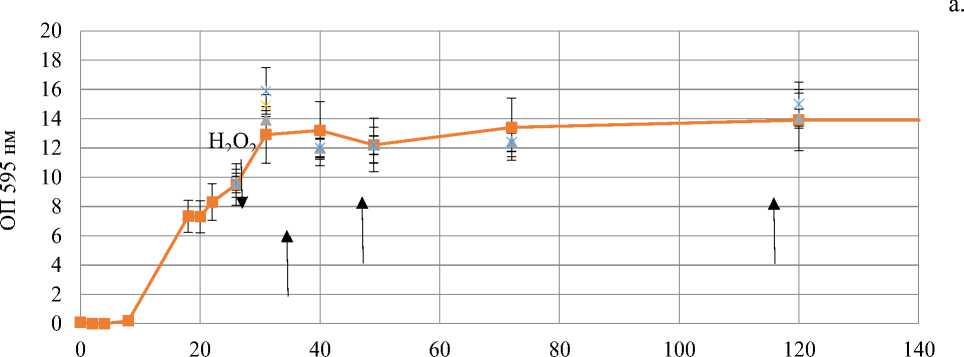
Как видно на рисунке 1, культивирование клеток Y. lipolytica продолжалось более 450 ч (Рисунок 1, а). Лаг-фаза длилась около 8 часов (Рисунок 1, б), а переход в стационарную стадию роста происходил через 28-30 ч роста. Значительных изменений в течение стационарной стадии роста не отмечалось. Для дальнейших манипуляций и оценки окислительно-восстановительного статуса клеток дрожжей были выбраны следующие точки: 24 ч — поздняя логарифмическая стадия роста; 40 ч — ранняя стационарная и 120 ч — поздняя стационарная стадия. Не наблюдалось и значительных изменений ОП и после внесения различных концентраций перекиси водорода. Таким образом, выбранные нами концентрации перекиси водорода не влияли на параметры накопления биомассы, по крайней мере, на выбранном нами отрезке времени в 120 ч. Кинетика накопления биомассы приведена на Рисунке 1.
Время, часы
—■— Контроль ▲ 10 мМ X 15 мМ ж 25 мМ
Рисунок 1. Кривые роста дрожжей Y. lipolytica W29: а — при продолжительном культивировании; б — после внесения различных концентраций H 2 O 2 в логарифмической стадии роста (показано стрелками).
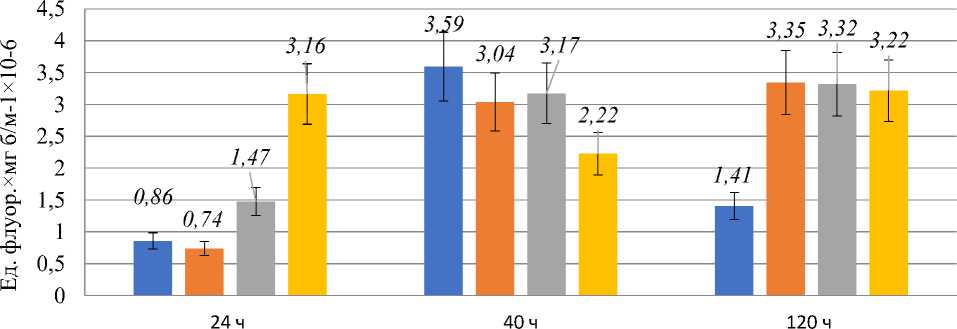
Изменения уровня АФК в культурах клеток приведены на Рисунке 2.
■ Контроль
■ 10мМ ■ 15 мМ ■ 25 мМ
Рисунок 2. Интенсивность флуоресценции (ед.) клеточной суспензии Y. lipolytica W29 через 45 мин после окрашивания ДХФДА.
Бюллетень науки и практики / Bulletin of Science and Practice Т. 6. №12. 2020
Из Рисунка 2 видно, что в контрольной культуре клеток минимальный уровень АФК отмечался в логарифмической стадии роста, а максимальный — в ранней стационарной стадии роста, что можно связать с метаболической перестройкой культуры для жизни в условиях ограничения по субстрату. К поздней стационарной стадии роста уровень АФК снижался, однако, оставался в 1,5-2 раза выше, чем в логарифмической стадии роста. Введение 10 мМ H 2 O 2 не приводило к значительному изменению уровня АФК через 24 ч и 40 ч культивирования относительно контроля, однако через 120 ч уровень АФК поддерживался на уровне раннего стационара и оставался в этой временной точке более, чем в 2 раза выше, чем в контроле. Введение 15 мМ H 2 O 2 приводило к повышению уровня АФК относительно контроля на 40% в логарифмической стадии роста, при этом в ранней стационарной стадии роста этот параметр находился на уровне контроля, оставаясь достаточно высоким (как и при 10 мМ) в поздней стационарной стадии. Введение 25 мМ H 2 O 2 приводило к резкому росту уровня АФК, который был в 4 раза выше, чем в контроле, уже через 6 часов после внесения. В ранней стационарной стадии роста, однако, этот параметр заметно снижался относительно остальных образцов и составлял ~70% от контроля. К поздней стационарной стадии роста значение этого параметра возвращалось к первоначально высокому значению и заметно не отличалось от других образцов.
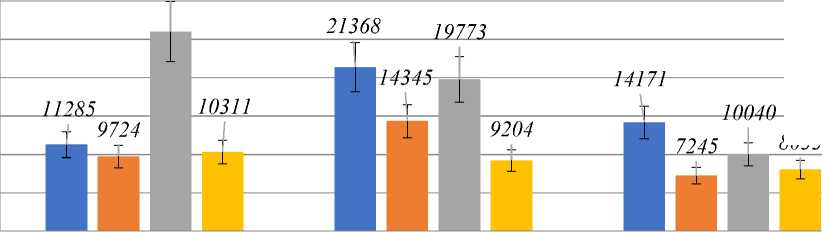
Активность СОД в ходе продолжительного культивирования Y. lipolytica представлена на Рисунке 3. СОД является антиоксидантным ферментом первой линии защиты, дисмутирующим супероксид-анион с образованием перекиси водорода.
к - о ю
s
24ч
40ч
120ч
■К
■ 10мМ
■ 15мМ
■ 25мМ
Рисунок 3. Активность СОД в зависимости от времени и внесенной концентрации перекиси водорода.
Профиль изменения СОД в контрольном образце коррелировал с профилем изменения АФК, что может говорить о связи этих двух параметров (Рисунок 4). Введение 10 мМ H2O2 никак не влияло на активность фермента в логарифмической стадии роста, однако уже в ранней стационарной стадии роста измеряемая активность фермента снизилась по сравнению с контролем на ~25%, что может быть связано с эффектом ингибирования фермента конечным продуктом. Сниженная по сравнению с контролем активность СОД наблюдалась в этом случае и в поздней стационарной стадии роста. Введение 15 мМ H2O2 приводило к резкому (более, чем в 2 раза) росту активности СОД в логарифмической стадии роста, однако, уже в ранней стационарной стадии активность фермента достигала значения, характерного для контрольного образца. В поздней стационарной стадии активность СОД снижалась относительно контроля на 20–25%. 25 мМ H2O2 не позволяла активности СОД изменяться ни в ранней, ни в поздней стационарной стадии роста.
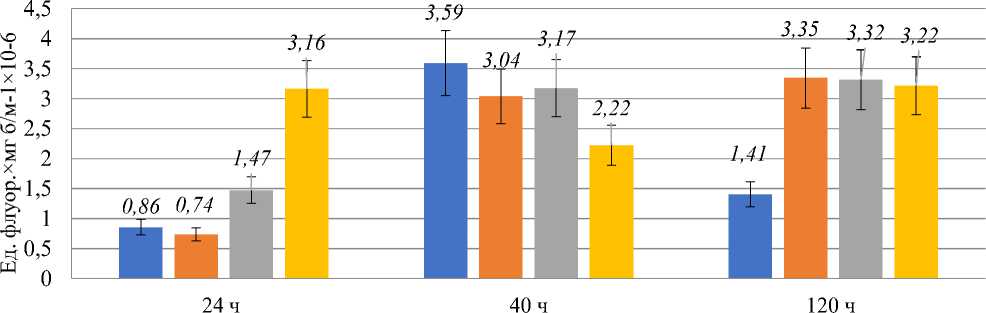
■ Контроль
■ 10мМ
■ 15 мМ
■ 25 мМ
Рисунок 4. Интенсивность флуоресценции (ед.) клеточной суспензии Y. lipolytica W29 через 45 мин после окрашивания ДХФДА.
На протяжении всего культивирования активность СОД оставалась на уровне контроля в логарифмической стадии, что можно связать с эффектом ингибирования продуктом. Активность каталазы приведена на Рисунке 5.
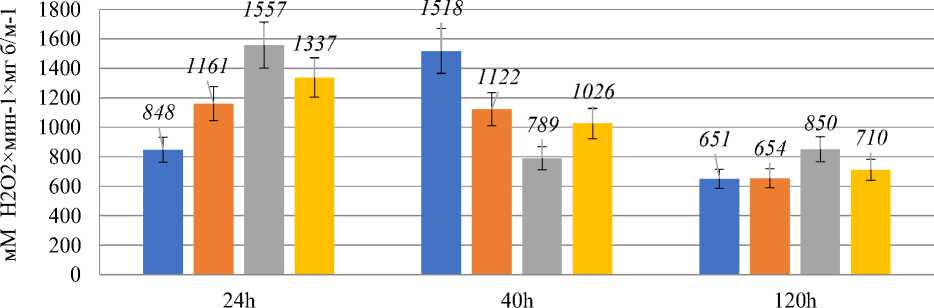
■K ■ 100ul ■ 150ul ■ 250ul
Рисунок 5. Активность каталазы в зависимости от времени и внесенной концентрации перекиси водорода.
Активность каталазы в контрольном образце изменялась пропорционально активности СОД и уровню АФК с течением времени. Введение различных концентраций перекиси водорода оказывало значительное влияние на этот параметр. 10 мМ H 2 O 2 приводила к возрастанию активности каталазы по сравнению с контролем на ~20% в логарифмической стадии роста. При этом в ранней стационарной стадии роста этот параметр оставался неизменным, принимая значение на ~20% ниже по сравнению с контролем в этой точке. К поздней стационарной стадии активность этого фермента снижалась до уровня контроля. 15 мМ перекись оказывала более выраженный эффект на активность каталазы в логарифмической стадии роста, который отменялся к началу стационарной стадии — в этом случае значение параметра было вдвое ниже, чем в контроле. Тем не менее, это значение
cc) ® I
сохранялось и в поздней стационарной стадии роста, что превышало уровень контроля на 25–30%. Эффект, оказываемый 25 мМ H 2 O 2 достоверно не отличался от эффекта, оказываемого 10 мМ. Можно предположить, что внесение H 2 O 2 приводило к быстрой индукции каталазы, однако в отличие от СОД, этот эффект длится не долго и снимался уже в ранней стационарной стадии роста.
Сопоставляя данные об уровне АФК в ходе продолжительного культивирования, можно говорить о развитии индуцированного окислительного стресса через 6 часов после внесения H 2 O 2 . Уровень АФК при этом увеличивался дозозависимым образом. Что касается активности антиоксидантных ферментов, то в первую очередь следует отметить ожидаемый всплеск активности каталазы в ответ на внесение H 2 O 2 [17] . Здесь стоит отметить, что активность фермента после внесения 10 мМ H 2 O 2 достоверно отличалась от активности фермента после внесения 15 мМ H 2 O 2. Также следует отметить достоверный рост активности СОД через 6 часов после внесения 15 мМ оксиданта на фоне остальных образцов. Связать такие различия в индукции активностей ферментов в существовании т. н. градиента перекиси водорода [18], который обусловлен внеклеточной концентрацией H 2 O 2 с одной стороны, и скоростью инактивации оксиданта — с другой. Также большое значение имеет проницаемость ЦПМ, которая в ряде случаев является лимитирующим фактором установления перекисного градиента, если клетки имеют конститутивно высокое содержание цитоплазматических каталаз и глутатионпероксидаз, а реакции разложения перекиси имеют кинетику первого порядка. Следует отметить, что все три этих фактора взаимосвязаны между собой, так как внеклеточная перекись водорода способна влиять как на проницаемость мембран [19], так и на активность антиоксидантных ферментов [20]. Таким образом, 15 мМ, предположительно, является именно той концентрацией H 2 O 2 , которая с одной стороны достаточно быстро повышает проницаемость ЦПМ, а с другой — быстро инициирует сигнальные события, приводящие к повышению активности антиоксидантных ферментов.
Наибольший интерес в данном случае представляет эффект резкого роста активности СОД через 6 часов после внесения 15 мМ H2O2. Известно, что митохондриальная Mn-SOD экспрессируется в ответ на повышение уровня АФК [21], причем этот эффект является дозозависимым, а различные концентрации АФК инициируют различные сигнальные механизмы, приводящие в конечном счете к экспрессии генов, кодирующих СОД. Эффект от воздействия 15 мМ H2O2 сохранялся до ранней стационарной стадии, однако, к поздней стационарной стадии роста активность фермента снижалась и оставалась вдвое ниже контроля в этой точке. Ожидаемо, происходило повышение уровня АФК во всех образцах, за исключением обработанного 25мМ H2O2 — в этом случае к началу стационарной стадии роста уровень АФК достоверно снижался. Можно предположить, что заметное повышение уровня АФК через 6 часов после введения оксиданта приводило к быстрой инициации сигнальных событий с последующей активацией защитных механизмов. Таким образом, всплеск генерации АФК, связанный с метаболической перестройкой в начале стационарной стадии роста, клетки переживали, будучи «подготовленными» к этому событию. Сравнительно невысокие активности СОД и каталазы в данном случае говорят о том, что в качестве защитных механизмов выступали не ферменты первой линии защиты, а другие, компоненты, такие как ферменты глутатионовой системы, а также низкомолекулярные антиоксиданты. Стоит отметить, что на протяжении как минимум 12 часов после внесения перекиси водорода клетки продолжали делиться. То есть возникшие изменения могли частично передаваться от материнских клеток дочерним. В данном случае можно предположить, что метаболическая перестройка, связанная с исчерпанием субстрата, приводила к повышению уровня АФК, который затем снижался. Введение 10 и 15 мМ перекиси оказывало слабое влияние на этот параметр в логарифмической и ранней стационарной стадиях культивирования, однако оказывало неожиданный эффект сохранения высокого уровня АФК и в поздней стационарной стадии роста. При введении 25 мМ H2O2 картина несколько изменялась: первые часы культивирования с оксидантом сопровождались резким ростом уровня АФК, после чего он заметно снижался. Этот эффект можно связать с активацией некоторых сигнальных каскадов введением достаточной концентрации перекиси водорода [4, 22], которые «подготавливают» клетку к существованию в условиях ограничения ресурсов. В поздней стационарной стадии роста этот эффект «смягчения» метаболической перестройки отменяется, и уровень АФК снова возрастал.
Влияние умеренного окислительного стресса у молодых культур/организмов на последующее накопление повреждений с течением жизни было продемонстрировано как на модели S. cerevisiae [7], так и на модели свободноживущей нематоды Caenorhabditis elegans , являющейся популярным объектом для исследования процессов старения [23]. В случае Y. lipolytica нам не удалось выявить горметических эффектов 10-25 мМ H 2 O 2 на состояние культуры в поздней стационарной стадии роста. Более того, 15 мМ H 2 O 2 оказывала негативное воздействие на редокс-статус культуры. Это можно связать с развитием окислительного стресса по механизму с положительной обратной связью, в том числе с формированием в ЦПМ кальциевых пор, повышением содержания ионов калия в цитоплазме и повышением в ЦПМ содержания белков семейства НАДФН-оксидаз (NOX), которые, сами по себе могут быть источниками супероксид-радикала при неполном восстановлении H 2 O 2 [24].
Заключение
Исходя из полученных данных можно заключить следующее: введение перекиси водорода в логарифмической стадии роста может иметь отсроченные последствия и приводить к развитию окислительного стресса в поздней стационарной стадии роста, что особенно выражено в случае внесения 15 мМ перекиси. Наблюдаемые эффекты зависят от воздействующего на клетку градиента перекиси водорода в первые часы после введения оксиданта. Этот параметр, в свою очередь, определяется концентрацией H 2 O 2 , проницаемостью ЦПМ и совокупностью антиоксидантных факторов внутри клеток. Различные концентрации H 2 O 2 инициируют различные сигнальные события, часть которых приводит к индукции ферментов первой линии защиты, а часть — к повышению содержания низкомолекулярных компонентов.
Работа выполнена при поддержке госзадания №0112-2019-0001.
Список литературы Активность антиоксидантных ферментов полиэкстремофильных дрожжей Yarrowia lipolytica при развитии окислительного стресса в ходе продолжительного культивирования
- Ruttkay-Nedecky B., Nejdl L., Gumulec J., Zitka O., Masarik M., Eckschlager T.,.. Kizek R. The role of metallothionein in oxidative stress // International journal of molecular sciences. 2013. V. 14. №3. P. 6044-6066. DOI: 10.3390/ijms14036044
- Bleier L., Wittig I., Heide H., Steger M., Brandt U., Dröse S. Generator-specific targets of mitochondrial reactive oxygen species // Free Radical Biology and Medicine. 2015. V. 78. P. 1-10. DOI: 10.1016/j.freeradbiomed.2014.10.511
- Ludovico P., Burhans W. C. Reactive oxygen species, ageing and the hormesis police // FEMS yeast research. 2014. V. 14. №1. P. 33-39. DOI: 10.1111/1567-1364.12070
- Semchyshyn H. M., Valishkevych B. V. Hormetic effect of H2O2 in Saccharomyces cerevisiae: involvement of TOR and glutathione reductase // Dose-Response. 2016. V. 14. №2. P. 1559325816636130. DOI: 10.1177/1559325816636130
- Baccolo G., Stamerra G., Coppola D. P., Orlandi I., Vai M. Mitochondrial Metabolism and Aging in Yeast // Mitochondria and Longevity. 2018. 1-33. DOI: 10.1016/bs.ircmb.2018.05.001
- Vasylkovska R., Petriv N., Semchyshyn H. Carbon Sources for Yeast Growth as a Precondition of Hydrogen Peroxide Induced Hormetic Phenotype // International Journal of Microbiology. 2015. V. 2015. P. 1-8.
- DOI: 10.1155/2015/697813
- Burdyliuk N., Bayliak M. Effects of Long-Term Cultivation on Medium with Alpha-Ketoglutarate Supplementation on Metabolic Processes of Saccharomyces cerevisiae // Journal of aging research. 2017. V. 2017.
- DOI: 10.1155/2017/8754879
- Parey K., Haapanen O., Sharma V., Köfeler H., Züllig T., Prinz S.,.. Kühlbrandt W. High-resolution cryo-EM structures of respiratory complex I: Mechanism, assembly, and disease // Science advances. 2019. V. 5. №12. P. eaax9484.
- DOI: 10.1126/sciadv.aax9484
- Maclean A. E., Kimonis V. E., Balk J. Pathogenic mutations in NUBPL affect complex I activity and cold tolerance in the yeast model Yarrowia lipolytica // Human molecular genetics. 2018. V. 27. №21. P. 3697-3709.
- DOI: 10.1093/hmg/ddy247
- Rzechonek D. A., Day A. M., Quinn J., Mirończuk A. M. Influence of ylHog1 MAPK kinase on Yarrowia lipolytica stress response and erythritol production // Scientific reports. 2018. V. 8. №1. P. 1-12.
- DOI: 10.1038/s41598-018-33168-6
- Arinbasarova A. Y., Machulin A. V., Biryukova E. N., Sorokin V. V., Medentsev A. G., Suzina N. E. Structural changes in the cell envelope of Yarrowia lipolytica yeast under stress conditions // Canadian journal of microbiology. 2018. V. 64. №5. P. 359-365.
- DOI: 10.1139/cjm-2018-0034
- Kolhe N., Zinjarde S., Acharya C. Impact of uranium exposure on marine yeast, Yarrowia lipolytica: Insights into the yeast strategies to withstand uranium stress // Journal of hazardous materials. 2020. V. 381. P. 121226.
- DOI: 10.1016/j.jhazmat.2019.121226
- Walker C., Ryu S., Haridas S., Na H., Zane M., LaButti K.,.. Trinh C. T. Draft Genome Assemblies of Ionic Liquid-Resistant Yarrowia lipolytica PO1f and Its Superior Evolved Strain, YlCW001 // Microbiology resource announcements. 2020. V. 9. №9.
- DOI: 10.1128/MRA.01356-19
- Секова В. Ю., Гесслер Н. Н., Исакова Е. П., Антипов А. Н., Дергачева Д. И., Дерябина Ю. И., Трубникова Е. В. Окислительно-восстановительный статус экстремофильных дрожжей Yarrowia lipolytica при адаптации к рН-стрессу // Прикладная биохимия и микробиология. 2015. Т. 51. №6. С. 570-570.
- DOI: 10.7868/S0555109915060136
- Davey H., Guyot S. Estimation of Microbial Viability Using Flow Cytometry // Current Protocols in Cytometry. 2020. V. 93. №1. P. e72.
- DOI: 10.1002/cpcy.72
- Дергачева Д. И., Машкова А. А., Исакова Е. П., Гесслер Н. Н., Дерябина Ю. И. Действие ресвератрола и дигидрокверцетина на физиолого-биохимические характеристики полиэкстремофильных дрожжей Yarrowia lipolytica в условиях температурного стресса // Прикладная биохимия и микробиология. 2019. Т. 55. № 2. С. 158-165.
- DOI: 10.1134/S0555109919020041
- Martins D., English A. M. Catalase activity is stimulated by H2O2 in rich culture medium and is required for H2O2 resistance and adaptation in yeast // Redox biology. 2014. V. 2. P. 308-313.
- DOI: 10.1016/j.redox.2013.12.019
- Marinho H. S., Cyrne L., Cadenas E., Antunes F. The cellular steady-state of H2O2: latency concepts and gradients // Methods in Enzymology. Academic Press. 2013. V. 527. P. 3-19.
- DOI: 10.1016/B978-0-12-405882-8.00001-5
- Branco M. R., Marinho H. S., Cyrne L., Antunes F. Decrease of H2O2 plasma membrane permeability during adaptation to H2O2 in Saccharomyces cerevisiae // Journal of Biological Chemistry. 2004. V. 279. №8. P. 6501-6506.
- DOI: 10.1074/jbc.M311818200
- Гордеева А. В., Звягильская Р. А., Лабас Ю. А. Взаимосвязь между активными формами кислорода и кальцием в живых клетках обзор // Биохимия. 2003. Т. 68. №10. С. 1318-1322.
- Scandalios J. G. Oxidative stress: molecular perception and transduction of signals triggering antioxidant gene defenses // Brazilian journal of medical and biological research. 2005. V. 38. №7. P. 995-1014.
- DOI: 10.1590/S0100-879X2005000700003
- Zhang N., Cao L. Starvation signals in yeast are integrated to coordinate metabolic reprogramming and stress response to ensure longevity // Current genetics. 2017. V. 63. №5. P. 839-843.
- DOI: 10.1007/s00294-017-0697-4
- Yang W., Hekimi S. A mitochondrial superoxide signal triggers increased longevity in Caenorhabditis elegans // PLoS Biol. 2010. V. 8. №12. P. e1000556.
- DOI: 10.1371/journal.pbio.1000556
- Zhang J. et al. ROS and ROS-mediated cellular signaling // Oxidative medicine and cellular longevity. 2016. V. 2016.
- DOI: 10.1155/2016/4350965


