Активность хитотриозидазы и динамика данных компьютерной томографии у пациентов с COVID-19
Автор: Щелкановцева Е.С., Миронова О.Ю., Соловьв К.А., Берестова Е.А., Балахонов А.А., Нагорнов И.О., Фомин В.В., Панферов А.С.
Журнал: Сибирский журнал клинической и экспериментальной медицины @cardiotomsk
Рубрика: Клинические исследования
Статья в выпуске: 3 т.38, 2023 года.
Бесплатный доступ
Цель: оценить взаимосвязь исходного уровня хитотриозидазы (ХТЗ) с динамикой данных компьютерной томографии (КТ): объемом поражения легочной ткани, плотностью печени и селезенки у госпитализированных пациентов с COVID-19.Материал и методы. Проведен субанализ исследования, зарегистрированного в Clinical Trial Registry под номером NCT04752085. Проанализированы данные пациентов, у которых были доступны данные КТ органов грудной клетки при поступлении и хотя бы однократно в динамике за период госпитализации и исходный уровень ХТЗ плазмы крови. На вошедших в зону сканирования изображениях верхних отделов брюшной полости была определена плотность печени и плотность селезенки с последующим расчетом отношения плотности печени к плотности селезенки (ОПС).Результаты. В субанализ включены данные 121 пациента (48,7% мужчины, медиана возраста: 62 [53; 70] года). В динамике через 7 [6; 9] дней отмечено статистически значимое увеличение средней плотности печени с 52,04 [45,4; 56,7] до 57,5 [49,8; 62,7] HU и ОПС - с 1,05 [0,91; 1,14] до 1,13 [0,99; 1,28], p
Хитотриозидаза, плотность печени, отношение плотности печени к плотности селезенки, компьютерная томография, поражение легких, covid-19, биомаркеры, прогноз, chi3l1, хитиназы, sars cov-2
Короткий адрес: https://sciup.org/149143655
IDR: 149143655 | УДК: 577.152.321:[61136:611.41]-061.2:[616.98:578.834.1]-073.756 | DOI: 10.29001/2073-8552-2022-602
Текст научной статьи Активность хитотриозидазы и динамика данных компьютерной томографии у пациентов с COVID-19
Создание стратегического плана долгосрочного управления коронавирусной инфекцией (COVID-19) в виде надежных лабораторно-диагностических методов и единого алгоритма действий, несмотря на окончание пандемии COVID-19, объявленной Всемирной организацией здравоохранения, остается актуальным, поскольку глобальный риск по-прежнему оценивается как высокий [1].
Пандемия COVID-19 потребовала поиска надежных диагностических тестов, позволяющих оценивать степень повреждения легочной паренхимы, самым востребованным из которых оказалась компьютерная томография (КТ), к тому же результаты КТ-сканирования имели большое значение для прогнозирования исходов [2]. В зону сканирования попадают изображения печени и селезенки, и в них часто выявляются различные изменения, поэтому их диагностическое и прогностическое значение продолжает изучаться.
Известно, что в настоящее время рассматривается несколько возможных механизмов повреждения печени у пациентов с COVID-19: прямое повреждающее действие SARS-CoV-2 на гепатоциты путем связывания с рецептором ангиотензинпревращающего фермента II типа и опосредованное повреждение печени на фоне проводимой терапии, а также под влиянием выраженной гипоксемии или синдрома системного воспалительного ответа и так далее [3]. Не ясно, как эти процессы отражаются на данных КТ.
Оценка плотности печени в качестве дополнительного фактора риска развития тяжелой пневмонии у пациентов с коронавирусной инфекцией уже рассматривалась в исследованиях [46, 57], однако в настоящее время этот вопрос остается дискутабельным. Известно, что клетки Купфера являются частью мононуклеарно-фагоцитар-ной системы и активно выделяют хитотриозидазу (ХТЗ) [64], синтез которой, согласно нашей предыдущей научной работе, повышается у пациентов с COVID-19 и имеет прогностическое значение [75]. Мы решили оценить, как исходный уровень ХТЗ связан с изменениями, выявленными при КТ у пациентов с новой коронавирусной инфекцией.
Материал и методы
Одноцентровое проспективное наблюдательное исследование было проведено с ноября 2020 по февраль 2021 гг., одобрено локальным этическим комитетом (протокол № 22-21) и зарегистрировано в Clinical Trial Registry под номером NCT04752085.
В этой работе мы провели субанализ, в который был включен 121 пациент старше 18 лет. Все они были госпитализированы с диагнозом «коронавирусная инфекция», поставленным на основании актуальных на тот период времени клинических рекомендаций [8], пациенты подписали добровольное согласие на участие. Были исключены больные, переведенные по различным причинам в другие стационары и закончившие курс лечения раньше времени по собственному желанию.
Всем больным была проведена КТ органов грудной клетки в день поступления и как минимум еще один раз за период госпитализации на аппарате Canon «Aquilion One Genesis» 640. Параметры сканирования были идентичны стандартным рекомендуемым производителем настройкам для процедуры сканирования грудной клетки. Для определения объема поражения легочной ткани использовалась адаптированная «эмпирическая» визуальная шкала [9], основанная на визуальной оценке примерного объема уплотненной легочной ткани в легком с наибольшим поражением:
-
– отсутствие характерных проявлений (КТ-0);
-
– минимальный объем / распространенность < 25% объема легких (КТ-1);
-
– средний объем / распространенность 25–50% объема легких (КТ-2);
-
– значительный объем / распространенность 50–75% объема легких (КТ-3);
-
– субтотальный объем / распространенность > 75% объема легких (КТ-4).
Плотность печени измеряли путем получения среднего значения в однородных круговых областях площадью 1,5 см² в каждой доле печени согласно денситометри-ческой шкале Хаунсфилда (HU). Аналогичным образом измерялась плотность селезенки. В обоих случаях избегали областей патологически высокой плотности или низкой плотности, затем рассчитывали отношение плотности печени к плотности селезенки (ОПС).
Статистический анализ выполняли с помощью пакета программ STATISTICA 10, StatSoft Inc. Количественные показатели представлены медианами и межквартильными промежутками, Ме [Q1; Q3]. Категориальные показатели представлены абсолютными и относительными (в %) частотами встречаемости. При сравнении количественных показателей в независимых группах пациентов использовали U-критерий Манна – Уитни, при сопоставлении связанных выборок – критерий Уилкоксона. Для оценки шансов неблагоприятных динамических изменений КТ-показателей в зависимости от исходного уровня ХТЗ плазмы крови в двух независимых группах пациентов использовалась модель логистической регрессии.
Результаты
Из 121 пациента, которые были включены в субанализ, умерли 3 (2,43%). Также 3 (2,43%) человека находились на искусственной вентиляции легких / неинвазивной вентиляции легких (ИВЛ/НИВЛ), а 50 пациентам (40,9%) потребовалось назначение биологической терапии. Исходные характеристики пациентов представлены в таблице 1, основные сопутствующие заболевания на рисунке 1.
Таблица 1. Характеристики пациентов на момент включения в исследование
Table 1. Characteristics of patients at the time of admission
|
Параметры Parameters |
n = 121 |
|
Мужской пол, % Male, % |
48,7 |
|
Возраст, лет Age, years |
62 [53; 70] |
|
День болезни, дни Day of disease, days |
8 [5; 10] |
|
NEWS, баллы NEWS, scores |
4 [2; 5] |
|
Стадия КТ 3–4 CT stage 3–4 |
11 (9,1%) |
|
ХТЗ, нмоль/мл/ч CHIT, nmol/ml/h |
91 [26; 208] |
|
Лимфоциты, × 109 Lymphocytes, × 109 |
1,7 [1,15; 2,05] |
|
АСТ, ед/л AST, Units/L |
31 [24,6; 49,7] |
|
АЛТ, ед/л ALT, Units/L |
30 [21,4; 46,1] |
|
Креатинин, мкмоль/мл Creatinine, ng/mL |
85 [74,6; 98,7] |
Примечание: АСТ – аспартатаминотрансфераза, АЛТ – аланинаминотрансфераза, КТ – компьютерная томография, ХТЗ – хитотриози-даза.
Примечание: ИМТ – индекс массы тела.
Note: AST – aspartate aminotransferase, ALT – alanine aminotransferase, CT – computed tomography, CHIT – chitotriosidase.
Note: BMI – body mass index.
Далее мы оценивали динамику КТ-показателей. Исходно КТ-исследование выполнялось всем пациентам в день включения в исследование, а повторно – в зависимости от клинической ситуации на 7-й [6; 9] день (табл. 2).
Далее мы разделили пациентов на группы в зависимости от того, как в динамике изменились КТ-параметры (объем поражения легочной ткани, плотность печени и ОПС), сравнили исходный уровень ХТЗ среди них (табл. 3).
По результатам анализа модели логистической регрессии, представленным в таблице 4, оказалось, что у пациентов с исходным уровнем ХТЗ менее 100 нмоль/ мл/ч статистически значимо повышены шансы прогрессирования поражения легочной ткани, в то время как динамика показателей плотности печени и селезенки не зависит от исходного уровня ХТЗ.
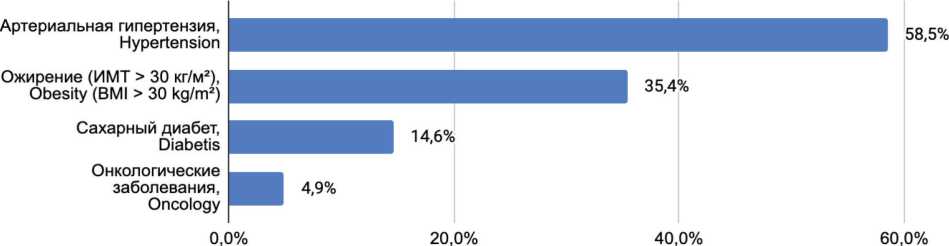
Рис. 1. Основные сопутствующие заболевания
Fig. 1. The main comorbidities
Доля сопутствующих заболеваний (Percentage of comorbidities), %
Таблица 2. Сравнение данных компьютерной томографии в динамике
Table 2. Comparison of CT data in dynamics
|
Показатели Parameters |
КТ исходно CT on admission |
КТ повторно CT repeatedly |
p |
|
Поражение легких, % Lung damage, % |
30 [20; 40] |
30 [15; 40] |
0,384 |
|
Плотность печени, HU Liver density, HU |
52,04 [45,4; 56,7] |
57,5 [49,8; 62,7] |
0,000 |
|
ОПС L/S ratio |
1,05 [0,91; 1,14] |
1,13 [0,99; 1,28] |
0,000 |
Примечание: КТ – компьютерная томография, ОПС – отношение плотности печени к плотности селезенки.
Note: CT – computed tomography, L/S – liver to spleen ratio.
Таблица 3. Сравнение исходного уровня хитотриозидазы в группах в зависимости от динамики КТ-изменений
Table 3. Comparison of the baseline level of chitotriosidase in the groups depending on the dynamics of CT changes
|
Данные КТ CT data |
Объем поражения легочной ткани Lung injury volume |
р |
Плотность печени Liver density |
р |
ОПС L/S ratio |
р |
|||
|
Увеличился Increased |
Не увеличился Didn’t increase |
Не увеличилась |
Увеличилась |
Не увеличилось Didn’t increase |
Увеличилось Increased |
||||
|
ХТЗ, нмоль/мл/ч |
65 |
124 |
0,006 |
84 |
100 |
0,694 |
105 |
88 |
0,336 |
|
CHIT, nmol/ml/h |
[27; 119] |
[53; 232] |
[47; 164] |
[28; 225] |
[68; 202] |
[26; 215] |
|||
Примечание: КТ – компьютерная томография, ХТЗ – хитотриозидаза, ОПС – отношение плотности печени к плотности селезенки.
Note: CT – computed tomography, CHIT – chitotriosidase, L/S – liver to spleen ratio.
Таблица 4. Влияние исходного уровня хитотриозидазы < 100 нмоль/мл/ч на динамику показателей компьютерной томографии
Table 4. The effect of baseline chitotriosidase level < 100 nmol/ml/h on the dynamics of CT parameters
|
Динамика КТ-показателей Dynamics of CT parameters |
ОШ (отношение шансов OR (odds ratio) |
95% доверительный интервал ОШ OR 95% confidence interval |
|
Увеличение объема поражения легочной ткани Increased volume of lung injury |
3,2 |
1,4–7,15 |
|
Увеличение плотности печени Increased liver density |
1,1 |
0,44–2,78 |
|
Увеличение ОПС Increased LSR |
2,14 |
0,72–6,33 |
Примечание: КТ – компьютерная томография, ОПС – отношение плотности печени к плотности селезенки.
Note: CT – computed tomography, L/S – liver to spleen ratio.
Обсуждение
КТ органов грудной клетки является широко распространенным и общепринятым методом визуализации у пациентов с COVID-19. Исследование имеет большое значение как для диагностики, так и для контроля эф- фективности лечения заболевания и прогнозирования его течения. Анализ изображений фрагментов печени и селезенки, попадающих в зону сканирования, не является общепринятым, а имеющиеся данные по этому вопросу неоднозначны. Среди пациентов с коронавирусной инфекцией описано достаточно много случаев повреждения печени, сопровождающихся различными клиническими проявлениями. Тем не менее в настоящее время говорить о точной причине печеночной дисфункции затруднительно за счет множества влияющих на это факторов [3, 10].
В работе E. Guler и соавт. показано, что уменьшение ОПС коррелирует с увеличением поражения легочной ткани у пациентов с коронавирусной инфекцией. Исследование носило ретроспективный характер и включало небольшое количество больных – 27 человек. Авторы не рассматривали плотность печени отдельно от плотности селезенки, аргументировав это тем, что в качестве диагностического метода исследования применялась нативная КТ, а не КТ с контрастным усилением [11], а также тем, что ОПС предпочтительно использовать для дифференциальной диагностики стеатоза печени. A. Palomar-Lever и соавт. также рекомендуют всем пациентам с COVID-19 измерять ОПС, так как наличие стеатоза коррелирует с тяжелым течением заболевания [7].
Мы решили оценить взаимосвязь активности ХТЗ плазмы крови и изменение плотности печени, селезенки и поражения легочной ткани по данным КТ, опираясь на гипотезу, что по активности ХТЗ можно судить об активации макрофагов и нейтрофилов [12]. Интересным является тот факт, что ХТЗ экспрессируется купферовскими клетками [4], что может играть роль в патогенезе повреждения печени у пациентов с COVID-19. Врожденный иммунитет старается поддерживать купферовские клетки в толерогенном состоянии, которое необходимо для предотвращения нежелательных иммунных реакций [13]. Активация данных клеток происходит в том числе за счет воздействия на Toll-подобные рецепторы 2-го и 4-го типов (TLR-2, TLR-4), что приводит к высвобождению провос-палительных медиаторов, которые индуцируют процессы повреждения и фиброза печени [14]. Исходя из того, что макрофаги высвобождают ХТЗ путем воздействия на эти же рецепторы [15], нас заинтересовал в том числе и вопрос потенциальной взаимосвязи уровня активности фермента с плотностными показателями печени и селезенки, определяемыми по КТ.
Результаты патологоанатомического вскрытия пациентов с COVID-19 в исследовании S.M. Lagana и соавт. [16] показали, что макровезикулярный стеатоз был обнаружен у 75% больных. Полученные данные не могут безоговорочно свидетельствовать о том, что повреждение печени развилось только во время инфекционного заболевания, но влияние купферовских клеток после выхода из толерогенного состояния в период активного воспаления на повреждение и формирование фиброти-ческих изменений печени вполне возможно и достаточно обосновано.
В ретроспективном исследовании отечественных коллег оценивалась плотность печени в зависимости от степени повреждения легочной паренхимы, а также плотность печени в динамике у 200 пациентов с коронавирусной инфекцией [6]. Согласно полученным результатам, плотность печени была меньше у больных COVID-19 при тяжелых повреждениях легких (КТ 3–4) и увеличивалась в динамике, при этом сильной взаимосвязи между плотностными показателями при первичной КТ и биохимическими показателями выявлено не было. В нашей работе мы получили схожие результаты относительно увеличения плотности печени в динамике.
По нашим данным, активность ХТЗ ниже 100 нмоль/ мл/ч достоверно сопровождалась прогрессированием поражения легочной ткани. В то же время, согласно нашему предыдущему исследованию, повышение ХТЗ выше 151 нмоль/мл/ч было сопряжено с плохим прогнозом и более тяжелым течением коронавирусной инфекции [5]. Возможно, это связано с потенциальным переключением в механизмах активации макрофагов и их перестройкой на альтернативный путь и может свидетельствовать о том, что при определенном пороговом значении фермента процесс воспаления перестает регулироваться классическим путем и становится системным.
Отсутствие влияния ХТЗ на динамику плотности печени и селезенки, вероятно, связано с тем, что для выхода купферовских клеток из толерогенного состояния необходимо больше времени и более длительное воздействие провоцирующего фактора, чем в нашем исследовании. Важность дальнейших исследований в этом направлении неоспорима, так как в будущем понимание патофизиологических процессов приведет к точной диагностике, эффективной профилактике и лечению COVID-19.
Заключение
В перспективе измерение плотностных показателей органов брюшной полости наряду с оценкой повреждения легочной ткани по данным КТ поможет расширить наши знания о болезни, прогнозировании тяжести заболевания и исходов и улучшить практику медицинского обслуживания для пациентов с COVID-19.
Ограничения исследования
Данное исследование является субанализом исследования, дизайн которого изначально не был рассчитан на анализ КТ в динамике, поэтому сроки повторных исследований оказались различными, что затрудняет интерпретацию полученных данных и выяснение причин выявленных изменений. Выполнение повторного КТ было невозможно у части пациентов в связи с тяжестью состояния или смертью, поэтому в субанализ попали пациенты с более легким течением заболевания, чем в основное исследование, поэтому нам представляется невозможным судить о прогностической значимости полученных нами данных.
Список литературы Активность хитотриозидазы и динамика данных компьютерной томографии у пациентов с COVID-19
- WHO Weekly epidemiological update on COVID-19; 11 May 2023. [Electronic resource]. URL: https://covid19.who.int/ (05.05.2023).
- Francone M., Iafrate F., Masci G.M., Coco S., Cilia F., Manganaro L. et al. Chest CT score in COVID-19 patients: correlation with disease severity and short-term prognosis. Eur. Radiol. 2020;30:6808–6817. DOI: 10.1007/s00330-020-07033-y.
- Tian D., Ye Q. Hepatic complications of COVID-19 and its treatment. J. Med. Virol. 2020;92(10):1818–1824. DOI: 10.1002/jmv.26036.
- Malaguarnera L., Di Rosa M., Zambito A.M., dell’Ombra N., Di Marco R., Malaguarnera M. Potential role of chitotriosidase gene in nonalcoholic fatty liver disease evolution. Am. J. Gastroenterol. 2006;101(9):2060–2069. DOI: 10.1111/j.1572-0241.2006.00680.x.
- Щелкановцева Е.С., Миронова О.Ю., Соловьев К.А., Берестова Е.А., Балахонов А.А. и др. Определение активности хитотриозидазы для прогнозирования неблагоприятных исходов у госпитализированных пациентов с новой коронавирусной инфекцией. Consilium Medicum. 2023;25(3):165–167. [Schelkanovtseva E.S., Mironova O.Yu., Solovev K.A. Berestova E.A., Balakhonov A.A. et al. Сhitotriosidase activity in prediction of poor prognosis in COVID-19 hospitalized patients. Consilium Medicum. 2023;25(3):163–167. (In Russ.)]. DOI: 10.26442/20751753.2023.3.202093.
- Ревишвили А.Ш., Кармазановский Г.Г., Шантаревич М.Ю., Замятина К.А., Сташкив В.И. и др. Характеристика паренхимы печени по данным нативной КТ на этапах лечения COVID-19. Анналы хирургической гепатологии. 2020;25(3):72–87. [Revishvili A.Sh, Kаrmаzаnovsky G.G., Shantarevich M.Yu., Zamyatina K.A., Stashkiv V.I. et al. Characteristics of the liver parenchyma according to the native CT examinations data at the stages of COVID-19 treatment. Annals of HPB surgery. 2020;25(3):72–87. DOI: 10.16931/1995-5464.2020372-87.
- Palomar-Lever A., Barraza G., Galicia-Alba J., Echeverri-Bolanos M., Escarria-Panesso R., Padua-Barrios J. et al. Hepatic steatosis as an independent risk factor for severe disease in patients with COVID-19: A computed tomography study. JGH Open. 2020;4(6):1102–1107. DOI: 10.1002/jgh3.12395.
- Профилактика, диагностика и лечение новой коронавирусной инфекции 2019-nCoV. Временные методические рекомендации Министерства здравоохранения Российской Федерации, 2021; версия 12. [Электронный ресурс]. [The prevention, diagnosis and treatment of the new coronavirus infection 2019-nCoV. Temporary guidelines Ministry of Health, 2021; version 12. [Electronic resourse]. (In Russ.)]. URL: https://static-0.minzdrav.gov.ru/system/attachments/attaches/000/058/075/original/%D0%92%D0%9C%D0%A0_COVID-19_V12.pdf (03.08.2023).
- Морозов С.П., Проценко Д.Н., Сметанина С.В., Андрейченко А.Е., Амброси О.Е., Баланюк Э.А. и др. (сост.) Лучевая диагностика коронавирусной болезни (COVID-19): организация, методология, интерпретация результатов: методические рекомендации. Серия «Лучшие практики лучевой и инструментальной диагностики». Вып. 93. М.: ГБУЗ «НПКЦ ДиТ ДЗМ», 2020:102. [Morozov С.P., Protsenko D.N., Smetanina S.V., Andreichenko A.E., Ambrosy O.E., Balanyuk E.A. et al. (comp.) Radial diagnosis of coronavirus disease (COVID-19): organization, methodology, interpretation of results: guidelines. Series “The best practices of radiology and instrumental diagnostics”. Vol. 93. Moscow: State Research and Clinical Center for Cardiovascular Surgery of the DZM, 2020:102. (In Russ.)].
- Feng G., Zheng K.I., Yan Q.Q., Rios R.S., Targher G., Byrne C.D. et al. COVID-19 and liver dysfunction: current insights and emergent therapeutic strategies. J. Clin. Transl. Hepatol. 2020;8(1):18–24. DOI: 10.14218/JCTH.2020.00018.
- Guler E., Unal N.G., Cinkooglu A., Savas R., Kose T., Pullukcu H. et al. Correlation of liver-to-spleen ratio, lung CT scores, clinical, and laboratory findings of COVID-19 patients with two consecutive CT scans. Abdom. Radiol. 2021;46(4):1543–1551. DOI: 10.1007/s00261-020-02805-y.
- Hollak C.E., van Weely S., Van Oers M.H., Aerts J.M. Marked elevation of plasma chitotriosidase activity. A novel hallmark of Gaucher disease. J. Clin. Invest. 1994;93(3):1288–1292. DOI: 10.1172/JCI117084.
- Thomson A.W., Knolle P.A. Antigen-presenting cell function in the tolerogenic liver environment. Nat. Rev. Immunol. 2010;10(11):753–766. DOI: 10.1038/nri2858.
- Rivera C.A., Adegboyega P., van Rooijen N., Tagalicud A., Allman M., Wallace M. Toll-like receptor-4 signaling and Kupffer cells play pivotal roles in the pathogenesis of non-alcoholic steatohepatitis. J. Hepatol. 2007;47(4):571–579. DOI: 10.1016/j.jhep.2007.04.019.
- Yap J., McCurdy S., Alcala M., Irei J., Garo J., Regan W. et al. Expression of chitotriosidase in macrophages modulates atherosclerotic plaque formation in hyperlipidemic mice. Front. Physiol. 2020;11:714. DOI: 10.3389/fphys.2020.00714.
- Lagana S.M., Kudose S., Iuga A.C., Lee M.J., Fazlollahi L., Remotti H.E. et al. Hepatic pathology in patients dying of COVID-19: a series of 40 cases including clinical, histologic, and virologic data. Mod. Pathol. 2020;33(11):2147–2155. DOI: 10.1038/s41379-020-00649-x.


