Активность карбоксипептидазы Е при длительном действии ноотропных препаратов
Автор: Алексеева Людмила Владимировна, Гамзин Сергей Сергеевич
Журнал: Вестник Тверского государственного университета. Серия: Биология и экология @bio-tversu
Рубрика: Биохимия
Статья в выпуске: 4, 2015 года.
Бесплатный доступ
Изучена активность карбоксипептидазы Е в отделах мозга крыс после введения ноотропных препаратов - пирацетама, фенотропила, ноопепта - каждые 24 ч в течение 14 сут. В условиях длительного режима введения применяемых нейрометаболических стимуляторов выявлены общие тенденции изменений активности карбоксипептидазы Е: наиболее высокая активность наблюдалась в гипофизе через 24 ч после последней инъекции. В порядке уменьшения влияния на активность карбоксипептидазы Е в гипофизе на этом этапе наблюдений ноотропные препараты можно расположить в следующем ряду: пирацетам, фенотропил, ноопепт. Наименее выраженная активность изученного фермента отмечалась в надпочечниках.
Карбоксипептидаза е, ноотропные препараты, длительное действие
Короткий адрес: https://sciup.org/146116620
IDR: 146116620 | УДК: 61:577.1
Текст научной статьи Активность карбоксипептидазы Е при длительном действии ноотропных препаратов
Введение. Ноотропы являются нейрометаболическими стимуляторами и представляют собой лекарственные средства, предназначенные для оказания специфического воздействия на высшие функции мозга (Лапина, Золотарева, 2009; Золотарева, 2011). В комплексе их биологических функций особый интерес представляет нейропротективное влияние - повышение устойчивости нервных клеток к воздействию неблагоприятных факторов различного рода.
Протеолитические ферменты, участвующие как в образовании, так и в деградации нейропептидов, контролируют уровень опиоидных пептидов и стресс-пептидов (Fricker, 1991; Scholzen, 2007). В процессинге предшественников опиоидных пептидов и стресс-пептидов участвует карбоксипептидаза Е (КПЕ) (Вернигора, 2010).
В связи с этим представляется практически значимым исследование влияния нейрометаболических стимуляторов на активность КПЕ.
Цель работы - изучить активность КПЕ в тканях крыс при длительном действии ноотропных препаратов (пирацетам, фенотропил, ноопепт).
Методика. Работа выполнена на 48 самцах белых беспородных крыс возрастом 3 мес. и массой 250-300 г. Животные содержались в стандартных условиях вивария (температура 22-24°С, относительная влажность воздуха 40-50%) с естественным световым режимом на сбалансированной диете при свободном доступе к воде, удовлетворяющей требованиям «Руководства по лабораторным животным и альтернативным моделям в биомедицинских технологиях» (Каркищенко и др., 2010).
Для изучения длительного влияния ноотропных лекарственных средств на активность КПЕ пирацетам вводили внутрибрющинно в дозе 300 мг/кг (Назарова и др., 2007), фенотропил в дозе 100 мг/кг (Белоусов, Мухина, 2005), ноопепт в дозе 10 мг/кг (Коваленко и др., 2002) каждые 24 ч в течение 14 сут. Контрольные животные получали эквивалентный объем физраствора. Крыс выводили из эксперимента через 24 и 72 ч после последней инъекции путем декапитации. Схема проведенного эксперимента показана на рис. 1.
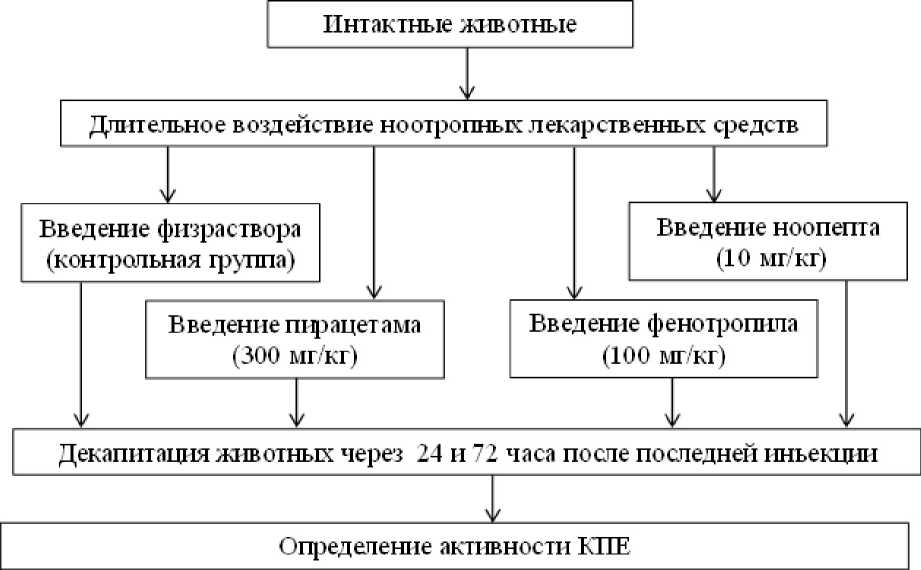
Рис. 1. Схема проведенного эксперимента
После декапитации извлекали гипофиз, четверохолмие, продолговатый мозг, гипоталамус, гиппокамп, амигдалу, стриатум и надпочечники. Ткани погружали в физиологический раствор, охлажденный до 3°С, после чего тщательно очищали их от оболочек и кровеносных сосудов. Активность КПЕ определяли методом Supattapone et al. (1984), белок - методом Лоури (1951). Активность КПЕ выражали в нмоль образовавшегося продукта реакции за 1 мин инкубации в пересчете на 1 мг белка.
Статистическую обработку результатов исследования осуществляли с помощью следующих пакетов программ: Microsoft Office Exel 2010 (Microsoft, США), Statistica 6,0 (StatSoft, Inc., США) и BioStat 2009 Professional. Достоверность различий между группами определяли с использованием параметрического t-критерия Стьюдента (при р<0,05) для сравнения средних независимых выборок с учетом предварительной проверки выборок на нормальность распределения. Результаты представлены в виде М ± т, где М - среднее, т -стандартная ошибка среднего. Критический уровень значимости при проверке статистических гипотез принимался равным р=0,05 (Р=95%).
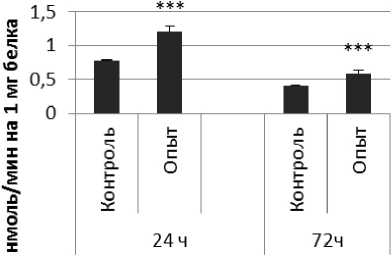
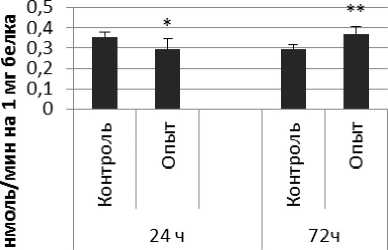
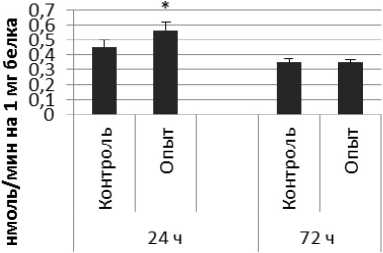
Результаты и обсуждение. Активность КПЕ в нервной ткани крыс при длительном действии пирацетама представлена на рис. 2. Активность КПЕ через 24 ч после последней инъекции пирацетама была выше на 56% по сравнению с контрольной группой животных.
Через 72 ч после последней инъекции активность КПЕ была выше на 46% по сравнению с контрольной группой самцов. В четверохолмии активность фермента повышалась на 72% через 24 ч и снижалась на 72% через 72 ч по сравнению с контрольной группой животных. В продолговатом мозге активность КПЕ снижалась на 21% и 75% через 24 и 72 ч после последней инъекции препарата соответственно. В гипоталамусе активность КПЕ была снижена на 20% через 24 ч и повышена на 25% через 24 и 72 ч соответственно. В гиппокампе активность исследуемого фермента повышалась через 24 ч, а через 72 ч в амигдале и стриатуме снижалась на 37% и 36% соответственно. В надпочечниках обнаружено повышение активности КПЕ на 160% через 24 ч по сравнению с контрольной группой животных.
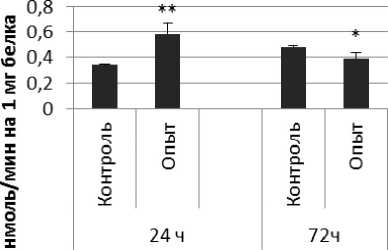
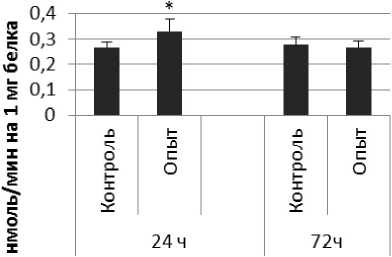
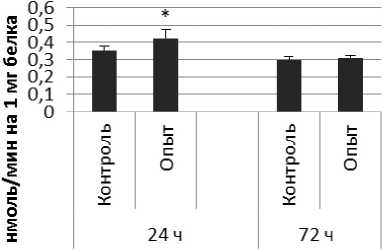
Активность КПЕ в нервной ткани крыс при длительном действии ноопепта показана на рис. 3.
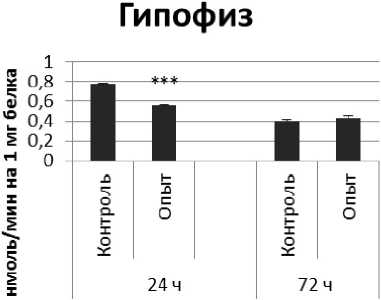
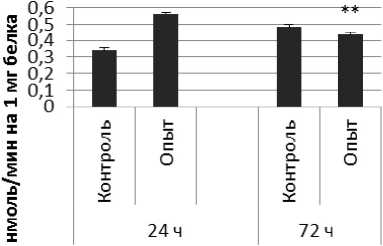
Через 24 ч после последнего введения ноопепта активность КПЕ в гипофизе оказалась сниженной на 38% по сравнению с контрольной группой животных. В четверохолмии длительное введение ноопепта вызывало повышение активности КПЕ на 66% и снижение на 10% через 24 и 72 ч после последней инъекции ноопепта по сравнению с контрольной группой животных. Продолговатый мозг ответил повышением активности КПЕ на 13% и 17% через 24 и 72 ч соответственно после последней дозы ноопепта по сравнению с контрольной группой самцов.
Гипофиз
Четверохолмие
Продолговатый мозг
Гипоталамус
Гиппокамп
Стриатум
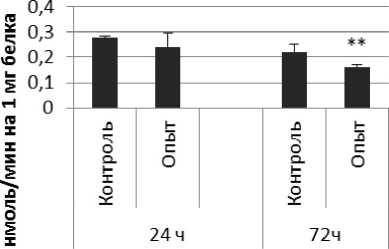
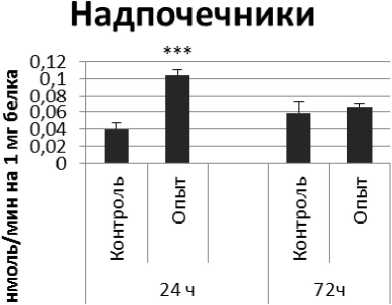
Рис. 2. Активность КПЕ при действии пирацетама в нервной ткани крыс
(нмоль продукта, образовавшегося за 1 мин инкубации на 1 мг белка, М ±т, п=6; * - р<0,05, ** - р<0,01, *** р<0,001 относительно контроля).
Четверохолмие
Продолговатый мозг
Гипоталамус
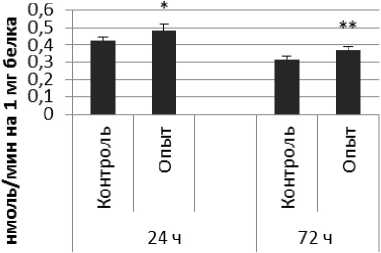
Гиппокамп
Стриатум
Амигдала
Надпочечники
72 ч
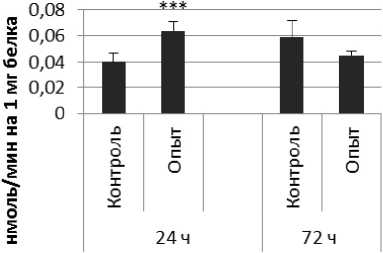
Рис. 3 . Активность КПЕ при действии ноопепта в нервной ткани крыс (нмоль продукта, образовавшегося за 1 мин инкубации на 1 мг белка, М ±т, п=6; * - р<0,05, ** - р<0,01, *** р<0,001 относительно контроля).
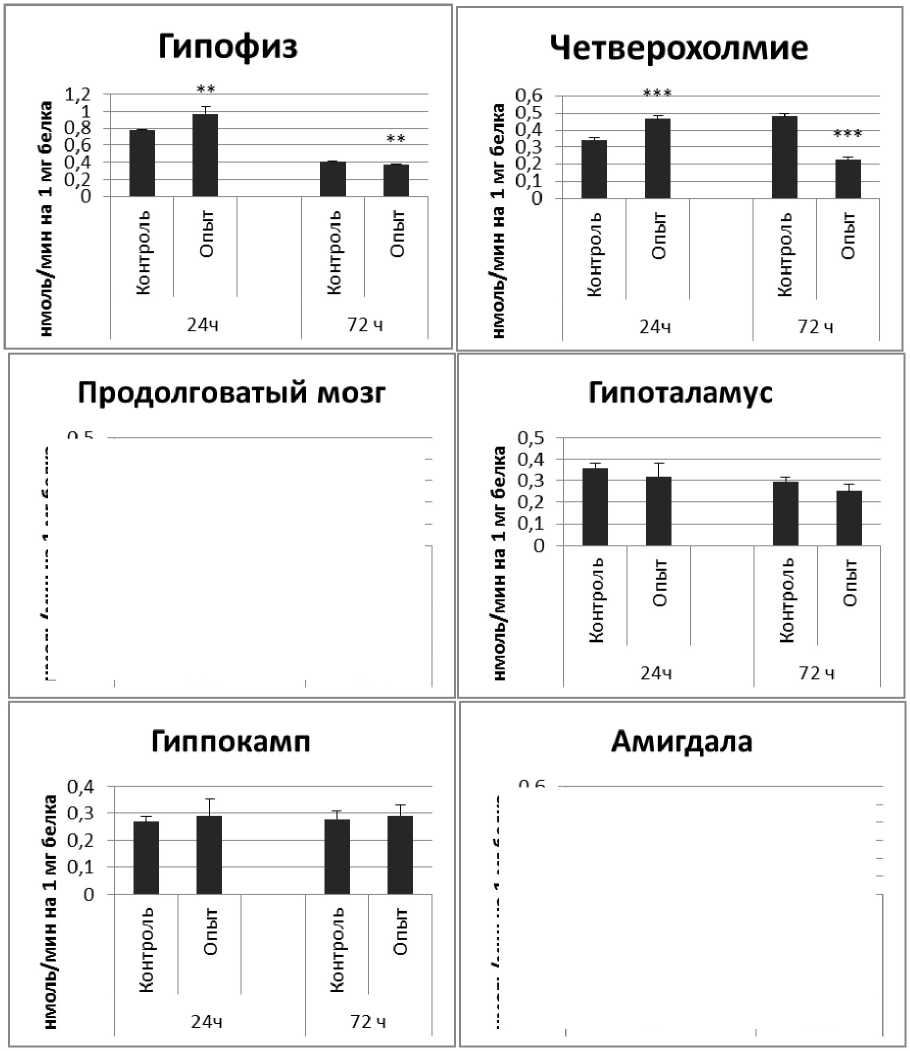
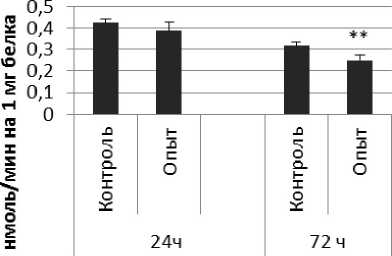
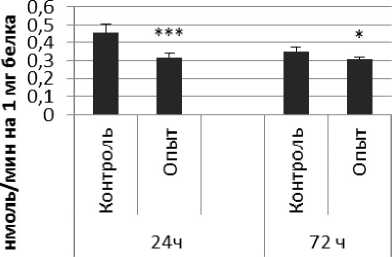
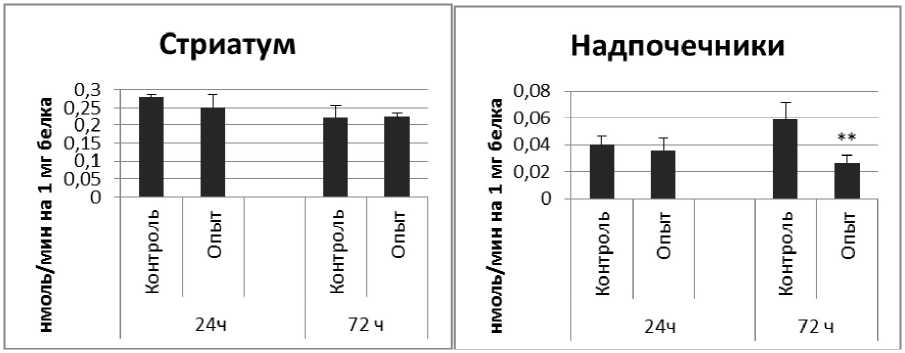
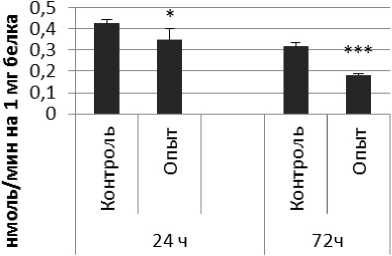
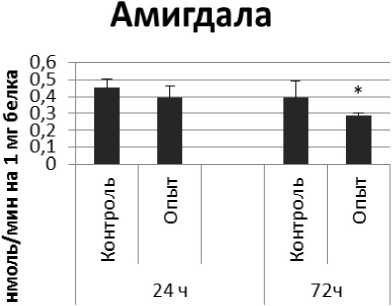
Рис. 4. Активность КПЕ при действии фенотропила в нервной ткани крыс (нмоль продукта, образовавшегося за 1 мин инкубации на 1 мг белка, М ±ш, п=6; * - р<0,05, ** - р<0,01, *** р<0,001 относительно контроля).
- 12 -
В гипоталамусе обнаружено повышение активности КПЕ на 19% через 24 ч после последнего введения ноопепта по сравнению с контролем. Активность КПЕ в гиппокампе возрастала на 49% и 14% через 24 и 72 ч соответственно после последней инъекции ноопепта по сравнению с контрольной группой животных. Через 24 ч после последнего введения ноопепта амигдала и надпочечники обнаружили повышение уровеня активности КПЕ по сравнению с контрольной группой животных на 24% и 60% соответственно.
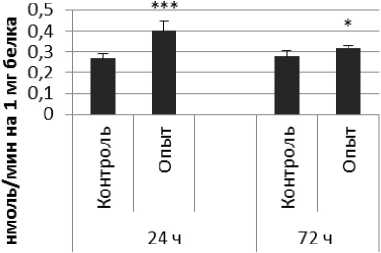
Активность КПЕ в нервной ткани крыс при длительном действии фенотропила отражает рис. 4.
Длительное введение фенотропила вызывало повышение активности КПЕ на 24% через 24 ч и снижение на 9% через 72 ч после последней инъекции по сравнению с контрольной группой животных. В четверохолмии обнаружено повышение активности КПЕ на 36% через 24 ч и снижение на 112% через 72 чпо сравнению с контролем.
Так же выявлено снижение активности КПЕ через 72 ч после последней инъекции препарата в продолговатом мозге на 27% и надпочечниках на 119% по сравнению с контролем. Активность КПЕ в амигдале снижалась по сравнению с контрольной группой животных на 44% и 14% через 24 и 72 ч соответственно.
Заключение. Полученные результаты свидетельствуют о наличии общих тенденций изменений активности КПЕ в условиях длительного режима введения применяемых нейрометаболических стимуляторов: наименее выраженная активность изученного фермента отмечалась в надпочечниках, наиболее высокая активность наблюдалась в гипофизе. В порядке уменьшения влияния на активность КПЕ в гипофизе на этапе выведения из эксперимента крыс путем декапитации через 24 ч после последней инъекции ноотропные препараты можно расположить в следующем ряду: пирацетам, фенотропил, ноопепт.
Выводы. 1. Среди изученных отделов нервной ткани крыс наименьшая активность КПЕ выявлена в надпочечниках. 2. Изменение активности КПЕ в гипофизе в опытной группе крыс, по сравнению с контрольной, на этапе их выведения из эксперимента через 24 ч после последней инъекции путем декапитации наблюдалось в сторону увеличения при введении пирацетама и фенотропила, и в сторону уменьшения - при введении ноопепта. 3. Наиболее выраженное влияние на активность КПЕ оказал пирацетам.
Список литературы Активность карбоксипептидазы Е при длительном действии ноотропных препаратов
- Белоусов Ю.Б., Мухина М.А. 2005. Фенотропил -ноотропный препарат нового поколения//Качественная клиническая практика. № 3. С. 1-9.
- Вернигора А.Н. 2010. Влияние потребления этанола на активность карбоксипептидазы Н и ангиотензинпревращающего фермента в некоторых отделах мозга крыс с различной устойчивостью к стрессу//Известия ПГПУ им. В.Г. Белинского. Естественные науки. № 17 (21). С. 101-103.
- Золотарева Н.В. 2011. Регуляция каталитической активности алкогольдегидрогеназы фармакологическими препаратами Пирацетам, Зорекс и Унитиол: дис. … канд. биол. наук. Тверь. 189 с.
- Коваленко Л.П., Смольникова Н.М., Алексеева С.В., Немова Е.П., Сорокина А.В., Мирамедова М.Г., Курапова С.П., Сидорина Е.И., Кулакова А.В., Даугель-Дауге Н.О. 2002. Доклиническое изучение токсичности ноопепта//Экспериментальная и клиническая фармакология. Т. 65. № 1. С. 62-64.
- Лапина Г.П., Золотарева Н.В. 2009. Пирацетам -регулятор каталитической активности алкогольдегидрогеназы печени лошади//Вестн. ТвГУ. Сер.: Биология и экология. Вып.11. № 2. С. 56-62.
- Назарова Г.А., Золотов Н.Н., Крупина Н.А., Крайнева Н.А., Гарибова Т.Л., Воронина Т.А. 2007. Изменение активности пролинспецифических пептидаз при экспериментальном моделировании ретроградной амнезии//Экспериментальная и клиническая фармакология. Т. 70. № 6. С. 6-8.
- Руководство по лабораторным животным и альтернативным моделям в биомедицинских исследованиях. 2010/под ред. Н.Н. Каркищенко, С.В. Грачева. М.: Профиль -2С. 358 с.
- Fricker L.D. 1991. Peptide processing exopeptidases: amino-and carboxypeptidases involved with peptide biosynthesis//Peptide biosynthesis and processing (Fricker L.D. ed.), CRC Press, Boca Raton, Florida. P. 199-230.
- Lowry O.H., Rosebrought N.J., Farr A.G., Randall R.J. 1951. Protein measurement with the Folin phenol reagent//J. Biol. Chem. V. 193. № 1. Р. 265-275.
- Scholzen T.E., König S., Fastrich M., Böhm M., Luger T.A. 2007. Terminating the stress: peripheral peptidolysis of proopiomelanocortin-derived regulatory hormones by the dermal microvascular endothelial cell extracellular peptidases neprilysin and angiotensin-converting enzyme//Endocrinology. V. 148. № 6. P. 2793-2805.
- Supattapone S., Fricker L.D., Snyder S.H. 1984. Purification and characterization of a membrane-bound enkephalin-forming carboxypeptidase, “enkephalin convertase”//Neurochem. V. 42. № 4. P. 1017-1023.


