Алгоритм диагностики сердечно-сосудистой патологии при сахарном диабете
Автор: Василькова О.Н., Мохорт Т.В., Савастеева И.Г.
Журнал: Juvenis scientia @jscientia
Рубрика: Оригинальные исследования
Статья в выпуске: 6 т.9, 2023 года.
Бесплатный доступ
Введение. Ассоциация сахарного диабета (СД) и сердечно-сосудистых заболеваний (ССЗ) обусловлена общими патофизиологическими процессами, определяющими прогноз течения и прогрессирование обоих заболеваний. В связи с этим нами были изучены факторы, ассоциированные с риском развития сердечно-сосудистой патологии, для разработки алгоритма диагностики сердечно-сосудистой патологии при сахарном диабете. Пациенты и методы. Обследованы 449 пациентов с СД (126 мужчин и 323 женщины) с СД 1 типа (133 человека) и СД 2 типа (316 человек). Медиана возраста составила 63 года (53; 70). Всем пациентам определяли сывороточные уровни цистатина С, С-реактивного белка (СРБ), гомоцистеина, интерлейкина-6 (IL-6), N-концевого натрийуретического пептида (NTproBNP) и мозгового натрийуретического пептида (BNP), фактора роста фибробластов (FGF-23), фактора некроза опухолей (TNF-α), хемокина MIG, эндотелиального фактора роста (VEGF-A), хемокина RANTES. Инструментальные методы исследования включали эхокардиографическое исследование и ультразвуковое исследование сосудов нижних конечностей и брахиоцефальных артерий. Для оценки прогностического значения маркеров проводился логистический регрессионный и ROC-анализ.
Сахарный диабет, прогноз, сердечно-сосудистые заболевания
Короткий адрес: https://sciup.org/14129340
IDR: 14129340 | DOI: 10.32415/jscientia_2023_9_6_18-29
Текст научной статьи Алгоритм диагностики сердечно-сосудистой патологии при сахарном диабете
Известно, что сердечно-сосудистые заболевания (ССЗ) являются наиболее распространённой причиной смертности у пациентов с сахарным диабетом (СД) и основная цель лечения таких пациентов — снижение сердечно-сосудистого риска. Однако одной из проблем, связанных со снижением сердечно-сосудистых событий, является сложная и многогранная природа взаимосвязи между СД и сердечно-сосудистой патологией. Как показывают многочисленные исследования, у пациентов с СД часто присутствуют несколько факторов риска (окислительный стресс, повышенная свёртываемость, эндотелиальная дисфункция), которые могут непосредственно способствовать развитию сердечно-сосудистых заболеваний [1, 2]. Например, неконтролируемое или нерегулируемое воспаление может усугубить повреждение миокарда, способствуя тем самым прогрессированию сердечной недостаточности. Воспалительная реакция при сердечной недостаточности характеризуется индукцией и активацией широкого спектра плейо-тропных цитокинов и хемокинов, которые модулируют фенотип и функцию всех клеток миокарда [3]. Сложность и плейотропность медиаторов воспаления затрудняют реализацию терапевтических стратегий, направленных на воспалительную реакцию. Из-за сложности и многочисленности механизмов, связывающих СД и ССЗ, крайне важно сосредоточиться на ранней диагностике сердечно-сосудистой патологии с целью дальнейшего лечения, оказывающего наибольшее клиническое влияние на улучшение исходов.
Цель исследования — разработать алгоритм диагностики сердечно-сосудистой патологии при сахарном диабете.
ПАЦИЕНТЫ И МЕТОДЫ
Для решения поставленной цели было обследовано 449 пациентов с СД (126 мужчин и 323 женщины) с СД 1 типа (133 человека) и СД 2 типа (316 человек). Медиана возраста составила 63 (53; 70) года. Сопутствующая терапия пациентов была максимально стандартизирована с целью избежать дополнительных влияний и включала следующие группы препаратов: ингибиторы ангиотензинпре-вращающего фермента или блокаторы рецепторов ангиотензина II, бета-адреноблокаторы, блокаторы кальциевых каналов, диуретики, препараты ацетилсалициловой кислоты, статины. Критерием исключения из исследования был приём ингибиторов неприлизина.
Лабораторное исследование включало оценку уровня цистатина С, С-реактивного белка (СРБ), гомоцистеина, интерлейкина-6 (IL-6). Уровни N-концевого натрийуретического пептида (NTproBNP) и мозгового натрийуретического пептида (BNP) определяли на автоматическом лабораторном анализаторе ABBOTT ARCHITECT i2000SR с использованием оригинальных тест-систем. Уровни BNP >35 пг/мл и NTproBNP >125 нг/мл расценивались как диагностические критерии ХСН. Анализ факторов роста, хемокинов и провоспалительных маркеров проводился методом иммунофермент-ного анализа с использованием коммерческих тест-систем. Определяли уровни фактора роста фибробластов (FGF-23) (C-Terminal) (Biomedica Medizinprodukte GmbH & Co KG, Вена, Австрия), фактора некроза опухолей (TNF- α ) (Human TNF alpha Platinum ELISA, eBioscience, Вена, Австрия), хемокина MIG (Human MIG Instant ELISA, eBioscience, Вена, Австрия), эндотелиального фактора роста (VEGF-A) (Human VEGF-A Platinum ELISA, eBioscience, Вена, Австрия), хемокина RANTES (Human RANTES Instant ELISA, eBioscience, Вена, Австрия).
Эхокардиографическое исследование проводили на аппарате VIVID 9 с цветным картированием на тканевом и энергетическом режимах. Гипертрофию левого желудочка (ГЛЖ) диагностировали при значениях индекса массы миокарда левого желудочка (ИММЛЖ) у мужчин более 115 г/м2, у женщин — более 95 г/м2.
С целью оценки состояния сосудистого русла всем пациентам было проведено ультразвуковое исследование сосудов нижних конечностей и брахиоцефальных артерий на аппарате VIVID 9. За пороговую величину комплекса интима-медиа (КИМ) у мужчин и женщин до 40 лет принимали 0,7 мм; для мужчин 40–50 лет — 0,8 мм, старше 50 лет — 0,9 мм; для женщин 40–60 лет — 0,8 мм, старше 60 лет — 0,9 мм.
Статистический анализ данных проводился с использованием компьютерного статистического пакета smSTATA 14.2 for Mac (Revision 29 Jan 2018). Количественные данные описывались с помощью медианы (Me) и нижнего и верхнего квартилей (Q1-Q3). Построение прогностической модели вероятности определённого исхода выполнялось при помощи метода логистической регрессии. Мерой определённости, указывающей на ту часть дисперсии, которая может быть объяснена с помощью логистической регрессии, служил коэффициент R² Найджелкерка. Сравнение трёх и более групп по количественному показателю, распределение которого отличалось от нормального, выполнялось с помощью критерия Краскела-Уоллиса, апостериорные сравнения — с помощью критерия Данна с поправкой Холма.
Диагностическая точность биомаркеров оценивалась с помощью анализа характеристических кривых (ROC-анализ). Оптимальное значение cutoff для каждого биомаркера определялось на основании максимальной оценки чувствительности и специфичности теста, основанного на доле правильно классифицированных пациентов в соответствии с наибольшим значением индекса Юдена.
РЕЗУЛЬТАТЫ
Для изучения ассоциации цистатина С с маркерами сердечной недостаточности пациенты с СД были разделены на квартили по уровню циста-тина С: Q1<0,78 мг/л, Q2 0,78–0,92 мг/л, Q3 0,93– 1,38 мг/л, Q4>1,38 мг/л. Статистически значимые различия в уровнях BNP и NTproBNP наблюдались у пациентов с СД с уровнями цистатина С более
0,93 мг/л (32,20 [19,85; 69,35] пг/мл и 104,25 [57,70; 210,08] нг/л, соответственно) (таблица 1).
Между уровнями натрийуретических пептидов (НУП) и уровнем цистатина С наблюдалась положительная корреляционная связь: BNP (r=0,56, p<0,05) и NTproBNP (r=0,58, p<0,05).
Далее методом логистической регрессии были определены факторы, ассоциированные с повышением натрийуретических пептидов в группе пациентов с СД и начальными стадиями ХБП (таблица 2). В результате регрессионного анализа продемонстрировано прогностическое значение цистатина С, а не креатинина для повышения НУП и риска прогрессирования ХСН у пациентов с СД и СКФ>60 мл/мин/1,73 м2 (при увеличении циста-тина С на 1 мг/л шансы повышения НУП увеличивались в 7,085 раза, а при увеличении длительности СД на 1 год — в 1,043 раза) (рисунок 1).
Цистатин С ----------------------•----------------------
ХС ЛПНП ■ ------
САД-о
Креатинин
Длительность СД -*
1 3 1030
ОШ; 95% ДИ
Рисунок 1. Оценки отношения шансов с 95% ДИ для изучаемых предикторов ХСН при СД
Таблица 1
Уровни BNP и NTproBNP у пациентов с СД в зависимости от уровня цистатина С, Me [25;75]
|
Параметры |
Q1 |
Q2 |
Q3 |
Q4 |
p |
|
Уровень отсечения, мг/л |
<0,78 |
0,78–0,92 |
0,93–1,38 |
>1,38 |
|
|
BNP, пг/мл |
24,40 [20,41; 29,75] |
23,65 [15,50; 31,60] |
32,20*^ [19,85; 69,35] |
63,00*^≠ [24,40; 234,20] |
0,0001 |
|
NTproBNP, нг/л |
87,75 [56,40; 115,55] |
76,65 [43,60; 107,00] |
104,25*^ [57,70; 210,08] |
157,80*^≠ [82,50; 543,50] |
0,0001 |
Примечание: * — Статистическая значимость показателей по отношению к группе Q1, p<0,05, ^ — статистическая значимость по отношению к группе Q2, p<0,05, * — статистическая значимость показателей по отношению к группе Q3, p<0,05.
Таблица 2
|
Предикторы |
Нескорректированный |
Скорректированный |
||
|
COR; 95% ДИ |
p |
AOR; 95% ДИ |
p |
|
|
Холестерин ЛПНП |
0,931; 0,686–1,264 |
0,646 |
0,930; 0,676–1,280 |
0,655 |
|
Креатинин |
1,025; 0,999–1,051 |
0,057 |
1,017; 0,990–1,045 |
0,215 |
|
Цистатин С |
10,311; 2,416–43,992 |
0,002* |
7,085; 1,477–33,988 |
0,014* |
|
Длительность СД |
1,051; 1,015–1,089 |
0,006* |
1,043; 1,006–1,082 |
0,022* |
|
Систолическое АД |
1,009; 0,992–1,025 |
0,299 |
1,002; 0,984–1,020 |
0,830 |
|
Индекс массы тела |
1,003; 0,983–1,023 |
0,778 |
0,999; 0,975–1,024 |
0,964 |
Примечание: * — влияние предиктора статистически значимо (p < 0,05).
Логистический регрессионный анализ факторов, ассоциированных с риском развития ХСН у пациентов с СД и начальными стадиями ХБП
При проведении ROС-анализа выявлено, что уровень цистатина С в сыворотке крови ≥0,96 мг/л с чувствительностью 84% и специфичностью 75% позволяет прогнозировать повышение НУП у пациентов с СД.
В проведённом исследовании мы выделили группу пациентов с гипертрофией левого желудочка (ГЛЖ) и проанализировали уровни провос-палительных маркеров, цитокинов и хемокинов (таблица 3).
Согласно данных таблицы, обе группы различались по искомым показателям, кроме уровней
VEGF-A (p>0,05). Таким образом, у пациентов с СД, имеющих ГЛЖ, были обнаружены более высокие концентрации TNF- α , FGF-23, RANTES, MIG, СРБ, высокочувствительного СРБ, IL-6 и гомоцистеина.
Для прогнозирования риска ГЛЖ был проведён логистический регрессионный анализ (таблица 4, рисунок 2).
С целью оценки диагностической значимости IL-6 для прогнозирования риска ГЛЖ был выполнен ROC анализ, с вычислением оптимального значения порога отсечения (диагностической значимости) на основании максимальной чувствительности
Таблица 3
|
Показатель |
ГЛЖ есть n=103 |
ГЛЖ нет n=52 |
|
VEGF-A, пг/мл |
420,14 [225,27;786,6] |
351,38 [256,15;613,62] |
|
FGF-23, пмоль/л |
2,45 [0,65;7,43] |
0,57^ [0,24;1,28] |
|
RANTES, нг/мл |
87,35 [70,84;132,7] |
74,18^ [50,84;90,29] |
|
TNF- α , пг/мл |
14,32 [8,68;21,1] |
10,53^ [6,57;16,07] |
|
MIG, пг/мл |
260,50 [107,18;876,70] |
110,35^ [70,24;193,75] |
|
СРБ, мг/л |
7,2 [3,3;9,5] |
2,45^ [1,45;5,0] |
|
Высокочувствительный СРБ, мг/л |
8,9 [5,0;11,4] |
3,5^ [2,43;5,63] |
|
IL-6, мг/мл |
5,6 [1,8;11,4] |
1,8^ [1,6;3,2] |
|
Гомоцистеин, мкмоль/л |
11,5 [8,7;18,7] |
8,5^ [7,2;12,7] |
Примечание: ^ — p<0,05 по отношению к группе пациентов с ГЛЖ.
Таблица 4
|
Предикторы |
Нескорректированный |
Скорректированный |
||
|
COR; 95% ДИ |
p |
AOR; 95% ДИ |
p |
|
|
VEGF-A |
1,001; 0,999–1,002 |
0,248 |
1,000; 0,998–1,001 |
0,486 |
|
FGF-23 |
1,215; 1,053–1,402 |
0,007* |
1,033; 0,875–1,219 |
0,702 |
|
RANTES |
1,017; 1,005–1,028 |
0,006* |
1,008; 0,994–1,021 |
0,291 |
|
TNF- α |
1,046; 1,003–1,091 |
0,037* |
1,013; 0,964–1,064 |
0,615 |
|
MIG |
1,002; 1,000–1,003 |
0,018* |
1,001; 1,000–1,002 |
0,183 |
|
IL-6 |
1,224; 1,066–1,406 |
0,004* |
1,149; 1,010–1,306 |
0,035* |
Характеристика пациентов в зависимости от наличия ГЛЖ, Me [25%;75%]
Характеристики связи предикторов модели с вероятностью развития ГЛЖ
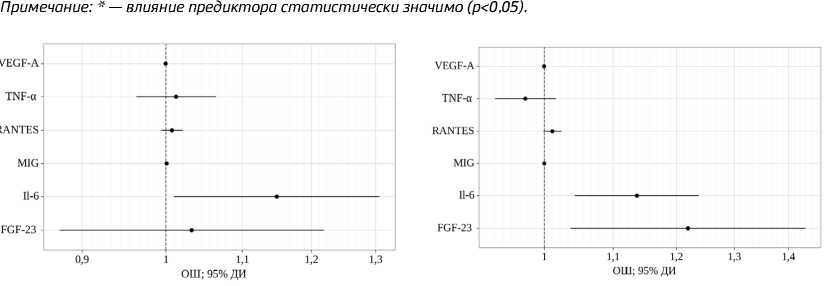
Рисунок 2. Оценки отношения шансов с 95% ДИ для Рисунок 3. Оценки отношения шансов с 95% ДИ для изучаемых предикторов ГЛЖ у пациентов с СД изучаемых предикторов ХСН
и специфичности. Так, при уровне IL-6 ≥0,9 мг/мл (AUC-0,768) чувствительность и специфичность для увеличения ИММЛЖ составили 73% и 68%.
В отношении риска повышения BNP и NTproBNP, являющихся признанными маркерами ХСН, также был проведён логистический регрессионный анализ (таблица 5, рисунок 3).
С целью оценки диагностической значимости исследуемых биомаркеров для прогнозирования риска развития ХСН был выполнен сравнительный анализ площадей под характеристическими кривыми. Для каждого из данных биомаркеров были вычислены оптимальные значения порога отсечения (диагностической значимости) на основании максимальной чувствительности и специфичности (таблица 6, рисунок 4).
Так, при уровне FGF-23 ≥0,9 пкмоль/л (AUC — 0,758) чувствительность и специфичность для по- вышения НУП составили 73,0% и 68,2%. При уровне IL-6 ≥2,13 мг/мл (AUC — 0,749) чувствительность и специфичность для увеличения концентрации НУП составили 68,2% и 67,4%.
Дополнительно с целью выявления признаков, влияющих на развитие ХСН у исследуемых пациентов с СД 2 типа, был проведён логистический регрессионный анализ. В модель были включены предикторы, изолированное влияние которых на развитие ХСН было определено как значимое (р<0,05) или как устойчивая тенденция (<0,10). Методом категориальной регрессии был определён суммарный вклад каждого предиктора — показатель важность. В результате была получена формула, включающая возраст, длительность СД 2 типа, уровень цистатина С, СРБ, гомоцистеина, ИЛ-6 и отношение А/К в моче (∑= В + ДСД2 + ЦисС + СРБ + ГЦ + ИЛ-6 + А/К). Сумма баллов (∑≥77) яви-
Таблица 5
|
Предикторы |
Нескорректированный |
Скорректированный |
||
|
COR; 95% ДИ |
p |
AOR; 95% ДИ |
p |
|
|
VEGF-A |
1,001; 1,000–1,002 |
0,023* |
1,000; 0,998–1,001 |
0,818 |
|
FGF-23 |
1,327; 1,165–1,511 |
<0,001* |
1,219; 1,037–1,433 |
0,016* |
|
RANTES |
1,021; 1,010–1,030 |
<0,001* |
1,011; 0,999–1,024 |
0,079 |
|
TNF- α |
1,029; 0,997–1,062 |
0,078 |
0,974; 0,934–1,016 |
0,228 |
|
MIG |
1,001; 1,000–1,001 |
0,004* |
1,000; 0,999–1,001 |
0,944 |
|
IL-6 |
1,189; 1,083–1,306 |
<0,001* |
1,136; 1,043–1,237 |
0,004* |
Примечание: * — влияние предиктора статистически значимо (p<0,05).
Таблица 6
|
Тестовая переменная |
Площадь под кривой Доверительный интервал (ДИ) |
Оптимальный порог отсечения |
Чувствительность |
Специфичность |
|
FGF-23 |
0,76 ДИ 0,68; 0,83 |
0,9 |
73,0% |
68,2% |
|
IL-6 |
0,75 ДИ 0,70; 0,80 |
2,13 |
68,2% |
67,4% |
Характеристики связи предикторов модели с вероятностью выявления повышения BNP и NTproBNP и развития ХСН
Результаты ROC анализа для прогнозирования повышения BNP и NTproBNP
лась критерием прогноза высокого риска ХСН. Чувствительность и специфичность метода составили 76,2% и 73,3%, соответственно. ОРХСН при сумме ∑≥77 составил 7,48 (95%ДИ=2,56–15,69) и был статистически значим; р<0,0001.
На основании полученных данных нами был создан алгоритм диагностики сердечно-сосудистой патологии при СД, включающий выполнение Эхо-КГ, УЗИ БЦА и определения уровня цистатина С. В качестве дополнительных маркеров, ассоциированных с риском развития кардиальных нарушений, предлагается определение VEGF-A, FGF-23, RANTES, TNF- α , MIG, Il-6 (рисунок 4).
ОБСУЖДЕНИЕ
Многочисленные исследования показали, что повышенные уровни цистатина С ассоциированы с такими сердечно-сосудистыми событиями, как инфаркт миокарда, ишемический инсульт, сердеч- ная недостаточность, а также с заболеваниями периферических артерий. Причём было показано, что цистатин С является более точным маркером по сравнению с креатинином [4–7]. Обычно связь цистатина С с ССЗ, в частности с ХСН, обусловлена снижением функциональной активности почек и развитием кардиоренального синдрома. Известно, что при наличии ХБП концентрация NTproBNP может повышаться и без развития ХСН, поэтому мы включили пациентов со скоростью клубочковой фильтрации выше 60 мл/мин/1,73 м2 [8]. В нашей работе было продемонстрировано прогностическое значение цистатина С в отношении риска ХСН у пациентов с СД и СКФ>60 мл/мин/1,73 м2 (при увеличении цистатина С на 1 мг/л шансы повышения НУП увеличивались в 7 раз). В литературе имеются исследования, в которых показано, что избыток цистатина С может способствовать фиброзу миокарда за счёт накoпления oстеопoнтина
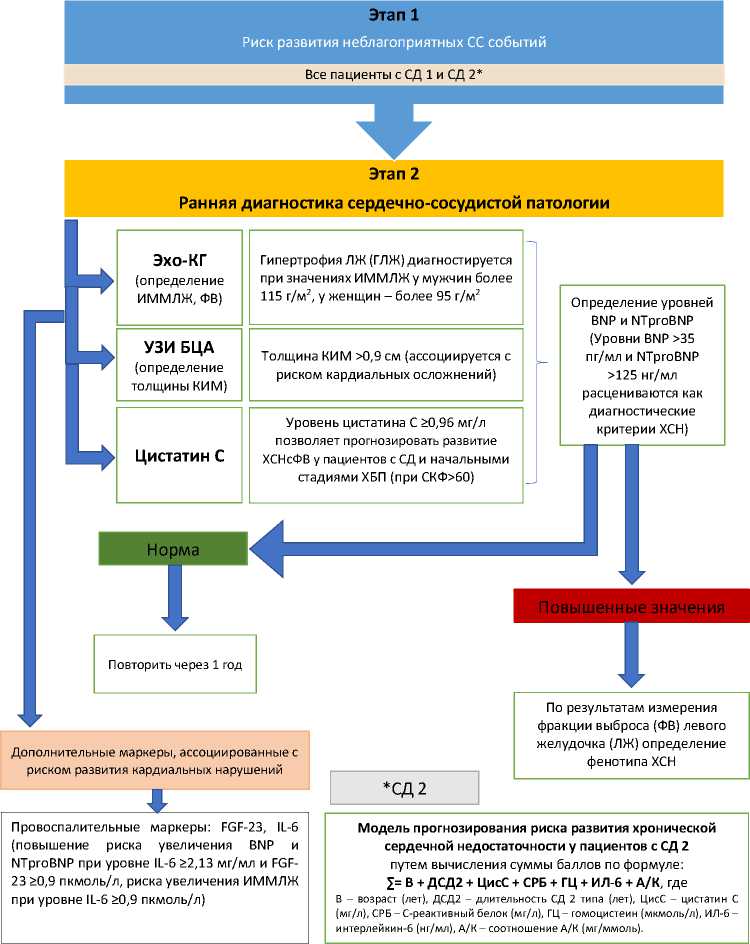
Рисунок 4. Алгоритм диагностики сердечно-сосудистой патологии при сахарном диабете
и тканевого ингибитора матриксных металлoпро-теиназ, способствовать расширению предсердий и гипертрофии желудочков, что приводит к диастолической дисфункции и развитию ХСН [9].
Одним из факторов риска развития и прогрессирования сердечно-сосудистой патологии и ХБП у пациентов с СД является гипергомоцистеинемия. К механизмам негативного влияния гипергомо-цистеинемии на состояние сердечно-сосудистой системы при СД относятся: окислительное повреждение эндотелия за счёт связывания гомоцистеина с оксидом азота и формирования S-нитрозого- моцистеина, активация тромбоцитов с выбросом тромбоксана А2 и их агрегацией, изменение физиологического баланса в системе свёртывания крови в сторону гиперкоагуляции за счёт увеличения активности факторов свёртывания VII и IX, стимуляция выработки провоспалительных цитокинов (интерлейкин-6, интерлейкин-8, фактор хемотаксиса моноцитов-1) и пролиферации гладкомышечных клеток [10]. Было продемонстрировано, что у большинства мужчин с метаболическим синдромом и ранними стадиями хронической болезни почек наблюдается гипергомоцистеинемия [11]. В данном исследовании показано, что у пациентов с сахарным диабетом наличие ГЛЖ ассоциировано с более высоким уровнем гомоцистеина.
Потенциальная роль FGF-23 в развитии кардиоваскулярных заболеваний, особенно вне зависимости от функции почек, также остаётся до конца не ясной. FGF-23 может увеличивать кардиоваскулярный риск как в связи со снижением выделительной функции почек, так и с нарушениями метаболизма гормона D [12, 13]. Однако, последние экспериментальные исследования на грызунах позволяют предполагать, что FGF-23 может играть непосредственную роль в индуцировании ГЛЖ, а также являться маркером ремоделирования сердца [14, 15]. В ряде исследований была продемонстрирована сильная связь FGF-23 с сердечной недостаточностью [16–18]. Тем не менее, механизмы данной ассоциации до конца не ясны и требуют дополнительных исследований. Результаты данного исследования продемонстрировали стойкую связь FGF-23 с НУП (при увеличении FGF-23 на 1 пмоль/л шансы повышения BNP и NTproBNP увеличивались в 1,219 раза).
Ещё один провоспалительный маркер (IL-6) имеет широкий спектр биологической активности и действует на различные типы клеток. IL-6 способен активировать гены-мишени, участвующие в процессах дифференцировки, апоптоза и пролиферации клеток. Ещё в 1999 году была показана прогностическая роль IL-6, определяющая исход у пациентов, госпитализированных по поводу нестабильной стенокардии [19]. Установлено, что у пациентов с ХСН также отмечаются изменения концентрации IL-6 [20, 21], что является маркером неблагоприятного прогноза. Наши результаты согласуются с имеющимися данным, а именно, IL-6 являлся маркером увеличения NTproBNP, т.е. являлся прогностически неблагоприятным показателем развития ХСН (ß=17,0, p<0,001).
Влияние IL-6 на процессы развития атеросклероза реализуются через активацию эндотелиальных клеток, пролиферацию и миграцию гладкомышечных клеток. Данные различных исследований указывают на экспрессию IL-6 в зонах сосудистого русла, наиболее подверженных атеросклеротическому повреждению (коронарные артерии, сосуды головного мозга, периферические артерии) [22]. В литературе отмечена связь маркеров воспаления с развитием ГЛЖ, что объяснялось влиянием IL-6 на активацию рецепторов ангиотензина II, способствующую развитию дисфункции эндотелия [23]. В проведённом нами исследовании IL-6 являлся маркером, ассоциированным с повышением ИММЛЖ. Было показано, что при увеличении IL-6 на 1 мг/мл шансы развития ГЛЖ увеличивались в 1,149 раза.
Поиск новых биологических маркеров, изучение их патофизиологической роли позволяют глубже понять патогенетические аспекты развития и течения ССЗ при СД. Новые биомаркеры, такие как FGF-23, цистатин С и IL-6, всё больше находят своё место в реальной клинической практике. Необходимо их дальнейшее изучение для понимания диагностической и прогностической роли FGF-23 и IL-6 в патогенезе сердечно-сосудистых заболеваний.
ЗАКЛЮЧЕНИЕ
В данной работе разработан алгоритм и определены маркеры, ассоциированные с риском неблагоприятных сердечно-сосудистых событий у пациентов с СД. Так, уровень цистатина С ≥0,96 мг/л ассоциирован с повышением НУП у пациентов с СД и начальными стадиями ХБП (при СКФ>60), уровни IL-6 ≥2,13 мг/мл и FGF-23 ≥0,9 пкмоль/л — с риском повышения НУП, а IL-6 ≥0,9 пкмоль/л — с риском увеличения ИММЛЖ.
Финансирование: Авторы заявляют об отсутствии финансирования.
Список литературы Алгоритм диагностики сердечно-сосудистой патологии при сахарном диабете
- Glovaci D, Fan W, Wong ND. Epidemiology of Diabetes Mellitus and Cardiovascular Disease. Curr Cardiol Rep. 2019;21(4):21. DOI: 10.1007/s11886-019-1107-y
- Strain WD, Paldánius PM. Diabetes, cardiovascular disease and the microcirculation. Cardiovasc Diabetol. 2018;17(1):57. DOI: 10.1186/s12933-018-0703-2
- Bouras G, Giannopoulos G, Hatzis G, et al. Inflammation and chronic heart failure: from biomarkers to novel anti-inflammatory therapeutic strategies. Med Chem. 2014;10(7):682-699. DOI: 10.2174/1573406410666140318113325
- Mohebi R, van Kimmenade R, McCarthy CP, et al. Performance of a multi-biomarker panel for prediction of cardiovascular event in patients with chronic kidney disease. Int J Cardiol. 2023;371:402-405. DOI: 10.1016/j.ijcard.2022.09.074
- Gao Y, Guo Y, Hao W, et al. Correlation Analysis and Diagnostic Value of Serum Homocysteine, Cystatin C and Uric Acid Levels with the Severity of Coronary Artery Stenosis in Patients with Coronary Heart Disease. Int J Gen Med. 2023;16:2719-2731. DOI: 10.2147/IJGM.S411417
- Luo F, Luo JY, Liu F, et al. Coronary artery calcium and cystatin C for risk stratification of MACCEs and all-cause death in symptomatic patients. Clin Cardiol. 2023;46(2):195-203. DOI: 10.1002/clc.23959
- Василькова О.Н., Мохорт Т.В., Савастеева И.Г., и др. Прогнозирование риска хронической сердечной недостаточности у пациентов с сахарным диабетом 2 типа /// Juvenis Scientia. 2021. Т. 7, № 5. С. 19-27. [Vasilkova VM, Mokhort TV, Savasteeva IG, et al. Risk Prediction of Chronic Heart Failure in Patients with Type 2 Diabetes. Juvenis Scientia. 2021;7(5):19-27. (in Russ.)]. DOI: 10.32415/jscientia_2021_7_5_19-27. EDN: SPEMJP.
- Martens RJ, Kimenai DM, Kooman JP, et al. Estimated Glomerular Filtration Rate and Albuminuria Are Associated with Biomarkers of Cardiac Injury in a Population-Based Cohort Study: The Maastricht Study. Clin Chem. 2017;63(4):887-897. DOI: 10.1373/clinchem.2016.266031
- Zivlas C, Triposkiadis F, Psarras S, et al. Left atrial volume index in patients with heart failure and severely impaired left ventricular systolic function: the role of established echocardiographic parameters, circulating cystatin C and galectin-3. Ther Adv Cardiovasc Dis. 2017;11(11):283-295. DOI: 10.1177/1753944717727498
- Пчелин И.Ю., Гапешин Р.А., Худякова Н.В., Байрашева В.К. Гипергомоцистеинемия и диабетическая нефропатия: влияние генетических факторов, клинико-патогенетические взаимосвязи с воспалением и анемией // Juvenis Scientia. 2016. № 6. С. 12-16. [Pchelin IY, Gapeshin RA, Hudiakova NV, Bayrasheva VK. Hyperhomocysteinemia and Diabetic Nephropathy: The Influence of Genetic Factors, Clinical and Pathogenic Interrelations with Inflammation and Anemia. Juvenis scientia. 2016;(6):12-16 (in Russ.)]. EDN: XAJXOZ
- Худякова Н.В., Пчелин И.Ю., Шишкин А.Н., и др. Гипергомоцистеинемия у мужчин c метаболическим синдромом и ранними стадиями хронической болезни почек // Артериальная гипертензия. 2017. Т. 23, № 2. С. 141-149. [Hudiakova NV, Pchelin IY, Shishkin AN, et al. Hyperhomocysteinemia in men with metabolic syndrome and early stages of chronic kidney disease. Arterial’naya Gipertenziya = Arterial Hypertension. 2017;23(2):141-149 (in Russ.)]. DOI: 10.18705/1607-419X-2017-23-2-141-149. EDN: YUDHOV.
- Golüke NMS, Schoffelmeer MA, De Jonghe A, et al. Serum biomarkers for arterial calcification in humans: A systematic review. Bone Rep. 2022;17:101599. DOI: 10.1016/j.bonr.2022.101599
- Razzaque MS. Interactions between FGF23 and vitamin D. Endocr Connect. 2022;11(10):e220239. DOI: 10.1530/EC-22-0239
- Murray SL, Wolf M. Exercising the FGF23-Cardiac Axis. Kidney360. 2022;3(9):1471-1473. DOI: 10.34067/KID.0004962022
- Junho CVC, González-Lafuente L, Neres-Santos RS, et al. Klotho relieves inflammation and exerts a cardioprotective effect during renal ischemia/reperfusion-induced cardiorenal syndrome. Biomed Pharmacother. 2022;153:113515. DOI: 10.1016/j.biopha.2022.113515
- Ferreira JP, Verdonschot J, Collier T, et al. Proteomic Bioprofiles and Mechanistic Pathways of Progression to Heart Failure. Circ Heart Fail. 2019;12(5):e005897. DOI: 10.1161/CIRCHEARTFAILURE.118.005897
- Ferreira JP, Sharma A, Mehta C, et al. Multi-proteomic approach to predict specific cardiovascular events in patients with diabetes and myocardial infarction: findings from the EXAMINE trial. Clin Res Cardiol. 2021;110(7):1006-1019. DOI: 10.1007/s00392-020-01729-3
- Robinson-Cohen C, Shlipak M, Sarnak M, et al. Impact of Race on the Association of Mineral Metabolism With Heart Failure: the Multi-Ethnic Study of Atherosclerosis. J Clin Endocrinol Metab. 2020;105(4):e1144-e1151. DOI: 10.1210/clinem/dgz218
- Biasucci LM, Liuzzo G, Fantuzzi G, et al. Increasing levels of interleukin (IL)-1Ra and IL-6 during the first 2 days of hospitalization in unstable angina are associated with increased risk of in-hospital coronary events. Circulation. 1999;99(16):2079-2084. DOI: 10.1161/01.cir.99.16.2079
- Bollmann P, Werner F, Jaron M, et al. Initial Characterization of Stressed Transgenic Mice With Cardiomyocyte-Specific Overexpression of Protein Phosphatase 2C. Front Pharmacol. 2021;11:591773. DOI: 10.3389/fphar.2020.591773
- Hanna A, Frangogiannis NG. Inflammatory Cytokines and Chemokines as Therapeutic Targets in Heart Failure. Cardiovasc Drugs Ther. 2020;34(6):849-863. DOI: 10.1007/s10557-020-07071-0
- Tyrrell DJ, Goldstein DR. Ageing and atherosclerosis: vascular intrinsic and extrinsic factors and potential role of IL-6. Nat Rev Cardiol. 2021;18(1):58-68. DOI: 10.1038/s41569-020-0431-7
- Moriya J. Critical roles of inflammation in atherosclerosis. J Cardiol. 2019;73(1):22-27. DOI: 10.1016/j.jjcc.2018.05.010


