Алгоритм персонализации диетотерапии пациентов с фибрилляцией предсердий и ожирением на основе комплексной оценки фактического питания и метаболического статуса
Автор: Романова Т.А., Богданов А.Р., Федулаев Ю.Н.
Журнал: Сибирский журнал клинической и экспериментальной медицины @cardiotomsk
Рубрика: Клинические исследования
Статья в выпуске: 1 т.39, 2024 года.
Бесплатный доступ
Цель: разработать алгоритм индивидуальной коррекции химического состава и энергетической ценности диетотерапии пациентов с ожирением и фибрилляцией предсердий (ФП) на основе оценки метаболического статуса.Материал и методы. В исследование включены 100 пациентов с ожирением III степени и пароксизмальной формой ФП. У всех обследуемых была неклапанная ФП. Проведены оценка антропометрических параметров, фактического питания, биоимпедансный анализ состава тела, основного обмена (ОО).Результаты. Выявлены изменения ОО по половой принадлежности: у женщин - снижение скорости окисления углеводов (СОУ) (на 27,69 ± 12,2%; р
Диетотерапия, ожирение, метаболический статус, биоимпедансометрия, основной обмен, фибрилляция предсердий
Короткий адрес: https://sciup.org/149144792
IDR: 149144792 | УДК: 616.12-008.313.2:616-056.257]-08:615.874.2 | DOI: 10.29001/2073-8552-2024-39-1-94-105
Текст научной статьи Алгоритм персонализации диетотерапии пациентов с фибрилляцией предсердий и ожирением на основе комплексной оценки фактического питания и метаболического статуса
УДК 616.12-008.313.2:616-056.257]-08:615.874.2
Романова Т.А., Богданов А.Р., Федулаев Ю.Н. Алгоритм персонализации диетотерапии пациентов с фибрилляцией предсердий и ожирением на основе комплексной оценки фактического питания и метаболического статуса. Сибирский журнал клинической и экспериментальной медицины. 2024;39(1):94–105.
Фибрилляция предсердий (ФП) – один из наиболее распространенных типов нарушений ритма сердца [1]. Ведущими факторами риска ФП считаются пожилой возраст, артериальная гипертензия (АГ) [2], сахарный диабет (СД) [3], сердечная недостаточность (СН), ишемическая болезнь сердца (ИБС) [4], хроническая болезнь почек (ХБП) [5], ожирение [6] и синдром обструктивного апноэ сна (СОАС) [7]. Перечисленные факторы ремоделирования миокарда сердца и триггеров ФП имеют алиментарно-зависимую основу, характеризующую нерегулярное, неполноценное питание человека.
В последние годы существенное значение в этиопа-тогенезе ФП придается ожирению [8]. Установлена четкая зависимость типа «доза-реакция» между индексом массы тела (ИМТ) и ФП – при увеличении ИМТ на 1 кг/м2 риск ФП возрастает на 3,0–4,7% [9]. По другим данным, значения окружности талии и общей жировой массы были ассоциированы с увеличением риска ФП на 13–16% в течение 10 лет наблюдения [10].
Согласно современным представлениям, профилактика развития избыточной массы тела и ожирения является мощным превентивным инструментом возникновения суправентрикулярных нарушений ритма, включая ФП. Редукция массы тела у лиц с ожирением и ФП может иметь потенциал самостоятельного терапевтического подхода для уменьшения частоты рецидивов пароксизмальной ФП, снижения медикаментозной нагрузки и оптимизации условий для проведения электрофизиологических процедур [11].
При этом в обсуждаемой научной области имеется ряд нерешенных вопросов. Так, диеты, широко используемые для редукции массы тела при ожирении, такие как низкоуглеводная, высокобелковая и кетогенная, не могут быть рекомендованы для лечения больных с ФП, ввиду их высокого триггерного потенциала для нарушений ритма сердца. Средиземноморская диета, являющаяся «золотым стандартом» диетотерапии больных с сердечно-сосудистыми заболеваниями, снижает риск развития суправентрикулярных нарушений ритма, включая ФП, однако ее эффективность в отношении редукции массы тела существенно ниже иных диетологических подходов.
Наибольший потенциал алиментарного фактора и диетотерапии ФП имеет подход, основанный на индивидуальных физиологических потребностях пациента в пищевых веществах и энергии, учитывающий принципы Средиземноморской системы питания, редукцию суточной калорийности преимущественно за счет квоты жиров с ограничением продуктов с триггерным потенциалом и обогащением кардиопротективными компонентами. Разработка диетотерапии на основе алгоритмов индивидуальной коррекции химического состава и энергетической ценности больных с ФП требует изучения показателей метаболического статуса, что и явилось целью настоящего исследования.
Материал и методы
В исследовании приняли участие 100 пациентов с пароксизмальной формой ФП и ожирением III степени. Работа выполнена на базе кардиологического отделения для больных инфарктом миокарда ГБУЗ «Городская клиническая больница № 13 Департамента здравоохранения города Москвы», которая является клинической базой кафедры факультетской терапии педиатрического факультета ФГАОУ ВО РНИМУ им. Н.И. Пирогова Минздрава России. От всех пациентов было получено письменное информированное согласие на участие в исследовании. Клиническое исследование в рамках выполнения диссертационной работы было одобрено комитетом по этике ФГАОУ ВО РНИМУ им. Н.И. Пирогова Минздрава России (протокол № 222 от 17.10.2022 г.).
Критериями включения в исследование служили возраст старше 18 лет, наличие пароксизмальной формы ФП, ИМТ более 40 кг/м2, отсутствие патологии щитовидной железы (подтвержденное анамнестическими данными, результатами гормонального профиля (ТТГ, Т3 св., Т4 св., АТ ТПО) и ультразвуковым исследованием щитовид- ной железы, наличие подписанного информированного согласия на участие в исследовании.
Критериями исключения из исследования были анемия, лихорадка, обострение хронического заболевания, хроническая почечная недостаточность, острая и/или декомпенсированная хроническая сердечно-сосудистая патология.
Все пациенты с ФП получали оптимальную медикаментозную терапию, включающую бета-блокаторы, анти-аритмики (по показаниям), ингибиторы АПФ или блокаторы рецепторов ангиотензина II, антикоагулянты.
Состав выборки по полу характеризовался наличием 53% ( n = 53) мужчин и 47% ( n = 47) женщин. Средний возраст обследованных больных составил 68,1 ± 10,3 лет. 69 обследованных больных (69%) были госпитализированы с первые выявленным пароксизмом ФП в жизни, у 31 пациента (31%) госпитализация на момент обследования была повторной.
В обеих группах при выполнении антропометрии определяли показатели массы тела, роста, обхват талии (ОТ) и обхват бедер (ОБ), расчет ИМТ и соотношения ОТ/ ОБ. Всем пациентам проводилась оценка фактического питания за сутки методом частотно-количественного анализа, а также физической активности с использованием программы «Цифровая диетология» с последующим анализом химического состава и суточной энергетической ценности рациона. Также проводился биоимпедансный анализ состава тела и общей жидкости с использованием анализатора InBody 770 (In Body, Корея). Для установления фактических потребностей пациентов в пищевых веществах и энергии выполнялось исследование основного обмена методом непрямой респираторной калориметрии с определением суточной экскреции азота с мочой с применением стационарного метаболографа «Quark RMR Cart» (COSMED, Италия). Обследуемым проводилась клинико-лабораторная диагностика, оценивались показатели кардиологического статуса.
Данные, полученные при исследовании основного обмена, позволяют рассчитать так называемый «оптимальный метаболический диапазон» потребностей в пищевых веществах и энергии, в котором нижней границей выступают показатели основного обмена, а верхняя граница определяется по формуле: ОО × КФА × КСА (с последующим пересчетом на белки, жиры и углеводы), где ОО – основной обмен, КФА – коэффициент физической активности, КСА – коэффициент спортивной активности.
Расчет верхней границы окисления макронутриентов выполнялся по формулам: СОУ = (ОО × 0,55)/4; СОЖ = (ОО × 0,30)/9; СОБ = (ОО × 0,15)/4; где ОО – основной обмен, СОБ – скорость окисления белка, СОЖ – скорость окисления жиров, СОУ – скорость окисления углеводов.
Статистическая обработка полученных данных проводилась с использованием пакета программы STATISTICA 12. Нормально распределенные показатели пациентов представлены средним значением ( М ) и его стандартной ошибкой ( m ), М ± m . Категориальные показатели описывались абсолютными ( n ) и относительными (в %) частотами встречаемости. Для сравнения категориальных показателей в независимых группах пациентов использовался критерий χ2 Пирсона. Нормально распределенные показатели в группах мужчин и женщин сравнивались с помощью критерия Стьюдента, для сравнения с нормой применялся одновыборочный критерий Стьюдента. Критический уровень значимости при проверке статистических гипотез составлял 0,05.
Результаты и обсуждение
Анализ фактического питания человека служит для оценки сбалансированности потребления пищевых веществ и расходования энергии, а также антропометрических, метаболических и иных характеристик организма, сформировавшихся в результате этого баланса. Конечной задачей оценки служит оптимизация характера питания (индивидуальная или группы лиц) с целью улучшения анатомо-физиологических характеристик, соматического статуса пациента, клинической картины и прогноза заболевания. Рутинная методология оценки метаболического статуса включает в себя оценку фактического питания, состава тела, показателей основного обмена, лабораторные данные, а также клинико-инструментальные показатели, необходимые для объективизации конкретной нозологии. Результаты оценки метаболического статуса пациентов с ФП на фоне морбидного ожирения представлены ниже.
Результаты метаболометрии в зависимости от пола больных приведены в таблице 1. Было установлено, что женщины характеризовались нормальным уровнем ОО (в среднем 1653,30 ккал/сут) и СОБ (в среднем 62,17 г/сут), но при этом значимым дисбалансом окисления энергоемких субстратов: снижением СОУ – в среднем 165,58 г/сут (–27,69%) и повышением СОЖ – в среднем на 82,48 г/сут (+48,58%). Пациенты мужского пола характеризовались снижением уровня ОО (в среднем 2271,48 ккал/сут, –26,23%), за счет снижения СОУ (в среднем на 181,30 г/сут, –57,18%) и СОБ (в среднем на 83,07 г/сут, –28,06%), при этом СОЖ была также повышена (в среднем 134,89 г/сут, +31,42%).
Результаты оценки физической активности пациентов показали (табл. 2), что 71 пациент (71%) характеризовался «сидячим» образом жизни, из них у 69 отсутствовала спортивная активность, а 2 занимались легким спортом. Малоактивный образ жизни вел 21 пациент (21%), из них 18 не занимались спортом, 3 занимались легким спортом; 7 пациентов (7%) вели активный образ жизни, из них 4 не занимались спортом, 2 – легким спортом и 1 – регулярным спортом; 1 пациент (1%) вел очень активный образ жизни и при этом не занимался спортом.
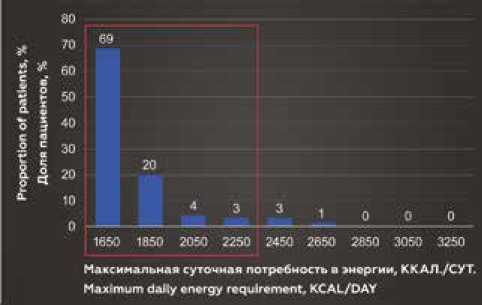
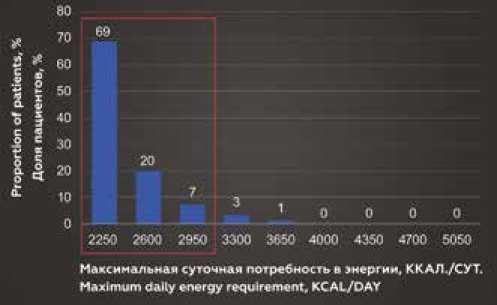
Распределение пациентов по значению максимальной суточной потребности в энергии (верхняя граница метаболического диапазона) представлены на рисунке 1. Из диаграмм видно, что максимальная суточная потребность 95% женщин находится в пределах 2250 ккал/сут, а мужчин – в пределах 2950 ккал/сут.
Таким образом, результаты метаболометрических исследований и оценки физической активности пациентов позволяют рассчитать параметры оптимального метаболического диапазона суточной потребности в пищевых веществах и энергии (табл. 3).
Следующим этапом анализа метаболического статуса пациентов является оценка их фактического питания, позволяющая получить информацию по отклонению рациона от оптимальных суточных потребностей в энергии и пищевых веществах.
Анализ фактического питания пациентов, проведенный методом частотно-количественного опроса, показал наличие выраженного «алиментарного паттерна» за счет избыточного потребления практически всех основных пищевых веществ и увеличении суточной энергоемкости рациона (табл. 4).
Анализ сбалансированности потребления и расхода энергии и макронутриентов показал, что женщины характеризуются более выраженным профицитом потребления энергии и макронутриентов по сравнению с мужчинами, что обусловлено преимущественно более низкими значениями энергозатрат.
Таблица 1. Показатели метаболометрии пациентов в сравнении с нормой
Table 1. Metabolometric parameters of patients compared with the norm
|
Показатели Parameters |
Измеренные показатели метаболометрии Measured metabolomics indices |
Норма* Norm* |
% отклонения от нормы % deviation from the norm |
||
|
М |
± m |
М |
±m |
||
|
Женщины Women |
|||||
|
ОО, ккал/сут Basal metabolic rate, kcal/day |
1653,30 |
411,26 |
1665,30 |
743,21 |
–0,72% |
|
СОУ, г/сут CHO, g/day |
165,58 |
68,37 |
228,98 |
102,19 |
–27,69% |
|
СОЖ, г/сут Rate of fat oxidation, g/day |
82,48 |
31,22 |
55,51 |
24,77 |
48,58% |
|
СОБ, г/сут Protein oxidation rate, g/day |
62,17 |
16,05 |
62,45 |
27,87 |
–0,44% |
|
Мужчины Men |
|||||
|
ОО, ккал/сут Basal metabolic rate, kcal/day |
2271,48 |
411,26 |
3079,24 |
743,21 |
–26,23% |
|
СОУ, г/сут CHO, g/day |
181,30 |
68,37 |
423,40 |
102,19 |
–57,18% |
|
СОЖ, г/сут Rate of fat oxidation, g/day |
134,89 |
31,22 |
102,64 |
24,77 |
31,42% |
|
СОБ, г/сут Protein oxidation rate, g/day |
83,07 |
16,05 |
115,47 |
27,87 |
–28,06% |
Примечание: * – норма рассчитана по формуле Харрисона – Бенедикта, ОО – основной обмен, СОУ – скорость окисления углеводов, СОЖ – скорость окисления жиров, СОБ – скорость окисления белка.
Note: * – the norm is calculated using the Harrison – Benedict formula, BMR – basal metabolic rate, CHO – rate of carbohydrate oxidation.
Таблица 2. Физическая активность пациентов с ожирением и фибрилляцией предсердий
Table 2. Physical activity of patients with obesity and AF
|
Спортивная активность Sports activity |
Образ жизни Lifestyle |
||||
|
1 |
1 if l^^H Isi8~i c[ ф ro c > Я Д Ф СК ф о u (Z) го ц Го Ф | ro s s У го о e a- |
О = 1 § — ф s > $2 A 8 ф - ST ° § 1 phM lul?^ 5 g ™ S 8 I ® 5 s E 2 Ils (Z) |
ю _ cLS 1 ф го 2-аз x- oj 2 E o II
- $ / s о 5-й 5 т Ф.2 8 f^^Sg" го го о О о ^ и — |
го с7 о Е ® i s 5^*5 -0 2 05 X Q U го § £ ® > g 8 о е т о CL |
|
|
Всего (%) Total (%) |
71 |
21 |
7 |
1 |
|
|
Отсутствует (КСА = 1) Absent (CSA = 1) Не занимаюсь спортом или занимаюсь редко I don’t play sports or rarely do sports |
92 |
69 |
18 |
4 |
1 |
|
Легкий спорт (КСА = 1,13) Light sports (CSA = 1.13) Тренажерный зал или плавание 1–2 раза в неделю или 2–3 легкие пробежки в неделю Gym or swimming 1–2 times a week or 2–3 light runs per week |
7 |
2 |
3 |
2 |
0 |
|
Регулярный спорт (КСА = 1,26) Regular sport (CSA = 1.26) Тренажерный зал или плавание 2–3 раза в неделю или ежедневные пробежки не менее 30 мин Gym or swimming 2–3 times a week or daily jogging for at least 30 minutes |
1 |
0 |
0 |
1 |
0 |
|
Активный спорт (КСА = 1,42) Active sport (CSA = 1.42) Ежедневные тренировки с серьезной нагрузкой или быстрый бег не менее 1 ч в день Daily vigorous exercise or fast running for at least 1 hour per day |
0 |
0 |
0 |
0 |
0 |
Примечание: КСА – коэффициент спортивной активности, КФА – коэффициент физической активности.
Note: AF – atrial fibrillation, CSA – coefficient of sports activity, PAC – physical activity coefficient.
Таблица 3. Оптимальные расчетные суточные потребности пациентов в пищевых веществах и энергии
Table 3. Optimal calculated daily needs of patients for nutrients and energy
|
Показатели Parameters |
Нижняя граница Bottom line |
Верхняя граница Upper limit |
|
Женщины Women |
||
|
Суточная потребность в энергии, ккал/сут Daily energy requirement, kcal/day |
1646 |
2250 |
|
Скорость окисления белка, г/сут Protein oxidation rate, g/day |
62 |
85 |
|
Скорость окисления жиров, г/сут Rate of fat oxidation, g/day |
82 |
112 |
|
Скорость окисления углеводов, г/сут Carbohydrate oxidation rate, g/day |
165 |
226 |
Мужчины Men
|
Суточная потребность в энергии, ккал/сут Daily energy requirement, kcal/day |
2271 |
2950 |
|
Скорость окисления белка, г/сут Protein oxidation rate, g/day |
83 |
108 |
|
Скорость окисления жиров, г/сут Rate of fat oxidation, g/day |
135 |
175 |
|
Скорость окисления углеводов, г/сут Carbohydrate oxidation rate, g/day |
181 |
235 |
А. Женщины
Б. Мужчины
B. Men
A. Women
Рис. 1. Распределение пациентов по значению максимальной суточной потребности в энергии Fig. 1. Distribution of patients by maximum daily energy requirement
Таблица 4. Показатели фактического питания в домашних условиях пациентов с фибрилляцией предсердий и ожирением III степени, М ± m
Table 4. Indicators of actual nutrition at home in patients with atrial fibrillation and stage III obesity, M ± m
|
Показатели Parameters |
Женщины Women |
Физиологическая норма (жен.) Physiological norm (woman) |
Мужчины Men |
Физиологическая норма (муж.) Physiological norm (men) |
||||
|
М |
m |
мин min |
макс. max |
М |
m |
мин min |
макс. max |
|
|
Энергия, ккал Energy, kcal |
2731,1 |
554,6 |
1547,4* |
1891,3* |
3013,6 |
568,9 |
2126,1* |
2598,5* |
|
Белки, г Proteins, g |
109,6 |
32,5 |
58,1* |
71,1* |
127,2 |
40,3 |
77,7* |
95,0* |
|
Жиры, г Fats, g |
110,3 |
16,1 |
77,1* |
94,3* |
112,8 |
20,0 |
126,2* |
154,3* |
|
Нас. жир, г Saturated fat, g |
74,2 |
68,4 |
19,3 |
23,6 |
74,2 |
68,4 |
19,3 |
23,6 |
|
МНЖК, г MUFA, g |
29,5 |
7,6 |
19,3 |
23,6 |
26,7 |
7,3 |
19,3 |
23,6 |
|
ПНЖК, г PUFA, g из них: of them: |
20,1 |
10,2 |
19,3 |
23,6 |
21,7 |
10,7 |
19,3 |
23,6 |
|
Омега-3, г Omega-3, g |
2,5 |
2,3 |
0,8 |
1,6 |
3,2 |
2,7 |
0,8 |
1,6 |
|
Омега-6, г Omega-6, g |
16,6 |
9,9 |
8 |
10 |
21,2 |
19,8 |
8 |
10 |
|
Углеводы, г Carbohydrates, g |
324,9 |
110,9 |
154,9* |
189,4* |
324,9 |
110,9 |
169,6* |
207,4* |
|
Сахара, г Sugar, g |
100,6 |
35,8 |
21,7 |
26,5 |
104,0 |
39,3 |
21,7 |
26,5 |
|
Пищ. волокна, г Dietary fiber, g |
20,2 |
9,6 |
17,4 |
21,2 |
24,5 |
13,6 |
17,4 |
21,2 |
|
Крахмал, г Starch, g |
204,1 |
110,6 |
330 |
450 |
231,0 |
92,9 |
330 |
450 |
|
Холестерин, мг Cholesterol, mg |
476,8 |
126,2 |
200 |
300 |
480,3 |
80,1 |
200 |
300 |
|
Натрий, Na, мг |
6611,1 |
2433,8 |
1300 |
3900 |
6799,6 |
2008,8 |
1300 |
3900 |
|
Калий, K, мг |
3775,0 |
725,6 |
1000 |
4000 |
4796,7 |
641,6 |
1000 |
4000 |
|
Кальций, Ca, мг |
997,9 |
482,8 |
500 |
2500 |
1726,2 |
1438,2 |
500 |
2500 |
|
Магний, Mg, мг |
403,7 |
176,2 |
200 |
750 |
540,0 |
288,1 |
200 |
750 |
|
Фосфор, P, мг |
1677,7 |
117,3 |
550 |
1200 |
2100,0 |
191,4 |
550 |
1200 |
|
Железо, Fе, мг |
20,2 |
11,4 |
6,7 |
60 |
24,6 |
12,2 |
6,7 |
60 |
|
Йод, I, мкг |
127,6 |
79,2 |
130 |
600 |
214,0 |
278,9 |
130 |
600 |
|
Селен, Se, мкг |
113,2 |
87,0 |
30 |
300 |
118,7 |
71,1 |
30 |
300 |
|
Цинк, Zn, мг |
12,3 |
10,3 |
9,5 |
25 |
12,6 |
8,1 |
9,5 |
25 |
Окончание табл. 4
End of table 4
|
Показатели Parameters |
Женщины Women |
Физиологическая норма (жен.) Physiological norm (woman) |
Мужчины Men |
Физиологическая норма (муж.) Physiological norm (men) |
||||
|
М |
m |
мин min |
макс. max |
М |
m |
мин min |
макс. max |
|
|
А, ретинол, мкг |
1222,7 |
963,9 |
600 |
3000 |
1333,7 |
1010,0 |
600 |
3000 |
|
B1, тиамин, мг |
1,6 |
1,1 |
1,1 |
25 |
2,1 |
1,2 |
1,1 |
25 |
|
B2, рибофлавин, мг |
2,1 |
1,0 |
1,1 |
50 |
2,7 |
1,5 |
1,1 |
50 |
|
B12, кобаламин, мкг |
6,5 |
8,2 |
3 |
12 |
6,0 |
6,5 |
3 |
12 |
|
B9, фолаты, мкг |
289,5 |
152,5 |
150 |
1000 |
326,4 |
169,3 |
150 |
1000 |
|
B6, пиридоксин, мг |
1,9 |
1,5 |
1,1 |
25 |
2,4 |
2,1 |
1,1 |
25 |
|
C, мг |
166,1 |
232,7 |
45 |
2000 |
198,6 |
152,4 |
45 |
2000 |
|
D, мкг |
2,3 |
3,5 |
10 |
50 |
6,0 |
23,6 |
10 |
50 |
|
E, α-токоферол, мг |
12,9 |
6,1 |
7 |
300 |
14,9 |
13,6 |
7 |
300 |
|
PP, ниацин, мг |
23,3 |
19,6 |
11 |
60 |
24,4 |
10,9 |
11 |
60 |
Примечание: * норма рассчитана, исходя из измеренных значений основного обмена, умноженных на коэффициент физической активности. Жирным шрифтом выделены значения, статистически значимо различающиеся в группах мужчин и женщин, при уровне значимости р -value < 0,05.
Note: * the norm is calculated based on the measured values of the basal metabolic rate multiplied by the physical activity coefficient. Values that are statistically significantly different in the groups of men and women are highlighted in bold, at a significance level of p- value < 0.05.
Так, профицит по энергетической ценности питания у женщин составил в среднем 1011,6 ± 138 ккал/сут, у мужчин – в среднем 651,3 ± 104 ккал/сут. При этом повышенная калорийность у женщин была обусловлена избыточным потреблением макронутриентов: углеводов – в среднем на 152,7 г/сут, жиров – в среднем на 24,5 г/сут, белков – в среднем на 45,0 г/сут. В мужской выборке повышенная калорийность была обусловлена избыточным потреблением углеводов (в среднем на 183,9 г/сут) и белка (в среднем на 40,8 г/сут), при относительном снижении потребления жиров (в среднем на 27,5 г/сут), что обусловлено прежде всего большей скоростью окисления жиров.
Представленные результаты позволяют заключить, что при разработке диетотерапии пациентов с морбидным ожирением и ФП необходимо учитывать пол больного – у женщин необходимо проводить снижение калорийности за счет всех макронутриентов, у мужчин – только за счет белков и углеводов.
Важным компонентом питания для пациентов с нарушениями ритма сердца традиционно считаются полине-насыщенные жирные кислоты (ПНЖК). Это основано, в частности, на предположениях, что ПНЖК семейства ω-3 могут снижать риск ФП за счет их антиаритмического действия [12] через предотвращение структурного повреждения сердца, которое является предшественником мерцательной аритмии [13]. Результаты нашего исследования показали, что пациенты с ожирением характеризуются избыточным потреблением ПНЖК: семейства омега-3 – в среднем на 44,4 ± 23,2% (2,88 ± 2,50 г/сут), ПНЖК семейства омега-6 – в среднем на 47,9 ± 20,1% (19,12 ± 16,02 г/сут).
Эти результаты согласуются с представлениями о нелинейном влиянии дозы потребления ПНЖК на частоту развития ФП, а именно о наличии U -образной кривой зависимости потребления ПНЖК-ω-3 и частоты ФП – при слишком малом или избыточном потреблении ПНЖК-ω-3 демонстрируется отрицательная корреляция с частотой ФП [14]. Таким образом, обогащение рациона питания ПНЖК-ω-3 у больных с ФП на фоне ожирения не имеет клинического основания.
В качестве важных самостоятельных целей для коррекции питания у данной когорты пациентов можно выделить избыточное потребление насыщенных жиров, которое превышало норму в среднем на 68,2 ± 12,2%, холестерина – в среднем на 59,3 ± 13,0%, добавленного сахара – в среднем на 74,1 ± 22,0%, натрия – в среднем на 41,9 ± 14,3%.
Выявлен статистически значимый алиментарный дефицит витамина D – в среднем на 57,1 ± 12,1%, что может иметь клиническое значение. Так, метаанализ 13 исследований с 6 519 случаями ФП среди 74 885 участников показал, что дефицит витамина D в сыворотке крови связан с повышенным риском ФП в общей популяции, а также послеоперационной ФП у пациентов после коронарного шунтирования [15].
Следует отметить, что, вопреки имеющимся представлениям, не удалось выявить недостаток потребления таких минеральных веществ, как калий, магний и фосфор. Кроме того, не был установлен недостаток потребления пищевых волокон, которые считаются одним из важнейших алиментарных факторов в профилактике сердечно-сосудистых заболеваний.
Результаты антропометрических показателей, состава тела и общей воды пациентов, представленные в таблице 5, с одной стороны являются отражением критериев включения в исследование (ожирение III степени), с другой стороны, – показанным выше дисбалансом потребления и расходования пищевых веществ и энергии.
Таблица 5. Показатели состава тела пациентов в сравнении с нормой
Table 5. Indicators of the body composition of patients in comparison with the norm
Показатели Indicators
М ± m
% отклонения от нормы % deviation from the norm
Расчетная норма* Calculated rate* М ± m
Рост, см Height, cm мужчины men женщины women
179,89 ± 7,65
161,30 ± 5,23
Окончание табл. 5
End of table 5
|
Показатели Indicators |
М ± m |
% отклонения от нормы % deviation from the norm |
Расчетная норма* Calculated rate* М ± m |
|
Масса тела, кг Body weight, kg мужчины men женщины women |
141,19 ± 16,31 112,65 ± 10,16 |
89,37% 88,05% |
74,56 ± 6,41 59,90 ± 3,92 |
|
ОТ/ОБ waist/hip size мужчины men женщины women |
1,09 ± 0,09 1,10 ± 0,14 |
8,96% 22,42% |
1,00 ± 0 0,90 ± 0 |
|
ИМТ, кг/м2 BMI, kg/m2 мужчины men женщины women |
43,56 ± 3,50 43,25 ± 2,69 |
74,26% 72,99% |
25,00 ± 0 25,00 ± 0 |
|
МСМ, кг Skeletal muscle mass, kg мужчины men женщины women |
41,49 ± 5,60 28,83 ± 2,77 |
23,65% 37,49% |
33,55 ± 2,88 20,97 ± 1,37 |
|
ЖМ, кг Fat mass, kg мужчины men женщины women |
62,97 ± 13,57 59,29 ± 7,78 |
в 4,6 раза в 3,3 раза |
11,18 ± 0,96 13,78 ± 0,90 |
|
ПВЖ, см2 Visceral fat area, cm2 мужчины men женщины women |
272,98 ± 21,93 269,04 ± 27,09 |
в 1,7 раза в 1,7 раза |
100,00 ± 0 100,00 ± 0 |
|
Общая вода, л Total water, l мужчины men женщины women |
55,16 ± 6,79 39,53 ± 4,16 |
47,95% 31,96% |
37,28 ± 3,20 29,95 ± 1,96 |
|
Тощая масса, кг Lean mass, kg мужчины men женщины women |
76,82 ± 5,66 54,33 ± 5,48 |
21,22% 17,80% |
63,37 ± 5,45 46,13 ± 3,02 |
Примечание: ОТ – объем талии, ОБ – объем бедер, ИМТ – индекс массы тела, МСМ – мышечно-скелетная масса, ЖМ – жировая масса, ПВЖ – площадь висцерального жира.
Note: BMI – body mass index.
Анализ показателей состава тела пациентов проводился дифференцированно для женщин и мужчин с учетом антропометрических норм. Выборка мужчин имела существенно большую массу тела по сравнению с женщинами, что объясняется тем фактом, что критерием включения в исследование являлся ИМТ > 40 кг/м2, а рост мужчин был в среднем выше женщин.
Мужчины в среднем характеризовались более выраженным превышением содержания жировой массы тела (в 4,6 и 3,3 раза соответственно) и жидкости (на 47,95 и 31,96% соответственно) и менее выраженным по сравнению с женщинами превышением мышечной массы
(на 23,65 и 37,49% соответственно) при сопоставимом превышении тощей массы тела (на 21,22 и 17,80% соответственно) и площади висцерального жира (в 1,7 раза в обеих группах).
Представленные данные свидетельствуют о том, что наличие морбидного ожирения с ИМТ > 40 кг/м2 у мужчин характеризуется значимой нагрузкой на сердечно-сосудистую систему в виде большего количества жировой массы и объема жидкости.
На основании полученных данных можно сформулировать ряд важных нарушений метаболического статуса у больных ожирением и ФП. Во-первых, это значимые нарушения показателей ОО, имеющие различия по полу. У женщин, несмотря на нормальный уровень энерготрат ОО и СОБ, выявлен выраженный дисбаланс соотношения «СОУ/СОЖ» – СОУ снижена в среднем на 27 ± 12,2%, р < 0,05, СОЖ в среднем повышена на 49 ± 14,6%, р < 0,01. Эти данные свидетельствуют о высокой значимости в развитии ожирения у женщин количества потребляемых углеводов. Пациенты мужского пола характеризуются достоверным снижением среднего уровня ОО (на 26 ± 13,6%, р < 0,05), но за счет снижения средней СОУ (на 57 ± 18,1%, р < 0,01) и средней СОБ (на 28 ± 12,9%, р < 0,05), при этом средняя СОЖ повышена на 32 ± 10,0%, р < 0,05.
Во-вторых, по данным фактического питания установлен выраженный «алиментарный паттерн», а именно: избыточная суточная калорийность рациона в среднем на 16–44% выше нормы, за счет избыточного потребления макронутриентов: белка – в среднем на 34–54%, жиров – в среднем на 17% (у женщин), углеводов – в среднем на 57–72% ( р < 0,05); избыточное потребление насыщенных жиров (в среднем на 44–136%), холестерина на 60% ( р < 0,05), добавленного сахара – в среднем в 2,7–2,9 раза выше нормы ( р < 0,05), отдельных минеральных веществ – натрия (на 70–74%), фосфора (в среднем на 40–75%) и калия (на 20% у мужчин) ( р < 0,05). Кроме того, зарегистрирован статистически значимый алиментарный дефицит витамина D в среднем на 8–16% ( р < 0,05).
Выявленный дисбаланс в потреблении пищевых веществ и расходовании энергии отражается в накоплении жировой массы тела и жидкости (показатели, наиболее выраженные у мужчин), являющийся мощным фактором гемодинамической перегрузки миокарда и нарушения гуморальной регуляции и электрической функции сердца. Индивидуальная оптимизация установленных метаболических и анатомо-физиологических отклонений может являться мощным компонентом профилактики и лечения ФП. Диетотерапию целесообразно проводить с учетом рассчитанного оптимального для пациентов метаболического диапазона (см. выше). Следует учитывать, что рацион питания целесообразно обогащать витамином Д, исключить потребление добавленного сахара, холестерина, натрия и фосфора. Дополнительное обогащение рациона калием, магнием и пищевыми волокнами нецелесообразно.
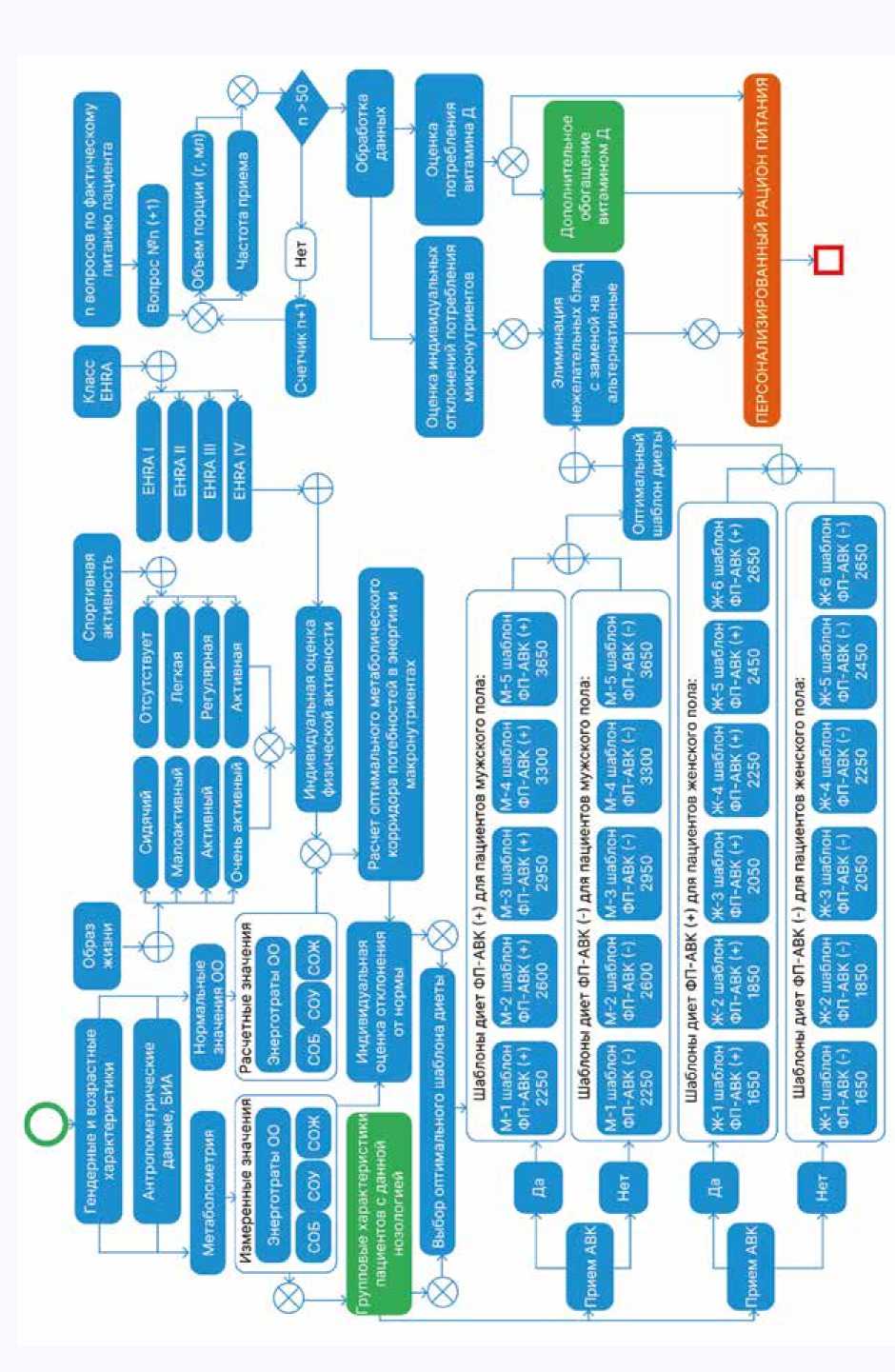
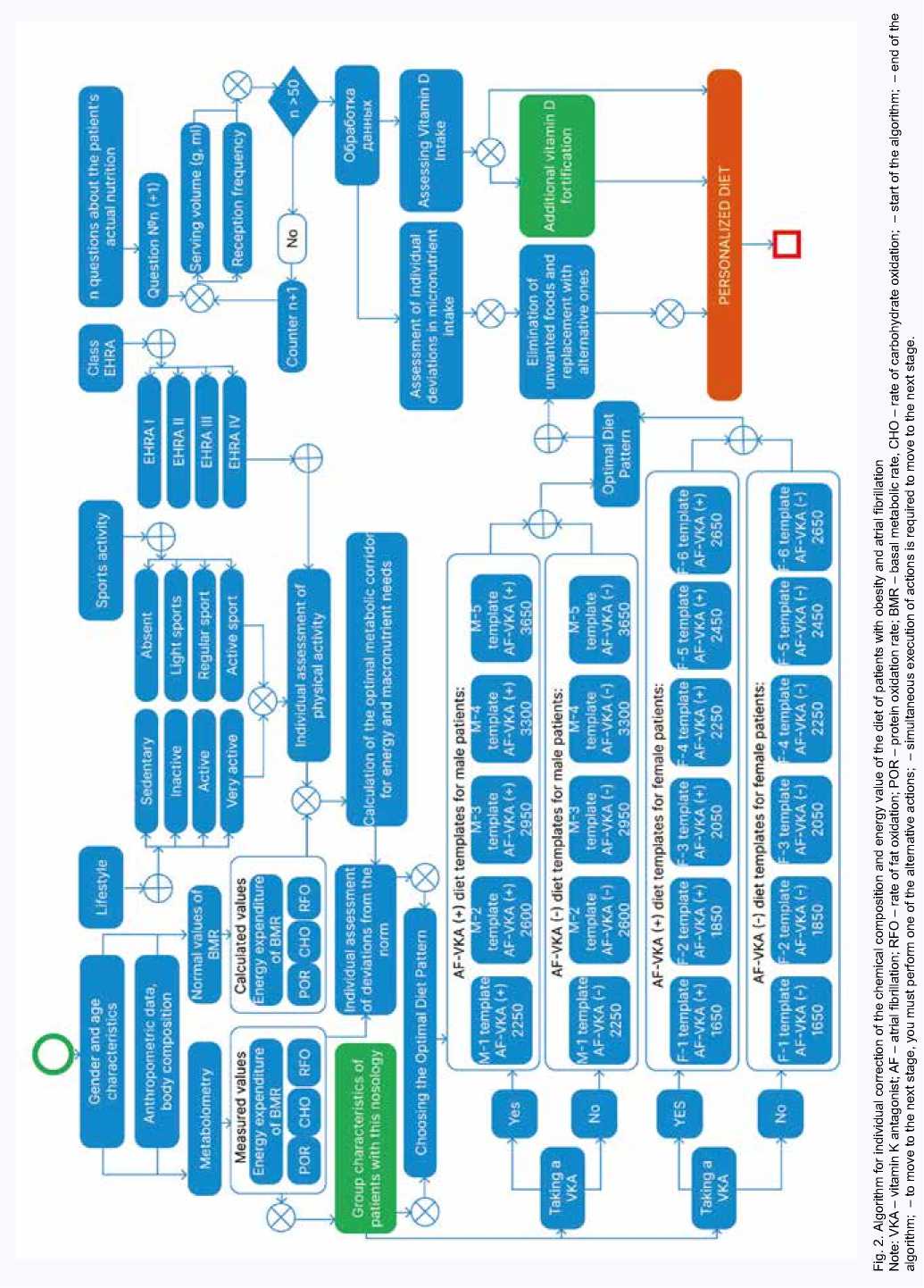
Важным аспектом индивидуальной алиментации является факт назначения пациентам препаратов из группы антагонистов витамина К (варфарин), что требует обязательной элиминации пищевых источников витамина К (зеленые листовые овощи, капуста, крапива, рожь, овес, плоды шиповника, печень, яйца и некоторые другие). Алгоритм индивидуальной коррекции химического состава и энергетической ценности диетотерапии больных ожирением III степени и ФП представлен на рисунке 2.
Ограничения
Главным ограничением данного исследования является малая выборка пациентов с пароксизмальной формой ФП и ожирением III степени, что было обусловлено низкой приверженностью пациентов к диетотерапии.
Заключение
У пациентов с ФП и морбидным ожирением имеют место значимые нарушения показателей основного обмена, имеющие половые различия; выраженный «алиментарный паттерн» рациона. Выраженный дисбаланс потребления и расходования энергии и пищевых веществ от- ражается в накоплении жировой массы тела и жидкости, являющейся существенным фактором гемодинамической перегрузки миокарда и нарушения гуморальной регуляции и электрической функции сердца. Диетологическая оптимизация выявленных метаболических и анатомических отклонений может являться мощным компонентом лечения и вторичной профилактики ФП. Диетотерапию целесообразно проводить индивидуально с учетом оптимального метаболического диапазона и потребности в пищевых веществах, обогащения рациона витамином D, а также исключения добавленного сахара, холестерина, натрия (соли), фосфора, источников витамина К.
Список литературы Алгоритм персонализации диетотерапии пациентов с фибрилляцией предсердий и ожирением на основе комплексной оценки фактического питания и метаболического статуса
- Virani S.S., Alonso A., Aparicio H.J., Benjamin E.J., Bittencourt M.S., Callaway C.W. et al. American Heart Association Council on Epidemiology and Prevention Statistics Committee and Stroke Statistics Subcommittee. Heart disease and stroke statistics-2021 Update: A report from the American Heart Association. Circulation. 2021;143(8):e254-e743. https://doi.org/10.1161/CIR.0000000000000950
- Lip G.Y.H., Coca A., Kahan T., Boriani G., Manolis A.S., Olsen M.H. et al. Hypertension and cardiac arrhythmias: a consensus document from the European Heart Rhythm Association (EHRA) and ESC Council on Hypertension, endorsed by the Heart Rhythm Society (HRS), Asia-Pacific Heart Rhythm Society (APHRS) and Sociedad Latinoamericana de Estimulación Cardíaca y Electrofisiología (SOLEACE). Europace. 2017;19(6):891-911. https://doi.org/10.1093/europace/eux091.
- Aune D., Feng T., Schlesinger S., Janszky I., Norat T., Riboli E. Diabetes mellitus, blood glucose and the risk of atrial fibrillation: A systematic review and meta-analysis of cohort studies. J. Diabetes Complications. 2018;32(5):501-511. https://doi.org/10.1016/j.jdiacomp.2018.02.004.
- Hobbelt A.H., Siland J.E., Geelhoed B., Van Der Harst P., Hillege H.L., Van Gelder I.C. et al. Clinical, biomarker, and genetic predictors of specific types of atrial fibrillation in a community-based cohort: data of the PREVEND study. Europace. 2017;19(2):226-232. https://doi.org/10.1093/europace/euw016.
- Boriani G., Savelieva I., Dan G.A., Deharo J.C., Ferro C., Israel C.W. et al. Chronic kidney disease in patients with cardiac rhythm disturbances or implantable electrical devices: clinical significance and implications for decision making-a position paper of the European Heart Rhythm Association endorsed by the Heart Rhythm Society and the Asia Pacific Heart Rhythm Society. Europace. 2015;17(8):1169-1196. https://doi.org/10.1093/europace/euv202.
- Голухова Е.З., Громова О.И., Булаева Н.И., Аракелян М.Г. Лифанова Л.С., Шляппо М.А. и др. Эпикардиальный жир и фибрилляция предсердий: роль профиброгенных медиаторов. Kardiologiia. 2018;58(7):59-65. https://doi.org/10.18087/cardio.2018.7.10145.
- Харац В.Е. Проблема ассоциации обструктивного апноэ сна и фибрилляции предсердий в условиях кардиологической практики. Сибирский журнал клинической и экспериментальной медицины. 2022;37(3):41-48. https://doi.org/10.29001/2073-8552-2022-37-3-41-48.
- Murphy N.F., MacIntyre K., Stewart S., Hart C.L., Hole D., McMurray J.J. Long-term cardiovascular consequences of obesity: 20-year follow-up of more than 15 000 middle-aged men and women (the Renfrew-Paisley study). Eur. Heart J. 2006;27(1):96-106. https://doi.org/10.1093/eurheartj/ehi506.
- Tedrow U.B., Conen D., Ridker P.M., Cook N.R., Koplan B.A., Manson J.E. et al. The long- and short-term impact of elevated body mass index on the risk of new atrial fibrillation the WHS (women’s health study). J. Am. Coll. Cardiol. 2010;55(21):2319-2327. https://doi.org/10.1016/j.jacc.2010.02.029.
- Aronis K.N., Wang N., Phillips C.L., Benjamin E.J., Marcus G.M., Newman A.B. et al. Associations of obesity and body fat distribution with incident atrial fibrillation in the biracial health aging and body composition cohort of older adults. Am. Heart J. 2015;170(3):498-505.e2. https://doi.org/10.1016/j.ahj.2015.06.007.
- Богданов А.Р., Романова Т.А. Ожирение как фактор риска развития фибрилляции предсердий. Креативная кардиология. 2022;16(3):278-288. https://doi.org/10.24022/1997-3187-2022-16-3-278-2.
- Gronroos N.N., Alonso A. Diet and risk of atrial fibrillation: epidemiologic and clinical evidence. Circ. J. 2010;74(10):2029-2038. https://doi.org/10.1253/circj.cj-10-0820.
- Boos C.J., Anderson R.A., Lip G.Y. Is atrial fibrillation an inflammatory disorder? Eur. Heart J. 2006;27(2):136-149. https://doi.org/10.1093/eurheartj/ehi645.
- Rix T.A., Joensen A.M., Riahi S., Lundbye-Christensen S., Tjønneland A., Schmidt E.B. et al. A U-shaped association between consumption of marine n-3 fatty acids and development of atrial fibrillation/atrial flutter - A Danish cohort study. Europace. 2014;16(11):1554-1561. https://doi.org/10.1093/europace/euu019.
- Liu X., Wang W., Tan Z., Zhu X., Liu M., Wan R. et al. The relationship between vitamin D and risk of atrial fibrillation: a dose-response analysis of observational studies. Nutr. J. 2019;18(1):73. https://doi.org/10.1186/s12937-019-0485-8.


