Алгоритм выбора метафизарной фиксации при ревизионной артропластике коленного сустава
Автор: Гиркало М.В., Щаницын И.Н., Островский В.В., Козадаев М.Н., Деревянов А.В.
Журнал: Кафедра травматологии и ортопедии @jkto
Рубрика: Оригинальное исследование
Статья в выпуске: 4 (54), 2023 года.
Бесплатный доступ
Цель исследования: изучить ближайшие и отдаленные результаты ревизионного эндопротезирования коленного сустава (реТЭКС) с применением метафизарных фиксаторов (втулок и конусов) и разработать алгоритм выбора метафизарного фиксатора. Материал и методы: в исследование вошли 134 пациента, перенесших ревизионную артропластику коленного сустава. Пациенты были разделены на две группы по типу использованного метафизарного фиксатора: втулки (группа 1) - 97 пациентов, и конусы (группа 2) - 37 пациентов. Оценку результатов операции проводили при выписке из стационара, через 6, 12, 24 месяца после оперативного вмешательства. Проводили анализ выживаемости эндопротеза методом Каплана-Мейера. Критическим событием считали реоперацию с полной заменой эндопротеза или его компонентов.
Ревизионное эндопротезирование, коленный сустав, дефекты костей, алгоритм
Короткий адрес: https://sciup.org/142240731
IDR: 142240731 | УДК: 616.728.3-089-003.93 | DOI: 10.17238/2226-2016-2023-4-16-26
Текст научной статьи Алгоритм выбора метафизарной фиксации при ревизионной артропластике коленного сустава
THE DEPARTMENT OF TRAUMATOLOGY AND ORTHOPEDICS
Одним из основных принципов ревизионного эндопротезирования коленного сустава (реТЭКС)является эффективное решение задачи замещения дефицита костной ткани, для прочной фиксации и корректной ориентации имплантата. Согласно данным специалистов РосНИИТО им Р.Р. Вредена [1], дефицит кости при реТЭКС имеет место у 94% больных. Стоит отметить, что степень выраженности дефицита костной ткани оказывает значительное влияние на качество фиксации эндопротеза и на прогнозирование отдаленного результата. Наиболее часто используемой классификацией костных дефектов, определяющей тактику их замещения является классификация AORI [2]. Так, небольшие ограниченные дефекты могут быть замещены костным аллотрансплантатом или цементом, в то же время большие дефекты могут требовать комбинации нескольких методов, включающих использование стержней, аугментов, втулок, конусов и костной пластики. Как показывает анализ, предложенные методики имеют определенные преимущества и недостатки, влияющие на исход лечения (табл. 1).
Таблица 1
Преимущества и недостатки применения различных методик замещения костных дефектов при ревизионном эндопротезирования коленного сустава [3]
|
Методика |
Тип дефекта AORI |
Преимущества |
Недостатки |
|
Цементирование +/- армирующие винты |
1 |
Недорогой, простой и воспроизводимый метод |
Термический некроз, расшатывание протеза, полоса просветления (на рентгенограмме) |
|
Модульная металлическая аугментация |
2 и 3 |
Стабильность и прочность фиксации компонентов протеза |
Износ, полоса просветления (на рентгенограмме), коррозия, расшатывание протеза |
|
Аутологичная костная пластика |
1 |
Эффективное восстановление стабильности конструкции |
Используется только при небольшом дефекте |
|
Аллогенная костная пластика |
1 |
Улучшается выживаемость протеза |
Иммунологическая реакция, повышенный риск инфекции и передачи вирусных заболеваний |
|
Импакционная костная пластика |
1 и 2А |
Остеоиндуктивность и остео-кондуктивность костного трансплантата улучшает стабильность конструкции |
Ограниченная доступность, резорбция |
|
Структурный костный аллотрансплантат |
2 и 3 |
Остеоиндуктивность, улучшенная механическая стабильность фиксации компонентов протеза |
Нестабильность, перелом трансплантата, передача бактериальных и вирусных заболеваний |
|
Метафизарные втулки из пористого титана |
2 и 3 |
Улучшается стабильность конструкции и выживаемость протеза |
Недостаточно отдаленных наблюдений |
|
Метафизарные конусы из пористого тантала/титана |
2 и 3 |
Структурная и механическая поддержка, восстановление стабильности конструкции |
Отсутствие отдаленных наблюдений, трудность удаления, перипротезный перелом |
|
Мегапротез/ индивидуальный протез |
2 и 3 |
Биоактивность |
Дорогой и длительный в производстве метод. Механические осложнения и инфекция в краткосрочном периоде |
Частота осложнений, связанных с асептической нестабильностью компонентов ревизионных эндопротезов, сохраняется примерно на одном уровне, а накопленный многолетний опыт не демонстрирует явного преимущества какой-либо методики компенсации костных дефектов [4]. Так, применение массивных структурных трансплантатов осложняется в 22–25% случаев [5] импакционной костной пластики — в 14% [6], металлических аугментов — в 8% [7].
Одним из вариантов повышения выживаемости ревизионных эндопротезов стало использование метафизарных втулок и конусов. Они принципиально меняют распределение нагрузок на кость, увеличивая загруженность метафизарной зоны большеберцовой и бедренной костей, при этом обеспечивают вторичную фиксацию компонентов эндопротеза за счет врастания кости в трабекулы металла. Имплантаты из пористого металла активно используются уже более десяти лет, и опубликованы промежуточные результаты их применения [8]. В последнее время отмечается тенденция к увеличению объема исследований результатов ревизионного эндопротезирования с применением втулок и конусов [9]. Лишь в нескольких исследованиях сравниваются результаты пористых имплантатов с традиционными методами трансплантации [10-12]. Они показывают смешанные результаты.
Таким образом, отсутствие чётких показаний для выбора того или иного метода метафизарной фиксации в зависимости от тяжести дефекта кости, оставляет дискутабельным вопрос оптимального метафизарного имплантата для реТЭКС [13]. Это и определило цель настоящего исследования – изучить ближайшие и отдаленные результаты реТЭКС с применением метафизарных фиксаторов (втулок и конусов) и разработать алгоритм выбора метафизарного фиксатора при реТЭКС.
Материал и методы
В исследование включены 134 пациента, которым выполнено реТЭКС в клинике «НИИТОН» СГМУ им В.И. Разумовского в период с 2013 по 2015 годы. Для выполнения ревизионной артропластики коленного сустава использовали ревизионные системы с увеличенной фронтальной стабильностью. В 97 случаях использовались метафизарные втулки, в 37 наблюдениях – ме-тафизарные конусы. Ретроспективное когортное исследование проведено на основе проспективно заполняемой базы данных пациентов после ревизионного эндопротезирования [14].
Критериями включения в исследование были: реТЭКС по поводу перипротезной инфекции или асептической нестабильности большеберцового, бедренного или обоих компонентов эндопротеза; наличие дефектов в бедренной или большеберцовой костях по классификации AORI типа 2А, 2B и 3. Критериями исключения: не корригированная тяжелая сопутствующая патология (сердечно-сосудистые и респираторные заболевания и/или другие состояния препятствующие хирургическому вмешательству); тяжелая деменция или другие умственные и физические нарушения, препятствовавшие самостоятельному заполнению анкеты пациентом.
Медиана и квартили возраста пациентов составила 67 (6173) лет, индекс массы тела — 34 (30-38) кг/м2. Мужчин было 34 (26%), женщин — 100 (74%). Ревизионное вмешательство выполнялось в связи с развившейся асептической нестабильностью эндопротеза — 55 (41%) и перипротезной инфекции – 79 (59%). Пациенты были разделены на две группы по типу использованного метафизарного фиксатора: втулки (группа 1) – 97 пациентов, и конусы (группа 2) – 37 пациентов (табл. 2). В группу 1 вошли пациенты, которым для замещения дефектов использовали втулки DePuy в составе ревизионной системы Sigma TC3 с ротационным вкладышем и усиленной фронтальной стабильностью, в группу 2 вошли пациенты, которым выполняли реТЭКС с применением танталовых конусов Zimmer с ревизионной системой Zimmer LCCK, или ревизионный эндопротез Stryker Triathlon с усиленной фронтальной стабильностью с конусом Tritanium. Соответственно при необходимости использования того или иного метафизарного фиксатора менялся дизайн импланта.
Перед оперативным вмешательством для выявления ведущей патологии выполнялось стандартное предоперационное клинико-диагностическое обследование, включающее осмотр, лабораторные исследования, рентгенографию, КТ и МРТ. Клиническое обследование проводили с применением шкалы KSS (Кnee Society Scores) [15]. Расчет баллов проводили на основе анкетирования пациентов. Рентгенографию выполняли стоя с захватом тазобедренных, коленных и голеностопных суставов. По данным рентгенографии выявляли отклонение осей нижней конечности, расположение линии сустава, оценивали наличие признаков остеолиза и ориентацию компонентов эндопротеза в соответствии со шкалой KSTKARE (Knee Society Total Knee Arthroplasty Roentgenographic Evaluation) [16]. Основным показателем рентгенологической оценки по шкале KSTKARE было наличие линии резорбции кости под компонентами эндопротеза. В соответствии со шкалой резорбция расценивалась как непрогрессирующая (0–4 балла); стабильная резорбция, требующая наблюдения (5–9 баллов); значительная остеорезорбция, проявляющаяся симптомами нестабильности (более 10 баллов). Компьютерную томографию (КТ) коленного сустава выполняли для оценки костных дефектов и пространственной ориентации компонентов эндопротеза. МРТ коленного сустава выполняли при подозрении на повреждение связочного аппарата.
В процессе выполнения оперативного вмешательства, после удаления компонентов компрометированного эндопротеза оценивали имеющиеся костные дефекты. Последние классифицировались на три типа по классификации AORI (Anderson Orthopaedic Research Institute) [2]. Для оценки локализации и протяженности дефекта использовали классификацию J. Insall [15], согласно которой костные дефекты поделены на центральные, которые не выходят на кортикальную стенку кости, и периферические, при которых повреждена кортикальная кость.
Таблица 2
Предоперационные данные включенных в исследование пациентов
|
Параметр |
Все пациенты (n=134) |
Группа 1 (втулки, n=97) |
Группа 2 (конусы, n=37) |
р* |
|
Возраст, года |
67 (61-73) |
67 (62-73) |
67 (60-73) |
0,854 |
|
Рост, м |
1,6 (1,5-1,6) |
1,6 (1,5-1,6) |
1,5 (1,5-1,6) |
0,038 |
|
Вес, кг |
90 (76-102) |
90 (79-102) |
86 (75-101) |
0,633 |
|
ИМТ, кг/м2 |
34 (30-38) |
34 (29-38) |
36 (30-39) |
0,344 |
|
Пол женский, n(%) |
100 (74%) |
67 (69%) |
33 (89%) |
0,025 |
|
Срок после первичной операции/ревизии, мес. |
23 (11-40) |
21 (11-42) |
24 (10-38) |
0,781 |
|
Показания к ревизионному эндопротезированию, n (%): |
||||
|
асептическая нестабильность |
55 (41%) |
37 (38%) |
18 (49%) |
0,269 |
|
парапротезная инфекция |
79 (59%) |
60 (62%) |
19 (51%) |
|
|
Тип дефекта кости по классификации AORI, n(%) |
||||
|
F1 |
10 (7%) |
7 (7%) |
3 (8%) |
0,992 |
|
F2A |
59 (44%) |
44 (46%) |
15 (41%) |
|
|
F2B |
60 (45%) |
42 (43%) |
18 (49%) |
|
|
F3 |
5 (4%) |
4 (4%) |
1 (2%) |
|
|
T1 |
2 (1%) |
2 (2%) |
0 |
0,005 |
|
T2A |
24 (18%) |
24 (25%) |
0 |
|
|
T2B |
99 (74%) |
66 (68%) |
33 (89%) |
|
|
T3 |
9 (7%) |
5 (5%) |
4 (11%) |
|
|
ИМТ - индекс массы тела; AORI - Anderson Orthopaedic Research Institute |
||||
|
Для количественных признаков определены: медиана и квартили |
||||
|
* - расчет критерия χ² (точный критерий Фишера) и критерия U Манна-Уитни |
||||
По результатам оценки дефектов кости определяли необходимость использования метафизарного фиксатора втулки или конуса. При невозможности получить стабильную фиксацию втулки принималось решение об использовании конуса [17]. В группе пациентов с метафизарными втулками бедренные втулки были применены у 10% (10/97) больных, большеберцовые метафизарные втулки — у 100% (97/97) пациентов. В группе пациентов с конусами реконструктивные конусы Zimmer в 57% (21/37) случаев, конусы Stryker у 43% (16/37) пациентов.
Послеоперационное ведение пациентов проводили согласно стандартному протоколу. Оценивали сроки госпитализации. Фиксировали нежелательные результаты лечения такие как: асептическая нестабильность, инфекционные осложнения, переломы костей при обработке и имплантации метафизарных фиксаторов, гематома, контрактура, Patella baja (низкое стояние надколенника). Оценку результатов операции проводили через 7-12 суток после вмешательства; через 6, 12, 24 месяца после оперативного вмешательства).
Полученные данные клинического и рентгенологического обследования всех групп подвергали статистическому анализу в программе SPSS 21.0 (USA). Нормальность распределения количественных признаков оценивали с применением методов Колмого- рова-Смирнова и Шапиро-Уилка. Учитывая малый объем выборки и ненормальное распределение большинства количественных признаков применяли непараметрические методы статистики. Для описания количественных параметров использовали медиану и квартили. Анализ различий между различными группами по количественным признакам проводили с использованием критерия U-Манна-Уитни, в связанных группах применяли двухфакторный ранговый дисперсионный анализ Фридмена. Для качественных признаков применяли критерий Хи квадрат Пирсона. Проводили анализ выживаемости протеза методом Каплана-Мейера. Критическим событием считали реоперацию с полной заменой эндопротеза или его компонентов. Строили кривую функции выживания протеза. Парные сравнения выживания в двух разных группах проводили с применением тестов: логранговый критерий (Log rank). Достоверным считали результаты при р<0,05, для всех критериев оценивали двустороннюю значимость.
Результаты
Пациенты исследуемых групп наблюдались в среднем 2 года, медиана времени наблюдения составила 24 мес. (11-42, квартили). Обследования выполнялись в сроки от 4 до 50 мес. после операции. В отдаленные сроки наблюдения (более 24 мес.) удалось проследить за результатами лечения у 67% (90/134) пациентов. Оценивали частоту повторных вмешательств, связанных с инфекцией, нестабильностью компонентов эндопротеза, контрактурой, длительным заживлением и отхождением гематомы. Выявляли признаки остеорезорбции по методике, предложенной Ewald и другие периоперационные осложнения.
Группы не различались по частоте одномоментных или двухэтапных вмешательств. Стоит отметить, что длительность операции и интраоперационная кровопотеря были больше в группе 2 (конусы) (табл. 3).
Таблица 3
Периоперационные данные включенных в исследование пациентов
|
Параметр |
Все пациенты (n=134) |
Группа 1 (втулки, n=97) |
Группа 2 (конусы, n=37) |
р* |
|
Одномоментная ревизия, n(%) |
46 (35%) |
31 (32%) |
15 (40%) |
0,417 |
|
Двухэтапное вмешательство, n(%) |
88 (65%) |
66 (68%) |
22 (60%) |
|
|
время между этапами, мес. |
6 (3-9,5) |
7 (4,5-11,5) |
4 (2,2-6) |
0,003 |
|
Время операции, мин |
120 (110-135) |
120 (105-130) |
130 (120-140) |
0,008 |
|
Кровопотеря интраоперационная, мл |
300 (200-300) |
200 (200-300) |
300 (200-300) |
0,027 |
|
Кровопотеря по дренажу, мл |
350 (225-550) |
350 (212-500) |
350 (225-600) |
0,854 |
|
Срок госпитализации, дни |
8 (7-10) |
7 (7-10) |
8 (7-11) |
0,818 |
|
Срок наблюдения, мес. |
24 (11-42) |
32 (22-46) |
12 (6-16) |
<0,001 |
Для количественных признаков определены: медиана и квартили
* - расчет критерия χ² (точный критерий Фишера) и критерия U Манна-Уитни
При оценке «выживаемости» ревизионного эндопротеза в обеих группах событием считалось выполнение повторного вмешательства. Вторая ревизия была выполнена у 17 (18,8%) пациентов, в том числе ревизия по поводу рецидива инфекции в 10 (11,1%) случаях, асептической нестабильности - 2 (2,2%), контрактуры и болевого синдрома – артрофиброза в 3 (3,3%) наблюдениях. У одного пациента отмечалось длительное отхождение гематомы 1,6%, потребовавшее повторного вмешательства, ирригации и дренирования. В одном случае повторного реэндопротезирования показанием к операции был перипротезный перелом. Ещё у одного пациента отмечено низкое стояние надколенника (рatella baja), не влияющее на повседневную жизнь и не потребовавшее дополнительного хирургического вмешательства. Данное осложнение на наш взгляд обусловлено укорочением собственной связки надколенника, вследствие многократных вмешательств. Замена или удаление компонентов ревизионного эндопротеза, характеризующие показатель его «выживаемости» зафиксированы в 15,5% (у 14 из 90 прослеженных пациентов). У 10 пациентов в группе применения втулок и у 4 пациентов в группе с конусами.
Проведенный анализ выживаемости протеза после реэндопротезирования с применением различных метафизарных фиксаторов показал, что группы втулок и конусов не различаются статистически значимо (критерий Log Rank (Mantel-Cox) р=0,108). Однако однолетняя выживаемость протеза в группе 1 (втулки) была несколько выше, чем во 2 группе, 96% и 74%, соответственно. В срок наблюдения 2 года «выживаемость» для втулок и конусов составила соответственно 86% и 74%. Медиана наблюдения в группе 2 (конусы) составила всего 12 мес (6-16, квартили). Поэтому 4-х летнюю накопленную выживаемость мы смогли оценить только для группы 1 (втулки), она составила 64%. Такие показатели обусловлены малым числом (12/134, 8,9%) прослеженных пациентов в отдаленном (более 48 мес) периоде (рис. 1).
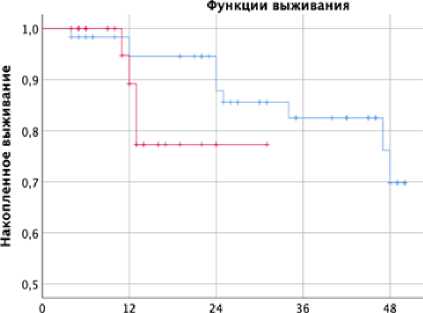
Срок наблюдения, мес
Рисунок 1. Кривая выживаемости (Каплан-Маейра) эндопротеза после реэндопротезирования в группе применения втулок и конусов. Цензурируемые точки – ревизия с реэндопротезированием
Оценку функционального и рентгенологического результата проводили с использованием шкал KSS и KSTKARE соответственно в сроки через 12-24 месяцев после реэндопротезирования. По шкале KSS общая (функциональная и клиническая) отличные результаты (80–100 баллов) зафиксированы у 35% (47/134) пациентов, хорошие (70–79 баллов) — у 31% (42/134), удовлетворительные (60–69 баллов) — у 21% (28/134) и неудовлетворительные (менее 60 баллов) — у 13% (17/134). Медиана KSS общее у всех пациентов составила 75 баллов (6580, квартили), что расценено как хороший результат. После операции группы статистически значимо отличались только по КSS функциональная.
Значительная остеорезорбция выявлена у 2,2% (3/134) пациентов, стабильная - 13,4% (18/134). Отсутствие или непрогрессирующая резорбция наблюдалась у 84,3% (113/134) пациентов через 12-24 мес. после реэндопротезирования. Ни у одного пациента наблюдаемой группы не отмечено прогрессирующей остеорезорбции в зоне бедренного компонента. Группы 1 и 2 не различались по данным рентгенологической шкалы остеорезорбции.
На основе нашего опыта и проведенного исследования, был разработан алгоритм выбора типа метафизарного фиксатора при реТЭКС на основании классификации костных дефектов (AORI), состоянием костномозгового канала и результатами первичной пробной фиксации втулки [17]. Данный алгоритм представлен на рисунке 2. Задачей являлось дифференцировка показаний для подбора метафизарных фиксаторов с учетом технологий их имплантации и используемого для нее инструментария при снижении риска возникновения осложнений, связанных с техникой выполнения оперативных приемов.
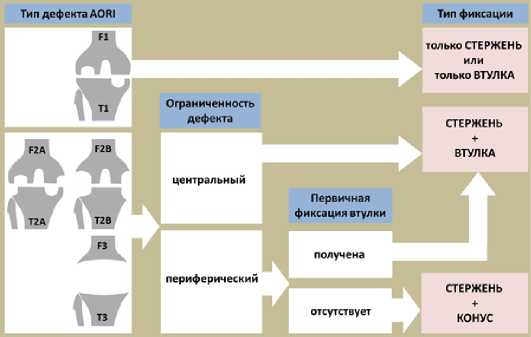
Рисунок 2. Алгоритм выбора типа метафизарного фиксатора при ревизионном эндопротезировании коленного сустава на основании классификации костных дефектов (AORI), ограниченности дефекта и результатами первичной пробной фиксации втулки
При реализации алгоритма учитывались 3 фактора:
-
1- тип костного дефекта по классфикации AORI
-
2- тип костного дефекта по классификации Insall (центральный или периферический)
-
3- качество первичной фиксации метафизарной втулки.
Идентификация типа костного дефекта по классификации AORI определяет необходимость использования метафизарной фиксации. Это соответствует концепции зональной фиксации, сформулированной Morgan Johns и соавторами в 2015 году [18]. Согласно данной концепции при дефектах 2А, 2B и 3 типа по классификации AORI метафизарная фиксация обязательна.
Идентификация костного дефекта по классификации Insall предполагает выбор между метафизарной втулкой и конусом. Так, при центральных ограниченных дефектах кости метафи-зарная втулка получит контакт с костью по всему периметру пористого покрытия, что обеспечит хорошую первичную и вторичную биологическую фиксацию эндопротеза. В случае неограниченного периферического дефекта, когда пористое покрытие втулки контактирует с костью менее чем на 75% периметра (условное значение), первичная фиксация эндопротеза и вторичная биологическая будут под сомнением, что приведет к необходимости перехода на использование метафизарного опорного конуса. Это влечет за собой необходимость смены инструментов ревизионной системы. Это важно, потому что вторичная биологическая фиксация втулки возникает при условии первичной стабильности имплатната, что создает оп- тимальные условия для остеоинтеграции пористого покрытия. Соответственно третий элемент предложенного алгоритма – это оценка качества первичной фиксации. Осуществляется интраоперационно путем проведения теста на ротационную и осевую стабильность рашпиля и тестовой втулки (рис. 3).
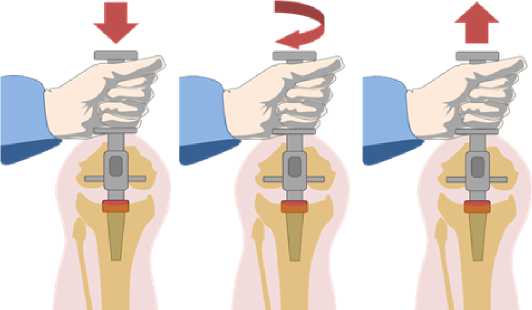
Рисунок 3. Интраоперационная оценка первичной фиксации втулки
При подтверждении стабильности втулки с помощью данного теста возможно ее использование при всех типах дефектов по классификациям AORI и Insall. В случае ротационной и осевой нестабильности тестовой втулки переход на использование метафизарного конуса будет обоснованным.
На практике алгоритм реализовывали следующим образом: при определении 1-го типа по AORI – после удаления компонентов эндопротеза наблюдали относительно нормальную по плот- ности и сохранности губчатую и кортикальную кости метафиза с нормальным уровнем суставной линии. Как правило такой вариант встречался после удаления хорошо фиксированных компонентов эндопротеза, манифестирования ранней переп-протезной инфекциии, нестабильности связочного аппарата коленного сустава. На предоперационных рентгенограммах при 1 типе дефектов бедренной и большеберцовой костей отсутствовали признаки миграции компонентов и остеолиза на интерфейсе имплант/кость, как правило был сохранён нормальный уровень суставной щели а метафизарный сегмент на фронтальных и сагиттальных рентгенограммах выглядел интактным. В случае 1 типа дефекта сохранившаяся губчатая кость не требовала своего замещения металлическими аугментами или структурными аллотрансплантатами, имеющиеся незначительные дефекты, которые появились вследствие работы остеотомом или осциллаторной пилой имели глубину от 1 до 3 миллиметров и заполнялись костной алло- и аутокрошкой или цементом. При выборе конструкции обращали внимание на состояние капсульно-связочного аппарата коленного сустава, где решающим моментом было определение степени связанности ревизионного эндопротеза.
При идентификации дефекта кости как 2А, 2В и 3 тип по классификации AORI, согласно предложенному алгоритму требовалось использование метафизарной втулки или конуса. При использовании метафизарной втулки обработку бедренного и большеберцового каналов выполняли сверлами до первого эндостального контакта. Далее проводили разработку мета-физарной зоны расширяющимся риммером. Эта процедура необходима для предварительного удаления зон остеосклероза, которые могут препятствовать продвижению рашпиля и провоцировать перелом большеберцовой и бедренной кости. Для подготовки костного ложа для втулки использовали рашпили соответствующего размера, начиная с наименьшего (29 мм для большеберцовой и 31 мм для бедренной втулки), постепенно увеличивая размер. При этом обращали внимание на степень покрытия втулки губчатой костью. Как правило, при достаточном покрытии отмечали хорошую ротационную и аксиальную стабильность. Глубину погружения втулки определяли исходя из необходимости восстановления суставной линии. Это связано с тем, что метафизарные втулки DePuy конструктивно связаны с большеберцовым и бедренным компонентами и составляют единое целое, имплантируются так же вместе. При восстановлении линии сустава ориентировались на такие структуры, как рубец мениска, точки прикрепления коллатеральных связок и нижний полюс надколенника. Используя метки на рашпилях, погружали втулку на необходимый уровень. Далее при помощи навигации устанавливали резекторные блоки для выполнения окончательных опилов большеберцовой и бедренной костей. Имплантировали примерочные компоненты эндопротеза и проверяли стабильность компонентов, артикуляцию в суставе и стабильность связочного аппарата, выполняли рентгенографию для подтверждения правильной ориентации эндопротеза в костномозговом канале. В случае подтверждения стабильности тестовой метафизарной втулки устанавливали все компоненты эндопротеза, при этом фиксацию метафизарных втулок и интрамедуллярных стержней осуществляли техникой press-fit, костный цемент использовали для эпифизарной фиксации и заполнения оставшихся дефектов (замещение дефекта костным цементом).
При отсутствии осевой и ротационной стабильности тестовой втулки, принималось решение об использовании опорного конуса из трабекулярного металла. Моделировали костное ложе с помощью рашпилей и буров, имплантировали тестовый конус и производили установку примерочных компонентов эндопротеза с целью проверки артикуляции и стабильности в суставе. Далее выполняли имплантацию конуса по методике press fit, бесцементно. Устанавливались компоненты ревизионного эндопротеза со стержнями, связь конуса с эндопротезом осуществлялась через цементную мантию.
Клинический пример №1: Мужчина 55 лет обратился на 2 этап лечения перипротезной инфекции. При планировании оперативного вмешательства по данным рентгенографии выявлен неправильно сросшийся перелом бедренной кости, что создавало потенциальные сложности для установки интрамедуллярного стержня. При обработке метафизарной кости был выявлен дефект типа F1/T2B по AORI (рис. 4).
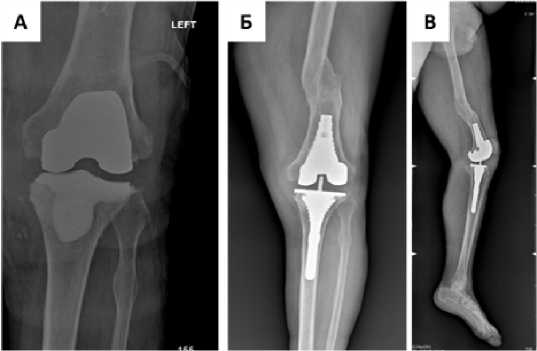
Рисунок 4. Рентгенограммы коленного сустава пациента Ч. А – с установленным артикулирующим спейсером. Б, В – после реТЭКС ревизионным эндопротезом с метафизарными втулками, прямая (Б) и боковая (В) проекции
Согласно алгоритму, так как в бедренной кости выявлен центральный дефект 1 типа, было принято использовать ме-тафизарную втулку без стержня, что в значительной степени облегчило установку ревизионного бедренного компонента на фоне деформации костномозгового канала. В отношении большеберцовой кости, учитывая ограниченность и центральную локализацию дефекта при обработке рашпилями удалось добиться адекватной ротационной и аксиальной стабильности для большеберцовой втулки, что обеспечило хорошую первичную стабильность и соблюдение принципа зональной фиксации реТЭКС.
Клинический пример №2. Женщина 69 лет. Диагноз: Пери-протезная инфекция, состояние после реТЭКС неартикулирующим спейсером Дефект костный идентифицирован как F2b/ T3 по классификации AORI (рис. 5А). Определены показания к использованию метафизарной фиксации.
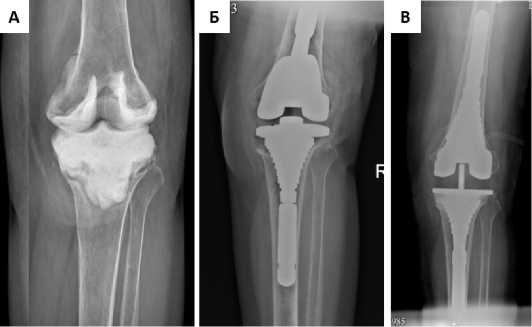
Рисунок 5. Рентгенограммы коленного сустава пациента С. А – спейсер коленного сустава. Б – интраоперационная рентгенограмма с тестовыми компонентами. В – состояние после реТЭКС ревизионным эндопротезом с метафизарными втулками
После удаления всех компонентов спейсера выявлен дефект кости: тип дефекта – F2b (AORI) центральный (Insall), T3 (AORI) периферический промежуточный 5-10 мм (Insall). При попытке установки большеберцовой втулки была получена стабильная фиксация тестового компонента, выполнена контрольная интраоперационнная рентгенограмма (рис. 5Б). Согласно имеющемуся алгоритму произведено реТЭКС с использованием метафизарных втулок (рис. 5В).
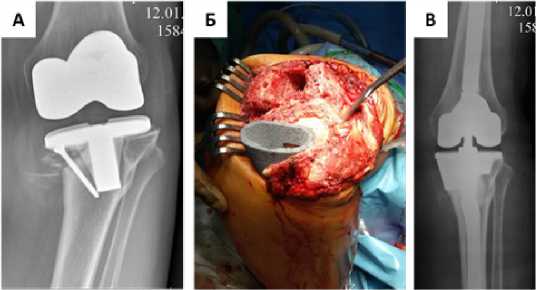
Рисунок 6. Рентгенограмма коленного сустава пациентки М, нестабильность большеберцового компонента. Б – интраоперационная фотография, установлен большеберцовый конус из трабекуллярного металла. В – состояние после ревизионного эндопротезирования с замещением дефекта большеберцовой кости опорным танталловым конусом
Клинический пример №3. Женщина 70 лет. Диагноз: Состояние после ТЭКС левого коленного сустава, асептическая нестабильность большеберцового компонента (рисунок 6А). После удаления всех компонентов эндопротеза идентифицировали тип дефекта AORI F1/T2b, выявлен периферический большой дефект медиального мыщелка по Insall, первичная фиксация тестовой втулки отсутствовала. Согласно предложенному алгоритму выполнили замещение дефекта большеберцовой кости опорным конусом из трабекуллярного металла (рис. 6Б).
На контрольных рентгеновских снимках отмечается полное замещение дефекта кости и корректное положение компонентов эндопротеза (рис. 6В).
Обсуждение
Полученные в ходе проведенного исследования данные свидетельствуют о хороших результатах ревизионного эндопротезирования с применением метафизарных систем фиксации. сходные функциональные, рентгенологические и клинические результаты и втулок и конусов обусловлены единой стратегией соблюдения принципов зональной фиксации. высокий показатель выживаемости - 89% при среднем периоде наблюдения около 2 лет и отсутствие отличий в показании ко второй ревизии, соответствуют данным зарубежной литературы. необходимо отметить, что количество и качество исследований, посвященных метафизарной фиксации при реТЭКС постоянно улучшается. внимания заслуживает систематический обзор литературы, опубликованный в 2021 г. roach с соавт., который включает 12 исследований по применению втулок и 15 – по использованию конусов при реТЭКС [19]. в 12 исследованиях было имплантировано 1617 втулок при 1133 реТЭКС у 1025 пациентов. в 15 исследованиях имплантировано 701 танталовый конус при 620 реТЭКС у 612 пациентов. показатели асептического расшатывания втулок и конусов не различались (0.8% и 1,7%, соответственно). однако частота ревизий была почти вдвое выше при использовании конусов, чем втулок, 18.7% и 9,7%, соответственно. обращает на себя внимание тот факт, что конусы из трабекуллярного металла чаще использовались при дефектах кости 2b и 3 типа по AORI – в 82% (553 из 702 наблюдений), а метафизарные втулки в 61% случаев массивных дефектов кости (933 из 1617 наблюдений).
Так и в нашем ретроспективном исследовании на большой когорте пациентов выживаемость эндопротезов коленного сустава в раннем и среднесрочном периоде наблюдения (медиана 24 мес., 11-42 мес. квартили) составила 89,6% (120/134). Однако обращают на себя внимание некоторые различия в длительности оперативного вмешательства, интраоперационной кровопотери и сроках наблюдения между группами пациентов с метафизарными втулками и опорными конусами. На наш взгляд меньшее время оперативного вмешательства в группе с метафизарными втулками можно объяснить более простой и воспроизводимой техникой обработки костного ложа для имплантата. Дело в том, что втулка тесно связана с большеберцовым и бедренным компонентами эндопротеза и обработка костномогового канала и метафизарной зоны сходна с таковой при эндопротезировании тазобедренного сустава. Аналогично технике обработки бедренной кости с помощью специального рашпиля за счёт поступательных движений обеспечивается уплотнение метафизарной кости и погружение большеберцового и бедренного компонентов на необходимую глубину, что позволяет на этапе обработки регулировать положение линии сустава и размеры сгибательного и разгибательного промежутков. При использовании опорного конуса, производится раздельная и поочередная обработка кости под конус и остальные компоненты (бедренный, большеберцовый компоненты) ревизионного эндопротеза, что безусловно требует дополнительного времени и как следствие влияет на уровень интраоперационной кровопотери. Факторы времени и уровня кровопотери косвенно могут определять риск инфекционных осложнений, что на наш взгляд делает ревизионное эндопротезирование с помощью метафизарных втулок более предпочтительным. В связи с этим в процессе исследования на основании нашего опыта был предложен алгоритм выбора метафизарного фиксатора, при котором особое внимание уделяется определению ограничений для использования ме-тафизарной втулки рутинно. С этой целью были совмещены две классификации костных дефектов: AORI (для выявления показаний к метафизарной фиксации), классфикация Insall, согласно которой наличие периферического дефекта должно вызывать настороженность при использовании втулки, что требует обязательной оценки первичной стабильности на тестовых компонентах, как третьей составляющей предложенного алгоритма.
Как было сказано ранее, выбор между метафизарным конусом или втулками в настоящее время дискутируется и в значительной степени определяется предпочтениями хирурга и, возможно, формой и размером костного дефекта. Однако долгосрочные клинические результаты и выживаемость имплантатов после реТЭКС остаются субоптимальными и зависят от множества факторов, таких как причина ревизии, хирургический доступ, тип используемого имплантата. Необходимы дополнительные научные данные, чтобы помочь выбрать оптимальный метод для каждого пациента.
Использование классификаций дефектов кости в совокупности интраоперационно определяемыми признаками, характеризующими состояние остаточной костной массы, широту анатомической дозволенности выполнения оперативных приемов и соответствующего им инструментария, а также оценку первичной фиксации втулки позволяет осуществить правильный подбор замещающего имплантата для обеспечения стабильной ротационной и аксиальной фиксации с учетом значительных отличий в особенностях хирургической техники установки втулок и конусов. Учет дополняющих друг друга признаков позволяет четко разграничить показания к использованию втулок и конусов для исключения интраоперационных осложнений, создавая для врача стандарт для принятия решений. Данный алгоритм внедрен в клиническую практику в НИИТОН СГМУ.
Заключение
В настоящее время существует несколько стратегий фиксации имплантатов для реТЭКС при наличии костных дефектов. Полученные в ходе настоящего исследования хорошие клиникорентгенологические результаты использования метафизарных втулок и конусов при реТЭКС в ранние и средние сроки после операции позволяют рекомендовать их использование при дефектах костей образующих коленный сустав 2А, 2В и 3 типа по классификации AORI. Оба метода обеспечивают надежное восстановление костных дефектов с сопоставимыми клиническими и рентгенологическими результатами и выживаемостью. Однако имеющиеся осложнения и неудовлетворительные клинические результаты определяют необходимость дальнейшего изучения и анализа отдаленных результатов применения данных конструкций. В связи с этим должны быть разработаны новые подходы для улучшения показателей выживаемости имплантатов и повышения качества жизни пациентов. Внедрение новых алгоритмов выбора того или иного метода фиксации, учитывающие размер дефектов кости, возраст, уровень активности является следующим шагом к улучшению результатов лечения этой сложной группы пациентов.
Список литературы Алгоритм выбора метафизарной фиксации при ревизионной артропластике коленного сустава
- Куляба Т.А., Корнилов Н.Н., Селин А.В., Разорёнов В.Л., Кроитору И.И., Петухов А.И., Каземирский А.В., Засульский Ф.Ю., Игнатенко В.Л., Сараев А.В. Способы компенсации костных дефектов при ревизионном эндопротезировании коленного сустава // Травматология и ортопедия России. 2011;17(3):5-12. [Kulyaba T.A., Kornilov N.N., Selin A.V., Razorenov V.L., Kroitoru I.I., Petukhov A.I., Kazemirsky A.V., Zasulsky Ph.Yu., Ignatenko V.L., Saraev A.V. The ways of bone defects compensation in revision knee arthroplasty // Travmatologiya i ortopediya Rossii (Traumatology and orthopedics of Russia). 2011;17(3):5-12. In Russian].
- Engh G.A., Ammeen D.J. Bone loss with revision total knee arthroplasty: defect classification and alternatives for reconstruction // Instr Course Lect. 1999;(48):167-75.
- Lei P.-F., Hu R.-Y., Hu Y.-H. Bone Defects in Revision Total Knee Arthroplasty and Management // Orthop Surg. 2019;11(1):15-24. DOI: 10.1111/os.12425
- Бовкис Г.Ю., Куляба Т.А., Корнилов Н.Н. Компенсация дефектов метаэпифизов бедренной и большеберцовой костей при ревизионном эндопротезировании коленного сустава – способы и результаты их применения (обзор литературы) // Травматология и ортопедия России. 2016;22(2):101-113. [Bovkis G.Y., Kulyaba T.A., Kornilov N.N. Management of femur and tibia metaphyseal bone defects during revision knee arthroplasty – methods and outcomes (review) // Travmatologiya i ortopediya Rossii (Traumatology and orthopedics of Russia). 2016;22(2):101-113. In Russian].
- Bauman R.D., Lewallen D.G., Hanssen A.D. Limitations of structural allograft in revision total knee arthroplasty // Clin Orthop Relat Res. 2009;467(3):818-24. DOI: 10.1007/s11999-008-0679-4
- Lotke P.A., Carolan G.F., Puri N. Impaction grafting for bone defects in revision total knee arthroplasty // Clin Orthop Relat Res. 2006;446:99-103. DOI: 10.1097/01.blo.0000214414.06464.00
- Patel J.V., Masonis J.L., Guerin J., Bourne R.B., Rorabeck C.H. The fate of augments to treat type-2 bone defects in revision knee arthroplasty // J Bone Joint Surg Br. 2004;86(2):195-199. DOI: 10.1302/0301-620x.86b2.13564
- Kamath A.F., Lewallen D.G., Hanssen A.D. Porous tantalum metaphyseal cones for severe tibial bone loss in revision knee arthroplasty: a five to nine-year follow-up // J Bone Joint Surg A. 2015;97(3):216-223. DOI: 10.2106/JBJS.N.00540
- Byttebier P., Dhont T., Pintelon S., Rajgopal A., Burssens A., Victor J. Comparison of Different Strategies in Revision Arthroplasty of the Knee with Severe Bone Loss: A Systematic Review and Meta-Analysis of Clinical Outcomes // J Arthroplasty. 2022;37(6S):S371-S381.e4. DOI: 10.1016/J.ARTH.2022.02.103
- Beckmann N.A., Mueller S., Gondan M., Jaeger S., Reiner T., Bitsch R.G. Treatment of severe bone defects during revision total knee arthroplasty with structural allografts and porous metal cones-a systematic review // J Arthroplasty. 2015;30(2):249-253. DOI: 10.1016/J.ARTH.2014.09.016
- Bohl D.D., Brown N.M., McDowell M.A., Levine B.R., Sporer S.M., Paprosky W.G, Della Valle C.J. Do Porous Tantalum Metaphyseal Cones Improve Outcomes in Revision Total Knee Arthroplasty? // J Arthroplasty. 2018;33(1):171-177. DOI: 10.1016/j.arth.2017.07.033
- Sandiford N.A., Misur P., Garbuz D.S., Greidanus N.V., Masri B.A. No difference between trabecular metal cones and femoral head allografts in revision TKA: Minimum 5-year Follow-up // Clin Orthop Relat Res. 2017;475(1):118-124. DOI: 10.1007/S11999-016-4898-9
- Rodríguez-Merchán E.C., Gómez-Cardero P., Encinas-Ullán C.A. Management of bone loss in revision total knee arthroplasty: therapeutic options and results // EFORT open Rev. 2021;6(11):1073-1086. DOI: 10.1302/2058-5241.6.210007
- Гиркало М.В. База данных интраоперационных параметров, определяющих выбор метафизарных фиксаторов для замещения костных дефектов при ревизионном эндопротезировании коленного сустава. Рег. №2021622939, дата регистрации: 14.12.2021. [Girkalo M.V. Database of intraoperative parameters determining the choice of metaphyseal fixators for bone defect replacements in revision knee arthroplasty. Reg. N 2021622939 of Dec. 14, 2021. In Russian].
- Insall J.N., Dorr L.D., Scott R.D., Scott W.N. Rationale of the Knee Society clinical rating system // Clin Orthop Relat Res. 1989;248:13-14.
- Ewald F.C. The Knee Society total knee arthroplasty roentgenographic evaluation and scoring system // Clin Orthop Relat Res. 1989;248:9-12.
- Гиркало М.В. Патент на изобретение «Способ подбора метафизарного фиксатора для замещения обширных дефектов больше-берцовой кости при ревизионном эндопротезировании коленного сустава». Рег. №2777929, дата регистрации 11.08.2022. [Girkalo M.V. Invention certificate for the Method of the metaphyseal fixator selection to replace extensive tibia defects in revision knee arthroplasty. Reg. N 2021622939 of Aug. 11, 2022. In Russian].
- Morgan-Jones R., Oussedik S.I.S., Graichen H., Haddad F.S. Zonal fixation in revision total knee arthroplasty // Bone Joint J. 2015;97-B(2):147-149. DOI: 10.1302/0301-620X.97B2.34144
- Roach R.P., Clair A.J., Behery O.A., Thakkar S.C., Iorio R., Deshmukh A.J. Aseptic loosening of porous metaphyseal sleeves and tantalum cones in revision total knee arthroplasty: a systematic review // J Knee Surg. 2021;34(10):1033-1041. DOI: 10.1055/s-0040-1701434


