Алкилирование 2-аминопиридина аллилбромидом и металлилхлоридом
Автор: Ким Дмитрий Гымнанович, Бердникова Елена Владимировна, Слепухин Павел Александрович
Журнал: Вестник Южно-Уральского государственного университета. Серия: Химия @vestnik-susu-chemistry
Рубрика: Органическая химия
Статья в выпуске: 4 т.6, 2014 года.
Бесплатный доступ
Изучено взаимодействие 2-аминопиридина с аллилбромидом и металлилхлоридом в нейтральной и щелочной средах. Методом масс-спектрометрии найдено, что в 2-пропаноле в присутствии КОН аллилирование протекает как по экзоциклическому, так и по эндоциклическому атомам азота с образованием смеси моно- и диаллильных производных.
2-аминопиридин, 2-аллиламинопиридин, 1-аллил-2-иминопиридин, 1-аллил-2-аллилиминопиридин, 2-диаллиламинопиридин, 1-металлил-2-иминопиридин, 1-металлил-2-металлилиминопиридин, рентгеноструктурный анализ, хроматомасс-спектрометрия
Короткий адрес: https://sciup.org/147160301
IDR: 147160301 | УДК: 547.822.7
Текст научной статьи Алкилирование 2-аминопиридина аллилбромидом и металлилхлоридом
2-Аминопиридин ( 1 ) является ценным исходным реагентом для создания самых разных гетероциклических систем. Одним из приемов построения таких систем является введение алкенильных заместителей с последующей их функционализацией. По литературным данным 2-аминопиридин алкилируется в ацетоне по эндоциклическому атому азота [1–3]. Чтобы осуществить алкилирование по экзоциклическому атому азота необходимо проведение реакции с натриевым производным 2-аминопиридина в отсутствии воды [4]. При алкилировании 2-аминопиридина хлористым аллилом в присутствии щелочи образуется 2-аллиламинопиридин ( 2 ) и 1-аллил-2-иминопиридин ( 3 ) [5]. 2-Циклогексиламинопиридин и 2-изопропиламинопиридин получены реакцией 2-аминопиридина с циклогексанолом и изопропиловым спиртом в присутствии 80–85 % H 2 SO 4 [6]. В то же время в литературе нет данных о диаллильных производных 2-аминопиридина, представляющих интерес для синтеза полифункциональных гетероциклических систем. В настоящей работе нами методом хроматомасс-спектрометрии (ХМС) проведено детальное исследование взаимодействия 2-аминопиридина с аллилбромидом и металлилхлори-дом в различных условиях.
Обсуждение результатов
При взаимодействии 2-аминопиридина с аллилбромидом в ацетоне образуется бромид 1-аллил-2-аминопиридиния ( 4 ), структура которого доказана методом ЯМР 1Н, 13С [3, 7].
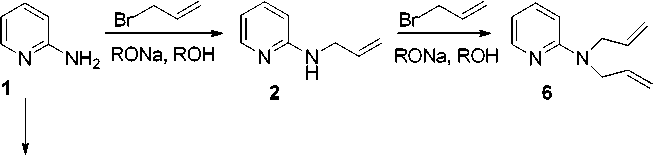
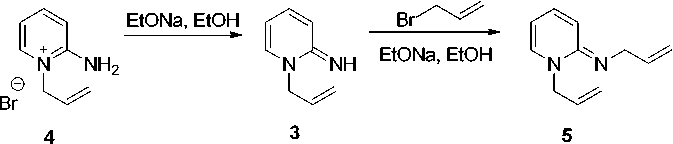
Схема 1. Синтез аллильных производных 2-амнопиридина
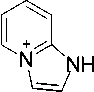
Нами найдено, что бромид 4 реагирует с этилатом натрия в этаноле с образованием имина 3 (схема 1). В масс-спектре имина 3 (рис. 1, табл. 1) максимальным является пик с m/z 119, соответствующий отщеплению метильного радикала с образованием ароматического 1 H -имидазо[1,2- а ]пиридиниевого катиона (схема 2).
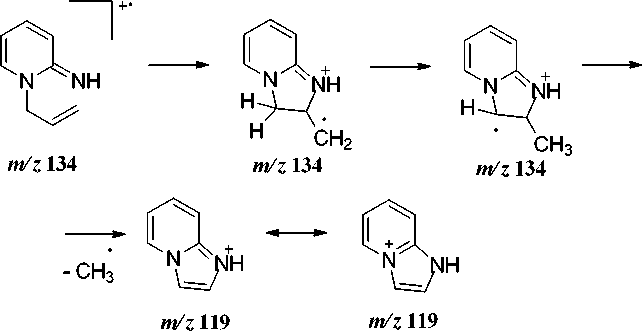
Схема 2. Фрагментация 1-аллил-2-иминопиридина 1-аллил-2-иминопиридина
Рис. 1. Масс-спектр
При взаимодействии бромида 4 с аллилбромидом в этаноле в присутствии двукратного избытка этилата натрия образуется 1-аллил-2-аллилиминопиридин ( 5 ). В его масс-спектре (рис. 2) имеется пик молекулярного иона [M]+•, а максимальным является пик с m/z 159, соответствующий катиону [M–СH3]+.
I, %
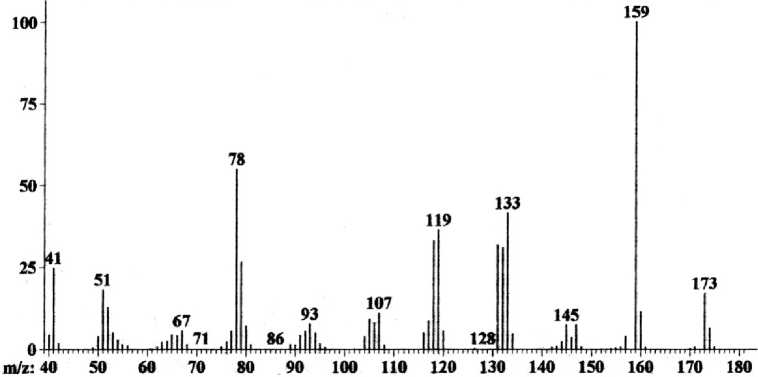
Рис. 2. Масс-спектр 1-аллил-2-аллилиминопиридина
При проведении реакции 2-аминопиридина с аллилбромидом в 2-пропаноле в присутствии КОН методом ХМС обнаружены аллил 2 , диаллил 5 и 2-диаллиаминопиридин ( 6 ). Диаллил 5 может образоваться только при дальнейшем аллилировании аллила 3 . Таким образом, аллилиро-вание 2-аминопиридина в щелочной среде протекает как по экзоциклическому, так и по эндоцик-лическому атому азота.
Масс-спектры соединений 2 (рис. 3) и 3 практически похожи, но есть и различия. В масс-спектре аллила 2 пик молекулярного иона [M]+• интенсивнее пика [M–H]+, а в спектре аллила 3 наоборот интенсивнее пик [M–H]+. В масс-спектре аллила 2 , так же, как и в аллиле 3, максимальным является пик с m/z 119, соответствующий отщеплению метильного радикала по схеме 3.
I, %
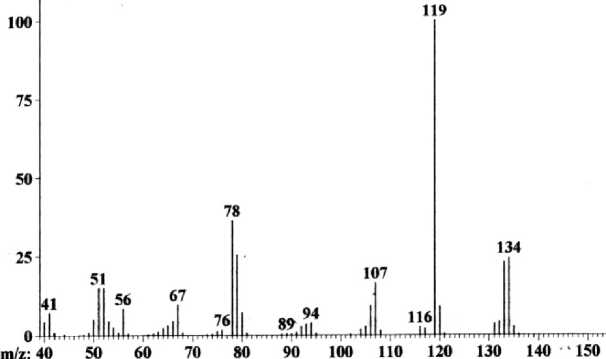
Рис. 3. Масс-спектр 2-аллиламинопиридина
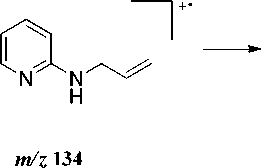
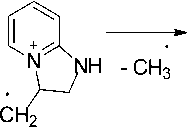
m/z 134
m/z. П9
Схема 3. Фрагментация 2-аллиламинопиридина
В масс-спектрах диаллильных соединений 5 и 6 (рис. 4) есть различия. Так, в спектре соединения 5 максимальным является пик с m/z 159 (отщепление метильного радикала), а соединения 6 – m/z 133 (отщепление аллильного радикала). В масс-спектре диаллила 5 интенсивность пика молекулярного иона [M]+• меньше, чем пика [M–H]+, а в диаллиле 6 наоборот.
I, %
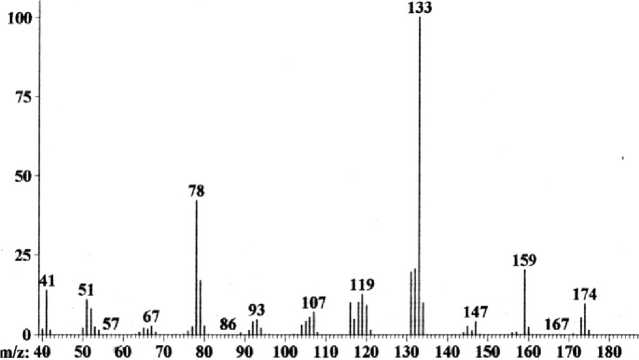
Рис. 4. Масс-спектр 2-диаллиламинопиридина
Более селективно протекает аллилирование 2-аминопиридина в изопропиловом спирте в присутствии изопропилата натрия, при этом образуются аллильное соединение 2 и незначительное количество диаллильного производного 6 .
В двухфазной системе KOH+H2O+CH2Cl2 в присутствии межфазного катализатора ТБАБ (тетрабутиламмоний бромид) основным продуктом неожиданно оказался диаллил 5. Это возможно при условии, что в двухфазной системе аллилирование протекает по эндоциклическому атому азота.
Таблица 1
Данные масс-спектров исследованных соединений
|
Соединение |
Характеристики ионов: m/z ( I, %) |
|
2 (C 8 H 10 N 2 ) |
134 [M]+• (24), 133 [M–H]+ (23), 120 (9), 119 [M–CH 3 ]+ (100), 107 [M–C 2 H 3 ]+ (17), 106 (9), 93 [M–C 3 H 5 ]+ (5), 80 (7), 79 (26), 78 [M–C 3 H 6 N]+ (30), 67 (10), 56 (9), 52 (15), 51 (15), 50 (6), 41 (7) |
|
3 (C 8 H 10 N 2 ) |
134 [M]+• (26), 133 [M–H]+ (39), 132 (7), 120 (9), 119 [M–CH 3 ]+ (100), 107 [M– C 2 H 3 ]+ (7), 106 (11), 93 [M–C 3 H 5 ]+ (6), 80 (9), 79 (16), 78 [M–C 3 H 6 N]+ (36), 77 (6), 67 (19), 66 (7), 53 (7), 52 (15), 51 (16), 43 (13) |
|
5 (C 11 H 14 N 2 ) |
174 [M]+• (7), 173 [M–H]+ (17), 160 (11), 159 [M–CH 3 ]+ (100), 147 [M–C 2 H 3 ]+ (7), 145 (7), 134 (5), 133 [M–C 3 H 5 ]+ (42), 132 (31), 131 (32), 120 (6), 119 [M–C 3 H 6 N]+ (37), 118 (33), 117 (9), 116 (5), 107 (11), 106 (8), 105 (9), 94 (6), 93 (8), 92 (6), 80 (7), 79 (27), 78 (44), 77 (6), 67 (6), 53 (5), 52 (14), 51 (19), 41 (26), 40 (5) |
|
6 (C 11 H 14 N 2 ) |
174 [M]+• (10), 173 [M–H]+ (6), 159 [M–CH 3 ]+ (21), 134 (10), 133 [M–C 3 H 5 ]+ (100), 132 (21), 131 (20), 120 (10), 119 [M–C 3 H 6 N]+ (13), 118 (6), 117 (6), 116 (10), 107 (7), 106 (6), 93 (5), 79 (17), 78 (42), 52 (9), 51 (11), 41 (14) |
|
8 (C 9 H 12 N 2 ) |
148 [M]+• (37), 147 [M–H]+ (23), 134 (10), 133 [M–CH 3 ]+ (100), 132 (12), 131 (5), 107 (37), 80 (8), 79 (16), 78 (35), 70 (7), 53 (5), 52 (9), 51 (11), 39 (8) |
|
9 (C 13 H 18 N 2 ) |
202 [M]+• (17), 201 [M–H]+ (11), 188 (11), 187 [M–CH 3 ]+ (73), 161 (8), 159 (5), 148 (12), 147 (100), 146 [M–C 3 H 6 N]+ (14), 145 (20), 134 (26), 133 (45), 132 (38), 131 (21), 119 (5), 118 (6), 107 (13), 105 (9), 95 (9), 93 (5), 80 (6), 79 (13), 78 (39), 55 (9), 53 (5), 52 (7), 51 (9) |
Примечание. Пики с интенсивностью менее 5 % не учитывались.
При взаимодействии 2-аминопиридина с металлилхлоридом в 2-пропаноле образуется хлорид 1-металлил-2-аминопиридиния ( 7 ) (схема 4), который кристаллизуется из реакционного раствора. Его структура подтверждается данными РСА (рис. 5, табл. 2).
17 8
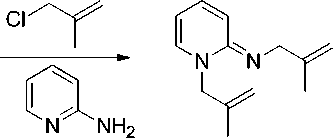
Схема 4. Взаимодействие 2-аминопиридина с металлилхлоридом
По данным РСА, две кристаллографически независимые молекулы кристаллизуются в виде хлорида состава Het+Cl–. Молекулы имеют близкие геометрические параметры. Общий вид и принятая в структурном эксперименте нумерация атомов соединения представлены на рис. 5 на примере одной из молекул, номера атомов второй молекулы несут дополнительный индекс «А». Сравнение геометрических параметров приводится в табл. 2. Согласно полученным данным, длины связей и валентные углы соединений близки к стандартным, а наблюдаемые отклонения от стандартных величин вполне ожидаемы и объяснимы. В частности, эффект гиперконъюгации приводит к заметному укорочению формально одинарных связей С(6)–С(7) и С(9)–С(7) в металлильной группировке, а делокализация заряда гетероцикла – к существенному укорочению связи С–NH2 до величины 1,32(1) Å. Такое значение длины связи, даже более короткой, чем связи C–N в гетероцикле (1,36(1) Å), а также плоская геометрия СAr-NH2-группы указывают на нахождение катиона преимущественно в иминиевой форме С=NH2+.
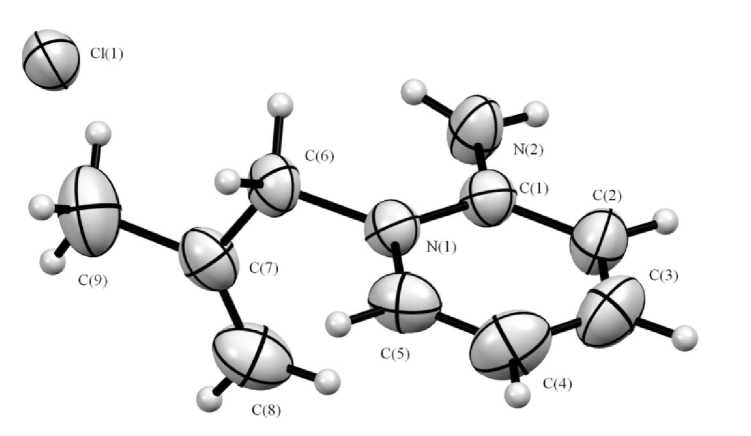
Рис. 5. Соединение 7 в тепловых эллипсоидах 50 % вероятности
Аллильный заместитель при N(1) располагается в плоскости, практически перпендикулярной плоскости гетероцикла, что, очевидно, обусловлено стерическими факторами (требованием отсутствия контактов между атомами заместителя, гетероцикла, и связанными межмолекулярными водородными связями (ММВС) с NH 2 -группами атомами хлора, располагающимися в плоскости гетероцикла). Данные ММВС, в которых каждый атом хлора связан с двумя аминогруппами, а каждая аминогруппа – с двумя атомами хлора, приводят к формированию молекулярной упаковки в виде бесконечных лент молекул. Иные значимо укороченные межмолекулярные контакты в кристалле отсутствуют.
Таблица 2
Избранные длины связей, валентные и торсионные углы соединения
|
Молекула 1 |
Молекула 2 |
||
|
Связь/угол |
Длина, Å/угол, о |
Связь/угол |
Длина, Å/ угол, о |
|
N(1)–C(1) |
1,3619(17) |
N(1A)–C(1A) |
1,3510(16) |
|
N(1)–C(5) |
1,3670(18) |
N(1A)–C(5A) |
1,3694(18) |
|
N(1)–C(6) |
1,4643(18) |
N(1A)–C(6A) |
1,4706(18) |
|
C(1)–N(2) |
1,3237(18) |
C(1A)–N(2A) |
1,3263(18) |
|
C(1)–C(2) |
1,399(2) |
C(1A)–C(2A) |
1,400(2) |
|
C(6)–C(7) |
1,499(2) |
C(6A)–C(7A) |
1,494(2) |
|
C(7)–C(8) |
1,313(2) |
C(7A)–C(8A) |
1,309(2) |
|
C(7)–C(9) |
1,498(2) |
C(7A)–C(9A) |
1,487(2) |
|
C(8)–C(7)–C(9) |
123,76(16) |
C(8A)–C(7A)–C(9A) |
122,39(18) |
|
C(8)–C(7)–C(6) |
123,04(16) |
C(8A)–C(7A)–C(6A) |
123,63(16) |
|
C(9)–C(7)–C(6) |
113,21(15) |
C(9A)–C(7A)–C(6A) |
113,98(16) |
|
N(2)–C(1)–N(1) |
120,13(14) |
N(2A)–C(1A)–N(1A) |
120,92(14) |
|
C(5)–N(1)–C(6)–C(7) |
-92,38(15) |
C(5A)–N(1A)–C(6A)–C(7A) |
82,61(16) |
|
C(1)–N(1)–C(6)–C(7) |
86,34(16) |
C(1A)–N(1A)–C(6A)–C(7A) |
-92,39(16) |
Нами методом ХМС исследован раствор после отделения хлорида 7 , при этом обнаружены исходный 2- аминопиридин, 1 -металлил-2-иминопиридин (рис. 6) ( 8 ) и следы 1-металлил-2-металлилиминопиридина ( 9 ) ( рис. 7 ). Диаллил 9 , очевидно, образуется за счет дальнейшего алки лирования по иминогруппе соединения 8 , а катализатором реакции служит 2-аминопиридин, об ладающий основными свойствами.
I , %
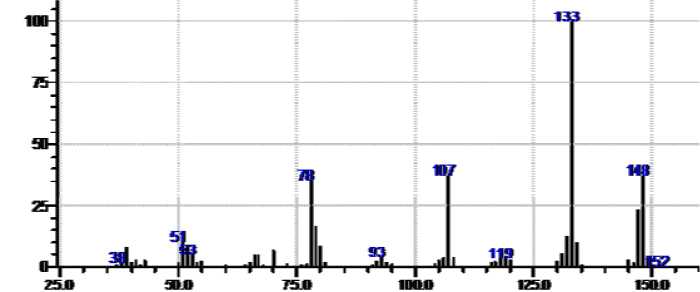
Рис. 6. Масс-спектр 1-металлил-2-иминопиридина
m/z
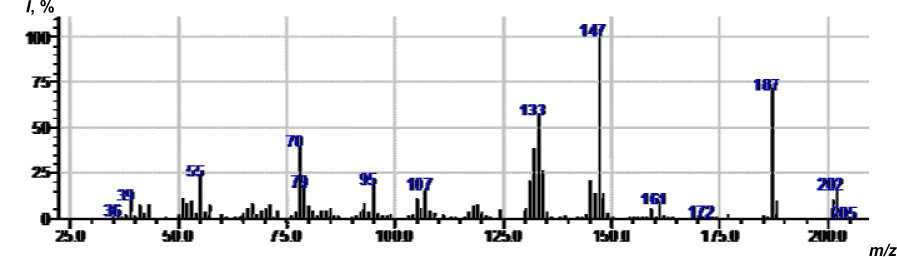
Рис. 7. Масс-спектр 1-металлил-2-металлилиминопиридина
В масс- спектре соединения 8 имеется пик молекулярного иона [M]+• с m/z 148, а максимальным является пик с m/z 133, со ответствующий отщеплению метильного рад икала .
Экспериментальная часть
Масс- спектры электронного удара сняты на газовом хроматомасс -спектрометре GCMS-QP2010 Ultra фирмы Shimadzu при энергии ионизации 70 эВ, а также на хроматомасс-спектрометре ГХ/МС- ЭВМ фи рмы Hewlet Packard, газовый хроматограф H P -5890, серия II, масс-селективный детектор MSD- 5972 при энергии ионизации 70 эВ.
РСА проведён для обломка бесцветного кристалла размером 0,43×0,34×0,21 мм на автоматическом монокристальном четырёхкружном дифрактометре «Xcalibur S» по стандартной процедуре (МоК-излучение, графитовый монохроматор, Т= 295(2) К, ω-сканирование с шагом 1о). Поправка на поглощение не вводилась (μ=0,325 мм–1). На углах отражений 2,68 < θ < 28,29o собрано 9371 отражений, из них независимых 4924 (Rint = 0,0268), в том числе 2274 с I>2σ(I). Кристалл моноклинный, a= 15,524(2) Å; b= 8,8113(11) Å; c= 15,794(2) Å; β=109,072(12)o; V= 2041,9(5) Å3; пр.гр. P21/n, комплектность для θ= 28,29o– 97,2 %. Для Z= 8 брутто-состав C9H13ClN2, М= 184,66, Dcalc= 1,201 г/см3. Структура решалась прямым методом и уточнялась полноматричным МНК по F2 c использованием программного пакета SHELXTL [8]. Неводородные атомы уточнены в анизотропном приближении, атомы водорода С–Н-связей добавлены в рассчитанные положения и включены в уточнение в модели «наездника», протоны N–H-групп уточнялись независимо в изотропном приближении. Окончательные параметры уточнения: R1= 0,0337; wR2= 0,0602 (по отражениям с I>2σ(I)), R1= 0,0826, wR2= 0,0626 (по всем отражениям) при факторе доброт- ности GooF= 1,000. Пики максимума и минимума остаточной электронной плотности Δρē= 0,217/–0,179 ēÅ–3.
Результаты РСА депонированы в Кембриджском банке структурных данных под номером CCDC 1025201. Эти данные находятся в свободном доступе и могут быть запрошены по адресу
Бромид 1-аллил-2-аминопиридиния (2) . Получен по методу [5]. Т. пл. 142 °С. Выход 85 %.
1-Аллил-2-аминопиридий (3). К 1,07 г (5 ммоль) бромида 2 добавляют раствор 0,115 г (5 ммоль) натрия в 5 мл этанола и перемешивают 30 минут. Отгоняют этанол, остаток экстрагируют 3 мл дихлорметана, фильтруют и испаряют CH 2 Cl 2 . Остаток исследуют методом ХМС.
1-Аллил-2-аллиламинопиридин (5) . Растворяют 0,23 г (10 ммоль) натрия в 6 мл этилового спирта, добавляют 1,07 г (5 ммоль) бромида 2 , затем 0,65 мл (7,5 ммоль) аллилбромида и перемешивают в течение 1 ч. Через 24 ч отгоняют растворитель. Остаток обрабатывают 4 мл CH 2 Cl 2 , фильтруют, испаряют CH 2 Cl 2 . Остаток исследуют методом ХМС.
Взаимодействие 2-аминопиридина с аллилбромидом
-
а) В присутствии КОН . Растворяют 0,56 г (10 ммоль) КОН в 7 мл изопропилового спирта, добавляют 0,47 г (5 ммоль) 2-аминопиридина, затем 0,65 мл (7,5 ммоль) аллилбромида, перемешивают при комнатной температуре 1 ч. Через 24 ч отфильтровывают, испаряют изопропиловый спирт. Остаток обрабатывают 5 мл CH 2 Cl 2 , фильтруют, испаряют CH 2 Cl 2 . Остаток исследуют методом ХМС.
-
б) В присутствии изопропилата натрия. Растворяют 0,115 г (5 ммоль) натрия в 6 мл изопропилового спирта, добавляют 0,47 г (5 ммоль) 2-аминопиридина, затем 0,65 мл (7,5 ммоль) ал-лилбромида, перемешивают при комнатной температуре 1 ч. Через 24 ч отфильтровывают, испаряют спирт. Остаток обрабатывают 4 мл CH 2 Cl 2 .
-
в) В двухфазной системе в присутствии межфазного катализатора. В 7 мл воды растворяют 0,47 г (5 ммоль) 2-аминопиридина, добавляют 1,61 г (5 ммоль) ТБАБ (тетрабутиламмоний бромид). К смеси добавляют раствор 0,65 мл (7,5 ммоль) аллилбромида в 3 мл CH 2 Cl 2 , сушат 2 г CaCl 2 , фильтруют, испаряют CH 2 Cl 2 . Остаток исследуют методом ХМС.
Хлорид 1-металлил-2-аминопиридиния (8) . Растворяют 0,47 г (5 ммоль) 2-аминопиридина в 5 мл изопропилового спирта, добавляют 0,59 мл (6 ммоль) металлилхлорида. Через 24 ч отфильтровывают выпавшие кристаллы и прекристаллизовывают из ацетонитрила. Выход 0,395 г (43 %) T. пл. 215 °С.
Заключение
При взаимодействии 2-аминопиридина с металлилхлоридом в отсутствие основания образуется хлорид 1-металлил-2-аминопиридиния, структура которого подтверждена методом РСА. При взаимодействии бромида 1-аллил-2-аминопиридиния с этилатом натрия образуется 1-аллил-2-иминопиридин, а с аллилбромидом в присутствии этилата натрия – 1-аллил-2-аллилиминопиридин. Методом хроматомасс-спектрометрии найдено, что аллилирование 2-аминопиридина в 2-пропаноле в присутствии КОН протекает как по экзоциклическому, так по эндоциклическому атомам азота с образованием смеси моно- и диаллиьных производных.
Список литературы Алкилирование 2-аминопиридина аллилбромидом и металлилхлоридом
- Пожарский, А.Ф. Теоретические основы химии гетероциклов/А.Ф. Пожарский. -М.: Химия, 1985. -280 с.
- Джилкрист, Т. Химия гетероциклических соединений/Т. Джилкрист. -М.: Мир, 1996. -464 с.
- Джоуль, Дж. Химия гетероциклических соединений/Дж. Джоуль, К. Миллс. -М.: Мир, 2009. -728 с.
- Соколов, В.И. Алкилирование N-анионов 2-и 4-аминопиридинов/В.И. Соколов, А.Ф. Пожарский, Б.И. Ардашев//Химия гетероцикл. соед. -1973. -№ 7. -С. 967-971.
- Ким, Д.Г. Взаимодействие гидрогалогенидов 1-аллил-2-имино-1,2-дигидропиридина с галогенами/Д.Г. Ким, С.Е. Успенская//Изв. вузов. Химия и хим. технол. -1993. -Вып. 9. -С. 121-123.
- Burmistrov, S.I. Alkylation of 2-aminopyridine/S.I. Burmistrov, V.A. Krasovskii//Khimiya Geterotsiklicheskikh Soedinenii. -1967. -V. 3, №. 1. -P. 173-174.
- Synthesis, characterization and biological evaluation of allyl, benzyl and 4-nitrobenzyl derivatives of aminopyridinium bromides/C. Muthukumar, M. Nallu, T. Arunachalam et al.//Indian Journal of Chemistry. -2012. -V. 51B. -P. 388-392.
- Sheldrick, G.M. A short history of SHELX/G.M. Sheldrick//Acta Cryst. -2008. -A64. P. 112-122.


