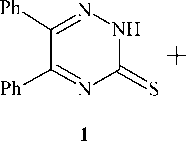
Алкилирование 5-фенил-6R-2Н-1,2,4-триазин-3-тиона и гетероциклизация 1-(4-бромфенил)-2-(5-фенил-6R-1,2,4-триазин-3-илсульфанил)этанонов
Автор: Рыбакова Анастасия Владимировна, Ким Дмитрий Гымнанович, Хайбуллина Ольга Андреевна, Соболевская Валерия Геннадьевна
Журнал: Вестник Южно-Уральского государственного университета. Серия: Химия @vestnik-susu-chemistry
Рубрика: Органическая химия
Статья в выпуске: 2 т.12, 2020 года.
Бесплатный доступ
Конденсацией дибензоила (бензила) и фенилглиоксаля с тиосемикарбазидом (или его гидрохлоридом) получены 5,6-дифенил-1,2,4-триазин-3-тион и 5-фенил-2,3-дигидро-1,2,4-триазин-3-тион, соответственно. При алкилировании последних пара- бромфенациломбромидом в ацетонитриле (ацетоне) в присутствии триэтиламина образуются 1-(4-бромфенил)-2-(5-фенил-(5,6-дифенил)-1,2,4-триазин-3-илсульфанил)этаноны. Для 5,6-дифенил-1,2,4-триазин-3-тиона также было осуществлено алкилирование монохлоруксусной кислотой и её метиловым эфиром. Следует отметить, что более высокий выход при алкилировании триазинтиона монохлоруксусной кислотой удалось получить в системе K2CO3-H2O-ДМФА. В спектрах ЯМР 1Н S-производных 5-фенил-(5,6-дифенил)- 1,2,4-триазин-3-тионов наблюдаются сигналы протонов SCH2 группы в области 4,04-5,01 м.д., сигналы ароматических протонов фенильных колец в виде мультиплета при 7,23-7,50 м.д. Ароматические протоны пара- бромфенацильной группы образуют в спектре ЯМР 1Н по два сигнала в слабом поле: при 7,77-7,83 и 8,02-8,06 м. д. В ИК-спектрах S-производных 5-фенил-(5,6-дифенил)-1,2,4-триазин-3-тионов имеются характерные полосы поглощения C=O группы с высокой интенсивностью при 1700, 1681, 1680, 1740 см-1. Действие концентрированной серной кислоты на 1-(4-бромфенил)-2-(5,6-дифенил-1,2,4-триазин-3-илсульфанил)этанон приводит к внутримолекулярному присоединению по карбонильной группе и последующей дегидратации с образованием 3-(4-бромфенил)-6,7-дифенил-8а- Н -[1,3]тиазоло[3,2- b ][1,2,4]триазин-8-ола. Об образовании последнего свидетельствуют данные спектра ЯМР 1Н, в котором отсутствуют сигналы протонов SCH2 группы и появляется дополнительный сигнал тиазольного протона Н-2 в области слабого поля (6,78 м. д.). Внутримолекулярной гетероциклизацией 1-(4-бромфенил)-2-(5-фенил-1,2,4-триазин-3-илсульфанил)этанона под действием концентрированной серной кислоты был получен гидросульфат 3-(4-бромфенил)-7-фенил[1,3]тиазоло[3`,2`; 2,3][1,2,4]триазиния, в спектре ЯМР 1Н которого присутствует характерный сигнал ароматического протона Н-2 тиазольного цикла при 8,96 м. д. Кроме того о протекании циклизации свидетельствует смещение сигнала протона Н-6 в более слабую область (10,29 м. д.) по сравнению с аналогичным сигналом исходного соединения, что связано с появлением положительно заряженного атома азота. Также следует отметить, что в ИК-спектрах продуктов гетероциклизации отсутствует полоса поглощения карбонильной группы в отличие от ИК-спектров исходных 1-бромфенил-2-(1,2,4-триазинилсульфанил)этанонов.
5, 6-дифенил-1, 2, 4-триазин-3-тион, 5-фенил-2, 3-дигидро-1, 2, 4-триазин-3-тион, 1-(4-бромфенил)-2-(5-фенил-1, 2, 4-триазин-3-илсульфанил)этанон, алкилирование, гетероциклизация, 1-(4-бромфенил)-2-(5, 6-дифенил-1, 2, 4-триазин-3-илсульфанил)этанон, 3-(4-бромфенил)-6, 7-дифенил-8а-н-[1, 3]тиазоло[3, 2-b][1, 2, 4]триазин-8-ол, гидросульфат 3-(4-бромфенил)-7-фенил[1, 3]тиазоло[3', 2'; 2, 3][1, 2, 4]триазиния, 3-(4-bromophenyl)-6, 7-diphenyl-8а-н-[1, 3]thiazolo[3, 2-b][1, 2, 4]triazine-8-ol
Короткий адрес: https://sciup.org/147234228
IDR: 147234228 | УДК: 547.873 | DOI: 10.14529/chem200206
Текст научной статьи Алкилирование 5-фенил-6R-2Н-1,2,4-триазин-3-тиона и гетероциклизация 1-(4-бромфенил)-2-(5-фенил-6R-1,2,4-триазин-3-илсульфанил)этанонов
Известно, что некоторые производные 5,6-дифенил-1,2,4-триазина проявляют антимикробную [1–4], противовирусную [5] и противораковую активность [6]. S-производные 5,6-диарил-1,2,4-триазин-3-тионов проявляют противосудорожную активность [7], нейропротекторное действие [8], ингибирующее действие на α-гликозиды [9] и по отношению к ацетилхолинэстеразе [10]. С другой стороны, 3-(4-фенил-2-пиридил)-5,6-дифенил-1,2,4-триазин эффективен как реагент для спектрофотометрического определения ионов Fe(II), так как способен реагировать с ни- ми в водных растворах с образованием комплексов [11]. Стабильные комплексы с ионами Hg2+, Ni2+, Cu2+, Pb2+ и Zn2+ также известны для 5-гидрокси-5,6-дипиридин-2-ил-4,5-дигидро-2Н-[1,2,4]триазин-3-тиона [12].
В литературе известны способы синтеза различных 1,2,4-триазин-3-тионов реакцией тиосемикарбазида и его производных с дикарбонильными соединениями [13–17]. В частности, синтез различных 5,6-диарил-2 Н -1,2,4-триазин-3-тионов осуществлен при взаимодействии 1,2-дикетонов с тиосемикарбазидом в различных растворителях (ДМФА, ацетонитрил, водноспиртовая среда) в присутствии концентрированной соляной кислоты при 120–130 °С и микроволновом облучении в течение 10–20 мин. [7, 18]. Конденсацией 2-гидрокси-1,2-дипиридин-2-илэтанона с тиосемикарбазидом в абсолютном спирте при нагревании в течение 4 ч в присутствии катализатора ( p -TsOH) получен 5-гидрокси-5,6-дипиридин-2-ил-4,5-дигидро-2 Н -[1,2,4]триазин-3-тион, структура которого подтверждена методом РСА [19]. Конденсацией тиосемикарбазида с 2-гидроксиимоно-1-(4-метоксифенил)-2-арилэтанонами получен 6-(4-метоксифенил)-5-арил-1,2,4-триазин-3-тион [18].
Алкилирование различных замещенных 1,2,4-триазин-3-тионов происходит по атому серы [13, 14], что, по-видимому, может быть обусловлено ее более высокой нуклеофильностью. Направление алкилирования в литературе доказано методом встречного синтеза на примере фенан-тро[9,10- е ][1,2,4]триазин-3-тиона [20] или иодазидной реакцией [21] на примере синтеза гидрохлорида 3-(3-морфолинопропилтио)-1,2,4-триазино[5,6- b ]индола. Согласно литературным данным метилирование 5,6-диарил-2 Н -1,2,4-триазин-3-тионов иодистым метилом протекает в метаноле в присутствии триэтиламина при комнатной температуре [7]. В работе [18] описано, что при взаимодействии 5,6-диарил-2 Н -1,2,4-триазин-3-тионов с этилхлорацетатом в ДМСО в присутствии карбоната калия при комнатной температуре в течение 10 ч образуются S-производные с этилацетатным фрагментом – этил 1,2,4-триазин-3-тиоацетаты. Последние, в свою очередь, были исследованы на aβ-индуцированную нейротоксичность. Также в литературе описано алкилирование 5,6-дифенил-2 Н -1,2,4-триазин-3-тиона хлорэтилметиловым эфиром и хлорацетонитрилом в среде K 2 CO 3 /ДМФА при нагревании и 2-(2-хлорэтокси)этанолом в среде КОН/EtOH при нагревании [22].
Целью настоящей работы является синтез новых S-производных реакциями алкилирования 5-фенил-6R-1,2,4-триазин-3-тионов ( 1a,b ) и исследование их в реакциях гетероциклизации.
Экспериментальная часть
Спектры ЯМР 1Н (500 МГц) соединений 2–6 и ЯМР 13С соединения 2b записаны на приборе Bruker AVANCE-500 (500 МГц и 126 МГц). Внутренний стандарт – ТМС для ЯМР 1Н и сигнал растворителя – для ЯМР 13С, растворитель – ДМСО-d6. ИК-спектр соединений 2–6 записаны на ИК-Фурье спектрометре Shimadzu IRAffinity-1S в таблетке KBr в области 4000– 400 см–1.
Дибензоил (Бензил) был получен нами по известной методике [23] нагреванием бензоина в течение 3 ч в смеси концентрированных азотной и уксусной кислот. 5-Фенил-2,3-дигидро-1,2,4-триазин-3-тион 1b получен нами конденсацией фенилглиоксаля с тиосемикарбазидом по известной методике [24].
5,6-Дифенил-1,2,4-триазин-3-тион (1a)
Смесь 0,816 г (6,4 ммоль) гидрохлорида тиосемикарбазида и 1,35 г (6,4 ммоль) дибензоила (бензила) в 100 мл 2н KOH перемешивали при комнатной температуре в течение 5 ч. Полученный раствор отфильтровали, фильтрат подкисляли ледяной уксусной кислотой до pH 6–7. Образовавшийся осадок отфильтровали, промыли дистиллированной водой и высушили. Выход вещества 1,428 г (84 %). Найдено, %: C 67,72; H 3,98. Для C 15 H 11 N 3 S вычислено, %: C 67,90; H 4,18.
1-(4-Бромфенил)-2-(5,6-дифенил-1,2,4-триазин-3-илсульфанил)этанон (2а)
К раствору 0,265 г (1 ммоль) 5,6-дифенил-1,2,4-триазин-3-тиона в 20 мл ацетонитрила добавляли 1,5 мл триэтиламина и 0,278 г (1 ммоль) пара -бромфенацилбромида. Реакционную смесь перемешивали в течение 5 ч. Через 24 ч отфильтровали, из фильтрата испарили растворитель. Остаток обработали водой, образовавшийся осадок отфильтровали, промыли водой и высушили. Выход 0,420 г (91 %). Найдено, %: C 59,55; H 3,31. Для C 23 H 16 BrN 3 OS вычислено, %: C 59,75; H 3,49.
1-(4-Бромфенил)-2-(5-фенил-1,2,4-триазин-3-илсульфанил)этанон (2b)
К раствору 0,289 г (1,53 ммоль) 5-фенил-1,2,4-триазин-3-тиона в 10 мл ацетона добавляли 1,5 мл Et 3 N и 0,424 мл (1,53 ммоль) пара -бромфеноцилбромида. Реакционную смесь перемешивали в течение 12 ч, образовавшийся осадок отфильтровывали, из фильтрата отгоняли растворитель. Полученные кристаллы перекристаллизовывали из ИПСа. Выход 0,425 г (72 %). Найдено, %: C 52,67; H 2,94. Для C 17 H 12 BrN 3 OS вычислено, %: C 52,86; H 3,13.
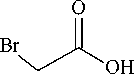
5,6-Дифенил-1,2,4-триазин-3-илсульфанилуксусная кислота (3)
Метод I:
К горячему раствору 0,265 г (1 ммоль) 5,6-дифенил-1,2,4-триазин-3-тиона в 10 мл ацетонитрила добавляли 1,5 мл триэтиламина и 0,095 г (1 ммоль) монохлоруксусной кислоты и перемешивали при комнатной температуре. Через 24 ч фильтровали, из фильтрата испарили растворитель. Остаток обработали 20 мл воды, продукт экстрагировали из водного раствора хлороформом три раза порциями по 7 мл. Из хлороформных вытяжек испаряли растворитель. Выход желтокоричневого осадка 0,236 г (73 %). Найдено, %: C 62,97; H 3,88. Для C 17 H 13 N 3 O 2 S вычислено, %: C 63,14; H 4,05.
Метод II:
К раствору 0,265 г (1 ммоль) 5,6-дифенил-1,2,4-триазин-3-тиона в 10 мл ДМФА добавили 0,138 г (1 ммоль) K 2 CO 3 и 1 мл воды, затем добавили 0,139 г (1 ммоль) монобромуксусной кислоты. Реакционную смесь перемешивали в течение 24 ч. К полученному раствору добавили 30 мл воды, содержащей 100 мг хлорида кальция. Образовавшийся осадок отфильтровали, промыли водой и высушили. Выход 0,307 г (95 %).
Метиловый эфир 5,6-дифенил-1,2,4-триазин-3-илсульфанилуксусной кислоты (4)
К горячему раствору 0,265 г (1 ммоль) 5,6-дифенил-1,2,4-триазин-3-тиона в 10 мл ацетонитрила и 1,5 мл триэтиламина добавили 0,088 мл (1 ммоль) метилового эфира монохлоруксусной кислоты и перемешивали при комнатной температуре. Через 24 ч реакционную смесь отфильтровали, из фильтрата испаряли растворитель. Остаток обработали 20 мл воды, продукт экстрагировали хлороформом из водного раствора 3 раза порциями по 7 мл. Из хлороформных вытяжек испаряли растворитель. Выход 0,202 г (60 %). Найдено, %: C 63,90; H 4,29. Для C 18 H 15 N 3 O 2 S вычислено, %: C 64,08; H 4,48.
3-(4-Бромфенил)-6,7-дифенил-8а-Н-[1,3]тиазоло[3,2-b][1,2,4]три-азин-8-ола (5)
К 0,160 г (0,35 ммоль) 1-(4-бромфенил)-2-(5,6-дифенил-1,2,4-триазин-3-илсульфанил)этанона добавили 4 мл концентрированной серной кислоты. Через 24 ч реакционную смесь аккуратно тоненькой струйкой выливают на лед. К полученному раствору добавляли 2н раствор KOH до нейтральной среды (рН=7). Выпавший осадок отфильтровали, промыли водой и высушили. Выход 0,082 г (51 %). Найдено, %: C 59,55; H 3,30. Для C 23 H 16 BrN 3 OS вычислено, %: C 59,75; H 3,49.
Гидросульфат 3-(4-бромфенил)-7-фенил[1,3]тиазоло[3`,2`; 2,3][1,2,4]триазиния (6)
К 0,068 г (0,18 ммоль) 1-(4-бромфенил)-2-(5-фенил-1,2,4-триазин-3-илсульфанил)этанона добавили 2 мл конц. H 2 SO 4 и оставили стоять на 72 ч при комнатной температуре. Реакционную смесь вылили на лед и нейтрализовали 10 % раствором КОН до рН=6. Выпавший осадок отфильтровали, промыли водой и высушили. Выход 0,072 г (88 %). Найдено, %: C 43,61; H 2,41. Для C 17 H 12 BrN 3 O 4 S 2 вычислено, %: C 43,79; H 2,59.
Обсуждение результатов
5,6-Дифенил-2 Н -1,2,4-триазин-3-тион ( 1a ) был получен ранее взаимодействием бензила с тиосемикарбазидом в этаноле в присутствии карбоната калия с выходом 80 % [25]. Отметим, что взаимодействие бензила с тиосемикарбазидом в этаноле в присутствии концентрированной соляной кислоты приводит к синтезу 5-метокси-5,6-дифенил-4,5-дигидро-2 Н -1,2,4-триазина, структура которого доказана методом РСА [26], в то время как аналогичное взаимодействие при 120 °С и микроволновом облучении в течение 10 мин уже даёт соединение 1 [7]. К образованию гидрированного 5,6-дифенил-триазинтиона приводит конденсация бензила с тиосемикарбазидом в метаноле в присутствии концентрированной соляной кислоты и NaBH4 [27].
Нами триазин-3-тион 1 с выходом 84 % получен конденсацией дибензоила с гидрохлоридом тиосемикарбазида (схема 1).
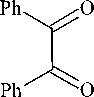
+
NH2
HN . HCl
2н KOH
H 2 N
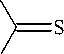
Ph
Ph
SK
CH3COOH
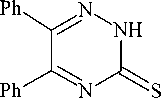
Схема 1
Нами найдено, что взаимодействие триазин-3-тионов 1a,b с пара -бромфенациломбромидом в ацетонитриле (ацетоне) в присутствии избытка триэтиламина протекает с образованием 1-(4-бромфенил)-2-(5-фенил-6R-1,2,4-триазин-3-илсульфанил)этанонов (2 a,b ) (схема 2). Следует отметить, что триэтиламин выполняет не только роль основания и способствует увеличению нуклеофильности серы, но и улучшает растворимость исходного триазинтиона.
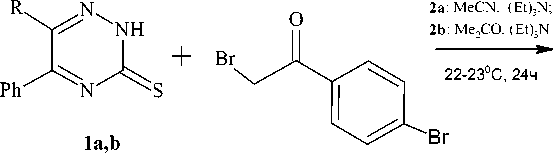
1a : R=Ph; 1b : R= H
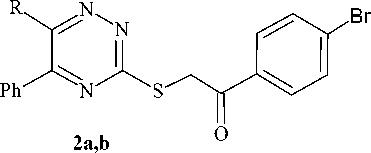
2a : R=Ph, 91%; 2b : R= H, 72%
Схема 2
Взаимодействие тиона 1а с монохлоруксусной кислотой и её метиловым эфиром осуществ- ляли также в присутствии триэтиламина. При этом образуются 5,6-дифенил-1,2,4-триазин-3- илсульфанилуксусная кислота (3) и её метиловый эфир (4) с выходами 73 и 60 %, соответственно
(схема 3).
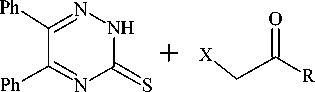
MeCN (Et)3N 22-230С, 24ч
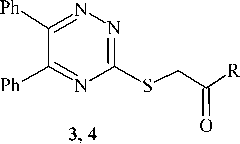
3 : R= -CH2COOH, 73%; 4 : R= -CH2COOCH3, 60%
Схема 3
Более высокий выход кислоты 3 (95 %) удалось получить взаимодействием тиона 1а с монобромуксусной кислотой в системе K 2 CO 3 –H 2 O–ДМФА (схема 4). Выделение продукта реакции в данном случае осуществляли добавлением избытка воды к реакционной смеси.
K2CO3-Н2О-ДМФА
22-230С, 24ч
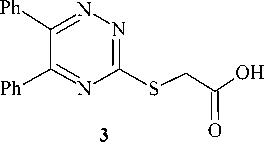
Схема 4
В спектрах ЯМР 1Н соединений 2a,b–4 сигналы протонов SCH2 группы наблюдаются в области 5,01, 4,99, 4,04 и 4,25 м.д., соответственно. Смещение данного сигнала в сторону более слабого поля в случае соединений 2a,b по сравнению с соединением 3 объясняется влиянием бромфенацильной группы, проявляющей электроноакцепторные свойства. В случае триазинил-сульфанилуксусной кислоты 3 в спектре ЯМР 1Н наблюдается синглет протона ОН-группы в об- ласти 8,32 м.д. В спектре её метилового эфира – синглет метокси-группы (-ОСН3) в области 3,68 м.д. Сигналы ароматических протонов фенильных колец в соединениях 2a,b-4 наблюдаются в виде мультиплета при 7,23–7,50 м.д. Ароматические протоны пара-бромфенацильной группы в соединениях 2a,b образуют в спектре ЯМР 1Н по два сигнала в слабом поле: при 7,77–7,83 и 8,02–8,06 м.д.
В ИК-спектрах соединений 2a,b–4 имеются характерные полосы поглощения карбонильной группы с высокой интенсивностью при 1700, 1681, 1680, 1740 см–1, соответственно.
С целью получения конденсированных гетероциклических соединений ионного типа нами впервые изучено действие концентрированной серной кислоты на 1-(4-бромфенил)-2-(5-фенил-6R-1,2,4-триазин-3-илсульфанил)этанон 2a,b .
В случае соединения 2а реакция, очевидно, протекает через внутримолекулярное присоединение по карбонильной группе с образованием промежуточного интермедиата I , который, по-видимому, далее подвергается дегидратации с образованием 3-(4-бромфенил)-6,7-дифенил-8а- Н -[1,3]тиазоло[3,2- b ][1,2,4]триазин-8-ола ( 5 ) (схема 5).
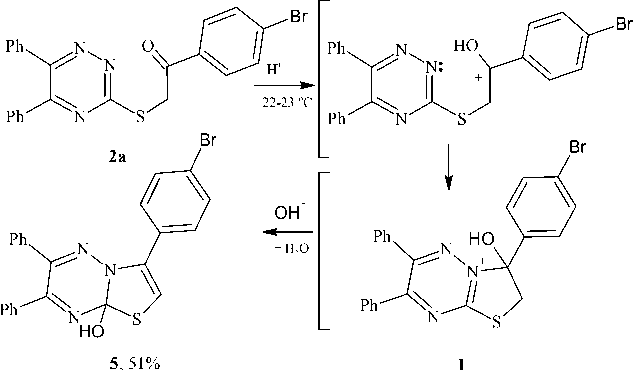
Схема 5
Об образовании соединения 5 свидетельствуют данные спектра ЯМР 1Н, в котором отсутствуют сигналы протонов SCH 2 группы и появляется дополнительный сигнал протона Н-2 в области слабого поля (6,78 м.д.). Также следует отметить, что в ИК-спектре продукта гетероциклизации (соединение 5 ) отсутствует полоса поглощения карбонильной группы в отличие от ИК-спектра исходного соединения 2а .
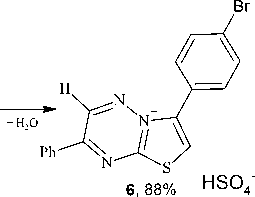
При циклизации соединения 2b образуется мезоионное соединение – гидросульфат 3-(4-бромфенил)-7-фенил[1,3]тиазоло[3,2-b][1,2,4]триазиния (6) (схема 6). В спектре ЯМР 1Н соединения 2b присутствует характерный сигнал ароматического протона Н-2 тиазольного цикла при 8,96 м.д. Кроме того, наблюдается смещение сигнала протона Н-6 в более слабую область (10,29 м.д.) по сравнению с аналогичным сигналом исходного соединения 2b, что связано с появ- лением положительно заряженного атома азота и свидетельствует о протекании циклизации.
Также следует отметить, что в ИК-спектре тиазолотриазиния 6 отсутствует полоса поглощения карбонильной группы.
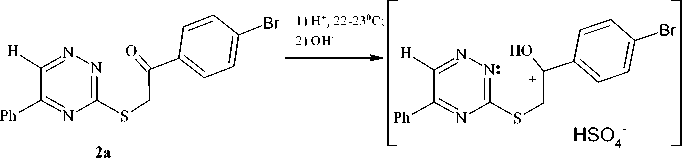
Схема 6
Данные спектров ЯМР 1, ИК-спектроскопии, температуры плавления и выход впервые полученных соединений 2–5 представлены в таблице.
Таблица
Данные спектров ЯМР 1, ИК-спектроскопии, Т пл и выходы соединений 2–5
Выводы
Таким образом, конденсацией гидрохлорида тиосемикарбазида с бензилом получен 5,6-дифенил-1,2,4-триазин-3-тион. Алкилированием 5,6-дифенил-1,2,4-триазин-3-тиона и 5-фенил-1,2,4-триазин-3-тиона в присутствии триэтиламина получены неизвестные ранее S-производные. Найдено, что 1-(4-бромфенил)-2-(5-фенил-6-R-1,2,4-триазин-3-илсульфанил)этаноны под действием концентрированной серной кислоты вступают во внутримолекулярную гетероциклизацию с образованием тиазолотриазиновых систем.
Список литературы Алкилирование 5-фенил-6R-2Н-1,2,4-триазин-3-тиона и гетероциклизация 1-(4-бромфенил)-2-(5-фенил-6R-1,2,4-триазин-3-илсульфанил)этанонов
- Synthesis and Antimicrobial Activity of Some Nitrogen Heterobicyclic Systems: Part III / F.A.A. El-Mariah, H.A. Saad, H.A. Alimony et al. // Indian J. Chem. - 2000. - V. 39B. - P. 36-41. DOI: 10.1002/chin.200031174.
- Abdel-Monem, W.R. Synthesis and Antimicrobial Evaluation of Some New Polyheterocyclic Systems Containing 1,2,4-Triazine Moiety / W.R. Abdel-Monem // Eur. J. Chem. - 2010. - V. 1, № 3. -P. 168-172. DOI: 10.5155/eurjchem.1.3.168-172.29.
- Arshad, M. 1,2,4-Triazine derivatives: Synthesis and Biological Applications / M. Arshad, T.A. Khan, M.A. Khan // Int. J. Pharma Sci. Res. - 2014. - V. 5, № 4. - P. 149-162. DOI: 10.1002/chin.201504278.
- Abdel-Rahman, R.M. Synthesis and Biological Activities of Some New 3-Substituted 5,6-Diphenyl-1,2,4-triazines / R.M. Abdel-Rahman, M. Ghareib // Indian J. Chem. - 1987. - V. 26. -P. 496-500.
- Novel Chalcone Derivatives Containing a 1,2,4-Triazine Moiety: Design, Synthesis, Antibacterial and Antiviral Activities / X. Tang, S. Su, M. Chen, J. He et al. // RSC Adv. - 2019. - V. 6. -P.6011-6020.
- Discovery of 5,6-Diaryl-1,2,4-triazines Hybrids as Potential Apoptosis Inducers / D.-J. Fu, J. Song, Y.-H. Hou et al. // Eur. J. Med. Chem. - 2017. - V. 138. - P. 1076-1088. DOI: 10.1016/j.ejmech.2017.07.011.
- Microwave-assisted Synthesis and Anticonvulsant Activity of 5,6-Bisaryl-1,2,4-triazine-3-thiol Derivatives / H. Irannejad, N. Naderi, S. Emami et al. // Med. Chem. Res. - 2014. - V. 23. - P. 25032514. DOI: 10.1007/s00044-013-0843-6.
- Synthesis and in Vitro Evaluation of Novel 1,2,4-Triazine Derivatives as Neuroprotective Agents / Н. Irannejad, M. Amini, F. Khodagholi et al. // Bioorg. Med. Chem. - 2010. - V. 18. -P. 4224-4230. D0I:10.1016/j.bmc.2010.04.097.
- Synthesis, Molecular Docking and a-Glucosidase Inhibition of 2-((5,6-Diphenyl-1,2,4-triazin-3-yl)thio)-N-arylacetamides / G. Wang, X. Li, J. Wang et al. // Bioorg. Med. Chem. Lett. - 2017. -V. 27. - P. 1115-1118. DOI: 10.1016/j.bmcl.2017.01.094.
- Gupta, A.K. Synthesis and Acetylcholinesterase Activity of 1-Aryl-3-(3,4-diphenyl-1,2,4-triazine-6-ylmercaptoacetyl)ureas / A.K. Gupta, A. Rastogi, K.S. Hajela // Indian J. Chem. - 1983. -V. 22, № 10. - P. 1074-1075.
- Spectrophotometry Determination of Iron(II) by Extraction of Its Ion Associiated Complex with 3-(4-Phenyl-2-pyridyl)-5,6-diphenyl-1,2,4-triazine and Tetraphenylborate into Molten Naphthalene / T. Nagahiro, M. Satake, B.K. Puri et al. // Mikrochimica Acta. - 1984. - V. 82. - P. 85-93.
- Potentiometric Study of Equilibrium Constants of Novel Triazine-thione Derivative and Its Stability Constants with Hg2+, Cu2+, Ni2+, Pb2+, and Zn2+ Metal Ions in Ethanol and Water Mixed / F. Polat, H. Atabey, H. Sari et al. // Turk. J. Chem. - 2013. - V. 13. - P. 439-448. DOI: 10.3906/kim-1207-55.
- Synthesis of Unsymmetric 6,6'-Diaryl-2,2'-bipyridines Using a 1,2,4-Triazine Methodology / D.S. Kopchuk, N.B. Chepchugov, G.A. Kim et al. // Rus. Chem. Bull. Intern. Ed. - 2015. - V. 64, № 3. - P. 696-698. DOI: 10.1007/s11172-015-0921-7.
- Синтез 3-аллилтио-5-оксо-1,2,4-триазин-6-карбоновой и 2-аллил-5-амино-1,2,4-триазин-6-карбоновой кислот / А.В. Рыбакова, Д.Г. Ким, П.А. Слепухин, В.Н. Чарушин // Вестник ЮУрГУ. Серия «Химия». - 2013. - Т. 5, № 3. - С. 10-17.
- Производные тиомочевины и тиосемикарбазида. Строение, превращения и фармакологическая активность. Часть II. Антигипоксическое действие производных 1,2,4-триазино[5,6-Ь]индола / А.Б. Томчин, О.Ю. Урюпов, Т.И. Жукова и др. // Хим.-фарм. журн. - 1997. - Т. 31, № 3. - С. 19-27.
- Kgokong, J.L. 1,2,4-Triazino-[5,6-b]indole Derivatives: Effect of the Trifluoromethyl Group on In Vitro Antimalarial Activity / J.L. Kgokong, P.P. Smith, G.M. Matsabisa // Bioorg. Med. Chem. -2005. - № 13. - Р. 2935-2942. DOI: 10.1016/j.bmc.2005.02.017.
- Жунгиету, Г.И. Изатин и его производные / Г.И. Жунгиету, М.А. Рехтер. - Кишинев: Штиинца, 1977. - 229 с.
- Kucukkilinc, T.T. Synthesis and Neuroprotective Activity of Novel 1,2,4-Triazine Derivatives with Ethyl Acetate Moiety Against H2O2 and Ap-Induced Neurotoxicity / T.T. Kucukkilinc, K.S. Yanghagh, B. Ayazgok // Med. Chem. Res. - 2017. - V. 26. - P. 3057-3071. DOI: 10.1007/s00044-017-2003-x
- Ab Initio and Semi-empirical Computational Studies on 5-Hydroxy-5,6-dipyridin-2-yl-4,5-dihidro-2#-[1,2,4]triazine-3-thione / T. Karakurt, M. Dinner, A. £ukurovali et al. // J. Mol. Struct. -2012. - V. 1024. - P. 176-188. DOI: 10.1016/j.molstruc.2012.05.022.
- Avendano, C. Quinones and Heteroatom Analogues Product Class 10: Anthraquinone and Phe-nanthrenedione Imines and Diimines / C. Avendano, J.C. Menendez // Sci. Synth. - 2006. - V. 28. - P. 735-806.
- Пат. SU 1 584 352 A1 СССР. Гидрохлорид 3-(3-морфолинопропилтио)-1,2,4-триазино[5,6-b]индола, восстанавливающий физическую выносливость после отравления фосфо-рорганическими пестицидами / А.Б. Томчин, Т.И. Жукова, Т.А. Кузнецова, И.Б. Калинина, Р.П. Спивакова, Д.В. Тонкопий, А.В. Смирнов. - № 4462898/04; заявл. 18.07.1988; опубл. 10.09.1996. - 5 с.
- Nassar, I.F. Synthesis and Antitumor Activity of New Substituted Mercapto-1,2,4-triazine Derivatives, Their Thioglycosides, and Acyclic Thioglycoside Analogs / I.F. Nassar // J. Heterocyclic. Chem. - 2013. - V. 50. - P. 129-134. DOI: 10.1002/jhet.1022.
- Лабораторные работы по органическому синтезу: учеб. пособие для хим. и биол. спец. пед. ин-тов / О.А. Птицына, Н.В. Куплетская, В.К. Тимофеева и др. - М.: Просвещение, 1979. -256 с.
- Reactivity of the A-CH=N-NR-CX-B System. 4-tf-5-Hydroxy-5-phenyl-2,3,4,5-tetrahydro-1,2,4-triazine-3-thiones / G. Werber, F. Buccheri, N. Vivona et al. // J. Heterocycl. Chem. - 1977. -V. 14, № 8. - P. 1433-1434. DOI: 10.1002/jhet.5570140831.
- Synthesis of 5,6-Diphenyl-2,3-dihydro-1,2,4-triazine-3-thione as a New Reagent for Spectrophotometry Determination of Palladium / B.T. Maliheh, T. Maryam, S. Effat et al. // Chemical Science Transactions. - 2015. - V. 4, № 1. - P. 227-233. DOI: 10.7598/cst2015.878.
- Rezaei, B. Synthesis, Solvatochromism and Crystal Structure of 5-Methoxy-5,6-diphenyl-4,5-dihydro-2#-1,2,4-triazine-3-thione / B. Rezaei, M. Fazlollahi // Chemistry Central Journal. - 2013. -V. 7, № 1. - P. 130-130. DOI: 10.1186/1752-153x-7-130.
- Macrocyclization of Cyclic Thiosemicarbazones with Mercury Salts / M.A. Blanco, E. Lopez-Torres, M.A. Mendiola et al. // Tetrahedron. - 2002. - V. 58. - P. 1525-1531. DOI: 10.1016/S0040-4020(02)00016-9.


