Аллельный дисбаланс в гене ТР53 у пациентов с диффузной В-крупноклеточной лимфомой - носителей rs78378222
Автор: Воропаева Елена Николаевна, Поспелова Татьяна Ивановна, Воевода Михаил Иванович, Маринкин Игорь Олегович, Максимов Владимир Николаевич, Агеева Татьяна Августовна, Березина Ольга Валерьевна, Колесникова Мария Александровна
Журнал: Сибирский журнал клинической и экспериментальной медицины @cardiotomsk
Рубрика: Клинические исследования
Статья в выпуске: 2 т.32, 2017 года.
Бесплатный доступ
Известно, что rs78378222 нарушает экспрессию гена ТР53 и приводит к снижению уровня индукции апоптоза в клетках под действием генотоксических факторов. Случаи обнаружения rs78378222 в опухолевой ткани ранее были описаны у больных ДВККЛ. Цель исследования: изучить частоту rs78378222 гена ТР53 в опухолевой ткани больных диффузной В-крупноклеточной лимфомы (В-ККЛ) г. Новосибирска. Материалом для исследования служила ДНК, выделенная методом фенольно-хлороформной экстракции с применением гуанидина из парафинизированных блоков биоптатов опухолевой ткани 92 больных диффузной В-ККЛ. Генотипирование rs78378222 проводилось методом ПЦР с анализом ПДРФ. Определение наличия редкого аллеля С rs78378222 выполнялось методом прямого секвенирования по Сенгеру. rs78378222 в опухолевой ткани ДВККЛ был выявлен в 9,8% случаев. В 5 образцах маркер встречался в гомозиготном состоянии, что свидетельствует о потере гетерозиготности в гене ТР53 в опухолевой ткани диффузной В-ККЛ. Ни в одном из опубликованных в настоящее время исследований, редкий аллель C rs78378222 в здоровой ткани не встречался в гомозиготном состоянии. Таким образом, явление потери гетерозиготности в гене ТР53 в опухолевой ткани больных диффузной В-ККЛ у носителей rs78378222 является примером классического “двух-ударного” механизма канцерогенеза.
Диффузная в-ккл, ген тр53, нетранслируемые последовательности гена, секвенирование по сенгеру, теория кнудсена, опухолевая прогрессия
Короткий адрес: https://sciup.org/14920191
IDR: 14920191 | УДК: 616.411-006.444
Текст научной статьи Аллельный дисбаланс в гене ТР53 у пациентов с диффузной В-крупноклеточной лимфомой - носителей rs78378222
Аномалии гена ТР53 вовлечены в развитие разных типов злокачественных новообразований, что обусловлено выполнением этим геном широкого спектра функций, предотвращающих и/или ингибирующих опухолевый рост: контроль клеточного цикла, старения, репарации ДНК, апоптоза, участие в обмене веществ, ангионеогенезе и антиоксидантной защиты [1, 3].
Ген ТР53 является центральным узлом в молекулярно-генетической сети сохранности постоянства и целост- ности генома, а его активация приводит к изменению в уровне экспрессии более тысячи генов [4].
В отличие от других клеток организма, подверженных в условиях стресса остановке клеточного цикла, р53-независимому апоптозу или некрозу, В-лимфоциты склонны к р53-опосредованному апоптозу. По этой причине нарушение процессов программированной клеточной смерти в результате нарушения функции р53 является основополагающим для развития и прогрессии лимфопролиферативных заболеваний [7].
Кроме того, инактивация ТР53 в В-лимфоцитах приводит к менее эффективному функционированию внутриклеточных сигнальных систем, останавливающих при повреждениях клеточный цикл в G1 и G2 фазах; нарушению репарации ДНК; более эффективной адаптации клеток к гипоксии и стимуляции ангиогенеза; ослаблению контроля над структурой теломер и ингибированию дифференцировки.
В экспериментах на мышах было показано, что при выключении функции ТР53 злокачественные лимфомы являются доминирующей формой неоплазий, а восстановления активности данного гена достаточно для регресса рака различных типов [13].
Более того, поскольку ТР53 играет центральную роль в медиации действия алкилирующих агентов и других химиопрепаратов, дефицит его функции неминуемо приводит к формированию фенотипа множественной лекарственной резистентности лимфомных клеток [10].
Подавляющее большинство работ, изучающих роль изменений в нуклеотидной последовательности ТР53 в окогенезе, были сосредоточены на анализе 5–8 экзонов гена, игнорируя фланкирующие их 3'- и 5'-нетранслиру-емые последовательности (НТП). Последние не выступают в качестве матрицы для синтеза белка, но входят в состав м-РНК и являются высоко-консервативными элементами гена [6]. Изменения в 32 -НТП могут иметь прямой биологический эффект на созревание В-лимфоцитов и активизировать лимфомогенез [9].
В настоящее время в ТР53 идентифицированы сотни аллельных вариантов, часть из которых изучается в аспекте влияния на предрасположенность к развитию онкопатологии [2]. Один из маркеров 32 -НТП гена ТР53 (rs78378222 по данным dbSNP) был описан в полногеномных исследованиях в контексте ассоциации с риском развития рака простаты, глиомы, базальноклеточной карциномы кожи, раком пищевода и колоректальной аденомы [14]. На крупной выборке пациентов (244 человека) показано наличие rs78378222 при диффузной В-ККЛ [9].
Обращает на себя внимание следующий факт. Ни в одном из опубликованных в настоящее время исследований редкий аллель C rs78378222 в здоровой ткани не встречался в гомозиготном состоянии. Считается, что данный маркер находится под действием отрицательного естественного отбора, а механизмом такого отбора, по всей видимости, являются злокачественные новообразования [12].
Данный маркер представляет собой однонуклеотидную замену в 32 -НТП гена TP53 , приводящую к изменению последовательности AATAAA, которая является сигналом к полиаденилированию на AATACA, что приводит к нарушению процессинга 32 -конца м-РНК гена TP53 . Экспериментальные данные показывают, что редкий аллель С rs78378222, в сравнении с аллелем А, обеспечивает значительно меньший уровень экспрессии ТР53 , что приводит к снижению уровня индукции апоптоза в клетках под действием генотоксических факторов [9].
Целью данного исследования было оценить частоту мутантного аллеля rs78378222 гена ТР53 в опухолевой ткани больных диффузной В-ККЛ.
Материал и методы
Геномная ДНК была выделена методом фенольно-хлороформной экстракции с применением гуанидина из парафиновых блоков биоптатов опухолевых лимфоузлов и экстранодальных очагов поражения 92 пациентов с диффузной В-ККЛ. В работу брались срезы ткани, содержащие не менее 80–90% опухолевых клеток.
Работа выполнена с соблюдением международных принципов Хельсинкской декларации и всех этических стандартов по защите людей в процессе выполнения научной работы, одобрена на заседании локального комитета по этике. Все пациенты, включенные в исследование, подписали добровольное информированное согласие.
Генотипирование rs78378222 в 3/-НТП гена ТР53 проводили по методике, описанной ранее, с использованием праймеров, содержащих введенный сайт рестрикции, и эндонуклеазы рестрикции HindIII [16].
Для подтверждения наличия редкого аллеля С выполняли прямое секвенирование по Сенгеру фрагмента 3/-UTR последовательности гена TP53, содержащего rs78378222, с применением тех же праймеров, что и для генотипирования маркера. Полученные ПЦР продукты подвергали очистке от солей, не включившихся праймеров и дезоксинуклеотидтрифосфатов с помощью микроколонок с SephadexТМ G-50 medium (США).
Секвенирование образцов осуществляли при помощи наборов BigDye® Terminator v1.3 и v1.1 компании Applied Biosystems методом капиллярного электрофореза на аппарате Hitachi 3500 Genetic Analyzer (Applied Biosystems) с применением полимера POP-7. Анализ результатов секвенирования и выравнивание фрагментов осуществляли с помощью программ Chromas, SeqScape v.2.7, Sequence Scanner. В качестве референсной использовалась последовательность гена ТР53 NG_017013.
Результаты и обсуждение
В ходе исследовательских работ крупных международных консорциумов с применением методов секвенирования нового поколения, проведенных в последние несколько лет, таких, как Cancer Genome Atlas Research Network (TCGA) и International Cancer Genome Consortium (ICGC) [8, 14], были определены многочисленные опу-холь-специфические мутации не только в последовательностях, кодирующих аминокислотную последовательность белков, но и изменения в некодирующих участках генов.
Аберрации в 3-НТП гена ТР53 могут являться универсальным механизмом онкогенеза, задействованным и в патогенезе диффузной В-ККЛ [5, 9]. В частности, мутации в 3-НТП гена ТР53 могут изменять взаимодействие с регуляторными микро-РНК или приводить к разрушению консервативной последовательности сигнала полиаденилирования и появлению преждевременных дополнительных сигналов [5].
В 2011 г. в ходе проекта по полногеномному секвенированию впервые был описан наследуемый полиморфизм rs78378222 3-НТП TP53, приводящий к нарушению процессинга 3/-конца м-РНК [6]. Он затрагивает пятый нук- леотид сигнала полиаденилирования ТР53, приводя к изменению канонической последовательности AAТAAA на AAТAСA. Данный сигнал необходим для распознавания аппаратом полиаденилирования, последующего расщепления, полиаденилирования, и экспорта зрелых мРНК в цитоплазму [9]. Функциональный анализ показал, что rs78378222 приводит к снижению как экспрессии р53, так и уровня апоптоза в клетках [11].
Строгое эволюционное закрепление сигнала полиаденилирования гена ТР53 было показано при исследовании генома 63 видов млекопитающих, а также древней ДНК неандертальцев и образцов Денисова [11]. Ни один из исследованных образцов ДНК не имел изменений в локусе rs78378222.
В работе Yong Li et al. (2013) на примере ДНК больных диффузной В-ККЛ впервые было показано, что мутации в 32 -НТП данного гена – распространенное явление в опухоли [9]. По данным авторов, мутации в 32-НТП последовательности ТР53 имели большинство пациентов с диффузной В-ККЛ, почти все выявленные замены были расположены в подтвержденных ранее или предполагаемых по данным анализа in silico сайтах связывания микро-РНК. Также авторы впервые сообщили о прогностическом значении аберраций в 3-НТП гена ТР53 при диффузной В-ККЛ.
Учитывая наличие таких данных, нами был выполнен анализ распространенности данного маркера в опухолевой ткани пациентов с ДВККЛ г. Новосибирска.
Генотипирование 92 образцов ДНК, выделенной из опухолевой ткани больных диффузной В-ККЛ г. Новосибирска, проведенной в рамках данного исследования, показало, что частота выявления rs78378222 составила 9/
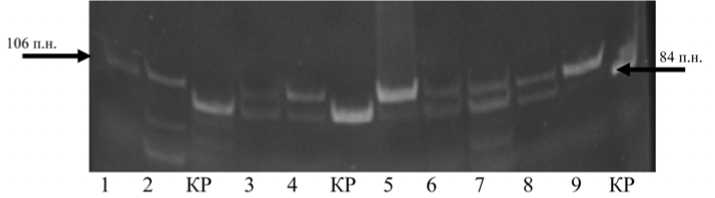
Рис. 1. Результаты генотипирования rs78378222 методом ПЦР с анализом ПДРФ образцов опухолевой ткани больных ДВККЛ, имеющих редкий аллель С: 1–9 номера случаев; КР – контроль рестрикции; 106+84 п.н. (генотип A/С); 84 п.н. (генотип А/A); 106 п.н. (генотип С/С)
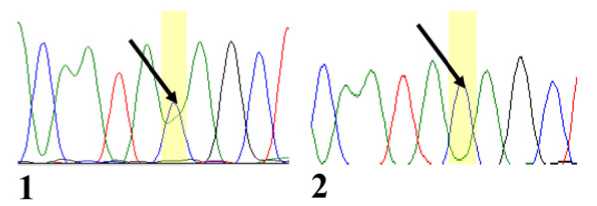
Рис. 2. Результаты секвенирования фрагмента гена ТР53 : 1 – гетерозигота по rs78378222; 2 – гомозигота по rs78378222
92 (9,8%). Обращали на себя внимание обнаружение у 5 пациентов минорного аллеля С в гомозиготном состоянии, а также разные "дозы" аллелей маркера rs78378222 на электрофореграммах (рис. 1).
С подтверждения результатов генотипирования было выполнено прямое секвенирование по Сенгеру фрагмента 32-НТП гена ТР53 9 образцов ДНК из опухолевой ткани ДВККЛ, имеющих минорный аллель С rs78378222 (рис. 2).
Обращает на себя внимание следующий факт. Ни в одном из опубликованных в настоящее время исследований, описанных в литературе, редкий аллель C rs78378222 в здоровой ткани не встречался в гомозиготном состоянии [11, 14]. Вместе с тем пять проанализированных нами образцов опухолевой ткани диффузной В-ККЛ имели генотип С/С rs78378222.
Поскольку выделение ДНК из парафинизированных блоков проводилось из срезов с содержанием опухолевой ткани не менее 70–80%, полученные результаты свидетельствуют о потере гетерозиготности в локусе расположения rs78378222 в опухолевой ткани диффузной В-ККЛ в случаях под номерами 1, 2, 4, 5 и 9 на рис. 1. В случаях 3, 6, 7 и 8 генотип rs78378222 был расценен как гетерозиготный.
Биологический смысл потери гетрозиготности в гене ТР53 , имеющем редкий аллель С rs78378222, при диффузной В-ККЛ может быть в следующем.
В клетках, имеющих rs78378222, было подтверждено снижение уровня м-РНК в сравнении с клетками без данного полиморфизма и наличием другого рядом расположенного маркера rs114831472. В случае обнаружения редкого аллеля С данного маркера уровень клеточного апоптоза был ниже, в сравнении с клетками с диким ти- пом гена ТР53. Эти данные показывают, что TP53 полиморфизм rs78378222 нарушает экспрессию p53 и угнетает апоптоз [9].
Также предполагается, что rs78378222 может нарушать связывание mir-545 с 3'-НТП TP53 [12]. Поскольку сайты связывания микро-РНК расположены преимущественно на 3’-НТП генов, наследуемые варианты 3’-НТП ТР53 могут значительно влиять на экспрессию гена путем отмены, ослабления или создания нового сайта связывания.
Таким образом, rs78378222 представляет собой уникальный аллельный вариант TP53 со снижением функции р53. Потеря нормального аллеля А способствует значительному приросту злокачественного потенциала клеток [9, 12].
Wang et al. (2016) провели первый мета-анализ ассоциа- ции маркера с риском развития опухолей [17]. В исследование были включены 34 работы с общей численностью 36 599 случаев и 91 272 контролей. Результаты показали, что rs78378222 гена TP53 был значимо связан с повышенным риском развития онкологических заболеваний в целом (AC vs. AA: OR=1,5, 95% CI=1,3–1,8). Из миллионов полиморфизмов в геноме человека, rs78378222 имеет самую сильную ассоциацию с базальноклеточной карциномой. Таким образом, было доказано, что аллель C rs78378222 является важным фактором риска развития опухолей у человека.
Интересно, что описанное в настоящем исследовании наблюдение не является уникальным. В работе Li et al. было показано, что 1/7 случаев выявления rs78378222 в опухолевой ткани ДВККЛ также имел гомозиготный генотип С/С [9].
Еще одна исследовательская группа Wang et al. (2015) провела интегративный анализ данных Cancer Genome Atlas для двух опухолевых нозологий: глиобласты и аденокарциномы легкого [15].
Используя данные секвенирования мРНК ТР53, авторы установили, что транскрипты гена, имеющие редкий аллель С rs78378222, на ~3 кb длиннее, чем транскрипты гена с аллелем А, что препятствовало трансляции полноценного белка р53 [15].
Биоинформационный анализ данных секвенирования экзома опухолевой ткани показал, что при глиобластомах, в отличие от аденокарциномы легкого, происходит потеря гаплотипа, несущего защитный аллель А. Авторы предположили, что потеря области генома, несущего частый защитный аллель А, происходит во время инициации опухоли или прогрессии глиомы [15].
Явление потери гетерозиготности в гене ТР53 у носителей гетерозиготного генотипа А/С rs78378222 в опухолевой ткани диффузной В-ККЛ является ни чем иным, как примером классического “двух-ударного” механизма канцерогенеза. Согласно ему, для развития опухоли необходимы последовательные изменения обеих аллелей антионкогена, одного в зародышевой линии, а второго за счет соматических аберраций.
Таким образом, эффект rs78378222 на процессинг 3’-конца представляет собой еще один механизм онкогенеза, подтвержденный на опухолях различного происхождения, который способствует формированию дефицита ТР53 при опухолевой прогрессии диффузной В-ККЛ [12].
Список литературы Аллельный дисбаланс в гене ТР53 у пациентов с диффузной В-крупноклеточной лимфомой - носителей rs78378222
- Копнин Б.П., Копнин П.Б., Хромова Н.В. и др. Многоликий р53: разнообразие форм, функций, опухольсупрессирующих и онкогенных активностей//Клиническая онкогематология. -2008. -Т. 1, № 1. -С. 2-9.
- Поспелова Т.И., Воевода М.И., Воропаева Е.Н. и др. Значение конституциональных полиморфизмов гена Р53 у больных неходжкинскими злокачественными лимфомами//Бюллетень Сибирской медицины. -2008. -Т.7, № 3. -С. 56.
- Поспелова Т.И., Лосева М.И., Ковынев И.Б. и др. Основы опухолевой прогрессии гемобластозов//Сибирский научный медицинский журнал. -2004. -Т. 24, № 2. -С. 71-73.
- Avery-Kiejda K.A., Zhang X.D., Adams L.J. et al. Small molecular weight variants of p53 are expressed in human melanoma cells and are induced by the DNA-damaging agent cisplatin//Clin. Cancer Res. -2008. -Vol. 14. -P. 1659-1668.
- Diederichs S., Bartsch L., Berkmann J.C. et al. The dark matter of the cancer genome: aberrations in regulatory elements, untranslated regions, splice sites, non-coding RNA and synonymous mutations//EMBO Mol. Med. -2016. -Vol. 8, No. 5. -P. 442-57.
- Enciso-Mora V., Hosking F.J., Di Stefano A.L. A Low penetrance susceptibility to glioma is caused by the TP53 variant rs78378222//Br. J. Cancer. -2013. -Vol. 108. -P. 2178-2185.
- Gudkov A.V., Komarova E.A. The role of p53 in determining sensitivity to radiotherapy//Nat Rev Cancer. -2003. -Vol. 3, No. 2. -P. 117-129.
- International Cancer Genome Consortium, Hudson T.J., Anderson W. et al. International network of cancer genome projects//Nature. -2010. -Vol. 464. -P. 993-998.
- Li Y., Gordon M.W., Xu-Monette Z.Y. et al. Single nucleotide variation in the TP53 39 untranslated region in diffuse large B-cell lymphoma treated with rituximab-CHOP: a report from the International DLBCL Rituximab-CHOP Consortium Program//Blood. -2013. -Vol. 121, No. 22. -P. 4529-40.
- Liang Y., Lin S.Y., Brunicardi F.C. DNA damage response pathways in tumor suppression and cancer treatment//World J. Surg. -2009. -Vol. 33. -P. 661-666.
- Macedo G.S., Araujo Vieira I., Brandalize A.P. et al. Rare germline variant (rs78378222) in the TP53 3'UTR: Evidence for a new mechanism of cancer predisposition in Li-Fraumeni syndrome//Cancer Genetics. -2016. -Vol. 209. -P. 97-106.
- Stacey S.N., Sulem P., Jonasdottir A. et al. A germline variant in the TP53 polyadenylation signal confers cancer susceptibility//Nat. Genet. -2011. -Vol. 43, No. 11. -P. 1098-1103.
- Ventura A., Kirsch D.G., McLaughlin M.E. Restoration of p53 function leads to tumour regression in vivo//Nature. -2007. -Vol. 445, No. 7128. -P. 661-665.
- Wang Y., Wu X.S., He J. et al. A novel TP53 variant (rs78378222 A > C) in the polyadenylation signal is associated with increased cancersusceptibility: Evidence from a meta-analysis//Oncotarget. -2016. - DOI: 10.18632/oncotarget.9056
- Wang Z., Rajaraman P., Melin B.S. et al. Further Confirmation of Germline Glioma Risk Variant rs78378222 in TP53 and Its Implication in Tumor Tissues via Integrative Analysis of TCGA Data//Hum Mutat. -2015. -Vol. 36, No. 7. -P. 684-688.
- Zhou L., Qipeng Y., Ming Y. A functional germline variant in the P53 polyadenylation signal and risk of esophageal squamous cell carcinoma//Gene. -2012. -Vol. 506. -P. 295-297.


