Аллилирование 1,3,4-тиадиазол-2,5-дитиола
Автор: Тарасова Наталья Михайловна, Ким Дмитрий Гымнанович
Журнал: Вестник Южно-Уральского государственного университета. Серия: Химия @vestnik-susu-chemistry
Рубрика: Органическая химия
Статья в выпуске: 1 (260), 2012 года.
Бесплатный доступ
Установлено, что взаимодействие 1,3,4-тиадиазол-2,5-дитиола с 3-бромпропеном и 2-метил-3-хлорпропеном протекает с образованием ди-8-производных, а с 1,3-дихлорпропеном и 1-бром-3-метилбутеном-2 с образованием смеси моно- и ди-8-производных.
4-тиадиазол-2, 5-дитиол, 5-бис(аллилтио)-1, 4-тиадиазолы, 5-аллилтио-1, 4-тиадиазол-2-тионы, иодиды 2-(2-пропенилтио)- 5-иодметил-5, 6-дигидротиазоло[2, 4]тиа-диазолия и 2-(2-пропенилтио)- 6-иод-6, 7-дигидро-5н-[1, 4]тиадиазоло-[2, 3]тиазиния, иодциклизация, масс-спектры
Короткий адрес: https://sciup.org/147160216
IDR: 147160216 | УДК: 547.794.3
Текст научной статьи Аллилирование 1,3,4-тиадиазол-2,5-дитиола
Соединения 1,3,4-тиадиазольного ряда представляют большой интерес для научных исследований. Многие производные данной системы обладают практически ценными свойствами, в том числе высокой биологической активностью. Было выявлено, что соединения ряда 1,3,4-тиадиазола могут проявлять противовоспалительную, противомикробную [1, 2], фунгицидную [3] тромболитическую активность [4]. Кроме того, показана высокая эффективность S-производных 1,3,4-тиадиазол-2,5-дитиола как мультифункциональных добавок к смазочным маслам [5].
Согласно обзору [6], 1,3,4-тиадиазол-2,5-дитиол ( 1 ) существует в различных таутомерных формах:
По данным авторов [6], наиболее устойчивой является форма 1b. Следует отметить, что меркаптоазолы, несмотря на таутомерию, реагируют с алкилгалогенидами исключительно по атому серы.
Соединение 1 в зависимости от условий реакций может алкилироваться с образованием как моно-, так и диалкилпроизводных. По литературным данным, соединение 1 алкилируется гало-геналканами в присутствии K2CO3 с образованием S-монозамещенных производных [7]. При кипячении соединения 1 с 2-фенил-5-хлорметил-1,3,4-оксадиазолом в пиридине образуется ди-S-производное [8]. Кроме того, дизамещенные соединения получаются при взаимодействии тиадиазола 1 с избытком алкилгалогенидов в присутствии гидроксида натрия при комнатной температуре [9].
Обсуждение результатов
В настоящей работе нами изучено взаимодействие соединения 1 с 3-бромпропеном ( 2a ), 3-хлор-2-метилпропеном ( 2b ), 1,3-дихлорпропеном ( 2c ), 1-бром-3-метилбутеном-2 ( 2d ).
Взаимодействие соединений 1 и 2a, b в спиртах в присутствии KOH или этилата натрия ведет независимо от соотношения исходных реагентов к образованию 2,5-бис(2-пропенилтио)-1,3,4-тиадиазола (4а) и 2,5-бис(2-метил-2-пропенилтио)-1,3,4-тиадиазола (4b) соответственно. Га-логенпроизводные 2с и 2d менее активны в реакции с соединением 1. Так, при взаимодействии тиадиазола 1 с галогенпроизводным 2с образуется смесь 5-(3-хлор-2-пропенилтио)-1,3,4-тиадиазол-2-тиона (3с) и 2,5-бис(3-хлор-2-пропенилтио)-1,3,4-тиадиазола (4с), а с бромпроизводным 2d - смесь 5-(3-метил-2-бутенилтио)-1,3,4-тиадиазол-2-тиона (3d) и 2,5-бис(3-метил-2-бутенилтио)-1,3,4-тиадиазола (4d):
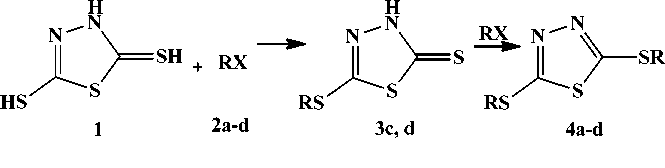
2a, 4a R=CH 2 CHCH 2 ; 2b , 4b R=CH 2 C(CH 3 )CH 2 ; 2c, 3с, 4с R=CH 2 CHCHCl; 2d , 3d, 4d R=CH 2 CHC(CH 3 ) 2 ; 2a , d X=Br; 2c , b X=Cl
В масс-спектрах всех синтезированных соединений присутствует пик молекулярного иона [M]+\ однако для соединений 4с, d он имеет весьма низкую интенсивность. Это возможно связано со снижением стабильности молекулярных ионов 2,5-замещенных производных 1,3,4-тиадиазолтиолов при увеличении длины заместителей на атомах серы. Для соединения 4с максимальным является пик [M-Cl]+, что обусловлено легкостью отрыва галогена от молекулярного иона [10].
Таблица 1
Данные масс-спектров исследованных соединений
|
Соединение |
Характеристики ионов: m / z ( I , %) |
|
3с (C 5 H 5 N 2 S 3 CI) |
224 [M]+ (59), 189 [M-Cl]+ (43), 157 (15), 75 (100), 59 (17), 49 (11), 39 (31) |
|
3d (C 7 H 10 N 2 S 3 ) |
218 [M]+; (34), 185 [M-SH]+ (12), 150 (29), 69 (100), 41 (59) |
|
4a (C8HwN 2 S 3 ) |
230 [M]+ (43), 215 [M-CH 3 ]+ (100), 131 (13), 98 (68), 73 (25), 55 (34), 41 (78) |
|
4b (C 10 H 14 N 2 S 3 ) |
258 | M Г (81), 243 [M-CH 3 ]+ (100), 112 (90), 87 (28), 69 (58), 55 (66), 39 (23) |
|
4c (C8H8N 2 S 3 Cl 2 ) |
298 |M Г (5), 263 [M-Cl]+ (100), 188 (15), 132 (13), 107 (6), 75 [M-C 5 H 4 N 2 S 3 C1]+ (79), 39 (26) |
|
4d (C 12 H 18 N 2 S 3 ) |
286 [M]+ (5), 249 [M-SCH 2 ]+ (3), 218 (27), 185 (10), 150 (20), 69 (100), 41 (37) |
Для соединений 4а, b максимальную интенсивность имеет пик [M-CH3]+, обусловленный, как и для 2-(2-метил-2-пропенил)тио-5-метил-1,3,4-тиадиазола [11], образованием устойчивой тиазолотиадиазолиевой системы А :
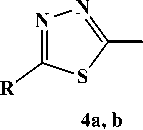
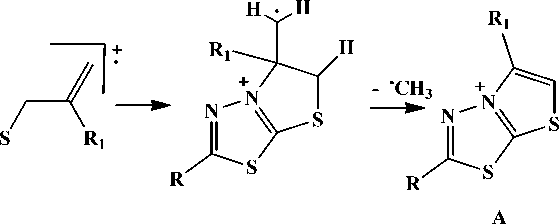
4a R=SCH3CHCH 2 , R 1 =H; 4b R= SCH 2 C(CH 3 )CH 2 , R 1 =CH 3 .
Соединение 3d содержит в масс-спектре пик [M-SH]+, характерный для ароматических ал-лилсульфидов [10, 12], и обусловленный образованием устойчивой азолотиадиазолиевой ароматической системы В :
Органическая химия
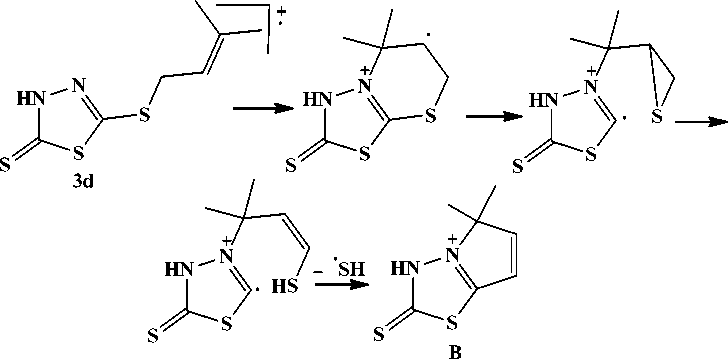
Следует отметить, что в отличие от соединения 3с , в масс-спектрах соединений 4a, b, d пик [M–SH]+ отсутствует, что, по-видимому, связано с трудностями в образовании устойчивой ароматической системы, вызванными наличием второго заместителя по атому серы в положении 5.
На примере соединения 4а была исследована реакция с иодом. Установлено, что иодцикли-зация протекает с аннелированием пяти- и шестичленного циклов и образованием иодидов 2-2-пропенилтио)-5-иодметил-5,6-дигидротиазоло[2,3- b ][1,3,4]тиадиазолия 6а и 2-(2-пропенилтио)-6-иод-6,7-дигидро-5 Н -[1,3,4]тиадиазоло[2,3- b ][1,3]тиазиния 6b :
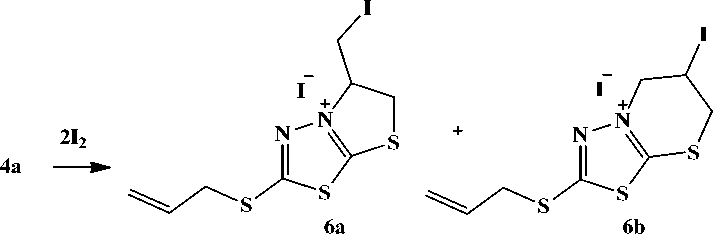
Соотношение соединений 6а и 6b по данным ЯМР 1Н составляет 10 : 3.
Экспериментальная часть
Спектры ЯМР 1Н полученных соединений записаны на спектрометре Bruker DRX-400 (400 МГц) в ДМСО-d6, внутренний стандарт ТМС. Масс-спектры (ЭУ, 70 эВ) сняты на хромато-масс-спектрометре фирмы SHIMADZU GCMS QP-2010 Ultra.
2,5-Бис(2-пропенилтио)-1,3,4-тиадиазол. ( 4а ). Растворяют 0,16 г (4 ммоль) KOH в 10 мл 2-пропанола и к полученному раствору добавляют 0,65 г (4 ммоль) соединения 1 и, медленно при перемешивании, 0,97 мл (8 ммоль) 3-бромпропена. Смесь кипятят в течение 2 часов, затем фильтруют от осадка бромида калия и испаряют растворитель при комнатной температуре. Остаток растворяют в горячем гексане, при охлаждении выпадает в виде желтого масла. Выход 0,52 г (56 %).
2,5-Бис(2-метил-2-пропенилтио)-1,3,4-тиадиазол ( 4b ). Растворяют 0,18 г (4 ммоль) натрия в 10 мл этанола и к полученному раствору добавляют 0,60 г (8 ммоль) соединения 1 и 0,79 мл (8 ммоль) 3-хлор-2-метилпропена. Смесь кипятят в течение 5 часов. После охлаждения фильтруют, из фильтрата испаряют растворитель, остаток обрабатывают диэтиловым эфиром и снова фильтруют. После испарения эфира остается соединение 4b в виде желтого масла. Выход 0,70 г (68 %).
Смесь 5-(3-хлор-2-пропенилтио)-1,3,4-тиадиазол-2-тиона (3с) и 2,5-бис(3-хлор-2-пропе-нилтио)-1,3,4-тиадиазола (4с). Растворяют 0,18 г (4 ммоль) натрия в 10 мл этанола, к полученному раствору добавляют 0,60 г (8 ммоль) соединения 1 и 0,75 мл (8 ммоль) 1,3-дихлорпропена. Смесь кипятят в течение 5 часов. После охлаждения раствор фильтруют. Оставшееся после испа- рения из фильтрата растворителя вещество обрабатывают диэтиловым эфиром и снова фильтруют. После испарения эфира остается смесь соединений 3с и 4с в виде красно-коричневого масла. Выход 0,57 г.
Смесь 5-(3-метил-2-бутенилтио)-1,3,4-тиадиазол-2-тиона ( 3d ) и 2,5-бис(3-метил-2-буте-нилтио)-1,3,4-тиадиазола ( 4d ). Растворяют 0,20 г (5 ммоль) натрия в 15 мл этанола, к получен -ному раствору добавляют 0,75 г (5 ммоль) соединения 1 и 1,14 мл (10 ммоль) 1-бром-3-метилбутена-2. Смесь кипятят в течение 5 часов. После охлаждения, раствор фильтруют. Оставшееся после испарения из фильтрата растворителя вещество обрабатывают диэтиловым эфиром и снова фильтруют. После испарения эфира остается смесь соединений 3d и 4d . Выход 0,75 г.
Смесь иодидов 2-(2-пропенилтио)-5-иодметил-5,6-дигидротиазоло[2,3-Ь][1,3,4]тиадиазолия ( 6a ) и 2-(2-пропенилтио)-6-иод-6,7-дигидро-5Н-[1,3,4]тиадиазоло[2,3-Ь][1,3]тиазиния ( 6b ).
Растворяют 0,5 г (2 ммоль) иода в 4 мл диэтилового эфира, к полученному раствору добавляют 0,23 г (1 ммоль) в 3 мл эфира. Смесь оставляют при комнатной температуре на 24 часа. Раствор декантируют, оставшееся масло черного цвета растворяют в 3 мл ацетона и добавляют раствор 0,37 г (2 ммоль) NaI × 2H 2 O в 3 мл ацетона. Выпавший желтый осадок смеси соединений 6a и 6b отфильтровывают. Выход 0,27 г.
Соединение 6a , спектр ЯМР 1Н, δ, м.д.: 3,70 (1Н, м, СH 2 I); 3,82 (2Н, м, 6-CH 2 ); 4,00 (2Н, м, SCH 2 ); 4,30 (1Н, м, СH 2 I); 5,27 (1H, м, =CH 2 ); 5,36 (1H, м, +NCH); 5,44 (1H, м, =CH 2 ); 5,95 (1H, м, –CH=).
Соединение 6b , спектр ЯМР 1Н, δ, м.д.: 3,82 (2Н, м, 6-CH 2 ); 4,00 (2Н, м, SCH 2 ); 4,81 (1H, м, +NCH 2 ); 5,00 (1Н, м, СHI); 5,08 (1H, м, +NCH 2 ); 5,27 (1H, м, =CH 2 ); 5,44 (1H, м, =CH 2 ); 5,95 (1H, м, –CH=).
Заключение
Показано, что взаимодействие 1,3,4-тиадиазол-2,5-дитиола с 3-бромпропеном и 2-метил-3-хлорпропеном в присутствии KOH и этилата натрия протекает с образованием ди-S-производных, а с 1,3-дихлорпропеном и 1-бром-3-метилбутеном-2 с образованием смеси моно- и ди-S-производных. Установлено, что при взаимодействии 2,5-бис(2-пропенилтио)-1,3,4-тиадиазола с иодом образуется смесь иодидов 2-(2-пропенилтио)-5-иодметил-5,6-дигидро-тиазоло[2,3- b ][1,3,4]тиадиазолия и 2-(2-пропенилтио)-6-иод-6,7-дигидро-5 Н -[1,3,4]тиадиа-золо [2,3- b ][1,3]тиазиния. Структура синтезированных соединений подтверждена данными хромато-масс-спектрометрии и ЯМР 1Н.
Список литературы Аллилирование 1,3,4-тиадиазол-2,5-дитиола
- Synthesis, antimicrobial and anti-inflammatory activities of novel 5-(1-adamantyl)-1.3.4-thiadiazole derivatives/Adnan A. Kadi, Ebtehal S. Al-Abdullah, Ihsan A. Shehata et al.//European Journal of Medicinal Chemistry. -2010. -Vol. 45. -P. 5006-5011.
- Synthesis and evaluation of antitubercular activity of imidazo[2,1-b][1,3,4]thiadiazole derivatives/G. Kolavi, V. Hegde, I. А. Khazia, P. Gadad//Bioorg. and Med. Chem. -2006. -Vol. 14. -P. 3069-3080.
- New fungicidally active pyrazolyl-substituted 1,3,4-thiadiazole compounds and their preparation/H. S. Chen, Z. M. Li, Y. F. Han, Z. W. Wang//Chinese Chemical Letters. -1999. -Vol. 10. -№ 5. -P. 365-366.
- Methods and compositions for thrombolytic therapy/D.A. Claremon, P.A. Friedman, D.C. Remy, A.M. Stern//Assignee: Merc & Co Inc. US Pat. 4,968,494. -1990. -Nov. 6. -10 p.
- Karol, T.J. Succinate derivatives of 2,5-dimercapto-1,3,4-thiadiazoles/T.J. Karol//Assignee: R.T. Vanderbilt Company, Inc. US Pat. 5,177,213. -1993. -Jan. 5.
- Штефан, Е.Д. Таутомерия гетероциклических тиолов. Пятичленные гетероциклы/Е.Д. Штефан, В.Ю. Введенский//Успехи химии. -1996. -Т. 65, № 4. -С. 326-333.
- Поиск новых пестицидов в ряду производных 1,3,4-тиадиазола/В. Довлатян, Т. Папоян, Ф. Аветисян, А. Енгоян//Доклады НАН РА. -2006. -№ 1. -С. 106.
- Synthesis and antibacterial activity of some new 1,3,4-oxadiazole and 1,3,4-thiadiazole derivatives/J. Salimon, N. Salih, A. Hameed et al.//Journal of Applied Sciences Research. -2010. -№ 6. -P. 866-870.
- Kuodis, Z. Salts of 2,5-dimercapto-1,3,4-thiadiazole/Z. Kuodis, A. Rutavichyus, S. Valiulene//Chemistry of Heterocyclic Compound. -2000. -Vol. 36, №. 5. -С. 598-602.
- Вульфсон, Н.С. Масс-спектрометрия органических соединений/Н.С. Вульфсон, В.Г. Заикина, А.И. Микой. -М.: Химия, 1986. -311 с.
- Судолова, Н.М. Синтез новых производных тиазоло[2,3-Ь][1,3,4]тиадиазолиевой системы/Н.М. Судолова, Д.Г. Ким//Бутлеровские сообщения. -2011. -Т. 26, № 11. -С. 76-80.
- Исследование S-производных 2-тиоурацилов методом масс-спектрометрии/Т.В. Фролова, А.А. Анучин, Е.И. Бахтеева, Д.Г. Ким//Вестник ЮУрГУ. -2010. -Вып. 4. -№ 31(207). -С. 29-34.


