Анализ биодеградации in vivo тканевой бесклеточной матрицы на основе хитозана
Автор: Семенов Павел Сергеевич
Рубрика: Человек и окружающая среда: новые проблемы и исследовательские инновации
Статья в выпуске: 10, 2012 года.
Бесплатный доступ
Проанализированы варианты тканевого замещения пористых матриц на основе хитозана. Выявлены некоторые особенности процессов репарации и биодеструкции хитозанового имплантата. Дана гистологическая и цитологическая характеристика ремоделированным в хитозановой матрице тканям.
Хитозан, биодеградация, тканевая инженерия, скаффолды, биоинженерия, имплантат, биосовместимость, морфология
Короткий адрес: https://sciup.org/14967867
IDR: 14967867 | УДК: 57.089.67
Текст научной статьи Анализ биодеградации in vivo тканевой бесклеточной матрицы на основе хитозана
Хитозан является деацетилированной формой широко распространенного в природе полимера хитина. В настоящее время хитозан находит широкое применение во множестве отраслей народного хозяйства.
Широкое применение хитозана в биоинженерии началось относительно недавно и было ознаменовано выходом в свет статьи, написанной группой итальянских ученых под руководством R. Muzzarelli и опубликованной в журнале «Biomaterials» в мае 1988 года. В своей статье ученые описали замещение участка твердой мозговой оболочки хитозановой матрицей, отметив последующее полное морфологическое восстановление дефекта без каких-либо функциональных нарушений [4].
Обширные дефекты и повреждения опорных тканей требуют особого подхода, а также использования материалов, способных к полноценной заместительной терапии. В настоящее время все более широкое применение находят природные полимеры, что вполне объяснимо их биосовместимостью, способностью к биодеградации и доступностью [1; 6; 12; 9]. Ряд авторов, анализируя опыты применения различных биополимеров, приходит к выводу о наиболее перспективном применении хитозана, отличающегося хондро- и остео-кондуктивными свойствами, высокой биосов- местимостью и полной деградацией полимера, а также выраженной антибактериальной и фунгицидной активностью [1; 8; 2; 14].
Использование хитозана в качестве матричной подложки позволяет подавить иммуноиндуцированный ответ, повышая биосовместимость композитных матриц. Не менее значимым фактом, расширяющим возможные сферы биоинженерного применения хитозана, является его химическая активность, выражающаяся в различных модификациях полимера с широким спектром биологически активных компонентов как органического, так и неорганического состава [10; 5; 3; 13]. Также следует отметить, что при электростатическом и гидрофобном взаимодействии хитозана с модифицирующими агентами его биологически активные свойства не только не теряются, но и в ряде случаев усиливаются.
Не менее важными параметрами при создании 3D скаффолдов являются физические свойства компонентов матрицы: плотность, упругость, эластичность и толщина мембран. Непременное условие наличия объемных пор в бесклеточных матрицах на основе хитозана диктуется необходимостью метаболического и газового обменов во вновь образующихся тканях. В исследовании [7] доказано влияние толщины хитозановых мембран, образующих пористый объемный скаффолд, на качество клеточной адгезии, скорость пролиферации и неоангеогенеза. Твердо-упругие свойства некоторых модификаций хитозана, предлага- емых к использованию в тканевой инженерии, приближаются к значениям, свойственным губчатой кости, и способны выдерживать компрессионную нагрузку порядка 75 МПа с размером пор в диапозоне от 250 до 500 мкм [11]. Изначально высокая вязкость растворов хитозана позволяет использовать различные методы создания пористых матриц, начиная от лиофильного высушивания, заканчивая вспениванием газами, пузыри которых формируют стабильные поры диаметром до 500 мкм. Начало применения хитозана как биоинженерного полимера открыло новую веху в истории развития биоинженерии.
Качественные реакции организма при имплантации хитозановых скаффолдов неоднозначны и различными авторами трактуются по-разному, но все же всеми едино отмечена неспецифическая умеренная инфильтрация нейтрофилами и активация фибробластов [2; 12; 9].
Для понимания механизма биодеструкции полимера in vivo и формирования целостной морфологической картины возникшего биологического ответа проведена серия экспериментов по вживлению пористых бесклеточных матриц с их последующим морфологическим анализом.
Нами c применением оригинального метода «замораживание – высушивание» создана 3D-матрица с регулярным размером пор хитозана размером 50–100 мкм. Стерильные матрицы размером 5 х 5 мм были в асептических условиях подкожно вшиты в области холки крысам самцам линии Wistar, наркотизированным эфир-тиопенталовым наркозом. Операционное поле после механической депиляции обрабатывалось кожным антисептиком «Астрадез – ОП». После ориентации исследуемых образцов подкожно-жировую клетчатку ушивали внутренними швами кетгутовыми нитями, на кожу накладывали кожные швы шелковой нитью. Послеоперационное ведение заключалось в обработке раневой поверхности «Астрадез – ОП» до третьего дня и снятии кожных швов на пятый день эксперимента. При послеоперационном ведении животных общих реакций на имплантаты выявлено не было, термометрические показатели оставались в пределах нормы, масса тела у всех животных была стабильной. Забор био-птатов осуществляли через 4–6 недель после их постановки крысам. Ход операции и послеоперационное ведение экспериментальных животных соответствовали первому этапу эксперимента. При изъятии образцов оценивалась их подвижность in situ, состояние окружающей клетчатки, наличие питающих матрицу сосудов, спаечного процесса, степень биодеградации матриц. Матрицы фиксировали в 10%-ном растворе забуференного нейтрального формалина в течение 24 часов, промывали в течение 6 часов в проточной воде и после быстрой проводки заключали в парафин. Срезы после депарафинирования окрашивали гематоксилином Эрлиха – эозином, трехцветным методом по Массону, пикрофуксином по Ван-Гизону. Готовые препараты заключали в канадский бальзам.
В результате анализа полученных микропрепаратов помимо описанных в литературе реакций, выявлен ряд особенностей, не указывавшихся ранее. Морфологическая картина отличается выраженной мозаичностью и полиморфизмом клеточных элементов (рис. 1). Замещение биоразлагающегося полимера идет за счет нарастания соедини-тельно-тканных элементов с обилием внеклеточного матрикса. В биодеструкции хитозана активную роль играют макрофаги, объединенные в микроколонии и адгезированные на поверхности разрушаемого полимера, часто в их цитоплазме содержатся фагоцитированные хитозановые фрагменты (рис. 2). В отличие от ранее указывавшегося рядом авторов факта наличия в имплантатах большого количества базофилов, последние нами были обнаружены в единичных полях зрения. Также следует отметить большое сходство реакции на имплантат с гранулематозным воспалением. В пользу последнего говорят обнаруженные нами скопления эпителиоидных клеток (рис. 3) и гигантские многоядерные клетки инородных тел с лежащими на периферии цитоплазмы ядрами. Особый интерес представляет не указывавшийся ранее клеточный ответ в виде эозинофильной инфильтрации, образующей локальные разреженные инфильтраты. Не менее интересен гистогенез, в частности ангиогенез, интенсивно индуцированный в хитозановой матрице. В одном поле зрения возможно наблюдать «разновозрастные» сосуды, находящиеся на разных стадиях ангиогенеза. Фибробласты и гистиоциты образуют аморфный матрикс, указывая на активные репаративные процессы. Новым в реакции на пористую хитозановую бесклеточную матрицу является хондроиндуктивный эффект и как следствие об- разование в ней гиалиноподобного хряща (рис. 4). Хондробласты, рыхло лежащие во внеклеточном матриксе, образуют хрящеподобные структуры, доказывая возможность применения чистого хитозана в хондропластике и его индукцию хондрогенеза.
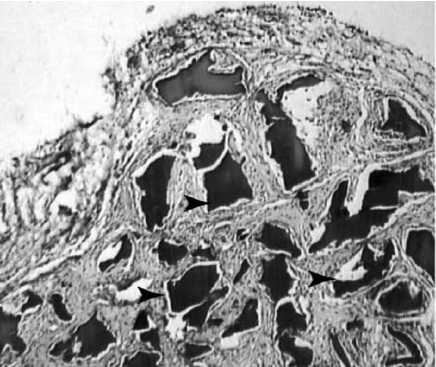
Рис. 1. Процесс биодеструкции и тканевого замещения бесклеточной пористой хитозановой матрицы ( стрелки – хитозан). Гематоксилин Эрлиха – эозин, ув. Ч 40
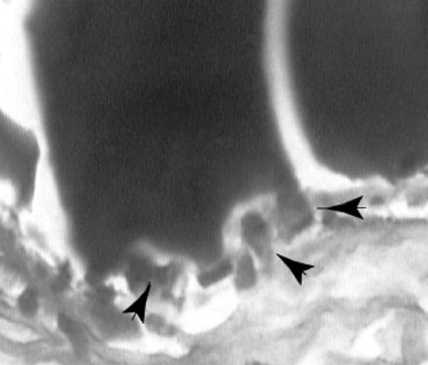
Рис. 2. Скопление макрофагов ( стрелки ), фагоцитирующих хитозан. Гематоксилин Эрлиха – эозин, ув. Ч 1000
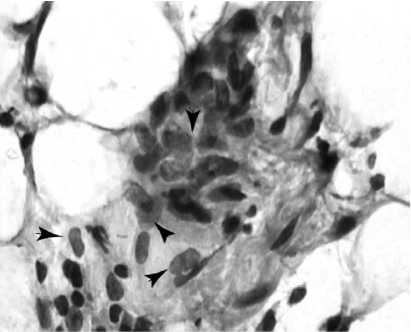
Рис. 3. Скопления эпителиоидных клеток ( стрелки ) окруженных коллагеновым матриксом. Трехцветный метод по Массону, ув. Ч 1000
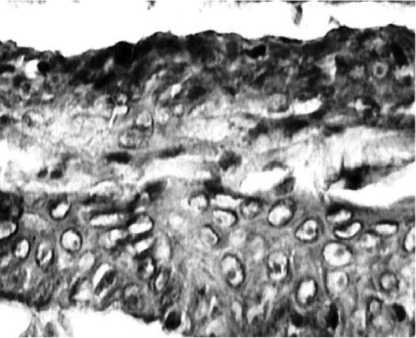
Рис. 4. Гиалиноподобный хрящ на месте резорбированного полимера. Трехцветный метод по Массону, ув Ч. 400
Проблема биосовместимости и биодеградации хитозана in vivo требует дальнейшей проработки и анализа с применением новых модифицирующих агентов и с привлечением возможностей иммуногистохимических методов анализа тканевого ремоделирования.
Список литературы Анализ биодеградации in vivo тканевой бесклеточной матрицы на основе хитозана
- Модификация поверхностей внутрикостных имплантатов: современные исследования и нанотехнологии/В. И. Калита [и др.]//Вестник Волгоградского государственного медицинского университета. -2009. -№ 4(32). -С. 17-22.
- Biochemistry, histology and clinical uses of chitins and chitosans in wound healing/R. A. Muzzarelli [et al.]//EXS. -1999. -Vol. 87. -P. 251-264.
- Biocomposites containing natural polymers and hydroxyapatite for bone tissue engineering/M. Swetha, K. Sahithi, A. Moorthi [et al.]//Int. J. Biol. Macromol. -2010. -Vol. 47, №1. -P. 1-4.
- Biological activity of chitosan: ultrastructural study/R. Muzzarelli, V. Baldassarre, F. Conti [et al.]//Biomaterials. -1988. -Vol. 9, № 3. -P. 247-252.
- Chen, J. P. Preparation and characterization of biomimetic silk fibroin/chitosan composite nanofibers by electrospinning for osteoblasts culture/J. P. Chen, S. H. Chen, G. J. Lai//Nanoscale Res Lett. -2012. -Vol. 7, № 1. -P. 170-178.
- Da Sacco, L. Chitin and chitosan as multipurpose natural polymers for groundwater arsenic removal and AS2O3 delivery in tumor therapy/L. Da Sacco, A. Masotti//Mar. Drugs. -2010. -Vol. 8, № 5. -P. 1518-1525.
- Dehghani, F. Engineering porous scaffolds using gas-based techniques/F. Dehghani, N. Annabi//Curr Opin Biotechnol. -2011. -Vol. 22, № 5. -P. 661-666.
- Di Martino, A. Chitosan: a versatile biopolymer for orthopaedic tissue-engineering/A. Di Martino, M. Sittinger, M.V. Risbud//Biomaterials. -2005. -Vol. 26, № 30. -P. 5983-5990.
- Evaluation of the biocompatibility of a chitosan scaffold in mice/P. J VandeVord., H. W. Matthew, S. P. DeSilva [et al.]//J. Biomed. Mater. Res. -2002. -Vol. 59, № 3. -P. 585-590.
- Morphological study of the capsular organization around tissue expanders coated with Ncarboxybutyl chitosan/G. Biagini, A. Pugnaloni, A. Damadei [et al.]//Biomaterials. -1991. -Vol. 12, № 3. -P. 287-291.
- Muzzarelli, R. A. Biomedical exploitation of chitin and chitosan via mechano-chemical disassembly, electrospinning, dissolution in imidazolium ionic liquids, and supercritical drying/R. A. Muzzarelli//Mar. Drugs. -2011. -Vol. 9, № 9. -P. 1510-1533.
- Therapeutic potential of chitosan and its derivatives in regenerative medicine/C. Shi, Y. Zhu, X. Ran [et al.]//J. Surg. Res. -2006. -Vol. 133, № 2. -P. 185-192.
- Venkatesan, J. Chitosan composites for bone tissue engineering-an overview/J. Venkatesan, S. K. Kim//Mar. Drugs. -2010. -Vol. 8, № 8. -P. 2252-2266.
- Yang, T. L. Chitin-based Materials in Tissue Engineering: Applications in Soft Tissue and Epithelial Organ/T. L. Yang//Int. J. Mol. Sci. -2011. -Vol. 12, № 3. -P. 1936-1963.


