Анализ биомеханики проксимального межфалангового сустава после эндопротезирования
Автор: Котельников Г.П., Колсанов А.В., Николаенко А.Н., Згирский Д.О., Дороганов С.О.
Журнал: Гений ортопедии @geniy-ortopedii
Рубрика: Оригинальные статьи
Статья в выпуске: 5 т.29, 2023 года.
Бесплатный доступ
Введение. Современное состояние проблемы эндопротезирования мелких суставов кисти, в частности проксимального межфалангового сустава, характеризуется необходимостью создания анатомически адаптированных конструкций с использованием оптимальных материалов. Внедрение нового медицинского изделия требует его комплексного доклинического испытания.Цель. Определить допустимый диапазон нагрузок на проксимальный межфаланговый сустав после эндопротезирования путём анализа его биомеханики для предупреждения развития критических состояний - осложнений.Материалы и методы. В период с 2016 по 2021 год был разработан цельнокерамический несвязанный анатомически адаптированный эндопротез проксимального межфалангового сустава на основании комплексного подхода, включающего доклинические испытания и клиническое исследование 42 пациентов (25 мужчин, 17 женщин) с остеоартритом проксимального межфалангового сустава. При помощи 3D-моделирования создана цифровая модель эндопротеза. С использованием метода конечных элементов изучены критические состояния разработанной цифровой модели, имитирующей стереотипные движения в суставе, получены объективные результаты, которые имеют применение в клинической практике.Результаты. При нагрузке до 5 килограммов устойчивость биомеханической конструкции не нарушается при амплитуде движений от 0 до 60 градусов, при нагрузке до 20 килограммов в пределах 0-30 градусов. Кортикальная костная ткань выдерживает нагрузки до 20 килограммов при амплитуде движений от 0 до 60 градусов.Обсуждение. Был проведён анализ предельных нагрузок на эндопротез с учетом прочностных характеристик костной ткани и циркониевой керамики как материала. Данное исследование задало вектор для разработки в дальнейшем оптимального режима двигательной активности в раннем послеоперационном периоде и наметило оптимальный диапазон движений после эндопротезирования ПМФС.Заключение. Прилагаемая нагрузка в раннем послеоперационном периоде до 5 кг является оптимальной для пациента, при этом диапазон сгибания не должен превышать 90°. Использование нагрузки в диапазоне от 5 до 20 кг возможно, но без превышения угла сгибания в проксимальном межфаланговом суставе более 30°. При заданной нагрузке в 20 кг при угле сгибания более 30° вероятен вывих компонентов эндопротеза, при угле сгибания более 60° крайне вероятно возникновение перипротезного перелома.
Эндопротезирование проксимального межфалангового сустава, метод конечных элементов, эндопротезирование суставов кисти, цифровое моделирование
Короткий адрес: https://sciup.org/142239025
IDR: 142239025 | УДК: 616.727.9-089.843-77:519.876.5 | DOI: 10.18019/1028-4427-2023-29-5-468-474
Текст научной статьи Анализ биомеханики проксимального межфалангового сустава после эндопротезирования
накладывает серьезные ограничения на функцию кисти в целом [3]. Эндопротезирование ПМФС на сегодняшний день становится наиболее предпочтительной и перспективной операцией для восстановления функции сустава и кисти в целом. Это становится возможным благодаря длительному эволюционному пути, начиная с 20-х годов прошлого века: в настоящее время импланты ПМФС представлены в виде связанных – силиконовых – и несвязанных конструкций, изготавливаемых из металл-полиэтилена и пирокарбона [4, 5].
Однако, несмотря на разнообразие ассортимента изделий, все импланты обладают своими достоинствами и недостатками, что сказывается на противоречивости функциональных результатов эндопротезирования ПМФС [6]. В последние годы внимание клиницистов и учёных-медицинских конструкторов привлекла циркониевая керамика. И это неудивительно: износостойкость, биосовместимость и био-интертность, коррозионная устойчивость – основные качества данного материала, которые превосходно находят своё отражение в ортопедической и дентальной имплантологии. В последнее десятилетие в мировой научной литературе стали появляться первые сообщения об использовании цельнокерамических эндопротезов, и это привлекло внимание, в том числе и кистевых хирургов [7, 8, 9].
Мировая практика сегодня взяла вектор на персонифицированную медицину, а хирургия суставов подчиняется всеобщей направленности, и в эндопротезировании мелких суставов кисти намечены движения по созданию оптимальной конструкции анатомически адаптированных имплантов и идеального материала для их изготовления [10, 11].
Научно-технический прогресс в медицине характеризуется огромным количеством новых изделий медицинского назначения, поступающих на рынок, фармакологических препаратов, методик и технологий лечения. Однако любое новшество, прежде чем поступить в использование широкой сетью лечебных учреждений, проходит тернистый путь доклинических испытаний; применительно к различного рода имплантам это токсикологические исследования на клеточных культурах, технические испытания образцов в лаборатории, обладающей сертификацией в конкретной области, доклиническая апробация на лабораторных животных и кадаверном материале [12]. Многочисленные сообщения о тяжести ревизионных вмешательств при эндопротезировании суставов кисти побудили нас к проведению данного цифрового исследования, для того чтобы оградить пациента от дополнительных физических и психоэмоциональных травм.
Эндопротезирование ПМФС несвязанными имплантами, среди всех прочих, характеризуется следующим рядом наиболее частых осложнений [13, 14]:
– вывих в эндопротезе;
– перелом ножки импланта;
– перипротезный перелом фаланги.
Цель – определить допустимый диапазон нагрузок на проксимальный межфаланговый сустав после эндопротезирования путём анализа его биомеханики для предупреждения развития критических состояний – осложнений.
МАТЕРИАЛЫ И МЕТОДЫ
В период с 2016 по 2021 год проведено обследование 42 пациентов, которые обратились на консультацию травматолога-ортопеда в Клиники Самарского государственного медицинского университета по поводу остеоартрита ПМФС. Среди обратившихся было 25 мужчин (59,5 %) и 17 женщин (40,5 %), средний возраст пациентов составил 44 ± 2,71 года. Все больные предъявляли жалобы на боль, умеренный отёк и выраженное ограничение движений в ПМФС. Болевой синдром у обследованных больных составил 5 ± 1,4 балла по ВАШ, средний объём сгибания в ПМФС составил 48,7 градуса.
Пациенты прошли комплексное обследование, включавшее сбор жалоб и анамнеза, клинический осмотр, рентгенографию кисти в двух проекциях, ком- пьютерную томографию (КТ). С целью биомеханического исследования здоровых и поражённых суставов выполнялась 3D-визуализация КТ-сканов.
Параллельно была выполнена диссекция 25 када-верных кистей для изучения анатомии капсульно-связочного аппарата ПМФС.
На основании вышеуказанного исследования и анализа опыта зарубежных коллег в области эндопротезирования ПМФС, принимая во внимание общий вектор развития персонифицированной медицины, нами была разработана конструкция цельнокерамического несвязанного анатомически адаптированного эндопротеза проксимального межфалангового сустава (Патент РФ на полезную модель № 202476 от 19.02.2021. Бюл. № 5) [15].
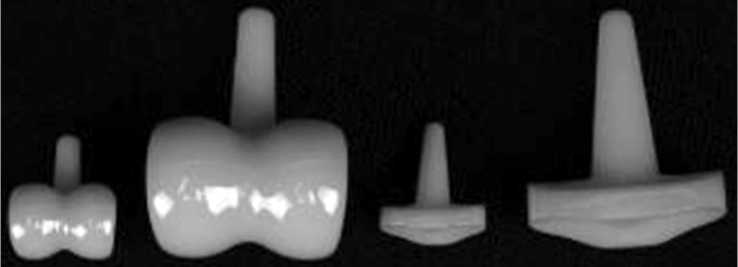
Рис. 1. Цельнокерамический несвязанный, анатомически адаптированный эндопротез проксимального межфалангового сустава, представленный в двух размерах
Изделие относится к эндопротезам несвязанного типа и выполнено из цельной циркониевой керамики. Суставные поверхности выполнены анатомично: проксимальный компонент представлен тороидальными мыщелками и бороздой между ними, образует дугу в 210 градусов, дистальный – имеет вогнутую поверхность, эллипсовидную форму и гребень-антагонист борозды посередине. Конструкция посадочных поверхностей суставных частей имеет две плоскости для обеспечения ротационной стабильности при минимальной резекции костной ткани. Ножки эндопротеза имеют коническую форму и округления на верхушках для простоты установки методом press-fit. Размерная линейка импланта представлена четырьмя позициями и поставляется с набором инструментов для установки. Эндопротез прошёл полный цикл доклинических технических и токсикологических испытаний: технические испытания пройдены на базе АНО «Центр качества, эффективности и безопасности медицинских назначений», г. Москва (акт № 11/022.Р-2021 от 10 ноября 2021 г.). Токсикологические тесты выполнены в физико-химической лаборатории «Дельма», г. Пущино (программа токсикологических исследований медицинского изделия № МИ21-0208/02 от 2 августа 2021 г.).
Медицинская наука, стоящая на службе практического здравоохранения, на сегодняшний день невозможна без коллективной работы специалистов различных специальности: врачей, инженеров-проектировщиков, IT-специалистов, графических дизайнеров. Этот эффективный тандем позволяет достичь высоких результатов на доклиническом этапе исследований, что способствует минимизации риска развития осложнений и прочих нежелательных состояний в клинической практике [16].
Для анатомо-биомеханического исследования ПМФС использовали базу сканов КТ-формата DICOM и выполняли 3D-моделирование методами полигонального моделирования, 3D-скульптинга, а также с использованием систем автоматизированного моделирования, разработанных в Институте инновационного развития СамГМУ. В процессе данного этапа исследования мы работали в программных комплексах ZBrush, Autodesk 3dsMax, в результате чего получали трёхмерные модели суставов для дальнейшего создания эндопротеза нового конструктивного дизайна.
Для воспроизведения критических состояний, приводящих к развитию осложнений, был использован метод конечных элементов (finite element method). Метод конечных элементов (МКЭ) является основным для анализа напряжённо-деформированных состояний конструкций, широко применяемым в авиастроении, промышленности и строительстве. В медицине МКЭ незаменим в разработке имплантов, в частности для ортопедии: с его помощью можно определить действующие нагрузки на эндопротез, винт, пластину, дентальный имплант и пр. и на сегмент опорно-двигательной системы, что позволяет спрогнозировать срок службы изделия при заданных нагрузках и оптимизировать его конструкцию ещё на доклиническом этапе. В данном исследовании МКЭ применяли в программном комплексе Ansys [17, 18]. Из всего многообразия движений кисти мы выбрали основные стереотипы и загрузили в программу в виде 3D-моделей.
Мы использовали следующие свойства керамики, представленные в таблице 1.
Таблица 1
Механические свойства керамики
|
Свойства |
Значение |
|
Плотность, г/см3 |
6 |
|
Средний размер частиц, мкм |
< 1 |
|
Прочность на изгиб, МПа |
900 |
|
Модуль Юнга, ГПа |
210 |
|
Твёрдость по Виккерсу, HV 0.1 |
1200 |
Механические свойства кортикальной кости, использованные при разработке цифровой модели:
-
– модуль Юнга 1,8 × 1010 Па;
-
– предел прочности 146 МПа;
-
– удельный вес 1800 кг/м3.
В разработанной цифровой модели эндопротезирования ПМФС для программного комплекса Ansys применялись данные только кортикальной кости, так как моделирование может подразумевать упрощение и абстрагирование от реальной ситуации из-за сложности воспроизведения физиологических и биомеханических процессов в нативной кости.
Твердотельная модель импланта была интегрирована в костную ткань, представляя собой биомеханическую конструкцию, которая подвергалась прочностному анализу. Целью выполняемых расчетов являлся анализ напряжённого состояния конструкции, выявление наиболее ослабленных зон, как в костной ткани, так и в материале импланта, предотвращение возможного разрушения составляющих биомеханической конструкции.
Для разработки цифровой конечно-элементной модели были взяты основные стереотипы движений, заключающиеся в шаровом захвате предметов с углом сгибания в ПМФС 0, 30, 60 и 90 градусов и сжатием предмета [19, 20].
На основе расчёта напряжённого состояния биомеханической конструкции «имплант – костная ткань» определялись допускаемые рабочие нагрузки для заданных углов сгибания сустава.
Прочностной анализ проводился на основе метода конечных элементов. Модель исследуемой биомеханической конструкции была размечена конечными элементами Solid 45, также к модели были приложены граничные условия: костная ткань проксимальной фаланги жёстко закреплялась по поверхности торца – закрепление «жёсткая заделка», а к дистальному фаланговому элементу кости были приложены усилия в осевом направлении. Конечно-элементная модель исследуемой биомеханической конструкции показана на рисунках 2-5.
Тип нагружения – шаровой захват с углом сгибания в ПМФС 0, 30, 60, 90 градусов, сжатие предмета. Нагрузки прилагались в диапазоне 1-20 кг. Величина прилагаемой нагрузки выбиралась на основании литературных данных, анализ которых показал предельные нагрузки, при которых возникали критические состояния в реальных клинических условиях [30]. С целью демонстрации на рисунках приведен только один вид прилагаемой нагрузки в качестве примера.
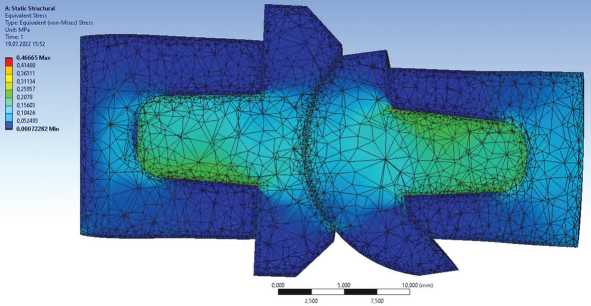
Рис. 2. Конечно-элементная модель имплантированного эндопротеза PIP. Модель приведена при усилии нагрузки 1 кг. Угол сгибания в PIP 0º
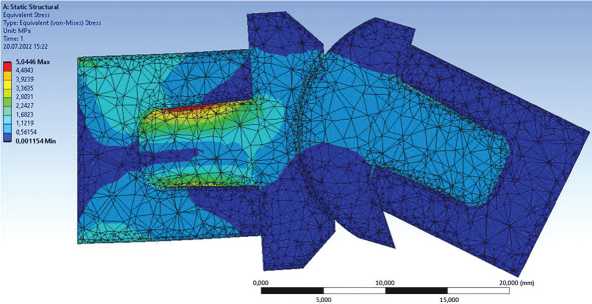
Рис. 3. Конечно-элементная модель имплантированного эндопротеза PIP. Модель приведена при усилии нагрузки 5 кг. Угол сгибания в PIP 30º

Рис. 4. Конечно-элементная модель имплантированного эндопротеза PIP. Модель приведена при усилии нагрузки 10 кг. Угол сгибания в PIP 60º
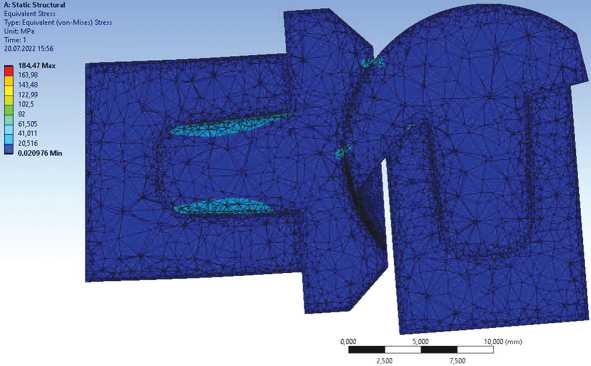
Рис. 5. Конечно-элементная модель имплантированного эндопротеза PIP. Модель приведена при усилии нагрузки 20 кг. Угол сгибания в PIP 90º
Также, помимо осуществления цифрового моделирования критических состояний методом конечных элементов, мы оценивали клиническую картину и амплитуду движений в оперированном суставе. В наше наблюдение вошло 10 пациентов, которым было выполнено эндопротезирование проксимального межфалангового сустава по поводу посттравматического артрита, максимальный срок наблюдения составил 6 месяцев.
РЕЗУЛЬТАТЫ
Зависимость напряжений в костной ткани от прилагаемых нагрузок показана на рисунке 6.
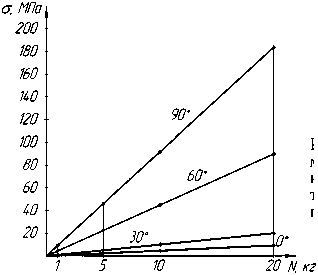
Рис. 6. Зависимость напряжений в костной ткани от прилагаемых нагрузок
При анализе моделирования критических нагрузок в ПМФС получены следующие результаты:
-
– при нагрузке до 5 килограммов устойчивость биомеханической конструкции не нарушается при всех положениях сгибания в суставе (0°, 30°, 60°), кроме 90°;
-
– кортикальная костная ткань выдерживает нагрузки до 20 килограммов при любом положении сгибания в суставе (кроме угла сгибания 90°);
-
– при нагрузках до 20 килограммов биомеханическая конструкция остается устойчивой при углах сгибания 0-30°;
– прочность элементов импланта существенно (более чем в 2 раза) превышает прочность костной ткани в соединении «имплант – костная ткань».
ОБСУЖДЕНИЕ
На сегодняшний день развитие медицины и, в частности хирургии, травматологии и ортопедии, происходит с огромной скоростью, с каждым днём внедряются всё новые методы диагностики и лечения различных патологий. Высокие обороты научно-технического прогресса не обошли стороной и эндопротезирование суставов: уже сегодня в США робот-ассистированное эндопротезирование коленного сустава стало рутинной практикой. В России ежегодно выполняется свыше 100000 эндопротезирований различных суставов, и более 90 % от этого числа приходится на крупные суставы – тазобедренный, коленный, плечевой [21]. Современные линейки имплантов крупных суставов допускают возможным лечение остеоартрита различной стадии, учитывая всевозможные технические сложности и коморбидность пациента, делая эндопротезирование рутинной, повсеместной и абсолютно доступной медицинской услугой [22, 23].
Несмотря на высокие успехи, достигнутые в хирургии крупных суставов, эндопротезирование мелких суставов кисти и стопы не может отличиться столь же оптимистичной картиной. Сложность геометрии и биомеханики суставов, ограниченный массив костной и периартикулярных тканей, высокие требования, предъявляемые пациентом к органу, – всё это делает результаты операций по замене суставов кисти противоречивыми и дискутабельными [24, 25]. Кисть – один из наисложнейших органов с наибольшим представительством в центральной нервной системе, к которому предъявляются максимально высокие требования любым человеком. Восстановление мелкой моторики пальцев, необходимость выполнения строго дозированных движений даже в повседневной жизни – это настоящий вызов для всей команды специалистов, занимающейся лечением заболеваний и повреждений кисти. Принимая во внимание вышесказанное, а также данные мировой литературы, мы находим неоспоримым факт о необходимости проработки конструкции имплантов для мелких суставов кисти [26, 27, 28, 29].
В период 2016-2021 годы в СамГМУ была разработана анатомически адаптированная конструкция ПМФС на основании анализа биомеханики и рентгенологических данных 42 пациентов с различными деге- неративными заболеваниями. Для того чтобы снизить долю осложнений, связанных с эксплуатацией эндопротезов, мы провели моделирование биомеханики, которая имеет место в реальных клинических условиях.
Данное направление является пилотным в развитии производственной имплантологии в РФ. Моделирование реальной биомеханики важно анализировать в аспекте избегания развития критических состояний у пациента в реальных клинических условиях, что влечет за собой физическую и психоэмоциональную травму. Безусловно, моделирование предполагает абстрагирование от реального применения у пациента эндопротеза, но дает нам возможность определить граничные условия применения разработанных имплантатов.
По данным конечно-элементного анализа определено, что наибольшие напряжения испытывают зоны соединений «имплант – костная ткань», за исключением расчётной модели с углом сгибания в ПМФС 0º. При угле сгибания в ПМФС 0º наибольшие напряжения наблюдаются непосредственно в компонентах эндопротеза.
Необходимо отметить, что наиболее нагруженным и подверженным разрушению материалом является костная ткань. Перспективами данного исследования может являться разработка «слабого звена», функция которого – предотвращение разрушения костной ткани путём внедрения в элементы импланта концентраторов напряжений. При этом в случае запредельных нагрузок разрушению будет подвержен эндопротез.
Проведение прочностных тестов у пациентов после эндопротезирования проксимального межфалангового сустава на основании объективных расчетных данных позволит избежать риска возникновения критических осложнений – вывиха компонентов эндопротеза, перелома ножки эндопротеза и перипротезного перелома.
Предложенная нами цифровая модель неидеальна, в ней имеются погрешности, допустимые для экспериментального исследования и в целом для процесса моделирования [30]. Программный комплекс Ansys визуализирует эндопротез в виде заранее упрощённой модели, что, с одной стороны, позволяет провести математические расчеты, но с другой стороны абстрагирует процесс от реальной клинической ситуации. В целом данный принцип возможен, так как речь идет о ком- плексных доклинических исследованиях, и на данном этапе реальные клинические условия не воссоздавались.
Тем не менее, мы достигли заданной цели – провели анализ предельных нагрузок на эндопротез с учетом прочностных характеристик костной ткани и циркониевой керамики как материала. Данное исследование задало вектор для разработки в дальнейшем оптимального режима двигательной активности в раннем послеоперационном периоде и наметило оптимальный диапазон движений после эндопротезирования ПМФС.
Подобные междисциплинарные исследования необходимы при разработке новых конструктивных осо- бенностей эндопротезов, при использовании новых материалов и их комбинаций.
Полученные в данном исследовании результаты мы использовали в послеоперационном ведении 10 пациентов с максимальным сроком наблюдения 6 месяцев. Математически обоснованные нагрузки в процессе реабилитации позволили достичь амплитуды движений в оперированном суставе от 49 до 70 градусов сгибания. При этом осложнений, связанных с критическими состояниями эндопротезированного сустава, – переломов ножки импланта, перипротезного перелома кости, нестабильности в суставе – отмечено не было.
ЗАКЛЮЧЕНИЕ
Прилагаемая нагрузка в раннем послеоперационном периоде до 5 кг является оптимальной для пациента, при этом диапазон сгибания не должен превышать 90°. Использование нагрузки пациентом в диапазоне от 5 до 20 кг возможно, но без превышения угла сги- бания в проксимальном межфаланговом суставе 30°. При заданной нагрузке в 20 кг при угле сгибания более 30° в значительной степени возрастает вероятность вывиха компонентов эндопротеза, при угле сгибания более 60° – развитие перипротезного перелома.
Список литературы Анализ биомеханики проксимального межфалангового сустава после эндопротезирования
- Yamamoto M, Malay S, Fujihara Y, et al. A Systematic Review of Different Implants and Approaches for Proximal Interphalangeal Joint Arthroplasty. Plast Reconstr Surg. 2017;139(5):1139e-1151e. doi: 10.1097/PRS.0000000000003260
- Harris CA, Shauver MJ, Yuan F, et al. Understanding Patient Preferences in Proximal Interphalangeal Joint Surgery for Osteoarthritis: A Conjoint Analysis. J Hand Surg Am. 2018;43(7):615-624.e4. doi: 10.1016/j.jhsa.2018.03.001
- Millrose M, Gesslein M, Ittermann T, et al. Arthrodesis of the proximal interphalangeal joint of the finger - a systematic review. EFORT Open Rev. 2022;7(1):49-58. doi: 10.1530/EOR-21-0102
- Zhu AF, Rahgozar P, Chung KC. Advances in Proximal Interphalangeal Joint Arthroplasty: Biomechanics and Biomaterials. Hand Clin. 2018;34(2):185-194. doi: 10.1016/j.hcl.2017.12.008
- Николаенко А.Н., Иванов В.В., Згирский Д.О. и др. Эндопротезирование проксимального межфалангового сустава. Обзор литературы. Medline. 2022;23:748-766.
- Forster N, Schindele S, Audigé L, Marks M. Complications, reoperations and revisions after proximal interphalangeal joint arthroplasty: a systematic review and meta-analysis. J Hand Surg Eur Vol. 2018;43(10):1066-1075. doi: 10.1177/1753193418770606
- Castagnini F, Cosentino M, Bracci G, et al. Ceramic-on-Ceramic Total Hip Arthroplasty with Large Diameter Heads: A Systematic Review. Med Princ Pract. 2021;30(1):29-36. doi: 10.1159/000508982
- Lakhdar Y, Tuck C, Binner J. et al. Additive manufacturing of advanced ceramic materials. Progress in Materials Science. 2021;116. doi: 10.1016/j. pmatsci.2020.100736
- Backes LT, Oldorf P, Peters R, et al. Study of the tribological properties of surface structures using ultrashort laser pulses to reduce wear in endoprosthetics. J Orthop Surg Res. 2020;15(1):205. doi: 10.1186/s13018-020-01719-1
- Rivière C, Vendittoli PA, editors. Personalized Hip and Knee Joint Replacement [Internet]. Cham (CH): Springer; 2020. doi: 10.1007/978-3-030-24243-5
- Zhang D, Bauer AS, Blazar P, Earp BE. Three-Dimensional Printing in Hand Surgery. J Hand Surg Am. 2021;46(11):1016-1022. doi: 10.1016/j. jhsa.2021.05.028
- Shegokar R. Preclinical-testing understanding the basics first. Drug Delivery Aspects. 2020:19-32. doi: 10.1016/b978-0-12-821222-6.00002-6
- Helder O, Marks M, Schweizer A, et al. Complications after surface replacing and silicone PIP arthroplasty: an analysis of 703 implants. Arch Orthop Trauma Surg. 2021;141(1):173-181. doi: 10.1007/s00402-020-03663-5
- Wagner ER, Weston JT, Houdek MT, et al. Medium-Term Outcomes With Pyrocarbon Proximal Interphalangeal Arthroplasty: A Study of 170 Consecutive Arthroplasties. J Hand Surg Am. 2018;43(9):797-805. doi: 10.1016/j.jhsa.2018.06.020
- Колсанов А.В., Николаенко А.Н., Ушаков А.А. и др. Эндопротез проксимального межфалангового сустава кисти. Патент РФ на полезную модель № 202476 U1. 19.02.2021. Бюл. № 5. Доступно по: https://patents.s3.yandex.net/RU202476U1_20210219.pdf. Ссылка активна на 29.06.2023.
- Chien S, Bashir R, Nerem RM, Pettigrew R. Engineering as a new frontier for translational medicine. Sci Transl Med. 2015;7(281):281fs13. doi: 10.1126/scitranslmed.aaa4325
- Angeles Maslucan R, Dominguez JA. A Finite Element Stress Analysis of a Concical Triangular Connection in Implants: A New Proposal. Materials (Basel). 2022;15(10):3680. doi: 10.3390/ma15103680
- Wei Y, Zou Z, Wei G, et al. Subject-Specific Finite Element Modelling of the Human Hand Complex: Muscle-Driven Simulations and Experimental Validation. Ann Biomed Eng. 2020;48(4):1181-1195. doi: 10.1007/s10439-019-02439-2
- Duruöz MT. Assessment of hand functions. In: Duruöz, M. (eds) Hand Function. Springer, New York, NY. 2014:41-55. doi: 10.1007/978-1-4614-9449-2_3
- Pang EQ, Yao J. Anatomy and Biomechanics of the Finger Proximal Interphalangeal Joint. Hand Clin. 2018;34(2):121-126. doi: 10.1016/j.hcl.2017
- Вороков А.А., Бортулев П.И., Хайдаров В.М. с соавт. Эндопротезирование тазобедренного и коленного суставов: показания к операции. Ортопедия, травматология и восстановительная хирургия детского возраста. 2020;8(3):355-364. doi: 10.17816/PTORS34164
- Maradit Kremers H, Larson DR, Crowson CS, et al. Prevalence of Total Hip and Knee Replacement in the United States. J Bone Joint Surg Am. 2015;97(17):1386-97. doi: 10.2106/JBJS.N.01141
- Singh JA, Yu S, Chen L, Cleveland JD. Rates of Total Joint Replacement in the United States: Future Projections to 2020-2040 Using the National Inpatient Sample. J Rheumatol. 2019;46(9):1134-1140. doi: 10.3899/jrheum.170990
- Vakalopoulos K, Arner M, Denissen G, et al. Current national hand surgery registries worldwide. J Hand Surg Eur Vol. 2021;46(1):103-106. doi: 10.1177/1753193420970155
- Swann J. The world at your finger tips: how the hand functions. Nursing and Residential Care. 2015;17(8):444-448. doi: 10.12968/nrec.2015.17.8.444
- Conson M, Di Rosa A, Polito F, et al. "Mind the thumb": Judging hand laterality is anchored on the thumb position. Acta Psychol (Amst). 2021;219:103388. doi: 10.1016/j.actpsy.2021.103388
- Young RW. Evolution of the human hand: the role of throwing and clubbing. JAnat. 2003;202(1):165-74. doi: 10.1046/j.1469-7580.2003.00144.x
- Qiu S., Kermani M.R. Inverse Kinematics of High Dimensional Robotic Arm-Hand Systems for Precision Grasping. J Intell Robot Syst. 2021;101(4). doi: 10.1007/s10846-021-01349-7
- Leibovic SJ, Bowers WH. Anatomy of the proximal interphalangeal joint. Hand Clin. 1994;10(2):169-78. 1994;10(2):169-178. doi: 10.1016/S0749-0712(21)01280-4
- Groenwold RHH, Dekkers OM. Measurement error in clinical research, yes it matters. Eur J Endocrinol. 2020;183(3):E3-E5. doi: 10.1530/EJE-20-0550


