Анализ биосовместимости сплава Ti6Al4V для реконструкции костных дефектов «in vivo»
Автор: Мурылев В.Ю., Куковенко Г.А., Елизаров П.М., Музыченков А.В., Алексеев С.С., Яковлев К.Г., Жучков А.Г., Ватников Ю.А., Бобров Д.С.
Журнал: Кафедра травматологии и ортопедии @jkto
Рубрика: Оригинальное исследование
Статья в выпуске: 2 (56), 2024 года.
Бесплатный доступ
Обоснование. С ростом количества первичного эндопротезирования неуклонно растет и потребность в ревизионном эндопротезировании суставов, что в свою очередь требует новых подходов таких как 3D печать и материалов для их реализации. Одним из основных направлений 3D-печати медицинских имплантатов из биосовместимых материалов на сегодняшний день является титановый сплав Ti6Al4V.Цели исследований. Оценить степень остеоинтеграции титанового сплава Ti6Al4V в зависимости от структурной пористости в исследовании in vivo.Методы: нами был применен граф пористой структуры на основе Ti6A14V, необходимо изучить биологические характеристики, включая клеточную адгезию, клеточную морфологию, клеточную пролиферацию и остеоинтеграцию, что мы оценили в эксперименте in vivo. Образцы были выполнены в виде цилиндров габаритами Ø 4 мм и высотой 8 мм в нескольких экземплярах и различной ширины ячейки пористой структуры. Ширина ячейки пористой структуры входит в четыре различных диапазона значений от 0,3 до 0,59 мм: группа 1- 0,3-0,39 мм; группа 2- 0,4-0,45мм; группа 3 - 0,46-0,49; группа 4-0,5-0,59. Толщина балок, образующих пористую структуры во всех образцах одинаковая и составляет 0,45-0,5 мм. Так было сформировано четыре группы. В эксперимент было введено 10 клинически здоровых животных которым было установлены графы на срок до 30 суток.Результаты: на основании проведенного экспериментального исследования in vivo нами доказано, что образцы титанового сплава Ti6Al4V с пористостью 0,4-0,49 мм обеспечивают лучшее прорастание костной ткани.Заключение: Полученный результат можно связать с корреляцией размеров костных пор с пористостью графов, тем не менее это требует дальнейшего изучения вопроса и проведения следующих исследований. Полученные результаты могут быть использованы для восполнения костных дефектов при персонифицированном эндопротезировании 3D компонентами и позволяют рассчитывать на долгий срок службы.
Отальное эндопротезирование, костная ткань, тестирование материалов, биосовместимость
Короткий адрес: https://sciup.org/142242547
IDR: 142242547 | УДК: 617-089.844 | DOI: 10.17238/2226-2016-2024-2-53-62
Текст научной статьи Анализ биосовместимости сплава Ti6Al4V для реконструкции костных дефектов «in vivo»
THE DEPARTMENT OF TRAUMATOLOGY AND ORTHOPEDICS
Количество операций по эндопротезированию крупных суставов у пациентов возрастает, как во всем мире, так и в России. С ростом количества первичного эндопротезирования неуклонно растет и потребность в ревизионном эндопротезировании суставов, которая требует персонифицированного подхода в связи некомпенсируемым стандартными имплантами возникшего костного дефекта. Вместе с этим, в травматологии и ортопедии получило широкое распространение применения индивидуальных имплантатов, изготовленных для пациентов на основании их антропометрических данных, полученных на основании данных КТ и/или МРТ пациентов, при обширных костных дефектах при первичном и ревизионном эндопротезировании. Одним из основных направлений 3D-печати медицинских имплантатов из биосовместимых материалов на сегодняшний день является титановый сплав Ti6Al4V. [1,3]
Наиболее распространенными методами 3D-печати, используемыми для изготовления титановых сплавов, являются селективное лазерное плавление (SM). селективное лазерное спекание, электронно-лучевое плавление. В многочисленных исследованиях использовались каркасы из пористого титана с различными механическими свойствами, такими как проницаемость, усталость и модульность, которые были тщательно изучены. [2,4]
Тем не менее, лишь в нескольких исследованиях [2,3,4,6] изучалось влияние материала на костную ткань in vivo, а также способность к интеграции кости у реципиента. В этой связи, следует отметить, что кость представляет собой ткань, которая обладает способностью заживать и регенерировать, тем не менее иногда костный дефект требует реконструктивно- восстановительной процедуры. [6,7,8]
Для успешной реконструкции кости необходимы остеопродукция, остеоиндукция, остеокондукция, механическая стимуляция, и васкуляризация. Так же, препараты, влияющие на костный метаболизм, могут играть важную роль в врастании кости. [12,14] Аутогенная губчатая кость является в настоящее время золотым стандартом лечения потери костной массы по ряду причин, включая остеогенные, остеокондуктивные и остеоиндуктивные свойства аутотрансплантата. Однако у использования аутологичной кости есть серьезные недостатки, такие как ограниченная доступность и изменчивое качество, увеличение времени операции и кровотечения, хроническая боль в донорской области и дополнительные затраты. [20,14,16]
Из-за этих ограничений растущая потребность в реконструкции кости сопровождается ростом интереса к дисциплине костных заменителей и тканевой инженерии. [25,29,7]
Клиническая практика, показывает, что в идеале биоматериалы для тканевой инженерии должны соответствовать нескольким требованиям: поверхность должна допускать адгезию клеток, способствовать росту клеток позволяя сохранить дифференцированные клеточные функции; и сам материал и его побочные продукты распада должны быть биосовме-стимыми, не вызывающим иммуногенный ответ не провоцирующие воспаление или интоксикацию in vivo. В конечном счете идеальный материал должен быть биоразлагаемым, что безусловно не подходит для металлических биоматериалов. В свою очередь пористость должна быть достаточно высокой, чтобы обеспечить достаточное пространство для клеточной адгезии, регенерации внеклеточного матрикса и минимальных диффузионных ограничений во время культивирования, а структура пор должна обеспечивать равномерное пространственное распределение клеток по каркасу для облегчения образования гомогенной ткани.
Таким образом, подбор параметров пористой структуры имплантатов позволит обеспечить дополнительную фиксацию протезов посредством остеоинтеграции, что улучшит показатели выживаемости имплантатов и снизит количество ревизионных операций.
Важный аспект в создание каркаса конструкции включает в себя точный контроль размера пор, их распределения и взаимосвязанность. Тем не менее, стабильные физико-химические свойства делают титановые сплавы трудными для создания пористых структур. Традиционные методы изготовления, (уточнить названия) позволяют регулировать всего несколько параметров, таких как пористость и размер пор. Развитие технологии 3D-печати значительно улучшило контроль над архитектурой конструкции.
Соответственно внутренняя и внешняя форма продуктов 3D-печати может быть ближе к модели компьютерного проектирования, гарантируя, что характеристики пор каркаса будут соответствовать требованиям формирования кости.
Разработка методики имплантации нового поколения биосовместимых стандартных и персонифицированных материалов для имплантатов, обеспечивающих высокую специфичность действия для реконструкции костных дефектов в травматологии и ортопедии, и изучение биосовместимости [18,27,28] позволит внести значительный вклад в здравоохранение и повышение качество жизни граждан. Ожидается, что предлагаемая технология увеличит шансы проведения успешных операций за счет уменьшения послеоперационного воспаления, осложнений и ревизионных оперативных вмешательств.
Цели исследований. Оценить степень остеоинтеграции титанового сплава Ti6Al4V в зависимости от структурной пористости в исследовании in vivo.
Материалы и методы
В данной работе нами был применен граф пористой структуры на основе Ti6A14V Нам было необходимо изучить биологические характеристики, включая клеточную адгезию, клеточную морфологию, клеточную пролиферацию и остеоинтеграцию, что мы оценили в эксперименте in vivo. В рамках поиска параметров пористых структур были разработаны несколько видов ячеек различной ширины. Основой пористой структуры был выбран граф в виде правильного додекаэдра. Правильный додекаэдр один из пяти возможных правильных многогранников. Додекаэдр составлен из двенадцати правильных пятиугольников, являющихся его гранями. Каждая вершина додекаэдра является вершиной трёх правильных пятиугольников. Таким образом, додекаэдр имеет 12 граней (пятиугольных), 30 рёбер и 20 вершин (в каждой сходятся 3 ребра). Образцы были выполнены в виде цилиндров габаритами Ø 4 мм и высотой 8 мм в нескольких экземплярах и различной ширины ячейки пористой структуры. Ширина ячейки пористой структуры входит в четыре различных диапазона значений от 0,3 до 0,59 мм: группа 1- 0,3-0,39 мм; группа 2- 0,4-0,45мм; группа 3 – 0,46-0,49; группа 4-0,5-0,59. Толщина балок, образующих пористую структуры во всех образцах одинаковая и составляет 0,45-0,5 мм. Таким образом было сформировано четыре группы. [28]
Таблица 1
Параметры и количество исследуемых образцов
|
Номер группы образцов |
Параметры ячейки, мм |
|
1 |
0,3-0,39 |
|
2 |
0,4-0,45 |
|
3 |
0,46-0,49 |
|
4 |
0,5-0,59 |
При обращении с обследуемыми животными соблюдались «Правила проведения работ с использованием экспериментальных животных» (Приказ Министерства высшего и среднего специального образования СССР № 742 от 13.11.1984 г.) а также «Директивы 2010/63/EU Европейского парламента и Совета Европейского Союза по охране животных, используемых в научных целях».
Для проведения клинической части эксперимента использовали лабораторных кроликов, самцов, возраст – 6 месяцев и более, массой от 3.3 кг. Все животные предварительно содержались на карантине (21 день). Количество животных, используемых в исследовании, является минимально возможным с точки зрения регуляторных требований при сохранении достоверности получаемых результатов и гуманного отношения к животным.
Содержание- стандартное клеточное, кормление сено, комбикорм для кроликов, вода в свободном доступе. Животные клинически обследованы, проведен общий клинический и биохимический анализы крови. В качестве ингаляции, для борьбы с оппортунистической микрофлорой верхних дыхательных путей, на время карантина, назначен марбофлоксацин (5 мг/ кг в стерильном растворе 0.9% раствора NaCl 5 -7).
В день проведения экспериментальной операции стандартно проводили клинический осмотр животного. Во время нахождения животных, в отрезке времени клинического эксперимента – ежедневный клинический осмотр, после вывода животных из эксперимента проведено вскрытие с фото документацией и отправкой материала на морфологическое исследование.
Итого в эксперимент было введено 10 клинически здоровых животных.
Каждое животное было промаркировано. В процессе эксперимента имплантаты устанавливались в обе большеберцовые кости конечности экспериментальных животных.
Распределение животных по группам осуществлялось методом случайных чисел с использованием массы тела в качестве ведущего признака. В рамках отобранных 10 биомоделей получилось соответственно 20 тазовых конечностей для установки импланта. Каждому образцу в область бугристости большеберцовой кости был внедрен цилиндр одного из типов пористости. После подготовки оперативного поля в асептических условиях осуществлялся хирургический доступ к бугристости большеберцовой кости. С помощью костного сверла подготавливалось костное ложе для установки импланта, далее имплант импактировался в подготовленное ложе. Рана послойно ушивалась наглухо, обрабатывалась растворами антисептиков.
После выполнения оперативного пособия за био-моделями осуществлялось наблюдение в течение 30 суток. Проводились перевязки и динамическое наблюдение за течением раневого процесса. Ни одна из био-моделей не вышла из исследования. После чего согласно протоколу исследования на 30 сутки осуществляли взятие образцов костной ткани.
Для гистологического исследования большеберцовую кость после удаления мягких тканей фиксировали в 10 % растворе формалина на фосфатном буфере не менее 1 суток (1, 3). Последующую декальцинацию костей проводили раствором на основе ЭДТА, что минимизирует влияние раствора на структуры тканей. Декальцинацию прекращали при размягчении кости (1,3). Далее кости обезвоживали в этаноле возрастающей концентрации, просветляли в ксилоле и заключали в пластифицированный парафин по следующей схеме (1,3): - этанол 50 %, этанол 70 %, этанол 80 %, этанол 90 %. Длительность нахождения костного фрагмента в растворе каждой концентрации не менее 2 часов. Завершающим этапом было погружение костных фрагментов в этанол 96 % концентрации-этанол 96 % в смеси с бензолом 1:1 -этанол 96 % в смеси с бензолом 1:1 –бензол – бензол в смеси с парафином 1:1 – и дальнейшая парафинизация разогретым парафином в течение 2 часов. Далее проходило окрашивание костного препарата гемотоксилином и эозином. Процесс окрашивания включал следующие шаги: Депарафинизация и целлоидинг. Пропитывание гемотоксилином. Промывка и сушка. Окрашивание эозином. Далее с помощью микроскопа Nicon Coolscope II на всех увеличениях проводилась оценка препарата.
Результаты исследования. В рамках проведенного эксперимента in vivo было получена статистически достоверная разница в качестве остеоинтеграции в зависимости от степени пористости. Основываясь на полученных данных результатов гистологического исследования мы можем сделать выводы, что образцы с пористостью 0,4-0,49 мм (т.е. вторая и третья группы) обеспечивают лучшее прорастание костной ткани, чем образцы с пористостью 0,3-0,39 и 0,5-0,59 мм.
Исследование гистопрепаратов 1 группы продемонстрировало снижение интенсивности полнокровия сосудов, образование фиброзной ткани в зоне дефекта, в ряде случаев увеличилось количество васкуляризированных участков с врастанием сосудов в кортикальное вещество и образование новых слоев костной ткани. Наблюдаются признаки компак-тизации кости и начала формирования остеонов. вследствие снижения васкуляризации, в условиях пониженного кровоснабжения происходит замещение мезенхимальных клеток в хондробласты, с последующим формированием хрящевой ткани, вместо трабекулярной.
Во всех случаях в Группе №2 гистологически наблюдалось выраженное полнокровие сосудов, усиленная васкуляризация кости за счет развивающейся сети капилляров, местами с врастанием сосудов в кортикальное вещество кости. По периферии материала густая ретикулофиброзная ткань с фокусами образования грануляционной ткани. Определяются очаги молодой хрящевой ткани, дифференциация клеток, выявлена локальная лимфогистиоцитарная инфильтрация.
Высокая васкуляризация очага формирования костного дефекта с участками активно образующихся костных матриксов, остеоцитами и кровеносными сосудами наблюдались в Группе №3 Большое количество трабекул новообразованной костной ткани. Лейкоцитарной инфильтрации, как и других признаков воспалительной реакции не выявлено. Пролиферирующие остеогенные клетки дифференцируются в остеобласты, формирующие новые костные трабекулы, грубоволокнистая кость первичной мозоли замещается пластинчатой костью. Остеогенные клетки при наличии хорошего кровоснабжения дифференцируются в остеобласты, формирующие трабекулы.
В гистологических препаратах Группы №4 в области надкостницы наблюдается преобладание волокнистых структур. Зона полостного дефекта (импланта) окружена новообразованными трабекулами, наблюдается небольшое количество остеоцитов, сохраняются очаги лейкоцитарной инфильтрации и грануляционной ткани. Новообразованный костный массив (3.1), с характерным пластинчатым строением, формирование трабекулярной кости.
Через 30 суток после прекращения исследования участки диафиза во всех случаях имели костномозговую полость и компактизирующуюся корковую пластинку. Костномозговая полость была заполнена преимущественно жировым костным мозгом с очагами кроветворения и немногочисленными небольшими по площади костными трабекулами, локализирующимися преимущественно в срединной части регенерата.
Видимое врастание кости наблюдалось не только внутри пористых каркасов, но и на границе между костью и пористыми каркасами в каждой группе. Балки каркасов были окружены костью, между новой костью и балками отмечались крошечные зазоры. Вокруг балок наблюдалось большое количество клеток костной выстилки, что свидетельствовало об уже активированной регенерации кости. В некоторых областях также наблюдалось наличие хрящеподобной ткани. Балки пористых графов были окружены новой костью.
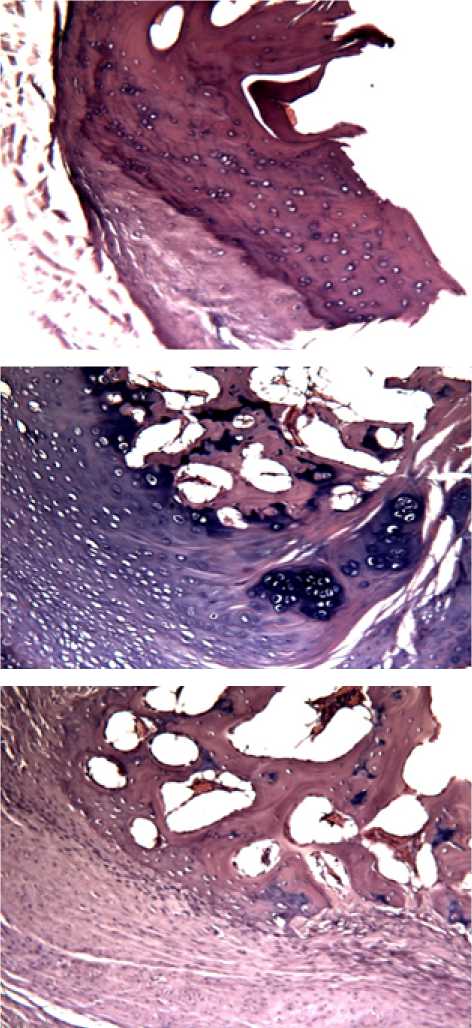
Рис.1 (кр. 1 пр л) Образец группы №1
На образце представленны трабекулы вновь образованной ретикулофиброзной костной ткани, формировавшие костный регенерат, остеоциты в лакунах окр. Г.-э.х100
Рис.2 (кр 2 лев л) образец группы 1
На рисунке 2 представлена вновь образованная ретикулофиброзная костная ткань костная ткань в периферической зоне дефекта, обилие остеоцитов и сосуды, образующиеся в новой ткани окр. Г.-э.х100
Рис 3 (кр 3 лев л) Образец группы 2 Представленное на срезе обилие остеоцитов, кровеносных сосудов и фрагментов незрелой кости, свидетельствует о на ранних стадиях заживления (рис 3) окр. Г.-э.х100 Дефекты хорошо заживают благодаря новообразованной сплетенной кости, богатой клеточной активностью (остеоид), на наличие собственной коллагеновой сетки по всей ткани
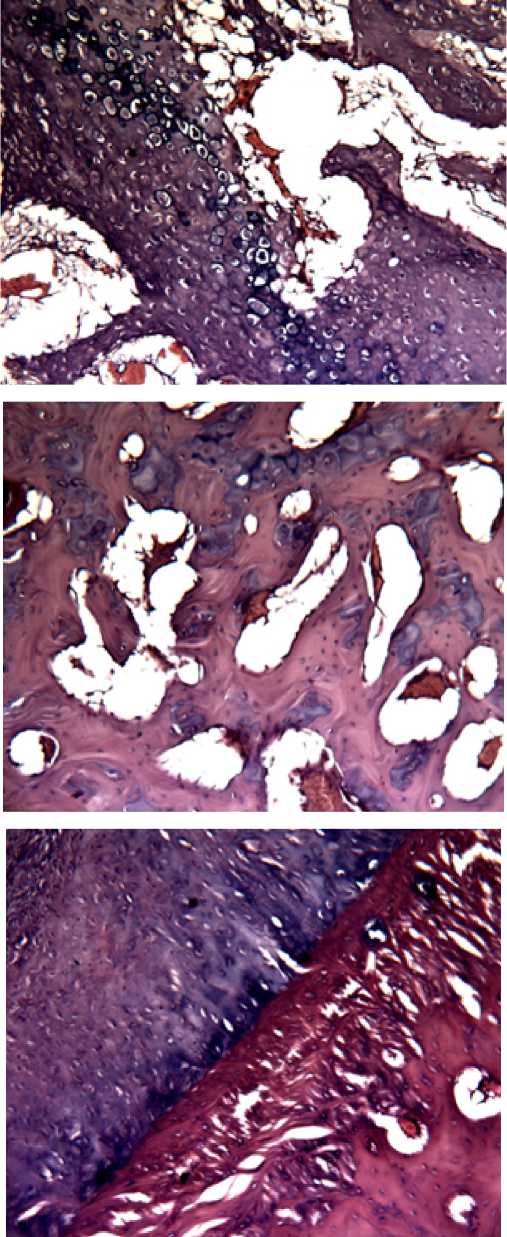
Рис 4. Образец группы 2
Представленное на рисунке 4 обилие остеоцитов, кровеносных сосудов и фрагментов незрелой кости, свидетельствует о ранних стадиях заживления костной ткани окр. Г.-э.х100
Рис.5 (кр 5 пр л) Образец группы 3
На рисунке 5 обилие вновь образованных трабекул и остеоцитов, кровеносных сосудов и фрагментов незрелой кости, свидетельствует о на ранних стадиях заживления окр. Г.-э.х100. Дефекты хорошо заживают благодаря новообразованной сплетенной кости, богатой клеточной активностью (остеоид), коллагеновую сетку по всему ткани.
Рис.6. (кр 9 лев л) Образец группы 3
На образце (рис 6) отмечается пролиферация хрящевых колонок, формирование кровеносных сосудов, Участок активной регенерации надкостницы в зоне формирования костного дефекта (имплантации) окр. Г.-э.х100
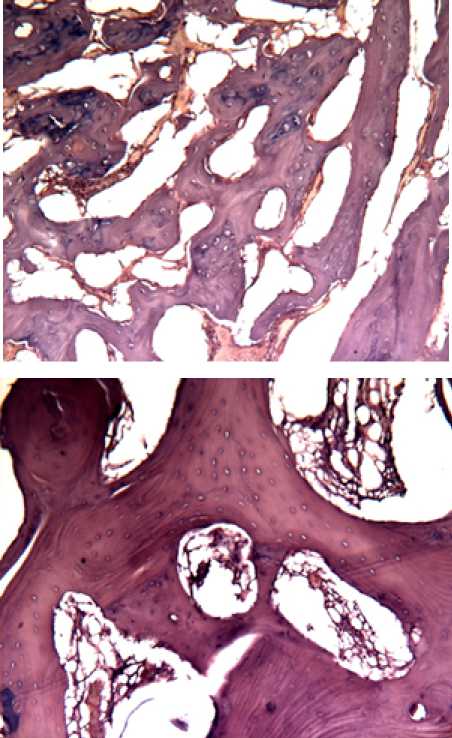
Рис.7. (кр 5 лев л) образец группы 4
Отмечается обилие балок новообразованной костной ткани с активными остеобластами на поверхности, отложениями остеоида (рис 7.) окр. Г.-э.х100
Рис.8 (кр 10 лев л)
Образец группы 4
В ряде образцов группы 4 выявлена высокая активность остеобластов на поверхности новообразованной кости с переходом на остопластический материал (см рис. 8) окр. Г.-э.х100
Обсуждение
Остеоинтеграция является одним из важнейших критериев при выборе типа материала в ортопедии. В рамках нашего исследования были получены убедительные данные подтверждающие выдающиеся характеристики врастания как в целом при использование Ti6Al4V.Тем не менее задача исследования было выполнена получены достоверные данные о лучшем качестве врастания групп 2 и 3. Регенерация кости представляет собой сложный, хорошо организованный физиологический процесс, на который могут влиять многие потенциальные факторы, включая остеогенную активность графов, секрецию биоактивных молекул и механические параметры [24, 25].
Биологическая и механическая среда in vivo является очень сложной. Поэтому мы имплантировали недавно разработанные графы кроликам в бугристость голени, а для оценки остеоинтеграции применяли визуализацию и гистологическую оценку. Наши результаты показывают интеграцию костных каркасов тест систем, хотя на гистологических срезах было несколько щелей между каркасами и новой костью что ярче всего отмечалось в группе 1 и 4
Тем не менее необходимо отметить, что имплантация на 30 суток является относительно короткой чтобы демонстрировать различия между группами, в то время как более продленная имплантация может нейтрализовать отклонения. Что безусловно можно отнести к дефектам нашего исследования.
Дальнейшее более всеобъемлющее и более продолжительное исследование с целью оптимизации конструкции графов безусловно необходимо.
По нашему мнению, остеоинтеграционная активность данных пористых каркасов является результатом взаимодействия внутренней биоактивности, адаптируемых механических свойств и пористой стереоскопической пространственной структуры.
Особенностями реакции костной ткани на пористые имплантаты является: быстрое ремоделирование гематомы и воспаления вокруг имплантата; образование и рост костной ткани одновременно во многих порах в виде отдельных ядер, которые постепенно разрастаются, заполняя поры и соединяющие их каналы и образуя высокопрочное соединение «имплантат – костная ткань». Что обеспечивает довольно успешное применение подобных имплантатов в реконструктивной ортопедии. Созданные и исследованные имплантаты позволят легко создать необходимые конструкции благодаря 3d-технологиям что обеспечат высокие остеокондуктивные качества имплантата и его биологическую инертность по отношению к окружающим тканям.
Костная репарация характеризуется прогрессирующей пролиферацией и дифференцировкой клеточных элементов, вырабатывающих органическую основу костного регенерата. При оптимальных условиях образуется остеоидная ткань, при менее благоприятных -хондроидная, которая впоследствии замещается костной. По мере развития и обызвествления костной ткани происходит резорбция хондроидных и фибробластических структур. Во всех группах между вновь образованной костной тканью и фрагментами имплантированных материалов, локализованными у краев костного дефекта, наблюдался контакт без формирования прослойки из кровоснабжаемой реактивно измененной волокнистой соединительной ткани. Хрящевая мозоль подвергается васкуляризации, ремоделированию и замещению грубоволокнистой губчатой костью, данный процесс наиболее выражен у животных в исследуемых группах №3, №2 и менее выражен в гр.№1, наименьшая васкуляризация, активность остеоцитов и формирование трабекул наблюдалось у животных из четвертой опытной группы.
Вывод. На основании проведенного экспериментального исследования in vivo нами доказано, что образцы титанового сплава Ti6Al4V с пористостью 0,4–0,49 мм обеспечивают лучшее прорастание костной ткани. Вероятнее всего подобный результат можно объяснить корреляцией с размерами костных пор с пористостью подготовленных графов, однако подобное заявление требует дальнейшего изучения вопроса проведения следующих исследований. В перспективе полученные результаты могут быть использованы для восполнения костных дефектов при персонифицированном эндопротезировании 3D компонентами и рассчитывать на долгий срок их службы.
Список литературы Анализ биосовместимости сплава Ti6Al4V для реконструкции костных дефектов «in vivo»
- Fu J, Xiang Y, Ni M, Qu X, Zhou Y, Hao L, Zhang G, Chen J. In Vivo Reconstruction of the Acetabular Bone Defect by the Individualized Three- Dimensional Printed Porous Augment in a Swine Model. Biomed Res Int. 2020 Nov 30;2020:4542302. doi: 10.1155/2020/4542302. PMID: 33335923; PMCID: PMC7723487.
- New biomaterials for bone regeneration Fabrizio Matassi1 Lorenzo Nistri2 Diana Chicon Paez2 Massimo Innocenti2 Clin Cases Miner Bone Metab. 2011 Jan-Apr; 8(1): 21–24. PMCID: PMC3230919 PMID: 22461799
- Vu, N., Truong, N., Dang, L. et al. In vitro and in vivo biocompatibility of Ti-6Al-4V titanium alloy and UHMWPE polymer for total hip replacement. Biomed Res Ther 3, 14 (2016). https://doi.org/10.7603/s40730-016-0014-8
- Т.И. Власова, Е.В. Арсентьева, Г.Д. Худайберенова, Д.И. Полякова СОВРЕМЕННЫЙ ВЗГЛЯД НА ИСПОЛЬЗОВАНИЕ КОСТНЫХ ЗАМЕНИТЕЛЕЙ И ВОЗМОЖНОСТЬ УСИЛЕНИЯ ИХ ОСТЕОГЕННОСТИ КЛЕТОЧНЫМИ ТЕХНОЛОГИЯМИ [T.I. Vlasova, E.V. Arsent’eva, G.D. Khudaiberenova, D.I. Polyakova SOVREMENNYI VZGLYaD NA ISPOL’’ZOVANIE KOSTNYKh ZAMENITELEI I VOZMOZhNOST’’ USILENIYa IKh OSTEOGENNOSTI KLETOChNYMI TEKhNOLOGIYaMI]
- Li L, Shi J, Zhang K, Yang L, Yu F, Zhu L, Liang H, Wang X, Jiang Q. Early osteointegration evaluation of porous Ti6Al4V scaffolds designed based on triply periodic minimal surface models. J Orthop Translat. 2019 Apr 6;19:94-105. doi: 10.1016/j.jot.2019.03.003. PMID: 31844617; PMCID: PMC6896722.
- Lei P, Qian H, Zhang T, Lei T, Hu Y, Chen C, Zhou K. Porous tantalum structure integrated on Ti6Al4V base by Laser Powder Bed Fusion for enhanced bony-ingrowth implants: In vitro and in vivo validation. Bioact Mater. 2021 Jun 16;7:3-13. doi: 10.1016/j.bioactmat.2021.05.025. PMID: 34430760; PMCID: PMC8367833.
- Новые технологии в хирургии позвоночника с использованием пористых имплантатов с памятью формы Н. Г. Фомичев, В. Э. Гюнтер, Н. В. Корнилов [и др.]. Томск: STT, 2002. 130 с. ISBN 5-93629-121-9. [Novye tekhnologii v khirurgii pozvonochnika s ispol’zovaniem poristykh implantatov s pamyat’yu formy / N. G. Fomichev, V. E. Gyunter, N. V. Kornilov [i dr.]. Tomsk: STT, 2002. 130 s. ISBN 5-93629-121-9]
- Ирьянов, Ю. М. Замещение дефекта кости в условиях чрескостного остеосинтеза и применения имплантата из никелида титана Ю. М. Ирьянов, Т. Ю. Ирьянова Морфология. 2012;142(4):83-86 [Ir’yanov, Yu. M. Zameshchenie defekta kosti v usloviyakh chreskostnogo osteosinteza i primeneniya implantata iz nikelida titana /Yu. M. Ir’yanov, T. Yu. Ir’yanova Morfologiya. 2012;142(4):83-86]
- Исследование особенностей интеграции различных биоматериалов в мягких и костной тканях организма А. В. Чернов, Ю. М. Ирьянов, С. А. Радченко [и др.] Гений ортопедии. 2012;1: 97-101. [Issledovanie osobennostei integratsii razlichnykh biomaterialov v myagkikh i kostnoi tkanyakh organizma A. V. Chernov, Yu. M. Ir’yanov, S. A. Radchenko [i dr.] Genii ortopedii. 2012;1: 97-101]
- Тактика хирургического лечения травматических повреждений средней зоны лица на основе применения имплантатов из сетчатого никелида титана Ю. А. Медведев, С. В. Шаманаев, Л. С. Шаманаева [и др.] Тихоокеанский медицинский журнал. 2013; 1(51):78–79. [Taktika khirurgicheskogo lecheniya travmaticheskikh povrezhdenii srednei zony litsa na osnove primeneniya implantatov iz setchatogo nikelida titana Yu. A. Medvedev, S. V. Shamanaev, L. S. Shamanaeva [i dr.] Tikhookeanskii meditsinskii zhurnal. 2013; 1(51):78–79]
- Медицинский нитинол: друг или враг? Ещё раз о биосовместимости никелида титана С. А. Муслов, О. А. Шумилина Фундаментальные исследования. 2007;10: 87-89. [Meditsinskii nitinol: drug ili vrag? Eshche raz o biosovmestimosti nikelida titana S. A. Muslov, O. A. Shumilina Fundamental’nye issledovaniya. 2007;10: 87-89]
- Никелид титана. Медицинский материал нового поколения В. Э. Гюнтер, В. Н. Ходоренко, Ю. Ф. Ясенчук [и др.]. Томск: ООО «Научно-производственное предприятие «МИЦ», 2006:296 ISBN 5-98589-020-1. [Nikelid titana. Meditsinskii material novogo pokoleniya V. E. Gyunter, V. N. Khodorenko, Yu. F. Yasenchuk [i dr.]. Tomsk: OOO «Nauchno-proizvodstvennoe predpriyatie «MITs», 2006:296 ISBN 5-98589-020-1]
- Применение биологически и механически совместимых имплантатов из нитинола для хирургического лечения повреждений и заболеваний позвоночника и спинного мозга Е. А. Давыдов, А. Ю. Мушкин, И. В. Зуев [и др.] Гений ортопедии. 2010;1:5-11. [Primenenie biologicheski i mekhanicheski sovmestimykh implantatov iz nitinola dlya khirurgicheskogo lecheniya povrezhdenii i zabolevanii pozvonochnika i spinnogo mozga / E. A. Davydov, A. Yu. Mushkin, I. V. Zuev [i dr.] // Genii ortopedii. 2010;1:5-11]
- Применение нанотехнологически структурированного никелида титана в медицине А. В. Федоров, М. Ю. Коллеров, С. С. Рудаков, П. А. Королев Хирургия. Журнал им. Н.И. Пирогова. 2009;2:71-74. [Primenenie nanotekhnologicheski strukturirovannogo nikelida titana v meditsine A. V. Fedorov, M. Yu. Kollerov, S. S. Rudakov, P. A. Korolev Khirurgiya. Zhurnal im. N.I. Pirogova. 2009;2:71-74]
- Функциональные покрытия для имплантационных материалов С. В. Гнеденков, Ю. П. Шаркеев, С. Л. Синебрюхов [и др.] Тихоокеанский медицинский журнал. – 2012;1(47):12-19. [Funktsional’nye pokrytiya dlya implantatsionnykh materialov S. V. Gnedenkov, Yu. P. Sharkeev, S. L. Sinebryukhov [i dr.] Tikhookeanskii meditsinskii zhurnal. – 2012;1(47):12-19]
- Экспериментальное исследование биологической инертности сплава никеля и титана с памятью формы Д.Е. Мацко, А.В. Омельченко, Ж.С. Жанайдаров, Е.Л. Давыдов, Л.В. Климаш Морфология. 2005;6:57–60. [Eksperimental’noe issledovanie biologicheskoi inertnosti splava nikelya i titana s pamyat’yu formy D.E. Matsko, A.V. Omel’chenko, Zh.S. Zhanaidarov, E.L. Davydov, L.V. Klimash Morfologiya. 2005;6:57–60]
- Eriksson C, Ohlson K, Richter K, Billerdahl N, Johansson M, Nygren H. Callus formation and remodeling at titanium implants. J Biomed Mater Res A. 2007 Dec 15;83(4):1062-1069. doi: 10.1002/jbm.a.31433. PMID: 17584899.
- Борзунов Д.Ю., Петровская Н.В., Дьячкова Г.В., Дьячков К.А. Замещение дефекта проксимального метафиза большеберцовой кости сетчатым имплантатом из никелида титана Фундаментальные исследования. 2014;10(7):1274-1279; URL: https://fundamental-research.ru/ru/article/view?id=36103 [Borzunov D.Yu., Petrovskaya N.V., D’yachkova G.V., D’yachkov K.A. Zameshchenie defekta proksimal’nogo metafiza bol’shebertsovoi kosti setchatym implantatom iz nikelida titana Fundamental’nye issledovaniya. 2014;10(7):1274-1279; URL: https://fundamental-research.ru/ru/article/view?id=36103]
- Iriyanov YM, Chernov VF, Radchenko SA, Chernov AV. Plastic efficiency of different implants used for repair of soft and bone tissue defects. Bull Exp Biol Med. 2013 Aug;155(4):518-21. doi: 10.1007/s10517-013-2191-4. PMID: 24143381.
- Junge K, Rosch R, Klinge U, Saklak M, Klosterhalfen B, Peiper C, Schumpelick V. Titanium coating of a polypropylene mesh for hernia repair: effect on biocompatibilty. Hernia. 2005 May;9(2):115-9. doi: 10.1007/s10029-004-0292-8. Epub 2004 Dec 4. PMID: 15583967.
- Kuttenberger JJ, Hardt N. Long-term results following reconstruction of craniofacial defects with titanium micro-mesh systems. J Craniomaxillofac Surg. 2001 Apr;29(2):75-81. doi: 10.1054/jcms.2001.0197. PMID: 11465437.
- Фокин В.Г. Метод конечных элементов в механике деформируемого твёрдого тела: Учеб. пособие В.Г. Фокин. Самара: Самар. гос. техн. ун-т, 2010. 131 с.: ил.[ Fokin V.G. Metod konechnykh elementov v mekhanike deformiruemogo tverdogo tela: Ucheb. posobie V.G. Fokin. Samara: Samar. gos. tekhn. un-t, 2010. 131 s.: il]
- Применение индивидуальных вертлужных компонентов при ревизионном эндопротезировании тазобедренного сустава. Кавалерский Г.М., Мурылев В.Ю., Рукин Я.А., Лычагин А.В., Елизаров П.М. Травматология и ортопедия России. 2016;22(4):114-121. DOI:
- 10.21823/2311-2905-2016-22-4-114-121.[ Primenenie individual’nykh vertluzhnykh komponentov pri revizionnom endoprotezirovanii tazobedrennogo sustava. Kavalerskii G.M., Murylev V.Yu., Rukin Ya.A., Lychagin A.V., Elizarov P.M. Travmatologiya i ortopediya Rossii. 2016;22(4):114-121. DOI: 10.21823/2311-2905-2016-22-4-114-121]
- Технология эндопротезирования суставов М. Дж. Кросс, Дж. Спайчер., ин, 2008. [Tekhnologiya endoprotezirovaniya sustavov M. Dzh. Kross, Dzh. Spaicher., in, 2008]
- Аддитивные технологические процессы. Базовые принципы. Часть 1. Термины и определения ГОСТ Р 57558-2017/ISO/ASTM 52900:2015. - М.: Стандартинформ, 2018:12.[ Additivnye tekhnologicheskie protsessy. Bazovye printsipy. Chast’ 1. Terminy i opredeleniya GOST R 57558-2017/ISO/ASTM 52900:2015. - M.: Standartinform, 2018:12]
- Аддитивные технологии в машиностроении М.В. Нагайцев, В.М. Довбыш пособие для инженеров. М. ГНЦ РФ ФГУП «НАМИ» 2015. 220 с.[ Additivnye tekhnologii v mashinostroenii M.V. Nagaitsev, V.M. Dovbysh posobie dlya inzhenerov. – M. GNTs RF FGUP «NAMI» 2015. 220 s]
- SLM (Selective Laser Melting) — технология 3D-печати – URL: https://3d.globatek.ru/3d_printing_technologies/slm-tech/
- «Замещение дефектов области вертлужной впадины индивидуальными имплантатами с заданной геометрической структурой поверхности». Базлов В.А. Диссертация на соискание ученой степени кандидата медицинских наук.[ «Zameshchenie defektov oblasti vertluzhnoi vpadiny individual’nymi implantatami s zadannoi geometricheskoistrukturoi poverkhnosti». Bazlov V.A. Dissertatsiya na soiskanie uchenoistepeni kandidata meditsinskikh nauk]
- Конечно-элементный анализ напряженно-деформированного состояния эндопротеза тазобедренного сустава при двухопорном стоянии А.И. Боровков, Л.Б. Маслов, М.А. Жмайло, И.А. Зелинский, И.Б. Войнов, И.А. Керестень, Д.В. Мамчиц, Р.М. Тихилов, А.Н. Коваленко, С.С. Билык, А.О. Денисов. Российский журнал биомеханики. 2018;22 (4): 437–458. [Konechno-elementnyi analiz napryazhenno-deformirovannogo sostoyaniya endoproteza tazobedrennogo sustava pri dvukhopornom stoyanii A.I. Borovkov, L.B. Maslov, M.A. Zhmailo, I.A. Zelinskii, I.B. Voinov, I.A. Keresten’, D.V. Mamchits, R.M. Tikhilov, A.N. Kovalenko, S.S. Bilyk, A.O. Denisov. Rossiiskii zhurnal biomekhaniki. 2018;22 (4): 437–458.]


