Анализ частоты TCR-мутантных лимфоцитов у больных колоректальным раком до лечения
Автор: Орлова Н.В., Смирнова С.Г., Рухадзе Г.О., Ерыгин Д.В., Бердов Б.А., Лозебной Н.И., Саенко А.С., Замулаева И.А.
Рубрика: Научные статьи
Статья в выпуске: 4 т.22, 2013 года.
Бесплатный доступ
Проведён сравнительный анализ частоты лимфоцитов, мутантных по локусу Т-клеточного рецептора (TCR), у больных колоректальным раком до лечения и контрольных лиц. Частота мутантных клеток у больных до лечения была статистически значимо выше таковой у контрольных здоровых лиц (p=0,02). Показано, что 24% онкологических больных до лечения имеют повышенные частоты мутантных клеток, что сопоставимо с результатами, полученными для ряда опухолей других локализаций. Не выявлено корреляции частоты мутантных клеток со стадией заболевания и локализацией первичного очага. Повышенная частота TCR-мутантных лимфоцитов у части больных колоректальным раком до лечения свидетельствует о возможности применения данного показателя соматического мутагенеза для оценки риска возникновения колоректального рака.
Колоректальный рак, соматический мутагенез, т-клеточный рецептор, нестабильность генома
Короткий адрес: https://sciup.org/170170127
IDR: 170170127
Текст научной статьи Анализ частоты TCR-мутантных лимфоцитов у больных колоректальным раком до лечения
Поиск эффективных биомаркеров канцерогенного риска продолжает оставаться актуальной проблемой онкологии на протяжении многих лет. В последнее время значимость этой проблемы не только не уменьшается, но всё больше возрастает в связи с увеличением онкологической заболеваемости во всём мире. Основой для решения этой проблемы являются фундаментальные знания о закономерностях и механизмах канцерогенеза, в том числе ключевого процесса в ходе злокачественной трансформации клеток – соматического мутагенеза. В частности, принято считать, что колоректальный канцерогенез связан с двумя формами нестабильности генома – хромосомной и микросателлитной [12, 16].
Фенотип хромосомной нестабильности, обнаруживаемый в 85% злокачественных новообразований различных отделов толстой кишки, характеризуется анэуплоидией и множественными хромосомными перестройками. Фенотип микросателлитной нестабильности найден примерно в 15% злокачественных новообразований. Он связан с небольшими по размеру, но многочисленными инсерциями и делециями, главным образом, в повторяющихся последовательностях нуклеотидов, при этом опухолевые клетки остаются диплоидными, но имеют множество генных мутаций. Часть опухолей с микросателлитной нестабильностью содержит наследственные мутации в генах репарации не спаренных оснований (синдром Линча), что и является причиной такой нестабильности. У части больных причиной микросателлитной нестабильности является гиперметилирование промоторов соответствующих генов репарации (в основном MLH1 ). Только небольшая часть (около 1%) всех колоректальных раков имеет признаки нестабильности генома обоих типов одновременно.
Орлова Н . В .* – ст . научн . сотр ., к . б . н .; Смирнова С . Г . – ст . научн . сотр ., к . б . н .; Рухадзе Г . О . – научн . сотр .; Ерыгин Д . В . – ст . научн . сотр ., к . м . н .; Бердов Б . А . – зам . директора по научн . работе , д . м . н ., профессор ; Лозебной Н . И . – аспирант ; Замулаева И . А . – зав . лаб ., д . б . н ., профессор . ФГБУ МРНЦ Минздрава России .
Как было показано в 90-е годы прошлого века, мутагенез нормальных соматических клеток (лимфоцитов периферической крови) больных колоректальным раком характеризуется высокой частотой структурных мутаций (хромосомных аберраций) по сравнению с таковой у здоровых лиц [11, 19]. Кроме того, лимфоциты больных обладают более высокой чувствительностью к разнообразным повреждающим агентам, чем лимфоциты здоровых лиц [9, 19]. Поэтому было сделано предположение о возможности использования частоты структурных мутаций в лимфоцитах в качестве биомаркера канцерогенного риска. Это предположение в дальнейшем было подтверждено в результате проспективных исследований онкологической заболеваемости, включая рак желудочно-кишечного тракта, у лиц с разной частотой структурных мутаций [17].
В то же время в отдельном исследовании соматического мутагенеза у больных колоректальным раком с микросателлитной нестабильностью было установлено отсутствие различий частоты структурных мутаций в лимфоцитах больных и здоровых лиц [14], что неудивительно, учитывая механизмы формирования таких мутаций. Скорее можно предположить, что у таких больных повышается частота генных, а не структурных мутаций, однако ни в этой работе, ни позднее такого анализа не проводилось. Более того, частота генных мутаций в лимфоцитах общей группы больных колоректальным раком также практически не исследована, хотя такая информация представляет несомненный интерес с точки зрения разработки биомаркеров канцерогенного риска. Поэтому целью данной работы является сравнительный анализ частоты генных соматических мутаций в лимфоцитах больных колоректальным раком до лечения и здоровых лиц. Для исследования были выбраны гены Т-клеточного рецептора (T-cell receptor – TCR), которые содержат микросателлитные последовательности, в том числе в кодирующих участках. Кроме того, частота TCR-мутаций является маркером генотоксического действия различных факторов [5, 18] спонтанной [6] и индуцированной [3] генетической нестабильности соматических клеток.
Материалы и методы
Частота TCR-мутантных лимфоцитов была определена у больных раком различных отделов толстой кишки до лечения. Больные находились на лечении в отделении лучевого и хирургического лечения заболеваний абдоминальной области ФГБУ МРНЦ Минздрава России. Было обследовано 55 человек (26 мужчин и 29 женщин) в возрасте от 47 до 88 лет (в среднем 63 года). У 3-х больных установлена I стадия заболевания, у 12-ти – II, у 22-х – III, у 18-ти – IV. 28 пациентов имели диагноз рак прямой кишки, 27 пациентов – рак различных отделов ободочной кишки.
Определение частоты TCR-мутантных клеток проводили по методике, разработанной в начале 90-х годов прошлого века японскими авторами [13] и усовершенствованной нами с целью повышения точности метода [5]. Для идентификации мутантных клеток использовали моноклональные антитела, меченные разными флуорохромами, к CD3, CD4 и HLA-DR (Becton Dickinson Immunocytometry Systems – BDIS, США).
Образцы анализировали на проточном цитофлуориметре FACSCalibur (BDIS, США). Компьютерную обработку проводили с использованием программы CellQuestPro (BDIS, США). Частоту мутантных клеток определяли как отношение числа клеток с фенотипом CD4+CD3-HLA-DR-к числу CD4+CD3+ клеток.
В связи с тем, что частота соматических клеток с мутациями увеличивается с возрастом даже в случае отсутствия генотоксических воздействий, обусловленных неблагоприятными условиями проживания, профессиональным контактом с вредными воздействиями различной природы или другими причинами, в работе выполнен расчёт возрастной нормы частоты TCR-мутантных клеток. Нормальный диапазон частоты TCR-мутантных клеток соответствовал 95%-ному доверительному интервалу, установленному для 455 контрольных здоровых лиц (в возрасте от 14 до 77 лет) с учётом возрастной зависимости, как показано на рис. 1.
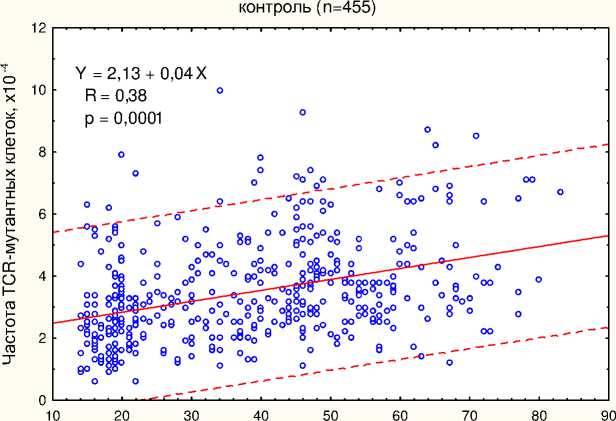
Возраст, лет
Рис . 1. Зависимость частоты TCR-мутантных клеток от возраста в группе контрольных лиц. Пунктирные линии показывают границы 95%-ного доверительного интервала для частоты мутантных клеток.
Для группового сравнения частот мутантных клеток у онкологических больных и контрольных лиц из вышеупомянутой базы данных была выбрана контрольная группа сходного возраста (n=73).
Статистическую обработку результатов проводили с помощью пакета программ Statistica 6.0 (StatSoft, Inc., США) для персонального компьютера. Значимость различий частоты мутантных клеток в двух выборках оценивали по критерию Манна-Уитни. Сравнение доли лиц с повышенными частотами мутантных клеток в двух группах проводили с помощью критерия Фишера. Различия считали статистически значимыми при р<0,05.
Результаты и обсуждение
На рис. 2 представлены гистограммы распределения частоты мутантных клеток у обследованных нами онкологических больных и контрольных лиц сходного возраста. Характер распределения частоты мутантных клеток в группе онкологических больных не соответствовал нормальному (р<0,05 по критерию Shapiro-Wilk’s W test). Исходя из этого, использовали непараметрические методы статистической обработки данных. У больных колоректальным раком до лечения частоты TCR-мутантных клеток находились в интервале от 0,8х10-4 до 30,8х10-4. Медиана составляла 5,3х10-4, квартили - (3,7-7,6)х10-4. Не было обнаружено статистически значимых различий частоты мутантных клеток у мужчин (n=26) и женщин (n=29): 5,5х10 " 4 vs 5,3х10 " 4, соответственно (p=0,9).
В группе контрольных лиц частота мутантных клеток варьировала от (1,2 до 8,7)х10-4. Медиана составляла 4,0х10-4, квартили - (3,3-6,4)х10-4.
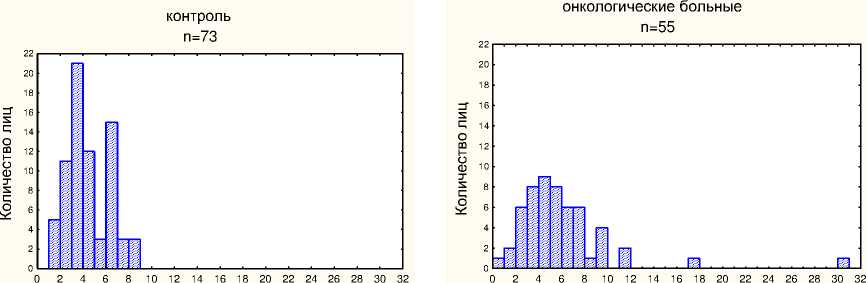
Частота TCR-мутантных клеток, х10 -4 Частота TCR-мутантных клеток, х10 -4
Рис . 2. Гистограмма распределения частоты TCR-мутантных клеток у больных раком толстой кишки до лечения и контрольных здоровых лиц сходного возраста.
По критерию Манна-Уитни частота мутантных клеток у больных до лечения была статистически значимо выше таковой у контрольных лиц (p=0,02).
У 24% онкологических больных частота мутантных клеток превышала возрастную норму (95%-ный доверительный интервал, установленный для контрольных лиц с учётом возрастной зависимости). Повышенная частота мутантных клеток встречалась статистически значимо чаще в группе больных, чем здоровых лиц сходного возраста (p=0,003). Сходные результаты были получены ранее нами и другими авторами в отношении генных соматических мутаций у онкологических больных с опухолями различных локализаций до лечения [1, 2, 4, 7, 10]. Однако до сих пор были известны лишь единичные данные о частоте генных мутаций в лимфоцитах больных колоректальным раком, полученные к тому же на ограниченной выборке больных [20].
Чтобы выяснить, имеется ли какая-либо связь частоты мутантных клеток со стадией заболевания по системе TNM и локализацией первичного очага все больные были разделены на несколько групп. Результаты, представленные в таблице 1, свидетельствуют об отсутствии значимых различий между выделенными группами как по частоте TCR-мутантных клеток, так и по доле лиц с повышенной частотой таких клеток.
Таблица 1
Частота TCR- мутантных клеток в разных группах онкологических больных
|
Группы лиц |
Число лиц |
Частота TCR-мутантных клеток, х10-4 |
Доля лиц с повышенными частотами, % |
|
|
медиана |
квартили |
|||
|
Контроль |
73 |
4,0 |
3,3-6,4 |
5,0 |
|
Колоректальный рак (все больные) |
55 |
5,3 |
3,7-7,6 |
24,0 |
|
Т1-Т2 |
15 |
5,8 |
4,2-7,8 |
26,7 |
|
Т3 |
22 |
4,4 |
3,2-7,0 |
22,7 |
|
Т4 |
18 |
6,0 |
4,3-7,6 |
22,2 |
|
N0M0 |
25 |
5,7 |
3,1-6,6 |
20,0 |
|
N+M0 |
15 |
5,0 |
3,6-7,0 |
20,0 |
|
N+M+ |
13 |
5,1 |
4,0-9,0 |
31,0 |
|
Рак прямой кишки |
28 |
5,6 |
3,7-7,5 |
25,0 |
|
Рак ободочной кишки |
27 |
4,7 |
3,5-6,5 |
22,0 |
Примечание: анализ данных в группе больных на стадии N0M+ не проводился из-за её малочисленности (n=2).
Одно из возможных объяснений повышенной частоты мутантных клеток у онкологических больных до лечения заключается в действии генотоксического фактора (-ов) на организм таких лиц в прошлом. Другая причина может быть связана с наличием у части больных нестабильности генома соматических клеток, обусловленной наследственными или какими-либо иными факторами. Возможно также, что в ответ на наличие опухолевых клеток происходит Т-клеточная активация, приводящая к увеличению частоты мутаций [8]. Наконец, нельзя исключить влияние самого опухолевого процесса (как источника окислительного стресса) на возникновение и элиминацию мутаций. Однако следует отметить, что наши данные об отсутствии увеличения частоты TCR - мутантных лимфоцитов у больных на поздних стадиях заболевания свидетельствуют против последнего предположения, которое довольно активно обсуждается в литературе. Так, в нашем исследовании не установлено различий в частоте мутантных лимфоцитов в группе больных без поражения регионарных лимфатических узлов и отдалённых метастазов (N0M0) по сравнению с остальными больными: 5,7 vs 5,1 (p=0,67) соответственно. Хотя, в литературе имеются данные о том, что опухоли с микросателлитной нестабильностью выявляются на более ранних стадиях опухолевого процесса и меньше метастазируют, чем опухоли с хромосомной нестабильностью [15].
Таким образом, в работе показано статистически значимое увеличение частоты TCR-мутантных лимфоцитов у части больных колоректальным раком до лечения по сравнению с таковой у здоровых лиц. Это свидетельствует о возможности применения данного показателя соматического мутагенеза для оценки риска возникновения колоректального рака, однако необходимы дальнейшие исследования для получения прямых доказательств проспективного характера, причём отдельно для опухолей с разными типами нестабильности генома.
Список литературы Анализ частоты TCR-мутантных лимфоцитов у больных колоректальным раком до лечения
- Верещагина А.О., Замулаева И.А., Орлова Н.В. и др. Частота лимфоцитов, мутантных по генам T-клеточного рецептора как возможный критерий для формирования группы повышенного риска развития опухолей щитовидной железы у облучённых и необлучённых лиц//Радиационная биология. Радиоэкология. 2005. Т. 45, № 5. С. 581-586.
- Замулаева И.А., Смирнова С.Г., Орлова Н.В. и др. Повышенная частота мутантных по локусам Т-клеточного рецептора и гликофорина А клеток как возможный критерий для формирования группы риска онкологических заболеваний//Российский онкологический журнал. 2001. № 1. С. 23-25.
- Замулаева И.А., Орлова Н.В., Смирнова С.Г. и др. Закономерности соматического мутагенеза у ликвидаторов аварии на ЧАЭС в отдалённые сроки после радиационного воздействия//Радиация и риск. 2006. Т. 15, № 1-2. С. 68-76.
- Замулаева И.А., Смирнова С.Г., Орлова Н.В. и др. Анализ частоты TCR-мутантных лимфоцитов у онкологических больных до и после химиолучевого лечения//Радиация и риск. 2011. Т. 20, № 1. С. 8-18.
- Саенко А.С., Замулаева И.А., Смирнова С.Г. и др. Определение частоты мутаций по локусам гликофорина А и Т-клеточного рецептора: информативность для биологической дозиметрии острого и пролонгированного облучения//Радиационная биология. Радиоэкология. 1998. Т. 38. С. 171-180.
- Фогель Ф., Мотульски А. Генетика человека//Проблемы и подходы/под ред. Алтухова Ю.П., Гиндилиса В.М. М.: Мир, 1990. Т.2. С. 142-277.
- Akiyama M., Umeki S., Kusunoki Y. et al. Somatic-cell mutations as a possible predictor of cancer risk//Health Physics. 1995. V. 68, N 5. P. 643-649.
- Albertini R.J. HPRT mutations in humans: biomarkers for mechanistic studies//Mutat. Res. 2001. V. 489, N 1. P. 1-16.
- Baria K., Warren C., Roberts S.A. et al. Chromosomal radiosensitivity as a marker of predisposition to common cancers?//Br. J. Cancer. 2001. V. 84, N 7. P. 892-896.
- Caggana M., Liber H.L., Mauch P.M. et al. In vivo somatic mutation in the lymphocytes of Hodgkin's disease patients//Environ. Mol. Mutagen. 1991. V. 18, N 1. P. 6-13.
- Fireman Z., Shabtai F., Lurie B. Chromosome sensitivity to bleomycin-induced mutagenesis in lymphocytes from colorectal cancer patients under 40 years of age//Dis. Colon. Rectum. 1994. V. 37, N 12. P. 1317-1320.
- Imai K., Yamamoto H. Carcinogenesis and microsatellite instability: the interrelationship between genetics and epigenetics//Carcinogenesis. 2008. V. 29, N 4. P. 673-680.
- Kyoizumi S., Akiyama M., Hirai Y. et al. Spontaneous loss and alteration of antigen receptor expression in mature CD4+ T cells//J. Exp. Med. 1990. V. 171. P. 1981-1999.
- Lindor N.M., Jalal S.M., Van DeWalker T.J. et al. Search for chromosome instability in lymphocytes with germ-line mutations in DNA mismatch repair genes//Cancer Genet. Cytogenet. 1998. V. 104, N 1. P. 48-51.
- Lynch H.T., Drescher K.M., de la Chapelle A. Immunology and the Lynch Syndrome//Gastroenterology. 2008. V. 134, N 4. P. 1246-1249.
- De Miranda N.F., Hes F.J., van Wezel T., Morreau H. Role of the microenvironment in the tumourigenesis of microsatellite unstable and MUTYH-associated polyposis colorectal cancers//Mutagenesis. 2012. V. 27, N 2. P. 247-253.
- Norppa H., Bonassi S., Hansteen I.L. et al. Chromosomal aberrations and SCEs as biomarkers of cancer risk//Mutat. Res. 2006. V. 600, N 1-2. P. 37-45.
- Saenko A.S., Zamulaeva I.A., Smirnova S.G. et al. Determination of somatic mutant frequencies at glycophorrin A and T-cell receptor loci for biodosimetry of acute and prolonged irradiation//Applied Radiation and Isotopes. 2000. V. 52, N 5. P. 1145-1148.
- Saxena A.K., Agarwal C.S., Kumar M. et al. Spontaneous unusual expression of frequency of chromosome aberrations and common fragile in human lymphocytes of colorectal cancer patients induced by Aphidicolin//J. Exp. Ther. Oncol. 2007. V. 6, N 2. P. 175-179.
- Uematsu K., Yasuda J., Sekine T. et al. A new T-lymphocyte cloning assay for detection of in vivo mutations in the human hypoxanthine-guanine phosphoribosyltransferase gene//Environ. Mol. Mutagen. 1997. V. 30, N 1. P. 31-39.


