Анализ факторов риска формирования дефицита здоровья и его индикаторных показателей у детей с врожденными пороками сердца через два года после радикальной операции
Автор: Игишева Людмила Николаевна, Румянцева Александра Александровна, Шабалдин Андрей Владимирович, Синицкая Анна Викторовна, Литвинова Надежда Алексеевна, Долгих Олег Владимирович
Журнал: Анализ риска здоровью @journal-fcrisk
Рубрика: Оценка риска в организации здравоохранения
Статья в выпуске: 2 (38), 2022 года.
Бесплатный доступ
Проанализированы факторы риска формирования нарушений состояния здоровья детей через два года после радикальной операции на сердце для задач оптимизации диагностики и прогноза негативных последствий хирургического лечения врожденного порока сердца с использованием данных широкого анамнеза и индикаторных генетических показателей. Проведено проспективное когортное наблюдение за 89 детьми с врожденными пороками сердца в течение двух лет с момента радикальной операции на сердце. Дизайн исследования включал следующие этапы: оценка качества жизни по Cardiac Module («Кардиологический модуль») вопросника Pediatric Quality of Life Questionnaire (USA, 2001); сбор широкого анамнеза с использованием анкетирования; проведение типирования полиморфных вариантов генов биотрансформации ксенобиотиков, врожденного и адаптивного иммунитета, участвующих в эмбриогенезе сердечно-сосудистой системы; логистический регрессионный пошаговый многофакторный анализ независимых переменных широкого анамнеза, особенностей радикальной операции, дооперационных показателей здоровья, а также полиморфных вариантов исследуемых генов с зависимыми вариантами: типы функционирования и комплексный интегральный показатель здоровья через два года после хирургического лечения. Значимыми показателями двухлетней динамики здоровья пациентов, оперированных по поводу врожденных пороков сердца, были показатели физического функционирования и комплексный интегральный показатель здоровья, отражающие качество жизни детей в отдаленном периоде после радикальной операции на сердце. Дефицит здоровья и качества жизни через два года после радикальной операции на сердце был ассоциирован с аллелями: HLADRB1*04, HLADRB1*11, HLADRB1*12, HLADRB1*13 и мажорным аллелем Т полиморфного варианта гена CYP1A1 T/C (rs1048943). Влияние этих аллелей на качество жизни в отдаленном периоде после радикальной операции на сердце формируется через детерминацию пролонгированного токсико-воспалительного процесса в оперированном сердце. Из медицинских и социальных факторов риска на формирование дефицита здоровья и качества жизни в отдаленном периоде после радикальной операции на сердце оказывали влияние тяжесть врожденных пороков сердца, возраст на момент радикальной операции, а также неудовлетворительные материальные и жилищные условия.
Cyp1a1, hladrb1, врожденные пороки сердца, качество жизни, факторы риска, радикальная операция на сердце, комплексный интегральный показатель здоровья, показатели физического функционирования
Короткий адрес: https://sciup.org/142235262
IDR: 142235262 | УДК: 612.17: | DOI: 10.21668/health.risk/2022.2.14
Текст научной статьи Анализ факторов риска формирования дефицита здоровья и его индикаторных показателей у детей с врожденными пороками сердца через два года после радикальной операции
В последнее десятилетие в отечественной и мировой кардиохирургии произошли кардинальные изменения, давшие возможность проводить хирургическое лечение врожденных пороков сердца (ВПС) на первом году жизни, а критических и тяжелых ВПС – в период новорожденности1. Применение современных хирургических технологий в раннем постнатальном периоде значительно снизило уровень неонатальной смертности, в том числе по причинам тяжелых и критических ВПС. Золотой стандарт хирургического лечения ВПС – открытая операция в условиях искусственного кровообращения. Радикальная операция на сердце является основой комплексного лечения ВПС, так как она максимально исправляет анатомические дефекты в сердечно-сосудистой системе. В то же время последующая медикаментозная терапия и реабилитация детей с ВПС позволяет компенсировать остаточные гемодинамические и функциональные нарушения в сердечно-сосудистой системе. Проведенные исследования показывают, что полной компенсации по функционированию сердечно-сосудистой системы у детей после радикальной операции на сердце достичь невозможно [1]. Это отражается и на других показателях здоровья, таких как отставание в физическом развитии [2]. Mussato et al. [3] показали, что после кардиохирургического вмешательства у детей с ВПС в 56 % случаев развивались речевые нарушения, а в 21 % – нарушения когнитивной функции.
Учитывая, что здоровье – это состояние полного физического, духовного и социального благополучия, а не только отсутствие болезни и физических дефектов2, можно говорить о дефиците здоровья у детей после радикальной операции на сердце в отдаленном послеоперационном периоде. Возвращаясь к определению здоровья, принятому Всемирной организацией здравоохранения, можно говорить о физическом, эмоциональном, социальном и умственном функционировании как составных частях здоровья индивидуума. Соответственно каждый из этих типов функционирования может быть нарушен и требует отдельного реабилитационного воздействия. Выявление отклонений в тех или иных типах функционирования является актуальной задачей индивидуальной реабилитации после радикальной операции, проведенной по поводу ВПС.
Другой важной проблемой является составление индивидуальной программы реабилитации после радикальной операции, проведенной по поводу ВПС. Для этого необходимо прогнозирование риска формирования дефицита здоровья как в целом, так и по отдельным типам функционирования, в частности, в отдаленном послеоперационном периоде. Предикторами дефицита здоровья могут быть как конститу- циональные (генетические) маркеры, так и показатели широкого анамнеза (социальные семейные и индивидуальные медицинские факторы), для которых неоднократно показаны ассоциации с ВПС [4–6].
Особое внимание хотелось бы уделить генам иммунного ответа ( HLA-DRB1 ) и сигнальным мембранным рецепторам врожденного иммунитета ( TREM1 ), которые могут участвовать в индукции ВПС как воспалительных эмбриопатий и в поддержании воспаления в сердечно-сосудистой системе до и после хирургического лечения этой патологии [7].
Основой для развития дефицита здоровья в отдаленном периоде после радикальной операции на сердце могут быть пролонгированный иммуновоспали-тельный процесс в сердечно-сосудистой системе или, напротив, частые респираторные инфекционные заболевания как проявления иммунной недостаточности.
Исходя из этого, была поставлена цель исследования – улучшение диагностики и прогнозирования отклонений в состоянии здоровья детей через два года после радикальной операции как результата хирургического лечения ВПС за счет анализа факторов риска с помощью показателей широкого анамнеза и генетических маркеров.
Материалы и методы. Для реализации поставленной задачи выполнено проспективное когортное исследование на базе ФГБНУ «Научноисследовательский институт комплексных проблем сердечно-сосудистых заболеваний» (НИИ КПССЗ) и ГБУЗ «Кузбасский клинический кардиологический диспансер имени академика Л.С. Барбараша». Набор в группу исследования проводился на базе детского отделения ГБУЗ «Кузбасский клинический кардиологический диспансер имени академика Л.С. Барба-раша» в период с 2019 по 2020 г. методом сплошного включения пациентов, имеющих в анамнезе радикальную операцию на сердце в условиях искусственного кровообращения.
Критериями включения в группу для проспективного исследования были:
-
♦ возраст пациента на момент операции от 0 до 15 лет включительно;
-
♦ врожденный порок сердца, требующий радикального оперативного вмешательства в условиях искусственного кровообращения;
-
♦ заполненный регистр ВПС по широкому анамнезу и инструментальным методам исследования.
Критерии исключения:
-
♦ врожденный порок сердца, требующий рент-генэндоваскулярного оперативного вмешательства;
-
♦ врожденный порок сердца, требующий паллиативного оперативного вмешательства в условиях искусственного кровообращения;
-
♦ генетические хромосомные болезни;
-
♦ незаполненный регистр ВПС.
В группе проспективного исследования наблюдались 89 детей (44 девочки и 45 мальчиков). Распределение ВПС по нозологиям представлено в табл. 1.
Анализ анамнестических факторов показал, что одна треть детей с ВПС рождалась путем кесарева сечения, больше половины детей были переведены на искусственное вскармливание, каждый пятый ребенок имел неонатальную пневмонию и конъюгационную желтуху (табл. 2). Около 80 % детей оставались до конца не привитыми. К часто и длительно болеющим детям по критериям В.Ю. Альбицкого, А.А. Баранова (1985) относилось более половины детей. Каждый пятый ребенок имел сопутствующие заболевания ЦНС, и в среднем около 8 % пациентов с ВПС имели сопутст- вующие заболевания мочеполовой системы, желудочно-кишечного тракта, а также атопический дерматит.
В раннем периоде после радикальной операции на сердце у 35 детей (39,33 %) развились инфекционные осложнения, а у 8 детей (8,99 %) – неинфекционные. К инфекционным осложнениям относили: длительную (более 5 дней) лихорадку, пневмонию, гидроторакс, гидроперикард, перикардит, септические проявления. К неинфекционным осложнениям, развившимся после хирургического лечения ВПС, относили нарушения ритма и проводимости, сопровождавшиеся снижением фракции выброса, судорожный синдром, парез купола диафрагмы.
Комплексная оценка здоровья. Всем пациентам была проведена оценка состояния здоровья по физическому, психоэмоциональному, социальному и умственному функционированию, а также уровня
Таблица 1
Распределение ВПС по нозологиям
|
Нозология ВПС |
Абсолютное кол-во детей |
Удельный вес, % |
|
Дефект межпредсердной перегородки |
31 |
34,83 |
|
Дефект межжелудочковой перегородки |
14 |
15,73 |
|
Сочетанные септальные дефекты |
4 |
4,5 |
|
Атриовентрикулярная коммуникация |
3 |
3,37 |
|
Тетрада Фалло, дефекты отхождения магистральных сосудов |
15 |
16,9 |
|
Единый желудочек сердца |
6 |
6,74 |
|
Коарктация аорты |
5 |
5,62 |
|
Стеноз аортального клапана |
3 |
3,37 |
|
Сочетание коарктации аорты и дефекта межжелудочковой перегородки, гипоплазия аорты |
3 |
3,37 |
|
Тотальный аномальный дренаж легочных вен |
2 |
2,25 |
|
Частичный аномальный дренаж легочных вен |
1 |
1,12 |
|
Атрезия легочной артерии первого типа |
1 |
1,12 |
|
Аномалия Эбштейна |
1 |
1,12 |
|
Итого |
89 |
100 |
Таблица 2
Характеристика группы исследуемых детей
|
Данные анамнеза |
Абсолютное число |
Удельный вес, % |
|
Родоразрешение путем кесарева сечения |
29 |
32,58 |
|
Грудное вскармливание до 6 месяцев |
60 |
67,42 |
|
Заболевания раннего неонатального периода: – пневмония – желтуха |
17 19 |
19,1 21,3 |
|
Вакцинация: – полная – неполная |
18 71 |
20,2 79,8 |
|
Частота респираторных инфекций за первый год жизни (более 2 раз) |
29 |
32,58 |
|
Частота респираторных инфекций на втором и третьем году жизни (ОРВИ, отиты, бронхиты, пневмонии) |
74 |
83,15 |
|
Аллергические дерматиты |
5 |
5,6 |
|
Заболевания ЖКТ* после года (ГЭР**, гастрит, дуоденит) |
5 |
5,6 |
|
Заболевания МПС*** (ИМВП****) |
8 |
8,9 |
|
Заболевания нервной системы |
22 |
24,7 |
|
Нарушение проводимости в анамнезе (транзиторная АВ-блокада 1–2-й степени) |
12 |
13,48 |
П р и м е ч а н и е : *ЖКТ – желудочно-кишечный тракт, **ГЭР – гастроэзофагеальный рефлюкс, ***МПС – мочеполовая система, ****ИМВП – инфекция мочевыводящих путей.
интеллекта (IQ) и речевого развития до оперативного лечения и через два года после хирургического лечения ВПС.
Важным показателем оценки состояния здоровья пациента является качество его жизни (КЖ), оцениваемое по результатам опросов с применением психометрических методов и опросников типа Pediatric Quality of Life Questionnaire, PEDsQL 4.0 (J.W. Varni et al., USA, 2001), с помощью которых можно оценить физическое (ФФ), эмоциональное (ЭФ), социальное функционирование (СФ), жизнь в школе (ЖШ), психическое здоровье и комплексный интегральный показатель здоровья [8, 9].
В исследовании был использован Cardiac Module («Кардиологический модуль») вопросника PEDsQL 4.0. Наличие параллельных форм вопросника – детской (self-report) и родительской (proxyreport) версий – позволило эффективно оценить КЖ ребенка.
После тестирования проводилась перекодировка данных в баллы КЖ по защищенным авторским правом (Межнациональный центр исследования качества жизни, г. Санкт-Петербург) процедурам, представленным авторами вопросника. Применялось обратное соотношение: чем ниже балл, тем выше процент функционирования. Принята следующая шкала: 1 балл соответствует 100–76 % – отличному функционированию, 2 балла равны 75–51 % – хорошему функционированию, 3 балла показывают 50–26 % – удовлетворительное функционирование и 4 балла указывают на 25–0 % – плохое функционирование. Заключение давалось по каждому типу функционирования: физическому, психоэмоциональному, социальному и умственному, оцененному родителем, ребенком (пациентом) и врачом.
Оценка физического, психоэмоционального, социального и умственного функционирования, а также уровня интеллекта (IQ) и речевого развития проводилась у детей с определенного возраста. Данные по возрасту, с которого началась оценка того или иного вида функционирования, а также по количеству детей, участвующих в этой оценке, представлены в табл. 3.
У всех детей был выполнен забор периферической крови для проведения иммуногенетического типирования.
Для анализа роли конституциональных факторов в детерминировании дефицита здоровья детей через два года после хирургического лечения ВПС проведено типирование полиморфных вариантов генов биотрансформации ксенобиотиков, врожденного и адаптивного иммунитетов.
Молекулярно-генетическое исследование. В качестве материала использована геномная ДНК, выделенная из лейкоцитов периферической крови. Выделение геномной ДНК производили методом фенол-хлороформной экстракции по стандартному протоколу. У всех участников исследования проводился забор крови на дооперационном этапе из локтевой вены в пробирку, содержащую этилендиамин-тетрауксусную кислоту (ЭДТА, Becton Dickinson Vacutainer, США). Далее кровь аликвотировали по 700 мкл в пробирки 1,5 мл типа «Эппендорф» (Axygen, США) с плотно закрывающимися крышками. Все образцы биологического материала маркировали соответствующим образом и хранили при -80 ºС до даты проведения исследования. Концентрацию выделенной ДНК измеряли на спектрофотометре NanoDrop ND-2000C (Thermo, USA). Выбор однонуклеотидных полиморфных сайтов для молекулярно-генетического типирования был обусловлен локализацией в генах: кодирующих ферменты биотрансформации ксенобиотиков (GSTP, CYP1A2, CYP1A1), участвующих в детерминировании кардиогенеза (CRELD1, GATA6), сигнальных мембранных (TREM1) и внутриклеточных (NOTCH1) рецепторов врожденного иммунитета и классического гена иммунного ответа (HLADRВ1). Для однонуклеотидных замен (SNP) распространенность минорного аллеля полиморфного сайта в популяции, по данным HapMap, была не более 5 %.
По открытым научным данным3 для выбранных SNP оценивались предполагаемые или доказанные последствия на молекулярном уровне в детерминировании формирования ВПС. Всего отобрано 20 полиморфных вариантов генов, представленных в табл. 4.
Генотипирование осуществляли с помощью метода ПЦР с использованием TaqMan зондов (Thermo Fisher Scientific, США) на детектирующем амплификаторе ViiATM 7 Real-Time PCR System (Life Technologies, США).
Анализ HLA-DRB1 проводили методом полимеразной цепной реакции с учетом результатов в режиме реального времени наборами компании «ДНК-технология» (Россия) при помощи детектирующего амплификатора DT-96 («ДНК-технология», Россия) в соответствии с протоколом производителя. Контроль качества генотипирования осуществляли посредством повторного генотипирования 10 % случайно отобранных образцов. Область интереса определена как анализ частоты встречаемости 14 аллелей гена HLA-DRB1.
Статистический анализ. Статистическую обработку результатов исследований проводили с использованием программ Statistica for Windows фирмы StatSoft Inc., версия 10.0, и MedCalc 17.5.3.
В настоящем исследовании для каждого количественного признака проводилось изучение характера распределения тестами Колмогорова – Смирнова и Шапиро – Уилка. Количественные данные представлены в виде медианы ( Me ), а также
Таблица 3
Возрастные пределы и выборки детей для проведения оценок физического, психоэмоционального, социального и умственного функционирования, а также уровня интеллекта (IQ) и речевого развития
|
Оценка |
Возраст, лет |
Количество детей, участвующих в оценке |
|
Физическое функционирование |
Старше 2 |
76 |
|
Психоэмоциональное функционирование |
Старше 5 |
51 |
|
Социальное функционирование |
||
|
Умственное функционирование |
||
|
Уровень интеллекта (IQ) |
||
|
Речевое развитие |
Таблица 4
Характеристика полиморфных сайтов изучаемых генов
|
Ген |
Тип SNP |
SNP ID |
Аминокислотная замена |
Локализация на хромосоме по GRCh.p12* |
Нуклеотидная замена |
|
GSTP1 |
Upstream variant |
rs6591256 |
- |
Chr11.67582428 |
A/G |
|
GSTP1 |
Upstream variant |
rs17593068 |
- |
Chr11.67583461 |
G/T |
|
GSTP1 |
Intron variant |
rs1871042 |
- |
Chr11.67586373 |
C/T |
|
GSTP1 |
Missense variant |
Rs1695 |
Missense mutation Ile105Val |
Chr11.67585218 |
A/G |
|
CYP1A1 |
Missense variant |
rs1048943 |
Missense mutation Ile462Val |
Chr15.74720644 |
T/C |
|
CYP1A2 |
Intron variant |
rs762551 |
- |
Chr15.74749576 |
C/A |
|
CRELD-1 |
Missense variant |
rs73118372 |
Missense mutation Met383Arg |
Chr3.9943989 |
T/C |
|
CRELD-1 |
Intron variant |
rs9878047 |
- |
Chr3.9943773 |
T/C |
|
CRELD-1 |
Synonymous variant |
rs3774207 |
Amino acid codon H [CAC] > H [CAT] |
Chr3.9943972 |
C/T |
|
GATA6 |
Intron variant |
rs10454095 |
- |
Chr18.22197478 |
T/C |
|
NOTCH1 |
Intron variant |
rs13290979 |
- |
Chr9.136531182 |
A/G |
|
TREM1 |
Intron variant |
rs1817537 |
- |
Chr6: 41276829 |
C/G |
|
TREM1 |
Intron variant |
rs3804277 |
- |
Chr6.41277434 |
C/T |
|
TREM1 |
Intron variant |
rs6910730 |
- |
Chr6.6: 41278895 |
A/G |
|
TREM1 |
Upstream variant |
rs7768162 |
- |
Chr6.41276829 |
A/G |
|
TREM1 |
Downstream Variant |
rs2234246 |
- |
Chr6.41276002 |
C/T |
|
TREM1 |
Downstream transcript variant |
rs4711668 |
- |
Chr6.41278735 |
C/T |
|
TREM1 |
Upstream variant |
rs9471535 |
- |
Chr6.41287752 |
C/T |
|
TREM1 |
Missense variant |
rs2234237 |
Missense mutation Thr25Ser |
Chr6.41282728 |
A/T |
П р и м е ч а н и е : *GRCh38.p12 – геномный консорциум по проверке локализаций SNP.
25-го и 75-го квартилей (Q25 – UQ и Q75 – LQ). Для сравнения непараметрических показателей использовался критерий Вилкоксона. Для попарного сравнения применялся критерий Манна – Уитни. Для определения статистической значимости отличий между качественными признаками применяли критерий хи-квадрат (χ2) с поправкой Йетса. Сила связи между изученными признаками определялась при помощи коэффициента корреляции Спирмена. Статистически значимыми считались показатели, у которых р-уровень не превышал 0,05, то есть нулевая гипотеза отвергалась при ошибке менее 5 %, что соответствует стандартам медико-биологических исследований4.
При математическом моделировании прогнозирования вероятности риска формирования дефицита здоровья через два года после хирургического лечения ВПС и его классификации использовались: множественная логистическая регрессия, в том числе пошаговый вариант для четырех балльных категорий зависимой переменной, деревья классификации и ROC-анализ. Деревья классификации позволили выявить значимые предикторы и их ранжирование. ROC-анализ дал возможность оценить значимость полученного уравнения расчета вероятности риска формирования дефицита здоровья через два года после хирургического лечения ВПС и включал в себя следующие параметры: AUC (area under curve) – площадь под кривой (характеризует диагностическую ценность показателя (0,9–1,0 – отличная; 0,8–0,9 – очень хорошая; 0,7–0,8 – хорошая; 0,6–0,7 – средняя; 0,6 и меньше – неудовлетворительная)), чувствительность (Se) и специфичность (Sp) фактора.
Результаты и их обсуждение. Распределение баллов функционирования (PD) по различным типам оценок здоровья с позиций врача, пациента и родителя приведено в табл. 5.
Значимых различий между оценками врача, родителя и пациента не выявлено. По результатам проведенного дополнительно корреляционного анализа через два года после радикальной операции на сердце, между оценочными показателями различных типов функционирования, выставленных родителями, пациентами и врачом, выявлена высокая степень достоверности корреляционных взаимосвязей (табл. 6).
Исходя из этого, для логистической регрессии использовали интегральные показатели (средняя арифметическая величина родительской, детской и врачебной оценки) для каждого типа функционирования (физического, эмоционального, социального и умственного), а также для комплексного интегрального показателя здоровья.
Выполнен поиск ассоциаций между независимыми факторами: широким анамнезом, нарушениями кровообращения до хирургического лечения, особенностями радикальной операции, доопераци-онными показателями здоровья, а также полиморфными вариантами исследуемых генов, с одной стороны, и зависимыми переменными: интегральными показателями различных типов функционирования, а также комплексным интегральным показателем здоровья, с другой стороны. Установлен ряд значимых связей, представленных в табл. 7 и 8.
В табл. 7 приведены статистически значимые ассоциации независимых переменных широкого анамнеза, нарушений кровообращения до хирургического лечения, особенностей радикальной операции, доопе-рационных показателей здоровья, а также полиморфных вариантов исследуемых генов с интегральным показателем физического функционирования через два года после хирургического лечения ВПС.
Таблица 5
Распределение баллов функционирования (PD) по различным типам оценок здоровья с позиций врача, пациента и родителя
|
Показатели |
1– Врач |
2 – Пациент |
3 – Родитель |
p 1,2 |
p 1,3 |
p 2,3 |
||||||
|
Me |
25 % PQ |
75 % PQ |
Me |
25 % PQ |
75 % PQ |
Me |
25 % PQ |
75 % PQ |
||||
|
PD физ. |
2,66 |
1,75 |
3,56 |
2,67 |
1,66 |
3,69 |
2,64 |
1,65 |
3,63 |
-0,04 |
0,04 |
0,08 |
|
PD эмоц. |
2,51 |
1,70 |
3,31 |
2,46 |
1,61 |
3,31 |
2,49 |
1,69 |
3,30 |
0,13 |
0,04 |
-0,09 |
|
PD соц. |
2,44 |
1,55 |
3,33 |
2,57 |
1,73 |
3,42 |
2,48 |
1,63 |
3,32 |
-0,34 |
-0,09 |
0,26 |
|
PD умств. |
2,39 |
1,32 |
3,46 |
2,41 |
1,53 |
3,29 |
2,46 |
1,57 |
3,35 |
-0,04 |
-0,16 |
-0,13 |
П р и м е ч а н и е : PD – балл функционирования: физ. – физического, соц. – социального, эмоц. – эмоционального, умств. – умственного; p – уровень значимости.
Таблица 6
Корреляция между оценочными баллами, выставленными врачами, детьми и родителями через два года после радикальной операции на сердце
|
Показатель |
Spearman R |
t · ( n -2) |
p -value |
|
PD физ. врач & PD физ. пациент |
0,967 |
29,948 |
0,000 |
|
PD эмоц. пациент & PD эмоц. родитель |
0,848 |
12,574 |
0,000 |
|
PD соц. врач & PD соц. пациент |
0,927 |
19,449 |
0,000 |
|
PD умств. врач & PD умств. пациент |
0,916 |
17,928 |
0,000 |
|
PD физ. пациент & PD физ. родитель |
0,964 |
28,646 |
0,000 |
|
PD эмоц. пациент & PD эмоц. родитель |
0,840 |
12,200 |
0,000 |
|
PD соц. пациент & PD соц. родитель |
0,837 |
12,045 |
0,000 |
|
PD умств. пациент & PD умств. родитель |
0,849 |
12,656 |
0,000 |
|
PD физ. врач & PD физ. родитель |
0,933 |
20,475 |
0,000 |
|
PD эмоц. врач & PD эмоц. родитель |
0,836 |
11,985 |
0,000 |
|
PD соц. врач & PD соц. родитель |
0,832 |
11,828 |
0,000 |
|
PD умств. врач & PD умств. родитель |
0,769 |
9,469 |
0,000 |
П р и м е ч а н и е : PD – балл функционирования: физ. – физического, соц. – социального, эмоц. – эмоционального, умств. – умственного; p – уровень значимости, R – коэффициент корреляции Спирмена.
Таблица 7
Результаты логистического регрессионного пошагового многофакторного анализа
|
Показатель |
β-коэффициент |
Стандартная ошибка β-коэффициента |
B-коэффициент |
Стандартная ошибка B-коэффициента |
p -value |
|
Intercept |
1,969 |
0,143 |
0,000 |
||
|
HLA-DRB1*12 |
0,343 |
0,146 |
0,874 |
0,372 |
0,025 |
|
HLA-DRB1*11 |
0,329 |
0,147 |
0,399 |
0,178 |
0,032 |
П р и м е ч а н и е : Intercept – свободный коэффициент логистической регрессии.
Таблица 8
Логистический регрессионный пошаговый многофакторный анализ независимых переменных
|
Показатель |
β-коэффициент |
Стандартная ошибка β-коэффициента |
B-коэффициент |
Стандартная ошибка B-коэффициента |
p -value |
|
Intercept |
1,711 |
0,206 |
0,000 |
||
|
Балл ВПС по тяжести и критичности |
0,633 |
0,123 |
0,065 |
0,013 |
0,000 |
|
Материальные условия |
-0,531 |
0,120 |
-0,559 |
0,127 |
0,000 |
|
HLA-DRB1*13 |
0,605 |
0,133 |
0,722 |
0,159 |
0,000 |
|
Состав семьи |
0,428 |
0,132 |
0,450 |
0,138 |
0,003 |
П р и м е ч а н и е : Intercept – свободный коэффициент логистической регрессии.
Как видно из табл. 7, статистически значимые положительные ассоциации были достигнуты только для генетических маркеров ( HLA-DRB1*11 и HLA-DRB1*12). Оба аллеля кодируют одну серологическую специфичность – HLA-DR5, и это указывает на особую роль молекул HLA II класса как антигенпрезентирующих рецепторов в детерминировании физического функционирования через два года после хирургического лечения ВПС.
Можно предположить, что иммунный фенотип определяет фенотипические проявления здоровья. Как для антигена HLA-DR5, так и для аллеля HLA-DRB1*12 выявлена положительная ассоциация с иммуновоспалительными заболеваниями, такими как недифференцированный спондилоартрит, ювенильный артрит, антифосфолипидный синдром [10, 11], а одновременно с аллелем HLA-DRB1*11 установлена положительная ассоциация с аутоиммунным тиреодитом [12]. Вполне вероятно, что субклиническое иммунное воспаление у детей с HLA-DRB1*11 и HLA-DRB1*12 могло проявляться и в угнетении физического функционала. Соответственно высокое представительство HLA-DRB1*12 в группе детей с ВПС может увеличивать его относительное содержание и в группе детей с низким физическим функционированием. Так или иначе, фенотип HLA-DR5 положительно ассоциирован с низким качеством физического функционирования через два года после радикальной операции на сердце.
Для других типов функционирования, оцененных через два года после радикальной операции на сердце, не выявлено значимых ассоциаций по всем независимым переменным.
Через два года после радикальной операции на сердце был оценен и комплексный интегральный показатель здоровья как среднее арифметическое всех интегральных показателей различных типов функционирования (физического, эмоционального, социального и умственного). Для комплексного интегрального показателя здоровья также были исследованы ассоциации с независимыми переменными широкого анамнеза, нарушений кровообращения до хирургического лечения, особенностей радикальной операции, дооперационных показателей здоровья, а также полиморфных вариантов исследуемых генов, представленные в табл. 8.
Как видно из табл. 8, комплексный интегральный показатель здоровья через два года после хирургического лечения ВПС был положительно ассоциирован с баллом ВПС по тяжести и критичности, с составом семьи и аллелем HLA-DRB1*13. Отрицательная статистически значимая ассоциация была выявлена для материальных условий. Эти ассоциации указывают на то, что чем критичнее ВПС, тем хуже результаты двухгодичной реабилитации с более высоким комплексным интегральным показателем неэффективного качества здоровья.
В отношении состава семьи необходимо отметить, что полная семья имела 1 балл, полная многодетная – 2 балла, неполная – 3 балла, дети из детского дома (не имеющие семьи) – 4 балла. Исходя из этой балльной системы, ассоциация указывает, что чем выше балл, отражающий проблемы в семье, тем выше балл неэффективности комплексной оценки качества здоровья. Соответственно, дети из детских домов имели самое плохое качество жизни через два года после хирургического лечения ВПС.
Балльная характеристика материальных условий была привязана к минимальному размеру оплаты туда (МРОТ) на каждого члена семьи. Если в семье размер финансов на одного члена семьи в месяц был меньше МРОТ, то эту семью относили к малообеспеченным (0 баллов), а если этот показатель был больше или равен МРОТ, то ее относили к обеспеченным семьям (1 балл). Соответственно, полученная отрицательная ассоциация с материальными условиями отражает то, что чем меньше достаток в семье, тем выше балл неэффективности качества здоровья через два года после хирургического лечения ВПС.
Другой механизм может быть связан с самой молекулой HLA-DR6, кодируемой аллелем HLA-DRB1*13 . Для данной молекулы еще в 80-х гг. прошлого столетия показаны слабые антигенные характеристики, что может проявляться неэффективным иммунным ответом на антигены окружающей среды. То есть данный аллель и мембранный рецептор с изотипом HLA-DR6 ассоциированы с функциональной Ir-ассоциированной иммунной недостаточностью [13]. Именно через феномен слабости иммунитета может быть реализована комплексная недостаточность качества здоровья.
Для разработки методических подходов комплексной диагностики и прогнозирования нарушений в состоянии здоровья детей, оперированных по поводу ВПС, использовали множественную логистическую регрессию, где основной зависимой вариантой было наличие или отсутствие дефицита здоровья у детей через два года после хирургического лечения ВПС.
Представленные выше данные указывают на то, что комплексный интегральный показатель отражает состояние здоровья у детей в отдаленный послеоперационный период. Для комплексного интегрального показателя здоровья через два года было выявлено среднее значение, медиана, а также перцентильные и среднеквадратическое отклонения. Эти показатели описательной статистики легли в основу выделения границы «плохих» и «хороших» результатов оценки для комплексного показателя здоровья в отдаленном послеоперационном периоде. Данные представлены в табл. 9.
Введение границ «плохих» и «хороших» результатов комплексной оценки здоровья через два года после радикальной операции на сердце, выполненной по поводу ВПС, позволило провести множественную логистическую регрессию с бинарной зависимой переменной («хороший» или «плохой» комплексный интегральный показатель здоровья) для построения логарифмического уравнения, прогнозирования риска развития события. Соответственно, «плохой» комплексный интегральный показатель здоровья принимали как дефицит здоровья через два года после хирургического лечения ВПС.
Данные логистической регрессии для комплексного интегрального показателя через два года после хирургического лечения ВПС представлены в табл. 10.
Таблица 9
Описательные статистические характеристики и границы «плохих» и «хороших» результатов балльной оценки для комплексного интегрального показателя здоровья через два года после хирургического лечения ВПС
|
Показатель |
Среднее |
Медиана |
25-й перцентиль |
75-й перцентиль |
|
Комплексный интегральный показатель здоровья через два года после хирургического лечения ВПС |
2,276 |
2,125 |
2,000 |
2,500 |
|
Показатель |
Ниже или равно |
Результат (балл для регрессии) |
Выше или равно |
Результат (балл для регрессии) |
|
Комплексный интегральный показатель здоровья через два года после хирургического лечения ВПС |
2,000 |
«Хороший» (0 баллов) |
2,250 |
«Плохой» (1 балл) |
Таблица 10
Результаты логистической регрессии для комплексного интегрального показателя
|
Регрессия зависимой варианты: «плохой» комплексный интегральный показатель здоровья – 1 / «хороший» – 0 |
β-коэффициент |
Стандартная ошибка β-коэффициента |
B-коэффициент |
Стандартная ошибка B-коэффициента |
p -value |
|
Intercept |
-0,759 |
0,350 |
0,041 |
||
|
Состав семьи |
0,524 |
0,108 |
0,541 |
0,112 |
0,000 |
|
Материальные условия |
-0,615 |
0,103 |
-0,634 |
0,106 |
0,000 |
|
Балл ВПС по тяжести и критичности |
0,705 |
0,127 |
0,071 |
0,013 |
0,000 |
|
Возраста проведения радикальной операции |
0,424 |
0,099 |
0,072 |
0,017 |
0,000 |
|
CYP1A1 T/C rs1048943*T |
0,215 |
0,094 |
0,396 |
0,174 |
0,033 |
|
HLA-DRB1*04 |
0,303 |
0,095 |
0,334 |
0,105 |
0,004 |
|
Жилищные условия |
0,443 |
0,112 |
0,465 |
0,117 |
0,001 |
|
HLA-DRB1*13 |
0,457 |
0,113 |
0,534 |
0,132 |
0,001 |
|
HLA-DRB1*01 |
-0,223 |
0,098 |
-0,258 |
0,113 |
0,033 |
П р и м е ч а н и е : Intercept – свободный коэффициент логистической регрессии.
Таблица 1 1
Баллы ВПС с учетом их тяжести, критичности для логистической регрессии
|
Нозология |
Балл для логистической регрессии |
|
Септальные дефекты и их сочетание |
1 |
|
Коарктация аорты |
2 |
|
Недостаточность клапанов (МК, ТК) |
2 |
|
Аномалия коронарных артерий |
3 |
|
Сочетание коарктации аорты и дефекта межжелудочковой перегородки, гипоплазия аорты |
4 |
|
Стеноз аортального клапана |
4 |
|
Тетрада Фалло, дефекты отхождения магистральных сосудов |
5 |
|
Атриовентрикулярная коммуникация |
5 |
|
Частичный аномальный дренаж легочных вен |
5 |
|
Аномалия Эбштейна |
6 |
|
Тотальный аномальный дренаж легочных вен |
7 |
|
Атрезия легочной артерии первого типа |
8 |
|
Единый желудочек сердца |
9 |
П р и м е ч а н и е : ТК – трикуспидальный клапан; МК – митральный клапан.
Из данных табл. 10 видно, что для комплексного интегрального показателя здоровья, отражающего наличие или отсутствие дефицита здоровья через два года после хирургического лечения ВПС, выявлено много значимых ассоциаций с одновременной значимой размерностью свободного коэффициента логистической регрессии (intercept). Это указывает на высокую степень эффективного прогнозирования предполагаемого события.
Необходимо отметить, что β-коэффициенты отражают относительное влияние предиктора на зависимую переменную, а B-коэффициенты показывают прогностическую значимость предиктора.
Исходя из этого, видим, что логистический регрессионный анализ позволил оценить вероятность риска формирования события, в данном случае развитие плохого (дефицита) состояния здоровья через два года после хирургического лечения ВПС, а B-коэффициенты каждого значимого предиктора использованы в формуле расчета этого риска.
В данном случае формула расчета риска дефицита здоровья через два года после хирургического лечения ВПС представлена следующим уравнением:
Y = (EXP (Z) / (1 + EXP (Z))) · 100 %, где
Z = (-0,759 + (X1 · 0,541) - (X2 · 0,634) + (X3 · 0,071) + (X4 · 0,072) + (X5 · 0,396) + (X6 · 0,334) + (X7 · 0,465) + (X8 · 0,534) - (X9 · 0,258)), где Y – вероятность риска формирования дефицита здоровья через два года после хирургического лечения ВПС (коэффициент вероятности риска формирования дефицита здоровья, %);
-
-0,759 – свободный коэффициент логистической регрессии;
-
X1 – состав семьи (полная – 1, полная многодетная – 2, неполная – 3, воспитанники детского дома – 4);
X2 – материальные условия (малообеспеченные, ниже МРОТ на одного человека, – 0, обеспеченная, равно или выше МРОТ на одного человека, – 1);
X 3 – балл ВПС по тяжести, критичности и встречаемости (баллы представлены в табл. 11);
X 4 – возраста проведения радикальной операции (лет);
X 5 – наличие аллеля T полиморфного варианта гена CYP1A1 T/C, rs1048943 (отсутствие – 0, присутствие в гетерозиготе – 1, присутствие в гомозиготе – 2);
X 6 – наличие аллеля 04 полиморфного варианта гена HLADRB1 (отсутствие – 0, присутствие в гетерозиготе – 1, присутствие в гомозиготе – 2);
X 7 – жилищные условия (очень хорошие – 1, хорошие – 2, плохие – 3, очень плохие – 4);
X 8 – наличие аллеля 13 полиморфного варианта гена HLADRB1 (отсутствие – 0, присутствие в гетерозиготе – 1, присутствие в гомозиготе – 2);
X 9 – наличие аллеля 01 полиморфного варианта гена HLADRB1 (отсутствие – 0, присутствие в гетерозиготе – 1, присутствие в гомозиготе – 2).
Баллы для различных нозологических форм ВПС были выставлены с учетом трех критериев: их тяжести, критичности и частоты встречаемости для проведения радикальной операции на сердце (табл. 11).
Логарифмический характер уравнения, полученного на основе логистической регрессии для расчета Y (вероятности риска формирования дефицита здоровья через два года после хирургического лечения ВПС), ограничивает интервал показателей риска от 0 до 100 %. Так, если Y стремится к 50 %, то риск развития предполагаемого события равновероятен; если Y стремится к нулю, то риск маловероятен; и, наоборот, при Y, близком к 100 %, риск развития дефицита здоровья через два года после радикального хирургического лечения ВПС становится высоковероятным. Вклад всех предикторов в формирование дефицита здоровья через два года после радикальной операции на сердце был статистически значимым (p < 0,001).
Как видно из уравнения, все предикторы вероятности риска формирования дефицита здоровья через два года после хирургического лечения ВПС можно оценить в пред- и операционный период и через это выявить степень вероятности риска формирования этого состояния, а также составить индивидуальный план реабилитационных мероприятий в течение послеоперационного периода.
Основными предикторами формирования дефицита здоровья в отдаленном послеоперационном периоде были тяжесть и критичность ВПС (табл. 11) и срок проведения радикальной операции на сердце по поводу самого ВПС. Положительная ассоциация указывала на то, что чем тяжелее и критичнее ВПС, тем хуже прогноз по качеству жизни в отдаленном послеоперационном периоде.
С другой стороны, положительная ассоциация с возрастом проведения радикальной операции показывает, что чем старше пациент, тем хуже прогноз по качеству его жизни и здоровью в отдаленном периоде после хирургического лечения ВПС. Вопрос о возрасте проведения радикальной операции на сердце у детей с септальными ВПС остается дискутабельным и требует отдельного изучения. В настоящем исследовании доминировали пациенты с септальными ВПС, и с этих позиций показатель возраста проявлял себя предиктором дефицита здоровья через два года после хирургического лечения ВПС. Отсюда можно предположить, что в отношении септальных спорадических несиндромальных ВПС возраст проведения радикальной операции должен уменьшаться. Это будет способствовать не только эффективному лечению ВПС, но и реабилитации после радикальной операции на сердце. В то же время необходим поиск нижних возрастных пределов для такого типа операций с учетом материала для имплантации.
Роль каждого из выявленных генетических предикторов дефицита здоровья в отдаленном послеоперационном периоде связана с их влиянием на сам процесс формирования ВПС и на пролонгирование иммунного воспаления в оперированном сердце. В частности, аллель HLA-DRB1*04 , высоко ассоциированный с системными и органоспецифическими аутоиммунными и аутовоспалительными заболеваниями, может детерминировать повышенный воспалительный потенциал у этих детей [14]. Напротив, аллель HLA-DRB1*13 , ассоциированный с иммунной недостаточностью, детерминирует иммунопарезы на антигены макро- и микроэкологии [15]. Как уже говорилось выше, иммунная недостаточность, ассоциированная с HLA-DRB1*13 (HLA-DR6), может проявляться частой респираторной заболеваемостью, и это будет способствовать ухудшению качества жизни детей в отдаленном периоде после хирургического лечения ВПС.
Отрицательная ассоциация с аллелем HLA-DRB1*01 указывает на то, что чем чаще встречается этот аллель, тем реже формируется дефицит здоровья через два года после хирургического лечения ВПС. То есть этот аллель является протектором дефицита здоровья и качества жизни в отдаленном периоде после хирургического лечения ВПС. Аллель HLA-DRB1*01 доминирует во всех популяциях мира [13], достигая 25 %, что указывает на его свойство детерминировать иммунную устойчивость индивидуумов к факторам макро- и микроэкологии. В данном случае этот аллель является маркером хороших адаптационных возможностей детей после радикальной операции на сердце.
Гомозиготность по мажорному (дикому) аллелю Т полиморфного варианта гена CYP1A1 T/C (rs1048943) детерминирует повышенное окисление ксено- и эндо-биотиков с образованием аддуктов [16], стимулирующих иммунный ответ и аутовоспалительные реакции, в том числе за счет участия в метаболизме арахидоновой кислоты [17]. Тем самым через этот полиморфный вариант гена также активируется токсико-воспалительный процесс. В целом эти полиморфные варианты генов будут способствовать манифестации пролонгированного воспалительного ответа на фоне дефицита эффекторных иммунных реакций. Частая респираторная заболеваемость у таких детей, описанная ранее [18], является следствием иммуногенетического детерминирования. Дефицит здоровья у этих детей развивается в том числе и за счет субклинического пролонгированного воспаления [19, 20].
Роль социальных факторов в потенцировании дефицита здоровья в отдаленном послеоперационном периоде связана с прямым и косвенным влиянием на эффективность реабилитации и комплаенс-терапии. Плохие жилищные и материальные условия являются основными неблагоприятными факторами, ограничивающими проведение эффективного курса амбулаторной реабилитации. С этих позиций дети из таких семей должны проходить дополнительные курсы реабилитации в стационарных условиях.
Для выявления порогового значения комплексного интегрального показателя здоровья, отражающего риск формирования дефицита здоровья через два года после хирургического лечения ВПС, и проверки качества полученного регрессионного уравнения был проведен ROC-анализ. Анализ выполнен между качественным показателем, указывающим на наличие (1) или отсутствие (0) дефицита здоровья через два года после хирургического лечения, с одной стороны, и расчетными данными Y (коэффициент вероятности риска формирования дефицита здоровья) для каждого пациента – с другой. Проведенный ROC-анализ показал критерий отсечения для вероятности риска формирования дефицита здоровья через два года после хирургического лечения ВПС. Эта величина равнялась 57,66 ( p < 0,001). Данные представлены на рис. 1.
Как видно из рис. 1, проведенный ROC-анализ показал, что величина комплексного интегрального показателя здоровья через два года после хирурги- ческого лечения ВПС, равная 57,66, является разграничительной между наличием и отсутствием дефицита здоровья. По данному критерию полученное уравнение характеризуется отличной диагностической ценностью (AUC = 0,901), специфичностью (100,0 %) и чувствительностью (77,5 %). То есть при проведении расчета вероятности риска формирования дефицита здоровья через два года после хирургического лечения ВПС можно с точностью, близкой к 90 %, определить развитие этого состояния. Это событие произойдет у детей с уровнем комплексного интегрального показателя здоровья, равным или выше 58 %, и не произойдет у пациентов с показателем ниже 58 %.
Одним из важных доказательств значимости предикторов в формировании дефицита здоровья через два года после хирургического лечения ВПС является их оценка посредством метода математического анализа «деревья классификации». Выполненный анализ «деревьев классификации» показал два важных классификационных фактора, представленных на рис. 2.
Как видно из рис. 2, классификация риска развития дефицита здоровья через два года после хирургического лечения ВПС происходит первично по возрасту проведения самой радикальной операции. Разделяющим критерием является возраст в 4 года 2 месяца; если операция проводится в более старшем возрасте, то риск дефицита здоровья увеличивается, а если в младшем – уменьшается. Следующим классификационным критерием выступает балл, ВПС по тяжести, критичности и распространенности (см. табл. 11). Критерием отсечения является балл, равный 7,5. Если балл ВПС по критичности, тяжести и распространенности выше этой отметки, то дефицит здоровья через два года после хирургического лечения ВПС весьма вероятен. Соответственно дети с тетрадой Фалло, оперированные до 4 лет, должны по комплексному интегральному показателю здоровья через два года после радикальной операции полностью восстановиться.
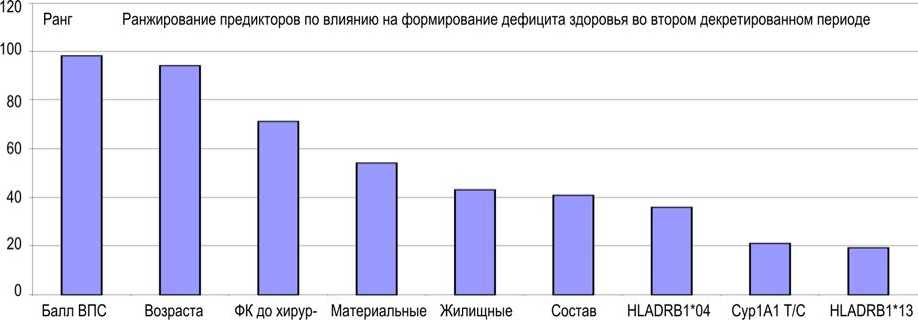
Ранжирование предикторов, выполненное посредством математического анализа «деревья классификации», для формирования дефицита здоровья через два года после хирургического лечения ВПС представлено на рис. 3.
Из рис. 3 видим, что балл ВПС по критичности, тяжести и распространенности (см. табл. 11) являлся самым значимым предиктором в отношении формирования дефицита здоровья через два года после хирургического лечения ВПС. Влияние его на зависимую переменную (наличие / отсутствие дефицита здоровья через два года после хирургического лечения ВПС) достигает 99 %. Второй по этому действию – предиктор возраста на момент радикальной операции на сердце. Соответственно, третий ранг приходится на функциональный класс (ФК) до хирургического лечения ВПС. Таким образом, наиболее значимое влияние на формирование дефицита здоровья в отдаленном послеоперационном периоде оказывают факторы, связанные с самим ВПС (тяжесть и критичность, возраст ребенка на момент радикальной операции и ФК в этом периоде). Вклад генетических маркеров по ранжированной шкале был самым низким – от 35 до 20 %.
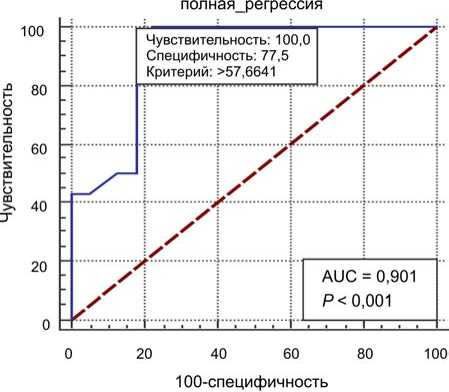
Рис. 1. ROC-анализ порогового значения комплексного интегрального показателя здоровья через два года после хирургического лечения ВПС и определение его диагностической значимости, чувствительности и специфичности в отношении расчета риска формирования этого состояния
0 Classification Tree for инт 2 Плохой1/хороший0
1 Number of splits = 2; Number of terminal nodes = 3
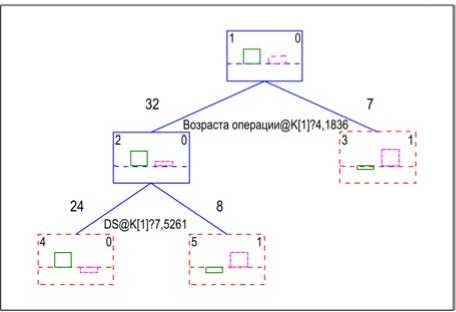
Рис. 2. Деревья классификации комплексного интегрального показателя здоровья во второй декретированный период (качественная оценка: 0 баллов – хороший, 1 балл – плохой) в зависимости от факторов широкого анамнеза, нарушений кровообращения до хирургического лечения, особенностей радикальной операции, дооперационных показателей здоровья, а также полиморфных вариантов исследуемых генов: DS – балл ВПС по критичности, тяжести и распространенности (см. табл. 11), @K[1]? – указатель разделительного коэффициента: для возраста операции – 4,1836, для балла ВПС по критичности – 7,5261
по тяжести и проведения гического условия условия семьи rs1048943*T критичности радикальной лечения ВПС операции
Рис. 3. Ранги значимых предикторных вариантов подчиненной переменной наличия / отсутствия (1 / 0) дефицита здоровья через два года после хирургического лечения ВПС, полученные при математическом анализе «деревья классификации»
Общий практический вывод вытекает из расчета комплексного интегрального показателя здоровья через два года после хирургического лечения ВПС. Если расчетный показатель в операционном периоде был выше 58 %, то для этого ребенка обязательными являются дополнительные курсы реабилитации в стационаре в течение двух лет после радикальной операции на сердце.
Выводы. Таким образом, проведенное исследование показало, что значимыми индикаторными показателями здоровья через два года после хирургического лечения ВПС были показатели физического функционирования и комплексный интегральный показатель здоровья, отражающие качество жизни детей в отдаленном периоде после радикальной операции на сердце.
Дефицит здоровья и качество жизни через два года после радикальной операции на сердце были ассоциированы с аллелями: HLA-DRB1*04, HLA-DRB1*11, HLA-DRB1*12, HLA-DRB1*13 и мажорным аллелем Т полиморфного варианта гена CYP1A1 T/C (rs1048943). Влияние этих аллелей на качество жизни в отдаленном периоде после радикальной операции на сердце могло осуществляться через детерминирование пролонгированного токсико-воспалительного процесса в оперированном сердце.
Из медицинских и социальных факторов риска, влияющих на формирование дефицита здоровья и качество жизни в отдаленном периоде после радикальной операции на сердце, следует выделить первичную тяжесть и критичность ВПС, возраст на момент радикальной операции, а также плохие материальные и жилищные условия. Одним из решений по улучшению реабилитации детей после хирургического лечения ВПС является проведение дополнительных курсов реабилитации в стационарных условиях с учетом величины комплексного интегрального показателя здоровья с пороговым значением 58 %.
Финансирование. Работа выполнена при поддержке комплексной программы фундаментальных научных исследований СО РАН в рамках фундаментальной темы НИИ КПССЗ № 0419-2022-0001.
Список литературы Анализ факторов риска формирования дефицита здоровья и его индикаторных показателей у детей с врожденными пороками сердца через два года после радикальной операции
- Task force 1: the changing profile of congenital heart disease in adult life / C.A. Warnes, R. Liberthson, G.K. Daniel-son, A. Dore, L. Harris, J.I. Hoffman, J. Somerville, R.G. Williams, G.D. Webb // J. Am. Coll. Cardiol. - 2001. - Vol. 37, № 5. - P. 1170 -1175. DOI: 10.1016/s0735-1097(01)01272-4
- Neurologic status of newborns with congenital heart defects before open heart surgery / C. Limperopoulos, A. Majne-mer, M.I. Shevell, B. Rosenblatt, C. Rohlicek, C. Tchervenkov // Pediatrics. - 1999. - Vol. 103, № 2. - P. 402-408. DOI: 10.1542/peds.103.2.402
- Risk factors for abnormal developmental trajectories in young children with congenital heart disease / K.A. Mussato, R. Hoffmann, G. Hoffman, J.S. Tweddell, L. Bear, Y. Cao, J. Tanem, C. Brosig // Circulation. - 2015. - Vol. 132, № 8. -P. 755-761. DOI: 10.1161/CIRCULATI0NAHA.114.014521
- The congenital heart disease genetic network study: cohort description / T.T. Hoang, E. Goldmuntz, A.E. Roberts, W.K. Chung, J.K. Kline, J.E. Deanfield, A. Giardini, A. Aleman [et al.] // PLoS One. - 2018. - Vol. 13, № 1. - P. e0191319. DOI: 10.1371/journal.pone.0191319
- Socioeconomic status in relation to selected birth defects in a large multicentered US case-control study / J. Yang, S.L. Carmichael, M. Canfield, J. Song, G.M. Shaw, National Birth Defects Prevention Study // Am. J. Epidemiol. - 2008. -Vol. 167, № 2. - P. 145-154. DOI: 10.1093/aje/kwm283
- Periconceptional stressors and social support and risk for adverse birth outcomes / K.A. Weber, S.L. Carmichael, W. Yang, S.C. Tinker, G.M. Shaw, National Birth Defects Prevention Study // BMC Pregnancy Childbirth. - 2020. -Vol. 20, № 1. - P. 487. DOI: 10.1186/s12884-020-03182-6
- Влияние социальных, медицинских и экологических факторов на формирование спорадических врожденных пороков сердца / А.В. Шабалдин, А.В. Цепокина, С.А. Шмулевич, М.Ю. Табакаев, Е.В. Шабалдина // Российский вестник перинатологии и педиатрии. - 2018. - Т. 63, № 1. - С. 14-21. DOI: 10.21508/1027-4065-2018-63-1-14-21
- Varni J.W., Seid M., Kurtin P.S. PedsQL 4.0: reliability and validity of the Pediatric Quality of Life Inventory version 4.0 generic core scales in healthy and patient populations // Med. Care. - 2001. - Vol. 39, № 8. - P. 800-812. DOI: 10.1097/00005650-200108000-00006
- Соснина С.Ф., Волосников Д.К., Тюков Ю.А. Анализ проблем родительско-детских отношений с помощью опросника PEDsQL™4.0 // Современные исследования социальных проблем. - 2010. - № 1. - С. 78-79.
- Хаитов Р.М., Алексеев Л.П., Кофиади И.А. Роль иммуногенетики в решении фундаментальных и прикладных задач персонализированной медицины // Медицина экстремальных ситуаций. - 2016. - Т. 3, № 57. - С. 9-24.
- Human leukocyte antigens in undifferentiated spondyloarthritis / H.-T. Liao, K.-C. Lin, C.-H. Chen, T.-H. Liang, M.-W. Lin, C.-Y. Tsai, D. Tak Yan Yu, C.-T. Chou // Semin. Arthritis Rheum. - 2007. - Vol. 37, № 3. - P. 198-201. DOI: 10.1016/j.semarthrit.2007.04.004
- Interaction of HLA-DRB1* alleles and CTLA4 (+ 49 AG) gene polymorphism in autoimmune thyroid disease / S. Ramgopal, C. Rathika, M.R. Padma, V. Murali, K. Arun, M.N. Kamaludeen, K. Balakrishnan // Gene. - 2018. - Vol. 642. -P. 430-438. DOI: 10.1016/j.gene.2017.11.057
- Caillat-Zucman S. Molecular mechanisms of HLA association with autoimmune diseases // Tissue Antigens. - 2009. -Vol. 73, № 1. - P. 1-8. DOI: 10.1111/j.1399-0039.2008.01167.x
- О влиянии тканевой совместимости по HLA и некоторых других факторов на выживаемость аллотранспланта-та (по результатам трансплантации трупной почки за 25 лет) / Ю.М. Зарецкая, В.Ю. Абрамов, Я.Г. Мойсюк, А.Г. Дол-бин // Трансплантология. - 2011. - № 2-3. - C. 39-47. DOI: 10.23873/2074-0506-2011-0-2-3-39-47
- Сепиашвили Р.И. Функциональная система иммунного гомеостаза // Аллергология и иммунология. - 2015. -Т. 16, № 1. - С. 91-100.
- Bozina, N., Bradamante, V., Lovric, M. Genetic polymorphism of metabolic enzymes P450 (CYP) as a susceptibility factor for drug response, toxicity, and cancer risk // Arh. Hig. Rada Toksikol. - 2009. - Vol. 60, № 2. - P. 217-242. DOI: 10.2478/10004-1254-60-2009-1885
- Morgan E.T. Regulation of cytochromes P450 during inflammation and infection // Drug Metab. Rev. - 1997. -Vol. 29, № 4. - P. 1129-1188. DOI: 10.3109/03602539709002246
- Особенности субпопуляций Т-лимфоцитов хелперов, экспрессирующих CD45RA^ CD31-маркеры, у детей после тимэктомии, выполненной при хирургическом лечении врожденного порока сердца / Ю.И. Ровда, С.А. Шмулевич, А.В. Шабалдин, Е.Б. Лукоянычева // Медицинская иммунология. - 2016. - Т. 18, № 2. - С. 119-128. DOI: 10.15789/1563-0625-2016-2-119-128
- Mental health disorders in children with congenital heart disease / V.J. Gonzalez, R.T. Kimbro, K.E. Cutitta, J.C. Shabosky, M.F. Bilal, D.J. Penny, K.N. Lopez // Pediatrics. - 2021. - Vol. 147, № 2. - P. e20201693. DOI: 10.1542/peds.2020-1693
- Health-related quality of life outcomes in children and adolescents with congenital heart disease / K. Mellion, K. Uzark, A. Cassedy, D. Drotar, G. Wernovsky, J.W. Newburger, L. Mahony, K. Mussatto [et al.] // J. Pediatr. - 2014. -Vol. 164, № 4. - P. 781-788. DOI: 10.1016/jjpeds.2013.11.066


