Анализ факторов риска развития продленного сброса воздуха после лобэктомий
Автор: Тонеев Е.А., Мартынов А.А., Комаров А.С., Мидленко О.В., Пикин О.В., Зарипов Л.Р., Зулькарняев А.Ш., Чавкин П.М.
Журнал: Ульяновский медико-биологический журнал @medbio-ulsu
Рубрика: Клиническая медицина
Статья в выпуске: 3, 2023 года.
Бесплатный доступ
Цель. Выявление факторов риска развития длительной утечки воздуха у пациентов после лобэктомии и создание номограммы для прогнозирования данного осложнения. Материалы и методы. В период с января 2019 г. по 31 декабря 2022 г. в ГУЗ ОКОД г. Ульяновска выполнено 417 лобэктомий у больных немелкоклеточным раком легкого. В исследование были включены 162 пациента, по которым удалось собрать полноценную информацию. Были определены статистически значимые факторы влияния на развитие продленного сброса воздуха. Результаты. При проведении многопараметрического логистического регрессионного анализа (результаты представлены как отношение шансов (ОШ) и 95 % доверительный интервал) были выявлены следующие параметры: кровопотеря (1,008; (1,003-1,013)), время операции (1,092; (1,029-1,158)), общий белок (0,732; (0,598-0,898)), выраженность борозды (0,100; (0,0150,653)), спаечный процесс (75,505; (6,527-873,056)), количество аппаратов (10,233; (1,883-55,590)), независимо связанные с наличием продленного сброса воздуха. На основании данной регрессии построена номограмма для расчета вероятности продленного сброса воздуха с использованием коэффициентов модели. Чувствительность и специфичность разработанной номограммы для исследуемых пациентов составили 97,0 % и 93,8 % соответственно. Выводы. Разработанная прогностическая номограмма позволяет оценить вероятность развития продленного сброса воздуха и обеспечить профилактику развития данного осложнения у пациентов с высоким риском.
Лобэктомия, продленный сброс воздуха, осложнение после лобэктомии, номограмма для прогнозирования продленного сброса воздуха
Короткий адрес: https://sciup.org/14128734
IDR: 14128734 | УДК: 616.831-089.87 | DOI: 10.34014/2227-1848-2023-3-109-121
Текст научной статьи Анализ факторов риска развития продленного сброса воздуха после лобэктомий
Введение. Развитие продленного сброса воздуха является одной из наиболее частых хирургических проблем у пациентов, которым была выполнена резекция легкого. У половины пациентов после резекции легкого возникает сброс воздуха по дренажам сразу после операции, который снижается, по данным отечественных и зарубежных авторов, до 5–20 % к 5-му послеоперационному дню [1]. Случай, когда после 5 сут послеоперационного периода сброс воздуха по дренажам продолжается, согласно рекомендациям Европейского сообщества торакальных хирургов (англ. European Society of Thoracic Surgeons, ESTS) следует классифицировать как продленный сброс воздуха (prolonged air leak, PAL) [2].
Продленный сброс воздуха (ПСВ) требует тщательного послеоперационного ведения, удлиняет сроки госпитализации, а также негативно сказывается на качестве жизни пациента. Данное осложнение провоцирует возникновение других, в частности эмпиемы плевры, нагноения послеоперационной раны и области постановки дренажей [3]. Разработка однонаправленных дренажных систем, таких как клапан Геймлиха, Atrium Pneumostat™ и Atrium Express Mini™, сыграла важную роль в снижении послеоперационной госпитализации, позволив пациентам с небольшим по объему сбросом воздуха по дренажам лечиться амбулаторно. Но и эти пациенты нуждаются в регулярном осмотре торакальным хирургом и требуют постоянного медицинского ухода [4].
Все вышеперечисленное делает ПСВ существенной проблемой для торакальных хирургов, несмотря на наличие многих профилактических методик (плевродез, использование биологического клея, правильно подобранное послеоперационное ведение плеврального дренажа и т.д.) [5]. Если у торакальных хирургов появится возможность выявлять пациентов, у которых может возникнуть ПСВ, то интраоперационные манипуляции и алгоритм ранней профилактики помогут снизить процент данного осложнения [6].
Материалы и методы. В ретроспективном исследовании проанализированы данные 417 пациентов, которым в ГУЗ ОКОД в период с января 2019 г. по 31 декабря 2022 г. проведена лобэктомия по поводу злокачественного новообразования легкого. При обработке историй болезни из исследования были исключены пациенты, которым выполнялось комбинированное вмешательство, торакоскопические лобэктомии, а также лобэктомии по поводу метастатического процесса из другого первичного очага (колоректальный рак, рак молочной железы и т.п.). В итоге в исследование было включено 162 пациента.
Лобэктомия выполнялась стандартным боковым доступом в 4-м или 5-м межреберье, систематическая медиастинальная лимфодис-секция проводилась стандартно. По завершении оперативного вмешательства устанавливалась 1 дренажная трубка в 8-е межреберье по задней подмышечной линии в купол плевральной полости; диаметр дренажной трубки – 28 Fr. Дренаж из плевральной полости удалялся при наличии герметичности дренажа, полном расправлении легкого по данным контрольных рентгенограмм и количестве отделяемого по дренажам менее 150 мл.
Продленный сброс воздуха определялся как постоянное поступление воздуха по дренажу в течение более 5 дней после операции.
Определялись исходные клинические параметры, включая возраст, пол, историю курения, предоперационные респираторные сопутствующие заболевания, гистологический тип, стадию TNM, характер междолевой ще- ли, наличие плевральных спаек, объем вмешательства, физический статус пациентов (по классификации Американского общества анестезиологов). Индекс коморбидности рассчитывался по шкале Charlson. Оценивались параметры функции внешнего дыхания (ОФВ1, ФЖЕЛ, ЖЕЛ, индекс Гейнслера). Отдельно выделялись пациенты с ХОБЛ, которые были распределены по стадиям заболевания. Степень влияния ХОБЛ определялась с использованием Chronic obstructive lung disease assessment test (CAT) score (тест для оценки влияния ХОБЛ на состояние здоровья) до оперативного вмешательства и перед выпиской из стационара [7]. Одышка оценивалась и классифицировалась также до операции и перед выпиской по модифицированной шкале одышки Совета медицинских исследований (modified Medical Research Council (mMRC)) [8]. Риск развития сердечно-сосудистых осложнений в торакальной хирургии определялся по торакальному пересмотренному индексу сердечного риска (Thoracic Revised Cardiac Risk Index (ThRCRI)) [9]. Риск развития летального исхода в стационаре рассчитывался по The Thoracic Surgery Scoring System (Thoracoscore), которая использует только 9 переменных для оценки риска развития летального исхода в стационаре при операции на легких. У курящих пациентов определялся индекс курильщика по формуле: произведение количества выкуриваемых сигарет в день и стажа курения (годы), деленное на 20. Все эти параметры анализировались на предмет установления факторов риска развития ПСВ [10]. Для стадирования использовалась классификация по системе TNM 8-го пересмотра, утвержденная Международным союзом по борьбе с раком (UICC).
В исследовании оценивались все виды послеоперационных осложнений: респираторных (пневмоторакс, пневмония, дыхательная недостаточность) и сосудистых (тромбоэмболия легочной артерии, острое нарушение мозгового кровообращения, острый коронарный синдром, аритмия). Также принимались во внимание инфекция области хирургического вмешательства (нагноение торакотомного доступа и раневая инфекция области постановки дренажа), повторная операция и периоперационная смерть (в течение 30 дней после операции).
Количественные показатели оценивались на предмет соответствия нормальному распределению с помощью критерия Шапиро – Уилка (при числе исследуемых менее 50) или Колмогорова – Смирнова (при числе исследуемых более 50). Количественные показатели, имеющие нормальное распределение, описывались с помощью средних арифметических величин (M) и стандартных отклонений (SD), границ 95 % доверительного интервала (95 % ДИ). В случае отсутствия нормального распределения количественные данные описывались с помощью медианы (Me) и нижнего и верхнего квартилей (Q1–Q3). Категориальные данные представлялись в виде абсолютных значений и процентных долей. Сравнение двух групп по количественному показателю, имеющему нормальное распределение, при условии равенства дисперсий выполнялось с помощью t-критерия Стьюдента. Сравнение двух групп по количественному показателю, распределение которого отличалось от нормального, выполнялось с помощью U-критерия Манна – Уитни. Сравнение процентных долей при анализе четырехпольных таблиц сопряженности проводилось с помощью критерия χ2 Пирсона (при значениях ожидаемого явления более 10). Построение прогностической модели вероятности опреде- ленного исхода выполнялось при помощи метода логистической регрессии. Мерой определенности, указывающей на ту часть дисперсии, которая может быть объяснена с помощью логистической регрессии, служил коэффициент R² Найджелкерка. Для оценки диагностической значимости количественных признаков при прогнозировании определенного исхода применялся метод анализа ROC-кривых. Разделяющее значение количественного признака в точке cut-off определялось по наивысшему значению индекса Юдена.
Результаты. Пациенты были разделены на 2 группы в зависимости наличия или отсутствия продленного сброса воздуха. Характеристики исследуемых пациентов представлены в табл. 1. Частота продленного сброса воздуха составила 20,4 % (33/162). У 60,6 % (20/33) пациентов с продленным сбросом воздуха до операции имелась ХОБЛ 2-й стадии. Наиболее частыми хирургическими операциями, после которых наблюдался продленный сброс воздуха, была верхняя лобэктомия слева (33,3 %) и нижняя лобэктомия справа (24,2 %). При сопоставлении показателей T (TNM) в зависимости от наличия или отсутствия ПСВ не удалось установить статистически значимых различий (p=0,154). При анализе показателя N (TNM) в группах сравнения статистически значимые различия также выявлены не были (p=0,419).
Таблица 1
Table 1
|
Характеристики Characteristics |
n |
Без продленного сброса воздуха Without prolonged air leak |
С продленным сбросом воздуха With prolonged air leak |
p |
|
|
Пол, n (%) Gender, n (%) |
Мужской Male |
40 |
35 (27,1) |
5 (15,2) |
0,154 |
|
Женский Female |
122 |
94 (72,9) |
28 (84,8) |
||
|
Возраст, лет Age, y.o. |
162 |
65 [59–69] |
64 [60–70] |
0,588 |
|
|
Стадия, n (%) Stage, n (%) |
IA |
46 |
38 (29,5) |
8 (24,2) |
0,424 |
|
Характеристики Characteristics |
n |
Без продленного сброса воздуха Without prolonged air leak |
С продленным сбросом воздуха With prolonged air leak |
p |
|
|
IB |
38 |
28 (21,7) |
10 (30,3) |
||
|
IIA |
12 |
8 (6,2) |
4 (12,1) |
||
|
IIB |
25 |
19 (14,7) |
6 (18,2) |
||
|
IIIA |
32 |
29 (22,5) |
3 (9,1) |
||
|
IIIB |
9 |
7 (5,4) |
2 (6,1) |
||
|
Гистотип, n (%) Histotype, n (%) |
аденокарцинома adenocarcinoma |
98 |
77 (59,7) |
21 (63,6) |
0,710 |
|
плоскоклеточный squamous carcinoma |
48 |
38 (29,5) |
10 (30,3) |
||
|
прочие others |
16 |
14 (10,9) |
2 (6,1) |
||
|
Кровопотеря, мл Blood loss, ml |
230 [190–280] |
310 [270–350] |
<0,001 |
||
|
Общий белок, г/л Total protein, g/l |
69,0 [63,3–71,5] |
61,6 [59,1–63,8] |
<0,001 |
||
|
ХОБЛ, n (%) COPD, n (%) |
нет no |
39 |
34 (26,4) |
5 (15,2) |
0,001 |
|
1 стадия stage 1 |
40 |
37 (28,7) |
3 (9,1) |
||
|
2 стадия stage 2 |
75 |
55 (42,6) |
20 (60,6) |
||
|
3 стадия stage 3 |
8 |
3 (2,3) |
5 (15,2) |
||
|
ИПЛ Pack-year |
23 [10–33] |
30 [23–35] |
0,043 |
||
|
Время операции, мин Surgery duration, min |
100 [85–120] |
135 [115–145] |
<0,001 |
||
|
Выраженность борозды, n (%) Fissura intensity, n (%) |
нет no |
67 |
41 (31,8) |
26 (78,8) |
<0,001 |
|
да yes |
95 |
88 (68,2) |
7 (21,2) |
||
|
Спаечный процесс, n (%) Adhesion process, n (%) |
нет no |
129 |
121 (93,8) |
8 (24,2) |
<0,001 |
|
да yes |
33 |
8 (6,2) |
25 (75,8) |
||
|
Количество используемых аппаратов Number of devices used |
2 [1–2] |
2 [2–3] |
<0,001 |
||
|
Послеоперационный койко-день After surgery bed day |
10 [9–12] |
16 [15–21] |
<0,001 |
||
|
Характеристики Characteristics |
n |
Без продленного сброса воздуха Without prolonged air leak |
С продленным сбросом воздуха With prolonged air leak |
p |
|
|
ГКС после операции, n (%) Postoperative GCS, n (%) |
нет no |
78 (60,5) |
17 (51,5) |
0,352 |
|
|
да yes |
51 (39,5) |
16 (48,5) |
|||
|
Вид лобэктомии, n (%) Type of lobectomy, n (%) |
ВЛЭ справа Right UL |
46 |
42 (32,6) |
4 (12,1) |
0,151 |
|
СЛЭ ML |
12 |
8 (6,2) |
4 (12,1) |
||
|
НЛЭ справа Right LL |
27 |
19 (14,7) |
8 (24,2) |
||
|
ВЛЭ слева Left UL |
48 |
37 (28,7) |
11 (33,3) |
||
|
НЛЭ слева Left LL |
29 |
23 (17,8) |
6 (18,2) |
||
|
Тип пневмоторакса на 1-е сут, n (%) Type of pneumothorax on the 1st day, n (%) |
нет no |
98 |
82 (63,6) |
16 (48,5) |
0,040 |
|
верхушечный apical |
49 |
39 (30,2) |
10 (30,3) |
||
|
малый small |
12 |
7 (5,4) |
5 (15,2) |
||
|
средний moderate |
3 |
1 (0,8) |
2 (6,1) |
||
|
Время дренирования, сут Drainage time, day |
5 [4–5] |
13 [10–18] |
<0,001 |
||
|
ИМТ, кг/м2 BMI, kg/m2 |
25,0 [23,1–28,4] |
23,9 [22,8–26,3] |
0,080 |
||
Примечание. ИПЛ – индекс пачка/лет, ХОБЛ – хроническая обструктивная болезнь легких, ГКС – глюкокортикостероиды, ВЛЭ – верхняя лобэктомия, СЛЭ – средняя лобэктомия, НЛЭ – нижняя лобэктомия, ИМТ – индекс массы тела.
Note. COPD – chronic obstructive pulmonary disease, GCS – glucocorticosteroids, UL – upper lobectomy, ML – middle lobectomy, LL – lower lobectomy, BMI – body mass index.
Статистически значимых различий при сравнении показателя степени влияния ХОБЛ на качество жизни, определенного по опроснику CAT на догоспитальном этапе и при выписке из стационара, в группах не выявлено (p=0,539 и p=0,540 соответственно). При сопоставлении показателей ThRCRI, Thoracoscore и ASA различий между группами также не установлено (p=0,331; p=0,951; p=0,152).
При анализе одышки у пациентов (mMRC) до операции и при выписке обе группы продемонстрировали отсутствие статистически значимых различий (p=0,591; p=0,443).
Осложнения в послеоперационном периоде были стратифицированы по шкале Thoracic mortality and morbidity (TMM) и представлены в табл. 2.
Таблица 2
Table 2
Complications according to TMM classification
|
Категория TMM TMM classification |
Продленный сброс воздуха Prolonged air leak |
p |
|
|
нет / no |
да / yes |
||
|
Нет / No |
94 (72,9) |
7 (21,2) |
<0,001 |
|
II |
26 (20,2) |
2 (6,1) |
|
|
IIIA |
1 (0,8) |
14 (42,4) |
|
|
IIIB |
2 (1,6) |
5 (15,2) |
|
|
IVA |
4 (3,1) |
4 (12,1) |
|
|
V |
2 (1,6) |
1 (3,0) |
|
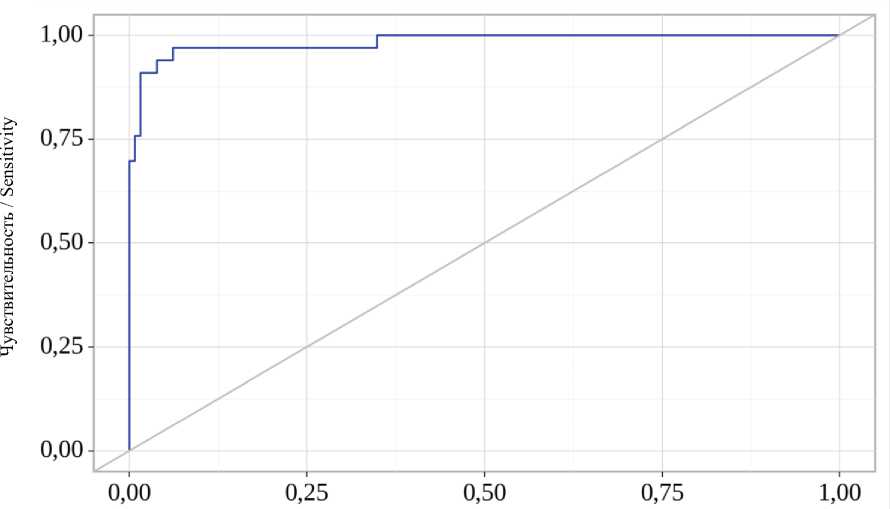
Специфичность / Specificity
Рис. 1. ROC-кривая, характеризующая зависимость вероятности показателя «ПСВ» от значения логистической функции P
Fig. 1. ROC-curve characterizing the correlation of PAL probability and logistic function P
О 10 20 30 40 50 60 70 80 90 100
Баллы / I_____ь_____._____i_____I_____i_____*_____i_____I_____a_____i_____*_____1_____i_____a_____<_____J_____i_____•_____ j _____1_____a_____i_____i_____1_____a_____i_____a_____1_____i_____i_____a_____I_____a_____a_____a_____I_____a_____a_____i_____I
Points
Кровопотеря /
Blood loss 100 200 300 400 500 600 700 800 900 1000 1100
Время операции /
Surgery duration 40 60 80 100 120 140 160 180 200220
Общий белок /
Total protein 85 80 75 70 65 60 55 50 4540
Выраженность борозды /
Fissura intensity+
Спаечный процесс /
Adhesion process
Количество аппаратов /
Number of devices 02
Сумма баллов /
Total points 0 20 40 60 80 100 120 140 160 180 200 220 240260
Значение линейного предиктора / 20 -15 -10 -5 0 5 1015
Linear predictor value
Рис. 2. Номограмма для расчета вероятности продленного сброса воздуха
Fig. 2. Construction and validation of a nomogram for PAL probability
Характеристики исследуемых пациентов
Patient characteristics
Осложнения по классификации TMM
При анализе показателя TMM по группам исследования были установлены статистически значимые различия (p<0,001).
Реторакотомия потребовалась в 6 случаях при ПСВ и в 1 случае в группе без ПСВ (по поводу внутриплеврального кровотечения). Летальные исходы не были связаны с продленным сбросом воздуха, а являлись следствием сердечно-сосудистых осложнений. Количество раневых инфекций в группе ПСВ составило 6 случаев и было связано с нагноением области постановки дренажа; в группе без ПСВ отмечен только 1 случай.
Разработка номограммы. Многопараметрическая логистическая регрессия (представленная как отношения шансов (ОШ) и 95 % доверительные интервалы) выявила следующие независимо связанные с наличием продленного сброса воздуха параметры: кровопотеря (1,008; (1,003–1,013)), время операции (1,092; (1,029–1,158)), общий белок (0,732; (0,598–0,898)), выраженность борозды (0,100; (0,015–0,653)), спаечный процесс (75,505; (6,527–873,056)), количество аппаратов (10,233; (1,883–55,590)).
Кривая, полученная при оценке зависимости вероятности показателя «ПСВ» от значения логистической функции P с помощью ROC-анализа, представлена на рис. 1.
Площадь под ROC-кривой составляет 0,984±0,016 с 95 % ДИ: 0,953–1,000. Полученная модель является статистически значимой (p<0,001).
Исходя из данных многопараметрической логистической регрессии была создана номограмма для расчета вероятности продленного сброса воздуха с использованием коэффициентов модели (рис. 2) . Эта номограмма позволяет прогнозировать вероятность ПСВ. Для этого собираются данные о пациенте, которому предстоит резекция легкого, и определяется положение каждой переменной на соответствующей оси. Общий балл формируется суммированием баллов по каждой переменной. Сумма баллов используется для оценки вероятности продленного сброса воздуха для данного пациента (рис. 3). Чувствительность и специфичность модели составляют 97,0 % и 93,8 % соответственно.
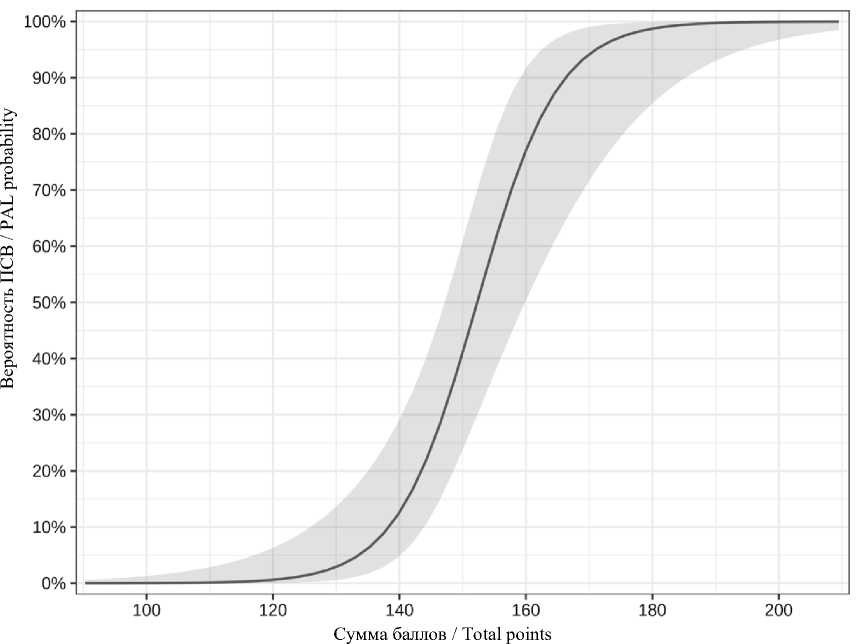
Рис. 3. Соотношение баллов и риска развития продленного сброса воздуха
Fig. 3. Correlation of points and the risk of prolonged air leak
Обсуждение. Прогнозирование и профилактика ПСВ играют важную роль. Есть три этапа, на возможно действовать:
-
1) на предоперационном этапе с применением моделей прогнозирования риска;
-
2) интраоперационно путем стратификации пациентов с риском ПСВ и селективного устранения интраоперационно выявленного сброса воздуха;
-
3) в послеоперационном периоде при правильном ведении плеврального дренажа и использовании методик плевродеза.
В нашем исследовании поставлена задача определить первый из трех этапов.
Создание моделей риска развития ПСВ при помощи логистической регрессии позволяет отобрать наиболее важные факторы риска развития данного осложнения, но использование этого метода в постоянной клинической практике достаточно проблематично [11].
На первом этапе исследования мы выполнили отбор переменных, статистически зна- чимо влияющих на развитие ПСВ. Было выявлено, что кровопотеря, время операции, общий белок, выраженность борозды, спаечный процесс, количество аппаратов, ХОБЛ и ИПЛ независимо связаны с наличием продленного сброса воздуха. Вторым этапом стало построение логистической регрессии с пошаговым отбором предикторов. На этом этапе были исключены ХОБЛ и ИПЛ, так как их влияние на развитие ПСВ в комплексе с другими факторами оказывалось статистически незначимым. Для более простого применения в клинической практике мы посчитали необходимым создать номограмму. Номограмма – это графическое представление математической формулы или алгоритма, которое включает в себя несколько предикторов, представленных в виде непрерывных переменных, и используется для прогнозирования конечной точки [12], в нашем случае – риска развития ПСВ. С помощью этой прогностической номограммы можно оценить вероятность ПСВ для отдельных пациентов и тем самым принять профилактические меры в отношении пациентов с высоким риском.
Ранее было опубликовано несколько прогностических моделей, основанных на различных определениях ПСВ. Attaar et al. в своем исследовании использовали то же определение ПСВ, что и мы (сброс воздуха по дренажам более 5 дней после операции). Это ретроспективное исследование включало 2317 пациентов, перенесших резекцию легкого с января 2009 г. по июнь 2014 г. В модель были введены хирургический объем, ОФВ1, ИМТ, курение в анамнезе, правосторонняя торакотомия, длительность предоперационной госпитализации, сублобарные резекции торако-томным доступом, повторная операция и объективный статус [13]. При проверке этой прогностической модели на наших пациентах мы получили чувствительность 68 % и специфич- ность 79 %, что уступает характеристикам разработанной нами модели. Таким образом зарубежные номограммы не всегда могут быть точно интегрированы в отечественную клиническую практику, требуется проверка их чувствительности и специфичности на проспективных группах пациентов [14].
Заключение. На основе дооперационных и интраоперационных параметров разработана номограмма для прогнозирования развития продленного сброса воздуха после лобэктомии у пациентов с первичной злокачественной опухолью. Номограмма показала удовлетворительную прогностическую эффективность в нашей группе исследования. Данная номограмма позволяет оценить риск развития ПСВ у отдельных пациентов и, следовательно, заранее принять профилактические меры для купирования данного осложнения у пациентов с высоким риском.
Список литературы Анализ факторов риска развития продленного сброса воздуха после лобэктомий
- Маслак О.С., ПищикВ.Г., Оборнев А.Д., Зинченко Е.И., Коваленко А.И. Влияние активной аспирации на риск продленного сброса воздуха после видеоторакоскопических лобэктомий: проспективное рандомизированное исследование. Инновационная медицина Кубани. 2020; (4): 14-19. DOI: https://doi.org/10.35401/2500-0268-2020-20-4-14-19.
- Fernandez F.G., FalcozP.E., Kozower B.D., SalatiM., Wright C.D., Brunelli A. The Society of Thoracic Surgeons and the European Society of Thoracic Surgeons general thoracic surgery databases: joint standardization of variable definitions and terminology. Ann Thorac Surg. 2015; 99 (1): 368-376. DOI: 10.1016/j.athoracsur.2014.05.104.
- Pischik V.G., Maslak O.S., Obornev A.D., Zinchenko E.I., Kovalenko A.I. Risk factors and outcomes of prolonged air leak after pulmonary resections. Indian J Thorac Cardiovasc Surg. 2019; 35 (4): 564-568. DOI: 10.1007/s12055-019-00827-w.
- Brims F.J., MaskellN.A. Ambulatory treatment in the management of pneumothorax: a systematic review of the literature. Thorax. 2013; 68 (7): 664-669. DOI: 10.1136/thoraxjnl-2012-202875.
- Тонеев Е.А., Базаров Д.В., Пикин О.В., Чарышкин А.Л., Мартынов А.А., Лисютин Р.И., Зулькарняев А.Ш., Анохина Е.П. Продленный сброс воздуха после лобэктомии у больных раком легкого. Сибирский онкологический журнал. 2020; 19 (1): 103-110. DOI: https://doi.org/10.21294/1814-4861-2020-19-1-103-110.
- Li R., Xue M., Ma Z. Construction and validation of a nomogram for predicting prolonged air leak after minimally invasive pulmonary resection. World J Surg Onc. 2022; 20 (1): 249. DOI: https://doi.org/ 10.1186/s12957-022-02716-w.
- Ghobadi H., Ahari S.S., Kameli A., Lari S.M. The Relationship between COPD Assessment Test (CAT) Scores and Severity of Airflow Obstruction in Stable COPD Patients. Tanaffos. 2012; 11 (2): 22-26. PMID: 25191410.
- Sunjaya A., Poulos L., Reddel H., Jenkins C. Qualitative validation of the modified Medical Research Council (mMRC) dyspnoea scale as a patient-reported measure of breathlessness severity. Respir Med. 2022; 203: 106984. DOI: 10.1016/j.rmed.2022.106984.
- Thomas D.C., Blasberg J.D., Arnold B.N., Rosen J.E., Salazar M.C., Detterbeck F.C., Boffa D.J., Kim A.W. Validating the Thoracic Revised Cardiac Risk Index Following Lung Resection. Ann Thorac Surg. 2017; 104 (2): 389-394. DOI: 10.1016/j.athoracsur.2017.02.006.
- Falcoz P.E., ContiM., BrouchetL., Chocron S., PuyraveauM., Mercier M., Etievent J.P., DahanM. The Thoracic Surgery Scoring System (Thoracoscore): risk model for in-hospital death in 15,183 patients requiring thoracic surgery. J Thorac Cardiovasc Surg. 2007; 133 (2): 325-332. DOI: 10.1016/j.jtcvs. 2006.09.020.
- Pompili C., Falcoz P.E., Salati M., Szanto Z., Brunelli A. A risk score to predict the incidence of prolonged air leak after video-assisted thoracoscopic lobectomy: An analysis from the European Society of Thoracic Surgeons database. J Thorac Cardiovasc Surg. 2017; 153 (4): 957-965. DOI: 10.1016/j.jtcvs.2016.11.064.
- Bonnett L.J., Snell K.I.E., Collins G.S. Guide to presenting clinical prediction models for use in clinical settings. BMJ. 2019; 365: l737. DOI: https://doi.org/10.1136/bmj.l737.
- Attaar A., Winger D.G., Luketich J.D., SchuchertM.J., SarkariaI.S., Christie N.A., Nason K.S. A clinical prediction model for prolonged air leak after pulmonary resection. J Thorac Cardiovasc Surg. 2017; 153 (3): 690-699.e2. DOI: 10.1016/j.jtcvs.2016.10.003.
- Jin R., Zheng Y., Gao T., Zhang Y., Wang B., Hang J., Li H. A nomogram for preoperative prediction of prolonged air leak after pulmonary malignancy resection. Transl Lung Cancer Res. 2021; 10 (8): 3616-3626. DOI: 10.21037/tlcr-21-186.


