Анализ гидролиза пептидов функционально важных участков мозгового и глиального нейротрофических факторов антителами больных шизофренией и другими нейроиммунными заболеваниями
Автор: Ермаков Евгений Александрович, Меламуд Марк Маркович, Невинский Георгий Александрович, Бунева Валентина Николаевна
Журнал: Сибирский вестник психиатрии и наркологии @svpin
Рубрика: Биологические исследования
Статья в выпуске: 4 (117), 2022 года.
Бесплатный доступ
Актуальность. При определенных нейроиммунных заболеваниях, таких как шизофрения, рассеянный склероз (РС) и системная красная волчанка (СКВ), в разной степени одновременно поражается нервная и иммунная системы. Некоторые нейроиммунные заболевания сопровождаются снижением концентрации мозгового (BDNF) и глиального (GDNF) нейротрофических факторов, что может быть обусловлено снижением образования или их избыточным разрушением в крови. Распад может быть связан с действием протеолитических ферментов. Гипотеза: недавно обнаруженные каталитические антитела с протеолитическими свойствами могут связывать и гидролизовать BDNF и GDNF. Цель: проанализировать уровень гидролиза пептидов функционально важных участков BDNF и GDNF антителами больных шизофренией, РС и СКВ. Материали методы. В общую (n=112) выборку исследования включены здоровые добровольцы (n=30), больные шизофренией (n=20), СКВ (n=32) и РС (n=30). Препараты IgG выделены методом аффинной хроматографии из сыворотки крови. Для анализа пептидазной активности препаратов IgG использовали четыре флуоресцентномеченых пептида, представляющих собой фрагменты функционально важных участков BDNF и GDNF, которые участвуют в связывании со специфическими рецепторами. Уровень относительной активности препаратов IgG определяли методом тонкослойной хроматографии. Результаты. Показано, что препараты IgG пациентов эффективно гидролизовали все анализируемые пептиды. Уровень гидролиза всех четырех пептидов препаратами IgG пациентов с шизофренией, РС и СКВ статистически значимо (p function show_abstract() { $('#abstract1').hide(); $('#abstract2').show(); $('#abstract_expand').hide(); }
Шизофрения, рассеянный склероз, системная красная волчанка, bdnf, gdnf, нейротрофический фактор, каталитические антитела
Короткий адрес: https://sciup.org/142237374
IDR: 142237374 | УДК: 66.094.941-543.645.6:57.083.34-82-486:616.895.8:616 | DOI: 10.26617/1810-3111-2022-4(117)-5-13
Текст научной статьи Анализ гидролиза пептидов функционально важных участков мозгового и глиального нейротрофических факторов антителами больных шизофренией и другими нейроиммунными заболеваниями
Мозговой нейротрофический фактор (от англ. Brain-Derived Neurotrophic Factor – BDNF) и глиальный нейротрофический фактор (Glial cell line-derived neurotrophic factor – GDNF) относятся к семейству белков, поддерживающих развитие и жизнеспособность нейронов [1, 2]. BDNF – один из основных нейротрофических факторов, регулирующих выживание, дифференцировку, рост и адаптацию нейрональных клеток к внешним воздействиям [3, 4]. BDNF регулирует процессы нейропластичности, совокупные с обучением и памятью, а изменение его экспрессии связано со многими патологиями, в том числе с шизофренией [5].
В литературе приводятся данные, что GDNF, так же как и BDNF, участвует в процессе эмбриогенеза и способствует выживанию разных популяций нейронов [6]. GDNF обладает нейропротективными свойствами и защищает дофаминергические нейроны [3]. Активированная микроглия продуцирует GDNF, способствуя снижению нейровоспаления [7]. Кроме того, GDNF принимает участие в синаптогенезе в гиппокампе [8].
BDNF и GDNF имеют аналогичное строение и представляют собой гомодимеры в зрелой форме [1, 2]. В структуре BDNF выделяют шпилькообразные петли 1, 2 и 4 и удлиненную петлю 3 [9]. Основную роль во взаимодействии BDNF со специфическими рецепторами TrkB и p75 играют петли 2 и 4: петля 2 взаимодействует с TrkB, а петля 4 – с рецептором p75 [10, 11]. В молекуле GDNF первые 39 N-концевых аминокислот функционально неактивны [6]. Напротив, С-концевой участок GDNF имеет решающее значение для стабилизации и биологической активности. В этом участке молекулы расположены в определенной последовательности, формируют специфические области «палец 1» и «палец 2», взаимодействующие с рецептором GFRα1 [12, 13].
Изменение уровней и функциональной активности BDNF и GDNF ассоциировано со множеством патологий, в том числе с нейро-иммунными заболеваниями [14]. Эти заболевания затрагивают как центральную нервную систему (ЦНС), так и иммунную систему, но отличаются по степени вовлеченности этих систем организма в патологический процесс [15]. К нейроиммунным заболеваниям относится шизофрения, поскольку изменения в периферической иммунной системе способствуют дисфункции ЦНС [16, 17, 18]. Нейровоспаление при шизофрении связано с когнитивными и нейроанатомическими изменениями и считается важным компонентом патогенеза заболевания [16]. Рассеянный склероз (РС) и системная красная волчанка (СКВ) относятся к нейроим-мунным заболеваниям. РС представляет собой специфическое аутоиммунное заболевание ЦНС, сопровождающееся выраженным нейровоспалением и демиелинизацией [19]. СКВ также сопровождается воспалением и связана с аутоиммунным поражением преимущественно соединительной ткани [20]. Однако до 75% взрослых и детей с СКВ могут демонстрировать симптомы поражения ЦНС на определенных этапах заболевания [20].
Таким образом, при шизофрении происходят воспалительные изменения в ЦНС, РС связан с аутоиммунным поражением ЦНС, а при СКВ иммунная дисфункция способствует вторичному повреждению тканей мозга. Сравнение таких разных нейроиммунных патологий в рамках одного экспериментального исследования может позволить выявить характерные особенности каждого из заболеваний, которые было бы невозможно обнаружить при сравнении со здоровыми лицами.
Нейроиммунные заболевания сопровождаются изменениями уровней BDNF и GDNF в крови пациентов. Результаты метаанализа указывают на снижение концентрации BDNF в крови пациентов с шизофренией по сравнению со здоровыми донорами [21]. Причем снижение наблюдалось как у пациентов с первым психотическим эпизодом, так и у больных, получающих терапию. Недавний метаанализ результатов 13 исследований выявил значительное снижение концентрации BDNF в сыворот-ке/плазме при РС [22]. Также встречаются данные о снижении концентрации BDNF при СКВ [23]. В то время как изменения концентраций GDNF при нейроиммунных заболеваниях исследованы в меньшей степени. Опубликованы данные о снижении GDNF в крови у пациентов с первым психотическим эпизодом и у хронических больных шизофренией [24, 25]. Исследования GDNF при СКВ малочисленны. Так, в одной работе показано снижение концентрации GDNF у пациентов [26], в другой, напротив, выявлено увеличение концентрации [27]. Литературные данные об изменении концентрации GDNF в крови при РС отсутствуют. Таким образом, ряд исследований указывают на снижение концентрации BDNF и GDNF при некоторых нейроиммунных заболеваниях, особенно при шизофрении.
Снижение концентрации нейротрофических факторов может быть связано с уменьшением их образования или интенсивным распадом. Разрушение нейротрофических факторов может происходить под действием протеолитических ферментов. Сравнительно недавно нами обнаружено, что некоторые аутоантитела проявляют протеолитические свойства [28]. Мы выдвинули гипотезу о том, что такие каталитические антитела могут разрушать нейротрофические факторы при нейроиммунных заболеваниях. Первым примером каталитических антител были IgG, гидролизующие вазоактивный интестинальный пептид (ВИП) [29].
Продемонстрировано, что ВИП продуцируется в различных тканях, включая центральную и периферическую нервную систему, и выполняет функцию нейротрансмиттрера, нейромодулятора и цитокина [30]. BDNF и GDNF также выполняют сигнальные и трофические функции. В связи с этим вполне вероятно, что при нейроиммунных заболеваниях образуются антитела, гидролизующие BDNF и GDNF.
ЦЕЛЬ ИССЛЕДОВАНИЯ
Проанализировать уровень гидролиза пептидов из функционально важных участков BDNF и GDNF антителами больных шизофренией и другими нейроиммунными заболеваниями, такими как РС и СКВ.
Цель сформулирована, исходя из выдвинутой нами гипотезы, что IgG с протеолитическими свойствами при шизофрении и других нейроиммунных заболеваниях способны гидролизовать BDNF и GDNF. Однако из-за дороговизны высокоочищенных нейротрофических факторов человека и необходимости больших количеств этих белков для анализа было принято решение провести скрининг антител и проанализировать гидролиз не полных молекул белков, а функционально важных пептидных фрагментов BDNF и GDNF.
МАТЕРИАЛЫ И МЕТОДЫ
В общую (n=112) выборку исследования вошли 30 здоровых добровольцев, а также пациенты с установленными по МКБ-10 диагнозами: параноидная шизофрения (F20.0) ‒ n=20, СКВ (М32) ‒ n=32, РС (G35) ‒ n=30. От каждого участника было получено добровольное информированное согласие на участие в эксперименте. Отбор пациентов с шизофренией проводился в отделении эндогенных расстройств НИИ психического здоровья Томского НИМЦ (Томск). Отбор здоровых доноров и больных СКВ выполнен в НИИ фундаментальной и клинической иммунологии (Новосибирск). Отбор больных РС организован на базе Областного центра неврологии и нейрохирургии Новосибирской областной больницы (Новосибирск). Средний возраст обследованных не имел статистически значимых (р>0,05) различий: здоровые доноры ‒ 36,8±11,2 года, больные шизофренией – 40,0±11,3 года, пациенты с СКВ – 39,1±13,4 года, пациенты с РС – 34,8±12,6 года. У большинства (n=13, 65%) пациентов с шизофренией превалирующая негативная симптоматика встречалась чаще, чем позитивная симптоматика (n=7; 36%). Пациенты с СКВ в основном находились в активной стадии заболевания, средний индекс SELENA-SLEDAI составил 6,5±3,4 балла. Половина пациентов с РС имели рецидивирующе-ремиттирующий рассеянный склероз (РРРС), другая половина – первично-прогрессирующий рассеянный склероз (ППРС). Группы здоровых доноров, больных шизофренией и РС имели сопоставимое соотношение мужчин и женщин, но в группе больных СКВ превалировали женщины (87,5%).
Для забора венозной крови натощак применяли вакуумные пробирки Vacuette (Greiner Bio-One, Австрия) с активаторами свертывания. Полученную после центрифугирования сыворотку крови использовали для анализа.
Для выделения IgG из сыворотки крови применяли метод аффинной хроматографии, описанный ранее [31]. Многократно показано, что этот метод позволяет получать гомогенные препараты IgG, не содержащие примесей других белков и ферментов. Полученные препараты IgG использовали для анализа пептидазной активности, а в качестве субстратов для анализа пептидазной активности ‒ флуоресцентно меченые (по N-концу 5-карбоксифлуоресцеином ‒ 5-FAM) пептиды функционально важных участков BDNF и GDNF. В таблице 1 представлены описание и биологическая роль пептидов.
Т аблица 1. Описание пептидов ‒ фрагментов нейротрофических факторов, использованных в работе
|
Нейротрофический фактор |
Название пептида |
Последовательность аминокислот (АК) |
Число АК |
Описание и биологическая роль пептида |
|
BDNF |
L2 |
T V L E K V P V S K G Q L K Q Y F Y E T K |
21 |
Фрагмент петли 2 BDNF, которая взаимодействует с рецептором TrkB |
|
L4 |
R A L T M D S K K R I G W R F I R I D T |
20 |
Фрагмент петли 4 BDNF, которая взаимодействует с рецептором p75 |
|
|
GDNF |
Gf1 |
E T K E E L I F R Y C S G S C D A A E T |
20 |
Фрагмент области «палец 1» молекулы GDNF, которая взаимодействует с рецептором GFRα1 |
|
Gf2 |
A F D D D L S F L D D N L V Y H I L R K H |
21 |
Фрагмент области «палец 2» молекулы GDNF, которая взаимодействует с рецептором GFRα1 |
Для BDNF использовали два пептида ‒ L2 и L4, представляющие собой фрагменты петли 2 и петли 4, взаимодействующие с TrkB или p75 рецепторами [9, 10, 11]. В случае GDNF так же применяли два пептида ‒ Gf1 и Gf2, представляющие собой фрагменты области «палец 1» или «палец 2», взаимодействующие с рецептором GFRα1 [12, 13]. Пептиды синтезированы и очищены (компания Biomatik, Онтарио, Канада).
Реакционная смесь объемом 10 мкл содержала следующие компоненты: 50 мМ Tris-HCl pH 7,5, 30 мМ NaCl и 0,1 мМ одного из исследуемых олигопептидов (табл. 1), растворенных в диметилсульфоксиде и 0,4 мг/мл (2,7 мМ) IgG. Трипсин, α-химотрипсин и протеиназу К использовали в качестве положительного контроля в конечной концентрации: 120 U/мл, 0,5 U/мл и 0,5 U/мл соответственно. Реакционную смесь, не содержащую антител или протеаз, использовали в качестве отрицательного контроля. Реакцию гидролиза проводили в термостате при 37°С в течение 15 минут (для реакций с протеазами) или 20 часов (для реакций с антителами). Для анализа продуктов гидролиза олигопептидов использовали метод тонкослойной хроматографии (ТСХ) в соответствии с представленным описанием [32]. Реакционные смеси (2 мкл) наносили на пластины TLC Silica gel 60 F254 с алюминиевой подложкой (Merck, Германия). Для разделения продуктов использовали хроматографическую смесь, состоящую из уксусной кислоты, n-бутанола, ddH2O в соотношении 1:4:5. Затем пластины высушивали и оценивали флуоресценцию (Abs λmax=495 нм, Em λmax=520 нм) на лазерном сканере (Amersham TyphoonTM, Cytiva, Германия).
Полученные хроматограммы анализировали в программе ImageQuant 5.2 (Molecular Dynamics, США). Относительную пептидазную активность препаратов IgG определяли из соотношения интенсивности исходного пятна пептида к интенсивности продуктов гидролиза. За 100% принимали полный гидролиз пептида. Статистический анализ проводили в программе Origin 2019b (OriginLab, США). Для оценки значимости различий использовали критерий Манна–Уитни, поскольку данные не подчинялись нормальному закону распределения.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
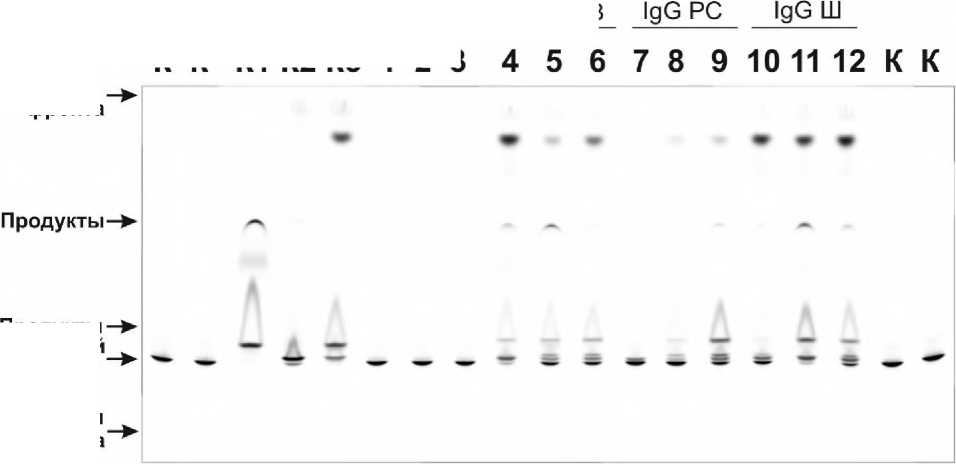
На рисунке 1 представлен пример результатов анализа ТСХ гидролиза пептида L2 препаратами IgG здоровых доноров, больных СКВ, РС и шизофренией. Продукты гидролиза, образующиеся под действием протеаз и антител, отличаются, но некоторые из них имеют сходство (рис. 1). Антитела здоровых доноров практически не обладали активностью, а эффективность гидролиза под действием IgG пациентов различается. Аналогичные результаты получены с использованием других пептидов .
Протеазы IgG здор.
IgG СКВ
К К К1 К2 КЗ 1 2 3
Линия фронта
Продукты Исходный субстрат
Линия старта
Рисунок 1. Анализ продуктов гидролиза пептида L2 препаратами IgG здоровых доноров, больных системной красной волчанкой, рассеянным склерозом и шизофренией методом тонкослойной хроматографии
П р и м е ч а н и е. ДорК – отрицательный контроль, дорК1 – α-химотрипсин, дорК2 – протеиназа К, дорК3 – трипсин, дор1, дор2, дор3 – IgG здоровых доноров, дор4, дор5, дор6 – IgG больных системной красной волчанкой, дор7, дор8, дор9 – IgG больных рассеянным склерозом, дор10, дор11, дор12 – IgG больных шизофренией.
На рисунке 2 представлены результаты анализа относительной пептидазной активности (%) препаратов IgG больных СКВ, РС, шизофренией и здоровых доноров. Показано, что уровень гидролиза всех четырех пептидов препаратами IgG пациентов с СКВ, РС и шизофренией статистически значимо выше, чем у здоровых доноров. Однако в случае гидролиза пептида Gf2 препаратами IgG больных шизофренией не обнаружено статистически значимых различий в уровне гидролиза по сравнению со здоровыми донорами (рис. 2 Г).
Пептиды L2, L4 и Gf1 наиболее эффективно (по медианным значениям) гидролизовались препаратами IgG больных шизофренией и хуже всего – препаратами IgG пациентов с РС. В то время как пептид Gf2 лучше всего гидролизовался препаратами IgG больных РС и хуже всего – антителами больных шизофренией. Таким образом, эффективность IgG-зависимого гидролиза различается в зависимости от пептида и заболевания, что указывает на различную специфичность антител при нейроиммунных заболеваниях.
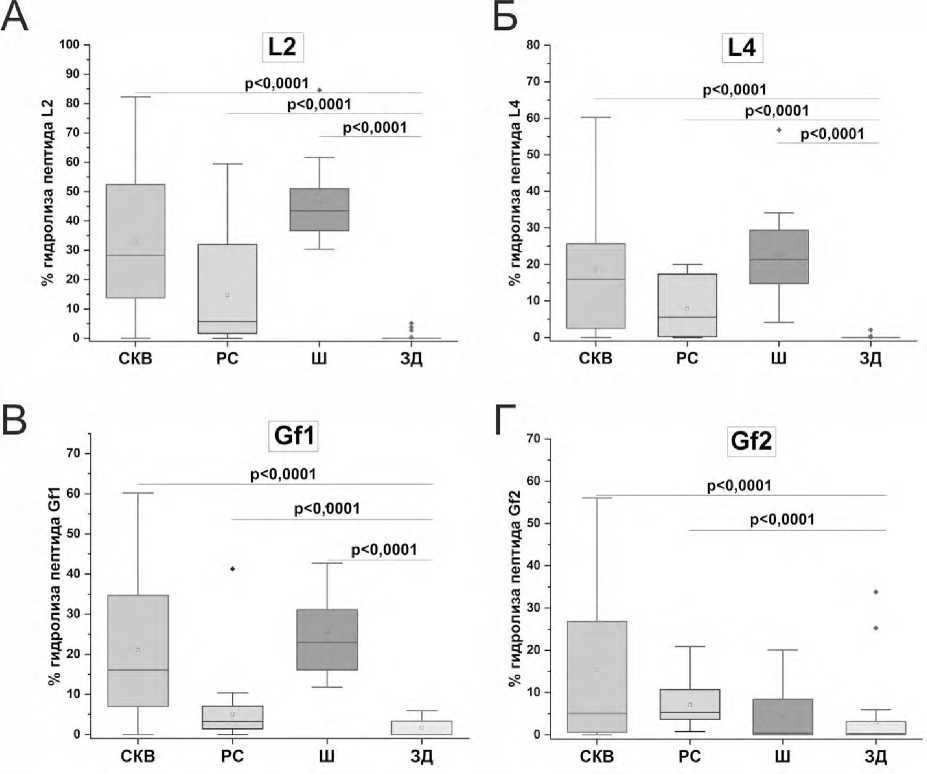
Р и с у н о к 2. Относительная пептидазная активность (%) препаратов IgG больных системной красной волчанкой, рассеянным склерозом, шизофренией и здоровых доноров в реакции гидролиза пептидов L2 (А), L4 (Б), Gf1 (В), Gf2 (Г)
П р и м е ч а н и е. За 100% принят полный гидролиз пептида. Статистическая значимость различий рассчитана с использованием критерия Манна–Уитни.
Уровень относительной пептидазной активности в гидролизе четырех пептидов статистически значимо (p<0,01) отличался при трех нейроиммунных заболеваниях. Однако не выявлено статистически значимых (р>0,05) различий между уровнями гидролиза L4 препарата- ми IgG при СКВ и шизофрении, а также IgG при СКВ и РС. Отсутствовали статистически значимые (р>0,05) различия между уровнями гидролиза пептида Gf1 препаратами IgG больных СКВ и шизофренией, а также уровнями гидролиза Gf2 антителами больных СКВ и РС.
Таким образом, в результате проведенного анализа выявлено, что препараты IgG пациентов эффективно гидролизовали пептиды L2, L4, Gf1 и Gf2. При этом препараты IgG больных шизофренией обладали наибольшей активностью в гидролизе пептидов L2, L4 и Gf1 по сравнению с IgG при РС и СКВ. Полученные данные указывают на то, что при исследуемых нейроим-мунных заболеваниях образуются каталитические антитела, специфически распознающие и гидролизующие пептиды BDNF и GDNF. Однако в дальнейшем эффекты каталитических антител необходимо проверить на полноразмерных молекулах нейротрофических факторов.
ЗАКЛЮЧЕНИЕ
По итоговым материалам работы впервые показано, что IgG при нейроиммунных заболеваниях гидролизуют пептиды BDNF и GDNF. Учитывая, что используемые в работе пептиды представляют собой фрагменты функционально важных участков BDNF и GDNF, гидролиз этих участков антителами может нарушать функционирование этих нейротрофических факторов. Также можно предположить, что образующиеся антитела гидролизуют и другие участки молекул нейротрофических факторов. Снижение уровней BDNF и GDNF при некоторых нейроиммунных заболеваниях [21, 22, 24, 26] может частично объясняться воздействием каталитических антител. Аутоантитела к цитокинам и ростовым факторам обнаружены как у здоровых доноров (низкий титр), так и у пациентов с аутоиммунными заболеваниями (высокий титр) [33, 34]. Считается, что такие аутоантитела регулируют избыточную экспрессию цитокинов. Возможно сделать предположение, что антитела к нейротрофическим факторам при нейроиммунных заболеваниях образуются схожим образом и выполняют аналогичные функции. Полученные данные дополняют и расширяют наши представления о неканонических свойствах иммуноглобулинов и разнообразии функциональных возможностей этих молекул [28].
Список литературы Анализ гидролиза пептидов функционально важных участков мозгового и глиального нейротрофических факторов антителами больных шизофренией и другими нейроиммунными заболеваниями
- Benarroch EE. Brain-derived neurotrophic factor: Regulation, effects, and potential clinical relevance. Neurology. 2015 Apr 21;84(16):1693-704. doi: 10.1212/WNL.0000000000001507. Epub 2015 Mar 27. PMID: 25817841.
- Airaksinen MS, Saarma M. The GDNF family: signalling, biological functions and therapeutic val-ue. Nat Rev Neurosci. 2002 May;3(5):383-94. doi: 10.1038/nrn812. PMID: 11988777.
- Попова Н.К., Ильчибаева Т.В., Науменко В.С. Нейротрофические факторы (BDNF, GDNF) и серотонинергическая система мозга (обзор). Био-химия. 2017. Т. 82, № 3. С. 449-459. Popova NK, Ilchibaeva TV, Naumenko VS. Neurotrophic factors (BDNF, GDNF) and the serotonergic system of the brain overview. Biochemistry (Mosc). 2017; 82(3):449-459. doi: 10.1134/S0006297917030099 (in Russian).
- Михалицкая Е.В., Левчук Л.А. Нейропластич-ность мозга: мозговой нейротрофический фактор и протеинкиназные сигнальные пути (обзор ли-тературы). Сибирский вестник психиатрии и наркологии. 2022. № 3 (116). С. 44-53. Mikha-litskaya EV, Levchuk LA. Brain neuroplasticity: brain-derived neurotrophic factor and protein kinase signaling pathways (literature review). Siberian Her-ald of Psychiatry and Addiction Psychiatry. 2022; 3(116):44-53. https://doi.org/10.26617/1810-3111-2022-3(116)-44-53 (in Russian).
- Miranda M, Morici JF, Zanoni MB, Bekinschtein P. Brain-Derived Neurotrophic Factor: A Key Mole-cule for Memory in the Healthy and the Pathologi-cal Brain. Front Cell Neurosci. 2019 Aug 7;13:363. doi: 10.3389/fncel.2019.00363. PMID: 31440144; PMCID: PMC6692714.
- Шишкина Т.В., Ведунова М.В., Мищенко Т.А., Мухина И.В. Роль глиального нейротрофическо-го фактора в функционировании нервной систе-мы (обзор). Современные технологии в меди-цине. 2015. Т. 7, № 4, С. 211-220. Shishkina TV, Vedunova MV, Mishchenko TA, Mukhina IV. The role of glial neurotrophic factor in the functioning of the nervous system. Modern Technologies in Medi-cine. 2015;7(4):211-220 (in Russian).
- Rocha SM, Cristovão AC, Campos FL, Fonseca CP, Baltazar G. Astrocyte-derived GDNF is a po-tent inhibitor of microglial activation. Neurobiol Dis. 2012 Sep;47(3):407-15. doi: 10.1016/j.nbd.2012.04.014. Epub 2012 May 3. PMID: 22579772.
- Ledda F, Paratcha G, Sandoval-Guzmán T, Ibáñez CF. GDNF and GFRalpha1 promote formation of neuronal synapses by ligand-induced cell adhesion. Nat Neurosci. 2007 Mar;10(3):293-300. doi: 10.1038/nn1855. Epub 2007 Feb 18. PMID: 17310246.
- Гудашева Т.А., Поварнина П., Тарасюк А.В., Середин С.Б. Мозговой нейротрофический фак-тор и его низкомолекулярные миметики. Фар-макокинетика и фармакодинамика. 2017. № 3. С. 3-13. Gudasheva TA, Povarnina P, Tarasiuk AV, Seredenin SB. Brain-derived neurotrophic factor and its small molecular weight mimetics. Pharma-cokinetics and Pharmacodynamics. 2017;3:3-13 (in Russian).
- Ibáñez CF, Ilag LL, Murray-Rust J, Persson H. An extended surface of binding to Trk tyrosine kinase receptors in NGF and BDNF allows the engineering of a multifunctional pan-neurotrophin. EMBO J. 1993 Jun;12(6):2281-93. doi: 10.1002/j.1460-2075.1993.tb05882.x. PMID: 8508763; PMCID: PMC413458.
- Rydén M, Murray-Rust J, Glass D, Ilag LL, Trupp M, Yancopoulos GD, McDonald NQ, Ibáñez CF. Functional analysis of mutant neurotrophins defi-cient in low-affinity binding reveals a role for p75LNGFR in NT-4 signalling. EMBO J. 1995 May 1;14(9):1979-90. doi: 10.1002/j.1460-2075.1995.tb07190.x. PMID: 7744005; PMCID: PMC398297.
- Chen ZY, He ZY, He C, Lu CL, Wu XF. Human glial cell-line-derived neurotrophic factor: a struc-ture-function analysis. Biochem Biophys Res Commun. 2000 Feb 24;268(3):692-6. doi: 10.1006/bbrc.2000.2196. PMID: 10679267.
- Parkash V, Leppänen VM, Virtanen H, Jurvansuu JM, Bespalov MM, Sidorova YA, Runeberg-Roos P, Saarma M, Goldman A. The structure of the glial cell line-derived neurotrophic factor-coreceptor complex: insights into RET signaling and heparin binding. J Biol Chem. 2008 Dec 12;283(50):35164-72. doi: 10.1074/jbc.M802543200. Epub 2008 Oct 8. PMID: 18845535; PMCID: PMC3259885.
- Левчук Л.А., Вялова Н.М., Михалицкая Е.В., Семкина А.А., Иванова С.А. Роль BDNF в пато-генезе неврологических и психических рас-стройств. Современные проблемы науки и обра-зования. 2018. № 6. С. 58. Levchuk LA, Vyalova NM, Mikhalitskaya EV, Semkina AA, Ivanova SA. The role of BDNF in the pathogenesis of neurologi-cal and mental disorders. Modern Problems of Sci-ence and Education. 2018:6:58. doi: 10.17513/spno.28267 (in Russian).
- Wells E, Hacohen Y, Waldman A, Tillema JM, Soldatos A, Ances B, Benseler S, Bielekova B, Dale RC, Dalmau J, Gaillard W, Gorman M, Greenberg B, Hyslop A, Pardo CA, Tasker RC, Yeh EA, Bar-Or A, Pittock S, Vanderver A, Ban-well B; attendees of the International Neuroimmune Meeting. Neuroimmune disorders of the central nervous system in children in the molecular era. Nat Rev Neurol. 2018 Jul;14(7):433-445. doi: 10.1038/s41582-018-0024-9. Erratum in: Nat Rev Neurol. 2018 Dec;14(12):749. PMID: 29925924.
- Ermakov EA, Melamud MM, Buneva VN, Ivanova SA. Immune System Abnormalities in Schizophre-nia: An Integrative View and Translational Per-spectives. Front Psychiatry. 2022 Apr 25;13:880568. doi: 10.3389/fpsyt.2022.880568. PMID: 35546942; PMCID: PMC9082498.
- Лобачева О.А., Ветлугина Т.П., Корнетова Е.Г., Семке А.В. Иммуноэндокринные нарушения у больных шизофренией в процессе антипсихоти-чеcкой терапии. Российский иммунологический журнал. 2019. Т. 13, № 2-1 (22). С. 374-376. Loba-cheva OA, Vetlugina TP, Kornetova EG, Semke AV. Immunoendocrine disorders in patients with schizophrenia during antipsychotic therapy. Russian Immunological Journal. 2019;13,2-1 (22):374-376 DOI: 10.31857/S102872210006632-0 (in Russian).
- Mednova IA, Boiko AS, Kornetova EG, Semke AV, Bokhan NA, Ivanova SA. Cytokines as Poten-tial Biomarkers of Clinical Characteristics of Schizophrenia. Life. 2022;12:1972. https://doi.org/10.3390/life12121972.
- Koudriavtseva T, Mainero C. Neuroinflammation, neurodegeneration and regeneration in multiple scle-rosis: intercorrelated manifestations of the immune response. Neural Regen Res. 2016 Nov;11(11):1727-1730. doi: 10.4103/1673-5374.194804. PMID: 28123401; PMCID: PMC5204213.
- Jeltsch-David H, Muller S. Neuropsychiatric sys-temic lupus erythematosus: pathogenesis and bi-omarkers. Nat Rev Neurol. 2014 Oct;10(10):579-96. doi: 10.1038/nrneurol.2014.148. Epub 2014 Sep 9. PMID: 25201240.
- Green MJ, Matheson SL, Shepherd A, Weickert CS, Carr VJ. Brain-derived neurotrophic factor levels in schizophrenia: a systematic review with meta-analysis. Mol Psychiatry. 2011 Sep;16(9):960-72. doi: 10.1038/mp.2010.88. Epub 2010 Aug 24. PMID: 20733577.
- Karimi N, Ashourizadeh H, Akbarzadeh Pasha B, Haghshomar M, Jouzdani T, Shobeiri P, Teixeira AL, Rezaei N. Blood levels of brain-derived neu-rotrophic factor (BDNF) in people with multiple sclerosis (MS): A systematic review and meta-analysis. Mult Scler Relat Disord. 2022;65:103984. doi: 10.1016/j.msard.2022.103984
- Baba O, Kisaoglu H, Bilginer C, Ozkaya E, Kalyoncu M. Depression, anxiety, and sleep quality in childhood onset systemic lupus erythematosus and relationship with brain-derived neurotrophic factor. Lupus. 2022 Nov;31(13):1630-1638. doi: 10.1177/09612033221127901. Epub 2022 Sep 16. PMID: 36114161.
- Xiao W, Ye F, Liu C, Tang X, Li J, Dong H, Sha W, Zhang X. Cognitive impairment in first-episode drug-naïve patients with schizophrenia: Relation-ships with serum concentrations of brain-derived neurotrophic factor and glial cell line-derived neu-rotrophic factor. Prog Neuropsychopharmacol Biol Psychiatry. 2017 Jun 2;76:163-168. doi: 10.1016/j.pnpbp.2017.03.013. Epub 2017 Mar 22. PMID: 28342945.
- Tunca Z, Kıvırcık Akdede B, Özerdem A, Alkın T, Polat S, Ceylan D, Bayın M, Cengizçetin Kocuk N, Şimşek S, Resmi H, Akan P. Diverse glial cell line-derived neurotrophic factor (GDNF) support be-tween mania and schizophrenia: a comparative study in four major psychiatric disorders. Eur Psychiatry. 2015 Feb;30(2):198-204. doi: 10.1016/j.eurpsy.2014.11.003. Epub 2014 Dec 24. PMID: 25543333.
- Dias AFMP, Lanna CCD, Teixeira AL, Ferreira GA. Neurotrophic factors in systemic lupus ery-thematosus: markers of disease activity. Clin Exp Rheumatol. 2021 Nov-Dec;39(6):1451-1452. doi: 10.55563/clinexprheumatol/7ncg6y. Epub 2021 Jun 8. PMID: 34128803.
- Bauer JW, Baechler EC, Petri M, Batliwalla FM, Crawford D, Ortmann WA, Espe KJ, Li W, Patel DD, Gregersen PK, Behrens TW. Elevated serum levels of interferon-regulated chemokines are bi-omarkers for active human systemic lupus erythe-matosus. PLoS Med. 2006 Dec;3(12):e491. doi: 10.1371/journal.pmed.0030491. PMID: 17177599; PMCID: PMC1702557.
- Ermakov EA, Nevinsky GA, Buneva VN. Immu-noglobulins with Non-Canonical Functions in In-flammatory and Autoimmune Disease States. Int J Mol Sci. 2020 Jul 29;21(15):5392. doi: 10.3390/ijms21155392. PMID: 32751323; PMCID: PMC7432551.
- Paul S, Volle DJ, Beach CM, Johnson DR, Powell MJ, Massey RJ. Catalytic hydrolysis of vasoactive intestinal peptide by human autoantibody. Science. 1989 Jun 9;244(4909):1158-62. doi: 10.1126/science.2727702. PMID: 2727702.
- Delgado M, Pozo D, Ganea D. The significance of vasoactive intestinal peptide in immunomodulation. Pharmacol Rev. 2004 Jun;56(2):249-90. doi: 10.1124/pr.56.2.7. PMID: 15169929.
- Ermakov EA, Parshukova DA, Nevinsky GA, Bune-va VN. Natural Catalytic IgGs Hydrolyzing Histones in Schizophrenia: Are They the Link between Hu-moral Immunity and Inflammation? Int J Mol Sci. 2020 Sep 30;21(19):7238. doi: 10.3390/ijms21197238. PMID: 33008051; PMCID: PMC7582518.
- Parshukova D, Smirnova LP, Ermakov EA, Bokhan NA, Semke AV, Ivanova SA, Buneva VN, Ne-vinsky GA. Autoimmunity and immune system dysregulation in schizophrenia: IgGs from sera of patients hydrolyze myelin basic protein. J Mol Recognit. 2019 Feb;32(2):e2759. doi: 10.1002/jmr.2759. Epub 2018 Aug 15. PMID: 30112774.
- Howe HS, Leung BPL. Anti-Cytokine Autoanti-bodies in Systemic Lupus Erythematosus. Cells. 2019 Dec 27;9(1):72. doi: 10.3390/cells9010072. PMID: 31892200; PMCID: PMC7016754.
- Meager A, Wadhwa M. Detection of anti-cytokine antibodies and their clinical relevance. Expert Rev Clin Immunol. 2014 Aug;10(8):1029-47. doi: 10.1586/1744666X.2014.918848. Epub 2014 Jun 5. PMID: 24898469.


