Анализ экспрессии CD3, CD68, CD163 и СК-19 в тимусах детей неонатального периода при инфекционных заболеваниях
Автор: Мудрак Д.А., Маслякова Г.Н.
Журнал: Саратовский научно-медицинский журнал @ssmj
Рубрика: Патологическая анатомия
Статья в выпуске: 3 т.20, 2024 года.
Бесплатный доступ
Цель: выявить особенности экспрессии иммуногистохимических маркеров CD3, CD68, CD163 и СК-19 в клетках тимусов детей неонатального периода с увеличенным тимусом, умерших от инфекционных заболеваний. Материал и методы. Материалом исследования послужил аутопсийный материал детей раннего и позднего неонатальных периодов (n=33), умерших в медицинских стационарах г. Саратова. Причинами смерти детей явились пневмония (n=17), сепсис (n=16). Морфологический материал разделен на две группы: 1-я группа (сравнения) - дети, масса вилочковой железы которых соответствовала возрастной норме (n=19); 2-я группа (исследуемая) - дети, масса тимуса которых превышала возрастную норму (n=14). В исследовании оценивали экспрессию следующих маркеров: CD3, CD68, CD163 и СК-19.
Тимус, инфекционные болезни, иммуногистохимия, cd3, cd68, cd163, ck-19
Короткий адрес: https://sciup.org/149146950
IDR: 149146950 | УДК: 616-091.5:612.438 | DOI: 10.15275/ssmj2003327
Текст научной статьи Анализ экспрессии CD3, CD68, CD163 и СК-19 в тимусах детей неонатального периода при инфекционных заболеваниях
EDN: JJBNBM
звена иммунитета — наличие оптимальных условий для созревания Т-клеток, мигрирующих из костного мозга в корковом слое вилочковой железы.
Под воздействием инфекций, врожденных пороков развития и других факторов наблюдаются нарушения функционирования тимуса [1]. Эти нарушения имеют наибольшее значение в детском возрасте, особенно в период младенчества (от рождения до 1 года), так как в это время ребенок более подвержен воздействию неблагоприятных факторов ввиду функциональной несовершенности ряда органов и систем [2].
Кроме Т-лимфоцитов, в вилочковой железе встречаются также В-лимфоциты, плазматические клетки, эозинофилы, нейтрофилы, гистиоциты, тучные клетки [3]. Среди популяций лимфоцитов обнаружены гемопоэтические предшественники CD117+, CD3+, CD4+ и CD8+ Т-клетки [4]. Правильная дифференцировка лимфоцитов тимуса напрямую зависит от микроокружения Т-клеток в вилочковой железе. Макрофаги презентируют антиген Т-лимфоцитам. При адекватном взаимодействии антигенпрезентирующей клетки и лимфоцита начинается антигензависимый иммунный ответ [5]. В литературе имеются данные о том, что увеличение тимуса является фактором риска развития осложнений у детей с инфекционными заболеваниями [6]. Однако в настоящее время не сложилось единого мнения относительно оценки этого симптома.
Сегодня остается недостаточно изученным вопрос морфологии тимуса в условиях увеличения ее массы при различных заболеваниях. Исходя из этого была обозначена цель нашего исследования.
Цель — выявить особенности экспрессии иммуногистохимических (ИГХ) маркеров CD3, CD68, CD163 и СК-19 в клетках тимусов детей неонатального периода с увеличенным тимусом, умерших от инфекционных заболеваний.
Материал и методы. Материалом исследования послужил аутопсийный материал детей неонатального периода ( n =33), умерших в медицинских стационарах г. Саратова. Причинами смерти детей явились пневмония ( n =17), сепсис ( n =16). Морфологический материал был разделен на две группы: 1-я группа (сравнения) — от детей, масса вилочковой железы которых соответствовала возрастной норме ( n =19); 2-я группа (исследуемая) — от детей, масса тимуса которых превышала возрастную норму ( n =14). Превышение возрастной нормы массы тимуса оценивали по центильным таблицам значений тимического индекса [6].
Полученный материал фиксировали в 10%-м растворе формалина, после чего выполняли стандартную гистологическую проводку и заливали в парафин. Затем изготавливали срезы толщиной 4–5 мкм при помощи ротационного микротома. На полученных срезах осуществляли ИГХ-реакцию с докрашиванием гематоксилином. Морфометрический анализ проводили при помощи микровизора ЛОМО-103.
Для ИГХ-реакции использовали кроличьи антитела (АТ) к CD3 (моноклональные, разведение 1:1000, abcam, Великобритания), CD68 (поликлональные, разведение 1:100, Spring Bioscience, США), CD163 (поликлональные, разведение 1:200, Spring Bioscience, США), цитокератин-19 (СК-19) (моноклональные, разведение 1:50, DAKO, США). Окраску проводили при помощи мультимерной безбиотино-вой системы детекции Reveal — Biotin-Free Polyvalent DAB (Spring Bioscience Corp., США). Для оценки специфичности иммунного окрашивания в каждом случае производили отрицательный контроль (обработка срезов вместо первичных АТ контрольными АТ), результатом чего было отсутствие специфического иммунного окрашивания.
Реакция с АТ к CD3 произведена для оценки активности тимопоэза и выявления популяции зрелых Т-лимфоцитов. Реакция с АТ к CD68 — для выявления макрофагов, моноцитов, базофилов, тучных клеток и В-клеток. Для выделения из этой группы макрофагов и моноцитов были использованы АТ к CD163. СК-19 использовали для выявления эпителиальных клеток тимуса.
Уровень экспрессии оценивали путем подсчета доли клеток с положительной экспрессией маркера из 1000 клеток в 10 случайных полях зрения при увеличении 774.0х в процентах. Оценку производили отдельно в корковом и мозговом веществах.
Статистическую обработку данных выполняли посредством программного пакета Microsoft Excel 2010. Анализ распределения данных проведен при помощи критерия Шапиро — Уилка. Распределение отличалось от нормального. Исходя из этого оценку достоверности полученных различий производили с использованием непараметрического критерия Манна — Уитни. Для описания групп рассчитывали следующие показатели: медиану (Me), 25-й и 75-й процентили [ Q25%; Q75% ], минимум (min) и максимум (max).
Исследование одобрено комитетом по этике ФГБОУ ВО «Саратовский ГМУ» Минздрава России (протокол № 6 от 06.02.2018).
Результаты. При обзорной микроскопии обращал на себя внимание выраженный отек и полнокровие капсулы тимуса, а также некоторое увеличение количества долек в увеличенном тимусе. В большинстве случаев в 1-й группе сохранялась дифференцировка мозгового и коркового слоев. Во 2-й группе отмечалось увеличение коркового слоя, причем в некоторых дольках дифференцировка мозгового и коркового слоев была невозможна. Тимические тельца в тимусах детей 1-й группы имели классическое строение и располагались преимущественно в мозговом слое дольки, во 2-й группе отмечалось вариативное расположение телец Гассаля по всей площади дольки. Кроме того, выявлялись их признаки деградации — преобладали кистозно-деформированные тельца.
Установлено, что общее количество клеток в поле зрения в группе с увеличенной массой тимуса было больше на 28,3% в корковом слое ( р <0,001). Общее количество клеток в мозговом слое вилочковой железы достоверно не отличалось в обеих группах.
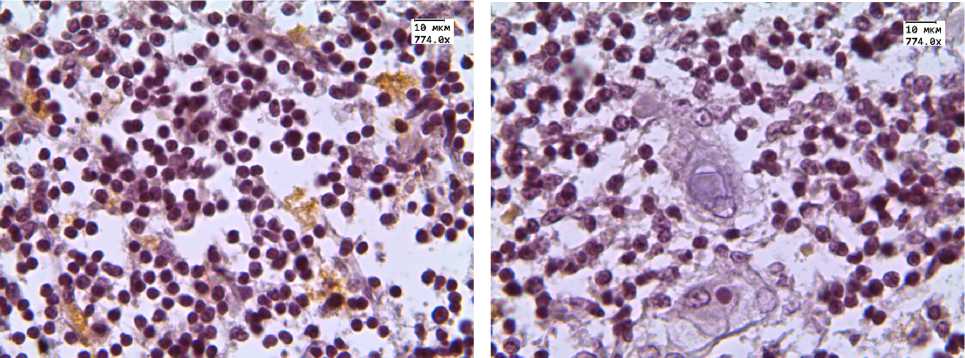
ИГХ-исследование показало, что в группе детей с увеличенным тимусом экспрессия маркера CD3 в корковом слое превышала соответствующий показатель в тимусах детей 1-й группы. Достоверных отличий в количестве данных клеток в мозговом веществе тимуса не обнаружено (табл. 1, рис. 1).
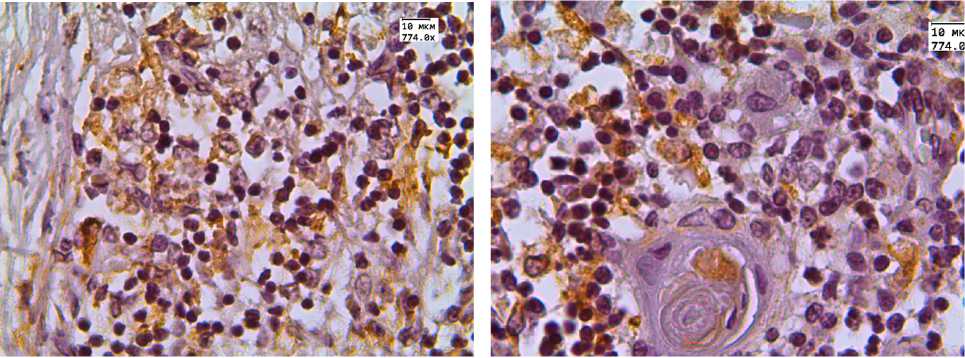
Количество клеток с положительной экспрессией ИГХ-маркера CD68 имела сходную тенденцию. Данный показатель был выше в корковом слое тимуса детей с увеличенной массой тимуса; достоверных отличий в уровне экспрессии в мозговом слое органа не установлено (табл. 1, рис. 2).
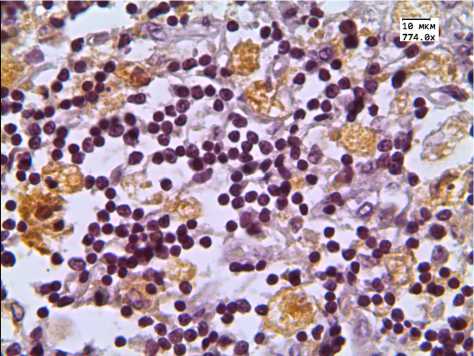
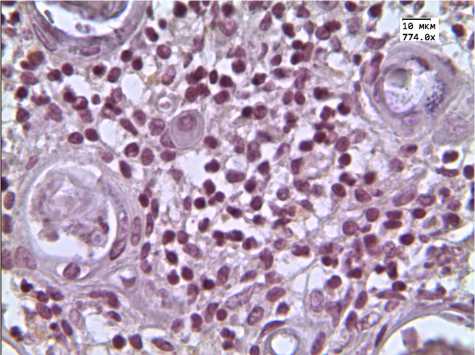
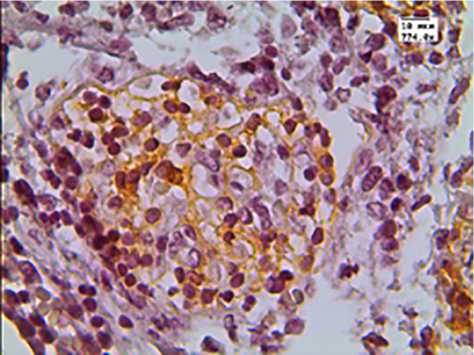
Экспрессия маркера CD163 в срезах вилочковых желез 2-й группы достоверно снижалась как в корковом, так и в мозговом слое тимуса (табл. 1, рис. 3).
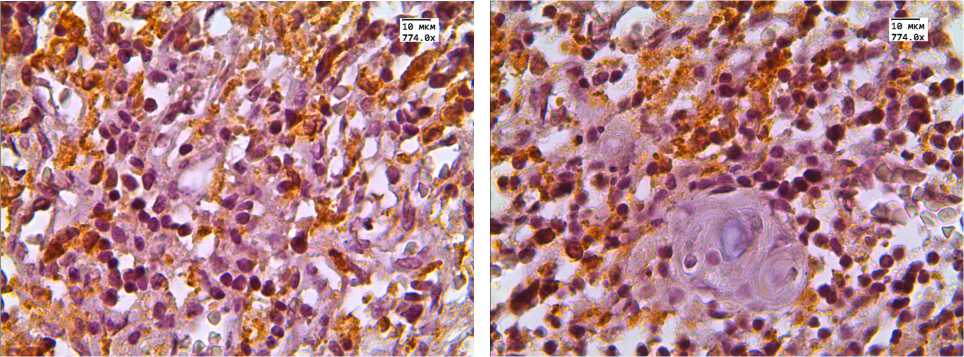
В группе детей с увеличенной массой тимуса ци-токератин-19 положительные клетки были распределены не равномерно: они располагались преимущественно в корковом веществе непосредственно у междольковых перегородок (рис. 4, б ) и не формируют сеть ни в корковом, ни в мозговом веществе (рис. 4). Доля СК-19 положительных клеток в мозговом слое достоверно не изменялась и составляла примерно 8%. В состав телец Гассаля входили клетки эпителиального происхождения с положительной экспрессией данного маркера. Доля тимических телец с положительной экспрессией СК-19 в обеих
Таблица 1
|
Локализация — слой тимуса |
Маркер |
Группа, Me [ Q 25%; Q 75%]; (min-max) |
р |
|
|
1-я |
2-я |
|||
|
CD3 |
14,2 [9,5–23,1]; (6,8–50,0) |
37,7 [36,8–41,1]; (21,1–48,4) |
0,009 |
|
|
CD68 |
4,1 [3,7–5,6]; (3,6–6,9) |
13,8 [7,3–14,3]; (3,8–21,7) |
0,001 |
|
|
Корковый |
CD163 |
25,9 [21,3–33,3]; (16,7–49,5) |
15,5 [11,3–25,0]; (6,4–30,0) |
0,005 |
|
Количество клеток |
145 [125–167]; (114–187) |
186 [170–225]; (137–253) |
<0,001 |
|
|
CD3 |
59,9 [37,4–65,1]; (29,2–76,2) |
57,7 [48,6–64,9]; (37,7–68,7) |
0,761 |
|
|
CD68 |
0 [0–2,1]; (0–3,1) |
1,52 [0–3,9]; (0–6,9) |
0,178 |
|
|
Мозговой |
CD163 |
16,7 [14,4–25,5]; (8,5–35,2) |
12,6 [12,4–13,9]; (8,4–15,8) |
0,008 |
|
Количество клеток |
120 [117–154]; (101–179) |
150 [129–167]; (121–198) |
0,286 |
|
П р и м еч а н и е . Использован непараметрический критерий Манна — Уитни, различия считали достоверными при р <0,05.
Экспрессия иммуногистохимических маркеров (%) в корковом и мозговом слоях тимуса
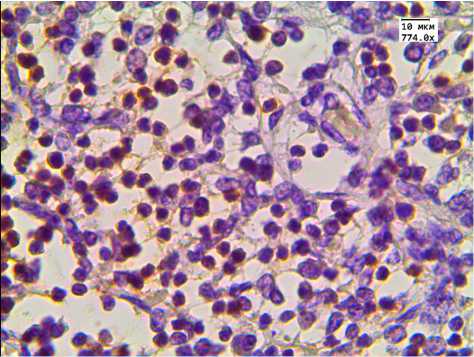
а
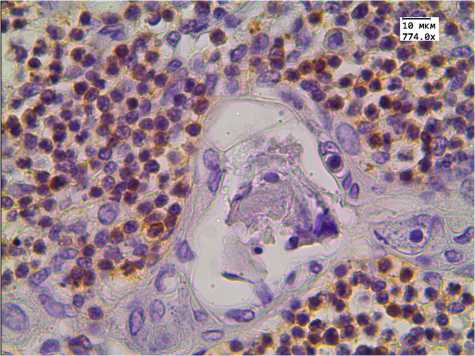
б
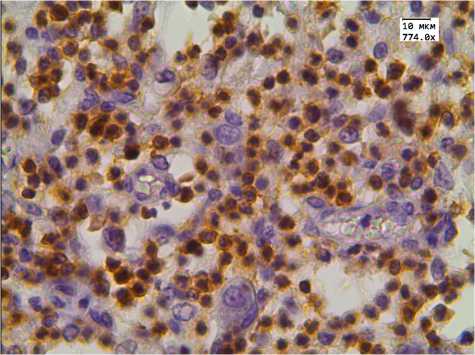
в
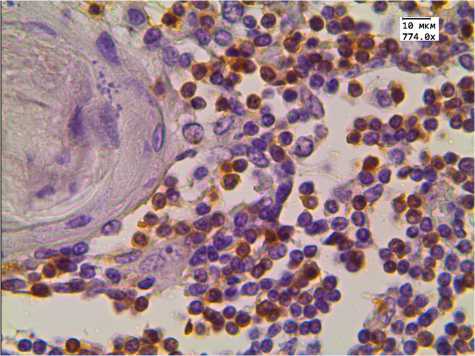
г
Рис. 1. Экспрессия CD3 в тимусе детей, умерших от инфекционных заболеваний. Иммуногистохимическая реакция.
Ув. 774.0. Здесь и далее на рис. 2–4 группы детей:
а , б — 1-я (с нормальной массой тимуса), в , г — 2-я (с увеличенной массой тимуса) ( а , в — корковое вещество; б , г — мозговое вещество)
группах находилась на уровне приблизительно 70% (рис. 4, г ).
Обсуждение. Хорошо известным является тот факт, что значительная доля клеток коркового вещества представлена клетками-предшественниками, мигрирующими из костного мозга. В корковом слое тимуса происходят дальнейшие процессы дифференцировки этих клеток. Зрелые лимфоциты мигрируют в мозговое вещество, откуда попадают в кровоток [7].
Наше исследование показало то, что увеличение массы тимуса происходит за счет увеличения его коркового слоя. Установлено, что у детей с увеличенной массой тимуса в корковом слое диагностировалось в 2,7 раза больше CD3+-тимоцитов. Обращало на себя внимание то, что статистически значимых отличий в экспрессии этого маркера в мозговом слое тимуса не наблюдалось. Таким образом, при увеличении массы тимуса происходит накопление Т-клеток в корковом слое тимуса.
а б
в г
Рис. 2. Экспрессия CD68 в тимусе детей, умерших от инфекционных заболеваний
а б
в г
Рис. 3. Экспрессия CD163 в вилочковой железе детей, умерших от инфекционных заболеваний
а
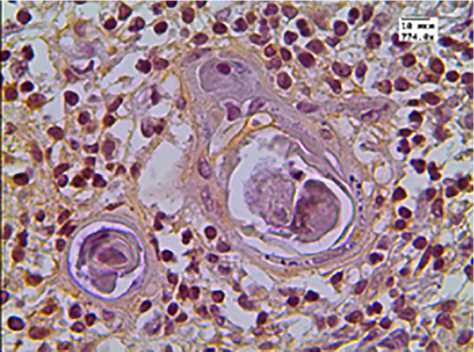
б
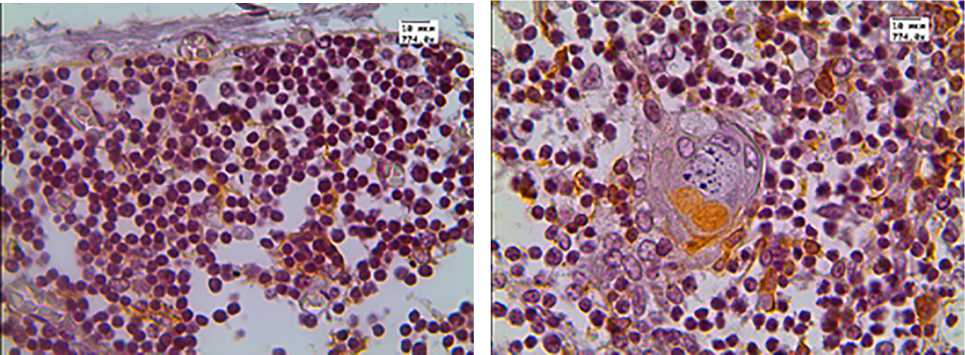
в г
Рис. 4. Экспрессия цитокератина-19
В норме на границе между корковым и мозговым слоями формируется гематотимусный барьер из эпи-телиоретикулярных клеток, который изолирует мозговое вещество. Исходя из этого увеличение CD3+-клеток в корковом слое может быть проявлением нарушения функции данного барьера, что приводит к задержке тимоцитов в корковом слое. Указанный факт свидетельствует о нарушении миграции тимоцитов. Однако этот вопрос требует дальнейшего изучения, поскольку увеличение количества клеток коркового вещества может быть связано с усиленной миграцией клеток-предшественников из костного мозга, некоторые авторы рассматривают CD3 как маркер активации тимопоэза [2]. Другие исследователи отмечают, что экспрессия CD3 не может быть трактована однозначно, потому что положительное окрашивание могут иметь как зрелые, так и незрелые Т-лимфоциты [8].
Следует указать, что количество CD3+-клеток в мозговом веществе вилочковых желез, где происходит заключительный этап дифференцировки лимфоцитов, в обеих группах не отличалось. Следовательно, увеличение массы вилочковой железы не является признаком активации клеточного иммунитета, так как из коркового слоя вилочковой железы эти клетки не могут попасть в кровоток и, соответственно, выполнять свои функции [4].
Большое количество исследователей применяют CD68 для выявления макрофагов в тимусе [9–11]. Между тем другие научные изыскания показывают, что более специфичным маркером макрофагов является CD163. Результаты наших исследований обнаружили разнонаправленную динамику изменений: экспрессия CD68 повышалась только в корковом веществе вилочковой железы детей с увеличенным тимусом, а экспрессия CD163 снижалась как в корковом, так и в мозговом веществе тимусов детей этой же группы. Таким образом, повышение экспрессии CD68 может быть обусловлено увеличением количества базофилов, тучных и В-клеток.
Ряд авторов отмечают значительную роль макрофагов в дифференцировке Т-клеток. Именно макрофаги участвуют в отрицательной селекции поврежденных лимфоцитов. Снижение уровня экспрессии CD163 в тимусах детей 2-й группы говорит о снижении уровня отрицательной селекции, а значит, ведет к увеличению количества дефектных лимфоцитов.
Тучные клетки обладают способностью снижать супрессорную активность Т-регуляторных клеток, к которым в том числе относят и макрофаги тимуса за счет выделения гистамина. Таким образом, в условиях увеличения тимуса, помимо снижения количества макрофагов, происходит усиленное подавление их функции. Этот факт также неблагоприятно влияет на процессы негативной селекции тимоцитов, то есть нарушает процесс их нормальной дифференцировки.
CD68 не является специфическим маркером макрофагов и тучных клеток, кроме этих клеток положительную реакцию имеют и B-клетки. Некоторые авторы полагают, что В-клетки могут участвовать в процессе негативной селекции [12] и, таким образом, можно было бы объяснить компенсацию негативной селекции за счет увеличения B-клеток. Однако другие авторы не считают достаточно обоснованной теорию участия В-клеток в процессах элиминации дефектных тимоцитов [13]. Это вопрос требует дальнейшего изучения.
В литературе имеются сведения о том, что тельца Гассаля — это финальный этап дифференцировки эпителиальных клеток тимуса [14]. В группе с нормальной массой тимуса СК-19 положительные клетки формируют сеть как в корковом, так и в мозговом веществе тимуса. Вероятно, данная сеть служит местом «общения» лимфоцитов с эпителиальными клетками и обеспечивает оптимальные условия для дифференцировки Т-лимфоцитов. Таким образом, нарушение этой сети в тимусе, что мы наблюдали в группе детей с увеличенным тимусом, — еще один признак морфофункциональной недостаточности тимуса с увеличенной массой.
Заключение. Анализ экспрессии маркеров CD3, CD68, CD163 и СК-19 в срезах тимусах детей, погибших от инфекционных заболеваний, показал, что увеличение массы тимуса у этих детей свидетельствует о нарушении процессов миграции и дифференцировки лимфоцитов, что может свидетельствовать о нарушении функционирования клеточного звена иммунитета.
Вклад авторов: все авторы сделали эквивалентный вклад в подготовку публикации.
Информированное согласие на публикацию. Авторы получили письменное согласие законных представителей пациентов на анализ и публикацию медицинских данных.
Список литературы Анализ экспрессии CD3, CD68, CD163 и СК-19 в тимусах детей неонатального периода при инфекционных заболеваниях
- Loginova NP, Chetvertnykh VA, Chemurziyeva NV. Morpho-functional changes of thymus tissues in children with congenital heart disease. Morfologiia. 2016; 149 (1): 57–63. (In Russ.) Логинова Н. П., Четвертных В. А., Чемурзиева Н. В. Морфофункциональные изменения тканей тимуса у детей с врожденными пороками сердца. Морфология. 2016; 149 (1): 57–63. PMID: 27487665
- Lavini CA, Moran U, Morandi R. Thymus gland pathology clinical, diagnostic, and therapeutic features. Milan: Springer- Verlag Italia, 2008; 273 p.
- Matveev VA. Method for detecting thymomegaly in infants to predict the course of infectious processes: Instruction for use No047–0511. Minsk, 2011; 6 p. (In Russ.) Матвеев В. А. Метод выявления тимомегалии у детей раннего возраста с целью прогнозирования течения инфекционных процессов: инструкция по применению №047–0511. Минск: Министерство зравоохранения Республики Беларусь, 2011; 6 c.
- Pearse G. Normal structure, function and histology of the thymus. Toxicologic Pathology. 2006; 34 (5): 504–14. DOI: 10.1080 / 01926230600865549
- Krivolapov YA, Leenman EE. Morphological diagnosis of lymphomas. Saint Petersburg: KOSTA, 2006; 208 p. (In Russ.) Криволапов Ю. А., Леенман Е. Е. Морфологическая диагностика лимфом. СПб.: КОСТА, 2006; 208 с.
- Taylor PR, Martinez-Pomares L, Stacey M, et al. Macrophage receptors and immune recognition. Annu Rev Immunol. 2005; 23: 901–44. DOI: 10.1146 / annurev.immunol.23.021704.115816
- Bruun JM, Helge JW, Richelsen B, Stallknecht B. Diet and exercise reduce low-grade inflammation and macrophage infiltration in adipose tissue but not in skeletal muscle in severely obese subjects. Am J Physiol Endocrinol Metab. 2006; 290: 961–
- DOI: 10.1152 / ajpendo.00506.2005
- Mäkitie T, Summanen P, Tarkkanen A, Kivelä T. Tumorinfiltrating macrophages (CD68 (+) cells) and prognosis in malignant uveal melanoma. Invest Ophthalmol Vis Sci. 2001; 42: 1414–21. PMID: 11381040
- Ferrero I, Anjuere F, Martin P, et al. Functional and phenotypic analysis of thymic B cells: Role in the induction of T cell negative selection. Eur J Immunol. 1999; 29 (5): 1598–609. DOI: 10.1002 / (SICI)1521-4141(199905)29:05<1598::AIDIMMU1598-3.0.CO;2‑O
- Starskaya IS, Polevshchikov AV. Morphological aspects of atrophy of the thymus under stress. Immunology. 2013; 5: 271–7. (In Russ.) Старская И. С., Полевщиков А. В. Морфологические аспекты атрофии тимуса при стрессе. Иммунология. 2013; 5: 271–7.
- Yastrebova SA, Illarionova SV, Zaitseva NA, Sergeeva VE. Reaction of CD68 positive cells of spleen and thymus to the introduction of immunomodulators. International Journal of Applied and Fundamental Research. 2016; 4–3: 589–93. (In Russ.) Ястребова С. А., Илларионова С. В., Зайцева Н. А., Сергеева В. Е. Реакция CD68 позитивных клеток селезенки и тимуса на введение иммуномодуляторов. Международный журнал прикладных и фундаментальных исследований. 2016; 4–3: 589–93.
- Bearman RM, Bensch KG, Levine GD. The normal human thymic vasculature: An ultrastructural study. Anat Rec. 1975; 183 (4): 485–97. DOI: 10.1002 / ar.1091830402
- Mori K, Itoi M, Tsukamoto N. The perivascular space as a path of hematopoietic progenitor cells and mature T cells between the blood circulation and the thymic parenchyma. Int Immunol. 2007; 19 (6): 745–53. DOI: 10.1093 / intimm / dxm041
- Postovalova EA, Makarova OV, Kosyreva AM, Mikhailova LP. Morphology of the thymus and the specific features of its cellular composition in experimental acute and chronic ulcerative colitis. Russian Journal of Archive of Pathology. 2019; 81 (5): 53–63. (In Russ.) Постовалова Е. А., Макарова О. В., Косырева А. М., Михайлова Л. П. Морфология тимуса и особенности его клеточного состава при экспериментальном остром и хроническом язвенном колите. Архив патологии. 2019; 81 (5): 53–63. DOI: 10.17116 / patol20198105153


