Анализ кишечной микробиоты африканского сома (Clarias gariepinus)
Автор: Скворцова Е.Г., Филинская О.В., Бушкарева А.С., Мостофина А.В.
Статья в выпуске: 4 т.256, 2023 года.
Бесплатный доступ
Целью данной работы явился анализ состава микробного сообщества желудочно-кишечного тракта молоди и взрослых рыб вида Clarias gariepinus с помощью технологии секвенирования на Illumina MiSeq. Результаты анализа показали, что в кишечнике всеядных сомов преобладающими типами являются Proteobacteria, Firmicutes, Actinobacteria и Fusobacteria. Доля неидентифицированных сиквенсов составила в первой группе 9,1±3.53, во второй 67,7±8,69 %. Доля типа Bacteroidetes в обеих группах была представлена в достаточно небольшом количестве (менее 2 %). Четыре минорные филы были представлены как у мелких, так и у крупных сомов (Cyanobacteria, Verrucomicrobia, Spirochaetes и Thermi). Представители же ещё семи бактериальных типов встречались у единичных особей (Planctomycetes, Chlorobi, Synergistetes и Gemmatimonadetes - у представителей первой группы; Thermotogae, Nitrospirae и Tenericutes - только у второй).
Африканский сом, аквакультура, кишечная микробиота, филотипы
Короткий адрес: https://sciup.org/142239877
IDR: 142239877 | УДК: 639.371.7:591.1 | DOI: 10.31588/2413_4201_1883_4_256_249
Текст научной статьи Анализ кишечной микробиоты африканского сома (Clarias gariepinus)
Африканский сом является популярным объектом аквакультуры, благодаря своей неприхотливости в выращивании, возможности содержания в бассейнах с высокой плотностью посадки, а также вкусным диетическим мясом. Есть мнение, что индустриальные условия выращивания оказывают негативное влияние на микробиоценоз кишечника рыб вследствие того, что они лишены естественной пищи, нарушены процессы самоочищения воды, увеличен уровень органического загрязнения воды и число условно-патогенных бактерий в водной среде [2]. При этом за последние 50 лет доля аквакультуры в производстве рыбной продукции увеличилась почти в 7 раз (с 7 до 46%) [4].
Н. Х. Сергалиев с соавторами описывают следующий феномен: различия по структуре микробиомов наблюдаются как между фазами очистки воды в пределах одного резервуара, так и между аналогичными показателями при различных температурных режимах, что подчеркивает важность анализа микробиоты в условиях промышленной аквакультуры, так как ее влияние может оказаться существенным на здоровье и продуктивность выращиваемых рыб [6].
Будучи важной частью пищеварения и всасывания, кишечник также является важным иммунным и эндокринным органом хозяина. Микробиота кишечника важна для хозяина, поскольку она тесно связана с нормальной работой функций кишечника. Рыба является одной из самых богатых видов, экономически и экологически важных групп позвоночных животных, что также важно для обеспечения людей качественной пищей. Несмотря на то, что в изучении и описании кишечной микробиоты многих видов рыб достигнут значительный прогресс, остается еще множество проблем, требующих решения [11]. Обзорный филогенетический и статистический анализ 25 исследований 16S рРНК показал, что соленость, трофический уровень и, возможно, филогенез хозяина определяют состав кишечных бактерий рыб [12]. Предыдущие анализы были сосредоточены на таких факторах, как среда обитания [8, 9, 13], видовые особенности [3], возрастные изменения в кишечной среде и изменения в режимах питания [7]. Сведений о кишечном микробиоме африканских сомов разного возраста в научной литературе не найдено, поэтому целью данной работы явился анализ состава микробного сообщества желудочно-кишечного тракта молоди и взрослых рыб вида Clarias gariepinus.
Материал и методы исследований. Объектами исследования явились две группы сомов Clarias gariepinus: 1) молодь средней массой 85,3±4,88 г, длиной тела 210,0±7,16 см; 2) взрослые особи средней массой 652,6±15,91 г, длиной тела 430,2±4,79 см, предоставленные ИП Салахутдинов В.Г. (г. Ярославль). Рыба была выращена в бассейнах объёмом 2,5 м3 с применением УЗВ. Использовали комбикорм «Экструдат» для сомов: первая группа – старт, 2 мм, вторая – рост, 6 мм. Геномную ДНК из толстого отдела кишечника рыб выделяли на базе Центра компетенций органического сельского хозяйства ФГБОУ ВО Ярославская ГСХА при помощи набора ДНК-ЭКСТРАН-2 (Синтол, г. Москва). Анализ метагенома (вариабельные участки 16S/ITS) сложных микробных сообществ: амплификация вариабельных регионов V3-V4 гена 16S рРНК с использованием универсальных праймеров, подготовка к секвенированию на платформе Illumina, а также секвенирование на Illumina MiSeq, набор v3, 2 × 250 нуклеотидов и таксономическая классификация OTU осуществлялись в ЗАО «Евроген» (г. Москва).
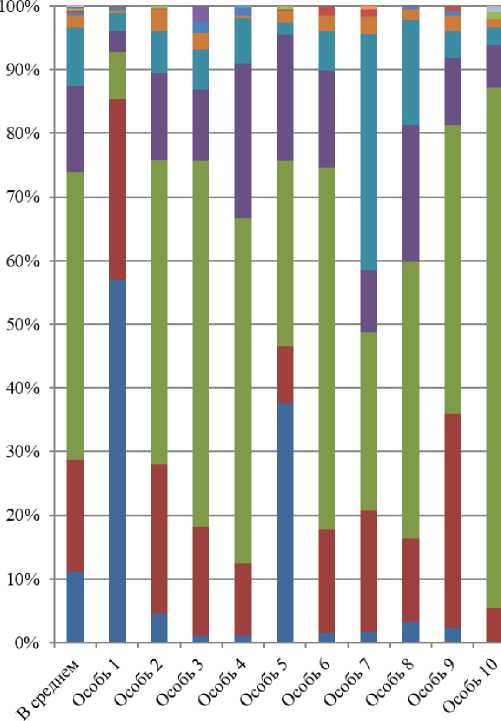
Результат исследований. У молоди сомов четко выделяется тип Proteobacteria, чья доля у разных представителей составила от 7,3 до 81,6 %, в среднем по выборке – 44,9±6,73%. Данная фила также является наиболее многочисленной в кишечнике обитающих в Байкале плотоядных больших и малых голомянок [1, 3], а по данным обзорной статьи Икеда-Оцубо В. с соавторами – всех пресноводных ихтиофагов, в том числе радужной форели [10, 11]. Далее следуют три типа: Firmicutes – 17,6±2,90; Actinobacteria – 13,5±2,21; Fusobacteria – 11,0±6,56%. Firmicutes обычно преобладают в кишечнике морских растительноядных рыб. Не удивительно, что у сомов лидирующие позиции занимают филы микроорганизмов, характерные для разных экологических групп рыб, так как комбикорм, которым они питались в условиях рыбзавода, содержит достаточное количество белковых и растительных компонентов. Актинобактерии также довольно часто встречаются среди доминирующих типов, но обычно варьируют на более низких таксономических уровнях. Фузобактерии могут представлять собой основную бактериальную группу «основного микробиома кишечника» некоторых морских и пресноводных рыб.
Международный коллектив авторов общей чертой микробиоты животных, рыб и даже растений считают то, что три типа: Proteobacteria, Firmicutes и Bacteroidetes доминируют в бактериальном сообществе [10]. В нашем же исследовании фила Bacteroidetes была представлена в кишечном микробиоме молоди сомов в достаточно небольшом количестве – 1,9±0,32 %.
Далее следуют минорные филотипы Cyanobacteria, Verrucomicrobia, Spirochaetes и Thermi, присутствующие в количестве менее 1 % как у молоди, так и у взрослых сомов, а также Planctomycetes, Chlorobi, Synergistetes и Gemmatimonadetes, представленные только у первой группы рыб. Данные филотипы также встречаются в водных сообществах, поэтому они могут быть отнесены к аллохтонной микробиоте.
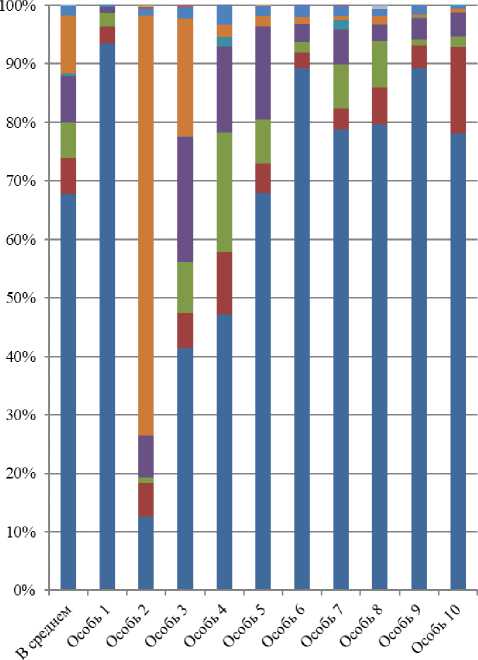
У второй группы сомов (крупные особи 652,6±15,91 г, 430,2±4,79 см) доля неидентифицированных сиквенсов была очень высокой 67,7±8,69 %, т.е. большая часть прочтений выпала из анализа. В другом нашем исследовании было установлено, что у стерляди, выращиваемой в аквакультуре, также процент неклассифицированных типов был выше у более старших особей (на 23,4%) [5]. Тем не менее, среди классифицированных типов чётко выделяются те же четыре филы, только их порядок немного меняется: больше всего было фузобактерий (10,0±7,49%), следующие три группы находятся почти в равном количестве: Firmicutes 8,0±2,29; Proteobacteria 6,2±1,27; Actinobacteria 6,0±2,00%. Фила Bacteroidetes, также, как и у маленьких сомов, была представлена в небольшом количестве, но всё-таки более 1%–1,5±0,30%.
Четыре минорные типа, Cyanobacteria, Verrucomicrobia, Spirochaetes и Thermi, встречаются как у первой, так и второй группы сомов, они могут быть как автохтонными, так и аллохтонными; три же других, Thermotogae, Nitrospirae и Tenericutes встречаются только у крупных, не обнаружены у мелких особей, следовательно, с большей долей вероятности являются аллохтонными.
Gemmatimonadetes
Thenni
Synergistetes
Chlorobi
-
■ Sphochaetes Planctomycetes
-
■ Verrucomicrobia
-
■ Cyanobacteria
Bacteroidetes
-
■ Unclassified at Phylum level
-
■ Actinobacteria
Proteobacteria
-
■ Fiimicutes
-
■ Fusobacteria
Рисунок 1 – Представленность доминирующих типов кишечной микробиоты молоди сомов
Thenni
-
■ Tenericutes
-
■ Nitrosphae
-
■ Thermotogae
-
■ Spirochaetes
-
■ Verrucomicrobia
-
■ Bacteroidetes
-
■ Fusobacteria
-
■ Cyanobacteria
-
■ Finnic utes
-
■ Actinobacteria
-
■ Proteobacteria
-
■ Unclassified at Phy him level
Рисунок 2 – Представленность доминирующих типов кишечной микробиоты взрослых сомов
Заключение. Проведённое исследование продемонстрировало, что в кишечнике всеядных сомов преобладающими типами являются Proteobacteria, Firmicutes, Actinobacteria и Fusobacteria, но порядок их представленности у мелких и крупных сомов различный. Эти данные подтверждают ранее проведённые исследования, в которых эти же филы отмечаются как автохтонные для плотоядных рыб. Самым большим отличием кишечной микробиоты двух групп сомов явилась большая доля неклассифицированных сиквенсов в группе крупных особей. Доля типа Bacteroidetes в обеих группах была представлена в достаточно небольшом количестве (менее 2%). Четыре минорные филы были представлены как у мелких, так и у крупных сомов (Cyanobacteria, Verrucomicrobia, Spirochaetes и Thermi). Представители же ещё семи бактериальных типов встречались у единичных особей (Planctomycetes, Chlorobi, Synergistetes и Gemmatimonadetes – у представителей первой группы; Thermotogae, Nitrospirae и Tenericutes – только у второй).
Резюме
Целью данной работы явился анализ состава микробного сообщества желудочнокишечного тракта молоди и взрослых рыб вида Clarias gariepinus с помощью технологии секвенирования на Illumina MiSeq. Результаты анализа показали, что в кишечнике всеядных сомов преобладающими типами являются Proteobacteria, Firmicutes, Actinobacteria и Fusobacteria. Доля неидентифицированных сиквенсов составила в первой группе 9,1±3.53, во второй 67,7±8,69 %. Доля типа Bacteroidetes в обеих группах была представлена в достаточно небольшом количестве (менее 2 %). Четыре минорные филы были представлены как у мелких, так и у крупных сомов (Cyanobacteria, Verrucomicrobia, Spirochaetes и Thermi). Представители же ещё семи бактериальных типов встречались у единичных особей (Planctomycetes, Chlorobi, Synergistetes и Gemmatimonadetes – у представителей первой группы; Thermotogae, Nitrospirae и Tenericutes – только у второй).
Список литературы Анализ кишечной микробиоты африканского сома (Clarias gariepinus)
- Белькова, Н. Л. Исследование микробиома кишечника малой голомянки Comephorus dybowski Korotneff, 1904 / Н. Л. Белькова, Н. Н. Деникина, Е. В. Дзюба // Известия Российской академии наук. Серия биологическая. – 2015. – № 5. – С. 544-551.
- Зуенко, В. А. Влияние кормового пробиотика на основе бактерий Bacillus subtilis на пищеварение рыб при садковом выращивании / В. А. Зуенко, К. С. Лактионов, И. В. Правдин, Л. З. Кравцова, Н. А. Ушакова // Вопросы ихтиологии. – 2017. – Т. 57. – № 1. – С. 112-117.
- Дзюба, Е. В. Исследование кишечных микробиомов голомянок (Cottoidei, Comephoridae) озера Байкал / Е. В. Дзюба, Н. Л. Белькова, Н. Н. Деникина // Известия Российской академии наук. Серия биологическая. – 2016. – № 6. – С. 658-662.
- Зуенко, В. А. Повышение продуктивности рыбоводческих хозяйств за счет использования биологически активных кормовых добавок (на примере использования пробиотика на основе бактерий Bacillus sybtillis при выращивании карпа и стерляди в садковых хозяйствах Орловской области) / В. А. Зуенко // Достижения вузовской науки 2018: сборник статей II Международного научно-исследовательского конкурса: в 2 ч., Пенза, 05 мая 2018 года. Том Часть 1. – Пенза: «Наука и Просвещение» (ИП Гуляев Г.Ю.). –2018. – С. 28-35.
- Скворцова, Е. Г. Исследование микробиомов кишечника стерляди Acipenser ruthenus, выращенной в условиях аквакультуры / Е. Г. Скворцова, О. В. Филинская, Д. В. Микряков // Сборник тезисов Всероссийской школы-конференции «Сохранение и преумножение генетических ресурсов микроорганизмов». – Москва: Издательство Перо, 2023. – С. 54.
- Сергалиев, Н. Х. Структура микробиома в установках замкнутого водоснабжения и их связь с возникновением инфекционной патологии осетровых рыб / Н. Х. Сергалиев, М. Г. Какишев, И. Н. Залялов, Н. С. Гинаятов, Ф. Х. Нуржанова // Ученые записки Казанской государственнойакадемии ветеринарной медицины им. Н.Э. Баумана. – 2020. – Т. 243. – № 3. – С. 237-244.
- Razak, S. A. Ecological and Ontogenetic Components of Larval Lake Sturgeon Gut Microbiota Assembly, Successional Dynamics, and Ecological Evaluation of Neutral Community Processes / S. A. Razak, K. T. Scribner // Applied and Environmental Microbiology. – 2020. – № 86 (10). – P. 1-17. doi: 10.1128/AEM.02662-19.
- Bacanu, G. M. Differences in the gut microbiota between wild and domestic Acipenser ruthenus evaluated by denaturing gradient gel electrophoresis / G. M. Bacanu, L. Oprea // Rom Biotechnol Lett. – 2013. – V. 18. – № 2. – P. 8069–8076. doi: 10.7717/peerj.12992.
- Betiku, O. C. Water system is a controlling variable modulating bacterial diversity of gastrointestinal tract and performance in rainbow trout / O. C. Betiku, C. J. Yeoman, T. G. Gaylord, B. Americus, S.Olivo, G. C. Duff, W. M. Sealey // PLoS ONE. – 2018. – № 13(4). – P. 1-20. doi.org/10.1371/journal.pone.0195967.
- Ikeda-Ohtsubo, W. How Can We Define «Optimal Microbiota?»: A Comparative Review of Structure and Functions of Microbiota of Animals, Fish, and Plants in Agriculture / W. Ikeda-Ohtsubo, S. Brugman, C. H. Warden, J. M. J. Rebel, G. Folkerts, C. M. J. Pieterse // Front Nutr. – 2018. – № 5:90. – P. 1–18. doi: 10.3389/fnut.2018.00090.
- Ou, W. Recent progress in the understanding of the gut microbiota of marine fishes / W. Ou, G. Yu, Y. Zhang, K. Mai // Mar Life Sci Technol. – 2021. – № 3(4). – P. 434-448. doi: 10.1007/s42995-021-00094-y.
- Sullam, K. E. Environmental and ecological factors that shape the gut bacterial communities of fish: a meta-analysis / K. E. Sullam, S. D. Essinger, C. A. Lozupone, M. P. O'Connor, G. L. Rosen, R. Knight, S. S. Kilham, J. A. Russell // MolEcol. – 2012. – № 21(13). – P. 3363-3378. doi: 10.1111/j.1365-294X.2012.05552.x.
- Yajima, D. Core species and interactions prominent in fish-associated microbiome dynamics / D. Yajima, H. Fujita, I. Hayashi, G. Shima, K. Suzuki, H. Toju // Microbiome. 2023. – №11(53). – P. 1-15. doi: 10.1186/s40168-023-01498-x.


