Анализ метилирования генов SHOX2, TGFBR1, MIR-375 в различных типах рака легких
Автор: Ходырев Дмитрий Сергеевич, Кулагина Наталья Сергеевна, Бровкина Ольга Игоревна, Покровский Василий Евгеньевич, Гордиев Марат Гордиевич, Келехсаева Анжела Степановна, Никитин Алексей Георгиевич, Аверьянов Александр Вячеславович
Журнал: Клиническая практика @clinpractice
Рубрика: Оригинальные исследования
Статья в выпуске: 4 (28), 2016 года.
Бесплатный доступ
В 21 веке остро стоит проблема поиска эффективных и дешевых методов раннего выявления рака легких. Пациенты с подозрением на злокачественное заболевание легких, как правило, подвергаются клиническим исследованиям, таким как КТ-сканирование грудной клетки и бронхоскопия. Последнее преимущественно применяется для подтверждения диагноза. Тем не менее, даже когда признаки, симптомы и рентгенологические данные указывают на то, что клинический диагноз злокачественного заболевания легких является очевидным, требуются дополнительные инвазивные процедуры для получения биологического материала, пригодного для окончательного подтверждения наличия злокачественных клеток. В настоящее время есть четкое понимание необходимости поиска биомаркеров, способных на доклинической стадии выявлять клетки рака с помощью малоинвазивных процедур. В данной работе для образцов ДНК пациентов с различными типами рака легких, с целью лучшего понимания причин возникновения онкопатологии легких был проведен анализ метилирования генов SHOX2, TGFBR1 и MIR-375.
Рак легких, днк метилирование, микрорнк
Короткий адрес: https://sciup.org/143164613
IDR: 143164613
Текст научной статьи Анализ метилирования генов SHOX2, TGFBR1, MIR-375 в различных типах рака легких
Метилирование ДНК является важным эпигенетическим процессом, играющим огромную роль в фундаментальных биологических собы- тиях, таких, как развитие и дифференцировка клеток [1]. Нарушение этого процесса играет важную роль в канцерогенезе [2], а аберрантное метилирование ДНК является отличитель- ной чертой возникновения рака у человека. [3, 4]. В настоящее время анализ метилирования ДНК является ценным источником при поиске биомаркеров рака [5]. Маркеры на основе метилирования ДНК представляют большой интерес в тех случаях, когда трудно поставить диагноз, используя обычные диагностические процедуры. Кроме того, материал для исследования маркеров метилирования может быть получен малоинвазивными способами. В то же время профили метилирования ДНК в значительной степени отличаются в различных типах раковых клеток и могут быть использованы для установления типа опухоли и определения лекарственной чувствительности.
Недавно был обнаружен ценный биомаркер, основанный на метилировании гена SHOX2, для выявления рака легких в бронхиальных аспиратах. [6]. Ген SHOX2 является членом семейства гомеобоксных генов, кодирующих белки, содержащих мотив из 60-аминокислотных остатков, который представляет собой ДНК-связывающий домен. Гомеобоксные гены были широко охарактеризованы как транскрипционные регуляторы. Увеличение числа копий гена SHOX2 было признано одним из самых распространенных и значимых хромосомных перестроек при раке легкого [7-11]. В то же время, ненормальное метилирование гена SHOX2 является отличительной чертой раковых опухолей легких и коррелирует с увеличением числа копий участка локуса 3q25.3 [12, 13].
Метилирование гена SHOX2 обнаруживается при злокачественной трансформации легких даже у пациентов с отрицательным результатом по цитогистологии [14, 15]. Стоит отметить, что метилирование гена SHOX2 наблюдается в различных гистологических подтипах рака легких [12, 14-16], с особенно высокой частотой при мелкоклеточном и плоскоклеточном раке легкого [16]. Однако, в настоящее время не хватает информации о молекулярном механизме регулирования SHOX2 .
SHOX2 действуя как транскрипционный фактор: повышает активность экспрессии трансформирующего фактора роста β-рецептора I (TβR-I). [17]. В течение последнего десятилетия tgf-β-сигнальный путь является одним из главных путей развития рака из-за его способности регулировать клеточный рост и дифференцировку. Различные члены суперсемейства tgf-β часто мутируют при раке [18, 19]. В нормальных клетках ТФР-β действует как супрессор опу- холи, ингибируя рост клеток, способствуя клеточной дифференцировке, и/или индуцируя апоптоз. Однако, в ходе поэтапного перехода от предраковых злокачественных клеток, ТФР-β утратил ингибирующие свойства из-за потери функциональных рецепторов и внутриклеточных мессенджеров в tgf-β-сигнальном пути [20, 21]. Предполагается, что метилирование промотора компонентов суперсемейства tgf-β является одним из основных способов инактивации ТФР-β сигнального пути [22, 23].
С другой стороны, было показано, что SHOX2 является мишенью mir-375 при эпителиальномезенхимальном переходе в клетках рака молочной железы [17]. Ранее сообщалось, что метилирование микроРНК mir-375 при немелкоклеточном раке легкого достаточно частое событие [24].
Материалы и методы
Образцы опухолей и гистологически нормальной ткани легкого от 187 пациентов (характеристики образцов даны в табл.1), которые подписали информированное согласие на проведение исследования и до операции не получавшие лучевую или химиотерапию, были собраны и клинически охарактеризованы в Республиканском клиническом онкологическом диспансере Министерства здравоохранения Республики Татарстан (г. Казань) в 2014-2016 гг. Опухоли классифицированы в соответствии с TNM-классифкацией Международного противоракового союза и описаны гистологически на основании классификации Всемирной Организации Здравоохранения (ВОЗ) [25, 26]. Для отбора образцов с высоким содержанием опухолевых клеток проводили дополнительный гистологический анализ микросрезов (толщина 3-5 мкм), окрашенных эозином и гематоксилином. Отбирали образцы с содержанием опухолевых клеток не менее 70%. Образцы тканей хранили при -70°С.
Выделение ДНК. Геномную ДНК из легочной ткани пациентов выделяли на автоматической станции QIAcube по протоколу Blood and body fluid spin protocol V3. Контроль количества и качества ДНК осуществляли с помощью спектрофотометра NanoVue Plus (GE Healthcare).
Бисульфитная конверсия. Бисульфит-ную конверсию ДНК осуществляли с помощью набора EpiTect Fast DNA Bisulfite Kit по протоколу Quick-StartProtocol. Очистку после конверсии проводили на автоматической станции QIAcube по протоколу Cleanup of 100 ng or more bisulfite converted DNA. В качестве контро- лей использовали геномную ДНК Jurkat (НПО «СибЭнзим») обработанную CpG-метилазой M.Sss I и геномную ДНК L-68 (НПО «СибЭн-зим»).
РТ-ПЦР. Амплификацию промотерных областей исследуемых генов проводили с помощью ПЦР «в реальном времени» на термоциклере “ABI StepOnePlus” (Applied Biosystems). Олигонуклеотидные праймеры синтезированы ЗАО «Евроген», г. Москва, флуоресцентные зонды синтезированы ООО «ДНК-Синтез», г. Москва). Условия амплификации фрагментов ДНК: 950C/2 мин – 1-й цикл; 940C/10 сек, 58-660C/60сек – 40 циклов, условия ПЦР, последовательности праймеров, флуоресцентных зондов приведены в табл. 2.
Статистический анализ проводили с при- менением точного критерия Фишера. Уровень значимости принят равным 0.05. Расчеты проводили с помощью программы для статистического анализа данных STATISTICA 10.
Результаты и обсуждения
При изучении метилирования использовался метод RQ анализа, который позволяет провести достаточно точное сравнение уровня метилирования матрицы в каждом образце. В качестве эндогенного контроля использовался ген COMT . В качестве калибратора геномная ДНК Jurkat, обработанная метилтрансферазой M.SssI. Для расчета значений RQ использовалось программное обеспечение фирмы Applied Biosystems.
На рисунках 1 и 2 приведены результы анализа метилирования для генов SHOX2, Mir-375 и TGFBR1 в образцах ткани пациентов с различ-
Таблица 1
|
Популяционные характеристики пациентов |
|||
|
Общее кол-во образцов |
Опухоль |
Условная норма* |
|
|
185 (100%) |
164 (100%) |
21 (100%) |
|
|
Возраст |
|||
|
До 50 лет |
25 (16%) |
25 (15%) |
5 (24%) |
|
После 50 лет |
139 (84%) |
139 (85%) |
16 (76%) |
|
Пол |
|||
|
Мужской |
104 (64%) |
104 (63%) |
15 (71%) |
|
Женский |
60 (36%) |
60 (37%) |
6 (29%) |
|
Гистологический тип |
|||
|
Аденокарцинома (АД) |
- |
126 (77%) |
- |
|
Плоскоклеточный рак легкого (ПРЛ) |
- |
24 (15%) |
- |
|
Мелкоклеточный рак легкого (МРЛ) |
- |
14 (8%) |
- |
|
Стадия |
|||
|
I |
- |
2 (1%) |
- |
|
II |
- |
159 (97%) |
- |
|
III |
- |
1 (1%) |
- |
|
IV |
- |
2 (1%) |
- |
|
Метастазы |
|||
|
No |
- |
18 (11%) |
- |
|
Nx |
- |
146 (89%) |
- |
|
Метастазы |
|||
|
Mo |
- |
156 (95%) |
- |
|
Mx |
- |
8 (5%) |
- |
|
Степень дифференцировки |
|||
|
Низкая |
- |
13 (8%) |
- |
|
Умеренная |
- |
30 (19%) |
- |
|
Высокая |
- |
4 (2%) |
- |
|
н/д |
- |
117 (71%) |
- |
* Образцы гистологически нормальной ткани, прилежащей к опухоли.
Таблица 2
Последовательности праймеров, зондов и условия амплификации
Как можно видеть, метилирование гена SHOX2 является более частым событием при ПРЛ (79%) и МРЛ (71%) нежели АД (43%) (рис.1), что согласуется с данными других авторов [16]. Напротив, для гена Mir-375 метилирование выявляется в 8% при ПРЛ, 7% при МРЛ и 6 % при АД. Сообщалось, что Mir-375 подавляет экспрессию SHOX2 в клетках рака молочной железы [27]. Как можно видеть на рисунке
1В, из 7 образцов, в которых обнаруживается метилирование Mir-375 , четыре не обнаруживают метилирования SHOX2 . Для ПРЛ и МРЛ такие случаи отсутствуют. Это может указывать на разные механизмы при возникновении онкопатологии легких.
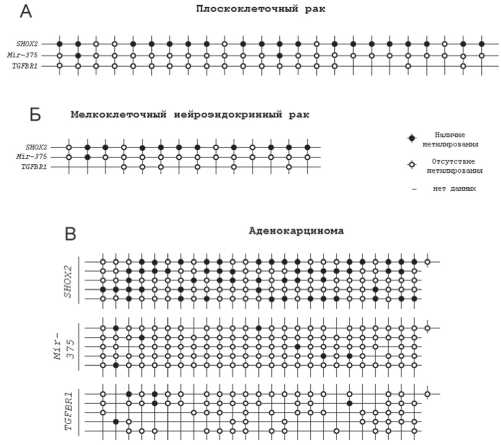
Рис. 1. Данные по метилированию для генов SHOX2, Mir-375 и TGFBR1 в образцах ткани пациентов с плоскоклеточным (А), мелкоклеточным нейроэндокринным (Б) и аденокацино-мой (В) легкого.
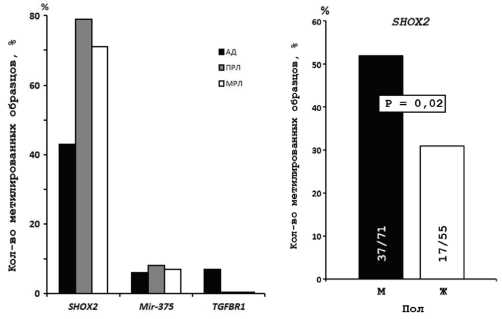
Рис. 3. Зависимость метилирования гена SHOX2 с полом пациентов.
Рис. 2. Результаты анализа метилирования для генов SHOX2, Mir-375 и TGFBR1 в образцах ткани пациентов с плоскоклеточным (ПРЛ), мелкоклеточным нейроэндокринным (МРЛ) и аденокациномой (АД) легкого.
показали, что метилирование TGFBR1 при раке легкого является довольно редким событием и обнаруживается в 7% случаев только при АД. Для ПРЛ и МРЛ отсутствие метилирования может объясняться малой выборкой образцов. С другой стороны, SHOX2 транскрипционно регулирует экспрессию TGFBR1 [17] и частое метилирование SHOX2 может приводить к снижению экспрессии TGFBR1 , что дает преимущество раковым клеткам в росте. Стоит заметить, что исследуемая выборка образцов состоит преимущественно из образцов II стадии (табл.1), это может указывать на то, что снижение экспрессии TGFBR1 является одним из ранних этапов при возникновении рака легкого. Сообщалось, что при плоскоклеточном раке пищевода метилирование гена TGFBR1 чаще отмечалось на стадии III и IV, чем на стадии I и II [28].
Для образцов условно нормальной ткани легкого метилирование генов SHOX2, TGFBR1 и miR-375 обнаружено не было (данные не приведены).
Исследованы возможные корреляции между частотами метилирования генов и клиникогистологическими характеристиками образцов пациентов. Статистически значимая корреляция с полом пациентов выявлена для гена SHOX2 (рис. 3).
Заключение
Полученные в данной результаты добавляют ясности в причины возникновения онкопатологии легких. Обнаруженная связь метилирования SHOX2 c полом пациентов требует более глубокого анализа. Кроме того, результаты данной работы могут найти применение при ранней диагностике рака легких.
Список литературы Анализ метилирования генов SHOX2, TGFBR1, MIR-375 в различных типах рака легких
- Robertson K.D. DNA methylation and human disease. Nat Rev Genet 2005; 6: 597-610.
- Ting A.H., McGarvey K.M., Baylin S.B. The cancer epigenome-components and functional correlates. Genes Dev 2006; 20: 3215-3231.
- Shen H., Laird P.W. Interplay between the cancer genome and epigenome. Cell 2013; 153: 38-55.
- Suva` M.L., Riggi N., Bernstein B.E. Epigenetic reprogramming in cancer. Science 2013; 339: 1567-1570.
- Laird P.W. The power and the promise of DNA methylation markers. Nat Rev Cancer 2003; 3: 253-266.
- Schmidt B., Liebenberg V., Dietrich D., et. al. SHOX2 DNA methylation is a biomarker for the diagnosis of lung cancer based on bronchial aspirates. BMC Cancer 2010; 10: 600.
- Qian J., Massion P.P. Role of chromosome 3q amplification in lung cancer. J Thorac Oncol 2008; 3: 212-215.
- Shen H., Gao W., Wu Y.J., et. al. Multicolor fluorescence in situ hybridization and comparative genomic hybridization reveal molecular events in lung adenocarcinomas and squamous cell lung carcinomas. Biomed Pharmacother 2009; 63: 396-403.
- Dehan E., Ben-Dor A., Liao W., et. al. Chromosomal aberrations and gene expression profiles in non-small cell Lung Cancer. Lung Cancer 2007; 56: 175-184.
- Yen C.C., Liang S.C., Jong Y.J., et. al. Chromosomal aberrations of malignant pleural effusions of lung adenocarcinoma: different cytogenetic changes are correlated with genders and smoking habits. Lung Cancer 2007; 57: 292-301.
- Huang Y.T., Heist R.S., Chirieac L.R., et. al. Genome-wide analysis of survival in early-stage non-small-cell lung cancer. J Clin Oncol 2009; 27: 2660-2667.
- Dietrich D., Hasinger O., Liebenberg V., et. al. DNA methylation of the homeobox genes PITX2 and SHOX2 predicts outcome in non-small-cell lung cancer patients. Diagn Mol Pathol 2012; 21: 93-104.
- Schneider K.U., Dietrich D., Fleischhacker M., et. al. Correlation of SHOX2 gene amplification and DNA methylation in lung cancer tumors. BMC Cancer 2011; 11: 102.
- Schmidt B., Liebenberg V., Dietrich D., et. al. SHOX2 DNA methylation is a biomarker for the diagnosis of lung cancer based on bronchial aspirates. BMC Cancer 2010; 10: 600.
- Dietrich D., Kneip C., Raji O., et. al. Performance evaluation of the DNA methylation biomarker SHOX2 for the aid in diagnosis of lung cancer based on the analysis of bronchial aspirates. Int J Oncol 2012; 40: 825-832.
- Kneip C., Schmidt B., Seegebarth A., et. al. SHOX2 DNA methylation is a biomarker for the diagnosis of lung cancer in plasma. J Thorac Oncol 2011; 6: 1632-1638.
- Hong S., Noh H., Teng Y., et. al. SHOX2 Is a Direct miR-375 Target and a Novel Epithelial-to-Mesenchymal Transition Inducer in Breast Cancer Cells Neoplasia 2014; 16(4): 279-290.
- Shelling A.N. Mutations in inhibin and activin genes associated with human disease. Mol Cell Endocrinol 2012; 359(1-2): 113-120.
- Akhurst R.J., Hata A. Targeting the TGFβ signalling pathway in disease. Nat Rev Drug Discov 2012; 11(10): 790-811.
- Bottinger E.P., Jakubczak J.L., Roberts I.S., et al. Expression of a dominant-negative mutant TGF-beta type II receptor in transgenic mice reveals essential roles for TGF-beta in regulation of growth and differentiation in the exocrine pancreas. EMBO J. 1997; 16(10): 2621-33.
- Amendt C., Schirmacher P., Weber H., et. al. Expression of a dominant negative type ii tgf-beta receptor in mouse skin results in an increase in carcinoma incidence and an acceleration of carcinoma evelopment. Oncogene 1998; 17(1): 25-34.
- Ammanamanchi S., Brattain M.G. Restoration of transforming growth factor-{beta} signaling through receptor RI induction by histone deacetylase activity inhibition in breast cancer cells. J Biol Chem. 2004; 279(31): 32620-32625.
- Osada H., Tatematsu Y., Masuda A., et al. Heterogeneous transforming growth factor (TGF)-β unresponsiveness and loss of TGF-β receptor type II expression caused by histone deacetylation in lung cancer cell lines. Cancer Res. 2001; 61(22): 8331-8339.
- Rykov S.V., Khodyrev D.S., Pronina I.V., et. al. Novel miRNA genes methylated in lung tumors. Genetika 2013; 49(7): 896-901.
- Sobin L.H., Gospodarowicz M.K., Wittekind Ch. Eds. TNM Classification of Malignant Tumors, 7th ed. Wiley-Blackwell, Oxford 2009; 310 pgs.
- Travis W.D., Coby T.V., Corrin B., et. al. World Health Organization International Histological Classification of Tumours; histological typing of lung and pleural tumours. Springer 1999.
- Pasche B., Pennison M. J., Jimenez H., et. al. Transactions of the american clinical and climatological association 2014; 125.
- Dong Z., Guo W., Guo Y. et. al. Concordant promoter methylation of transforming growth factor-beta receptor types I and II occurs early in esophageal squamous cell carcinoma. Am J Med Sci. 2012; 343(5): 375-381.
- Guo W., Dong Z., Guo Y., et. al. Concordant repression and aberrant methylation of transforming growth factor-beta signaling pathway genes occurs early in gastric cardia adenocarcinoma. Mol Biol Rep. 2012; 39(10): 9453-9462.


