Анализ микробного пейзажа у пациентов с перипротезной инфекцией тазобедренного сустава
Автор: Ермаков А.М., Богданова Н.А., Матвеева Е.Л., Гасанова А.Г.
Журнал: Гений ортопедии @geniy-ortopedii
Рубрика: Оригинальные статьи
Статья в выпуске: 3 т.31, 2025 года.
Бесплатный доступ
Введение. Концепция патогенеза перипротезной инфекции (ППИ) заключается в способности патогенных микроорганизмов колонизировать поверхности имплантатов, инфицирование которых осуществляется во время операции или гематогенной диссеминации бактерий. Это раскрывает причину неудовлетворительных результатов лечения ППИ. Микробиологическая идентификация вида возбудителя является золотым стандартом в диагностике ППИ. Цель работы — определить характер микробиологического пейзажа у пациентов c инфекцией, ассоциированной с ортопедическими имплантами тазобедренного сустава. Материалы и методы. Выполнен анализ ревизионных вмешательств (n = 294) по поводу ППИ тазобедренного сустава. В 2010–2021 гг. прооперировано 147 пациентов: 82 (56 %) мужчины и 65 (44 %) женщин. Свищевая форма ППИ отмечена у 105 (71 %), отек и гиперемия области послеоперационного шва — у 29 (20 %), открытые раны — у 13 (9 %) пациентов. Объектом исследования служили образцы костных и мягких тканей, полученные при иссечении инфицированного сустава, а также удаленные элементы эндопротеза. Посев производили на плотные питательные среды. Изучая бактериальные культуры, их идентифицировали общепринятыми методами, используя бактериологические анализаторы TB Expression (BioMerieux, Франция) и Walk Away 40 (США). Результаты. У подавляющего большинства пациентов (93 %) установлена этиология перипротезной инфекции, у остальных пациентов определить возбудителей не удалось. Бактериологический анализ выявил микробные ассоциации у 31 % больных, грамположительную микрофлору у 52 % и грамотрицательную микрофлору — у 10 %. Обсуждение. Наиболее распространенными видами микроорганизмов являются грамположительные бактерии с тенденцией роста резистентных штаммов. Выделение грамотрицательных бактерий при инфицировании суставов наблюдается значительно реже. Результаты демонстрируют изолированную грамнегативную культуру в 10 % случаев. Полимикробная инфекция является второй по частоте встречаемости (31 %) причиной инфицирования протезированного сустава. Микробные ассоциации встречаются в 10–45 % случаев, такая клиническая ситуация на старте лечения усложняет эмпирический выбор препаратов для антибактериальной терапии. Заключение. Микробиологическое исследование позволило установить этиологию инфекционного процесса у 93 % пациентов. Более чем в половине случаев (52 %) причиной возникновения имплантассоциированной инфекции являются гpампозитивная микрофлора, а 31 % случаев — и микробные ассоциации. Рецидивы инфекционного процесса в 41 % случаев отмечены у больных с полимикробным пейзажем.
Перипротезная инфекция, микрофлора, воспаление, эндопротезирование
Короткий адрес: https://sciup.org/142244807
IDR: 142244807 | УДК: [616.718.5/.6-007.24-089.227.84:004.9]-089.168 | DOI: 10.18019/1028-4427-2025-31-3-307-313
Текст научной статьи Анализ микробного пейзажа у пациентов с перипротезной инфекцией тазобедренного сустава
Концепция патогенеза перипротезной инфекции (ППИ) строится на динамическом равновесии взаимодействия импланта и иммунной системы человека [1]. Засев имплантов патогенными микроорганизмами осуществляется либо во время операции, либо при гематогенной диссеминации бактерий [2–6]. Многие бактерии формируют биопленки на металлических и полиэтиленовых поверхностях компонентов эндопротезов [2, 7–9]. Эта способность микроорганизмов (так называемых сесильных форм) обеспечивает их персистенцию и выживаемость в госпитальной среде. Кроме того, бактерии, устойчивые к противомикробным препаратам, оказываются устойчивы к ним и в форме биопленок, и в этом виде они становятся наименее уязвимыми для действия антибиотиков. [10, 11]. Длительное заживление послеоперационных костных ран зачастую связано с проникновением патогенов и возникновением в костной ткани микроабсцессов, колонизацией остеобластов [12–14]. Вместе с тем, существуют трудноизлечимые виды возбудителей ППИ, такие как штаммы стафилококков, резистентные к антибактериальным препаратам трех и более классов, фторхинолон-резистентные и карбапенем-резистентные грамотрицательные микроорганизмы, грибковая микрофлора [2, 15, 16]. Все вышеперечисленные факторы раскрывают причину неудовлетворительных результатов лечения ППИ и подчеркивают необходимость определения этиологии патологического процесса.
Микробиологическая диагностика осуществляется методом выделения и идентификации возбудителя после забора материала из нескольких наиболее контаминированных пораженных тканей [17]. Для деструкции биопленки осуществляют обработку ультразвуком удаленных компонентов эндопротеза, с этой же целью возможно применение раствора дитиотpеитола [18–21]. Время инкубации био-пленочных бактерий составляет 14–21 день, что ведет к их более высокой выживаемости, в сравнении с моноинфекциями, у которых инкубационный период составляет 5–14 суток [22].
Цель работы — определить характер микробиологического пейзажа у пациентов c инфекцией, ассоциированной с ортопедическими имплантами тазобедренного сустава.
МАТЕРИАЛЫ И МЕТОДЫ
Исследование проведено на материале, полученном от 147 пациентов (56 % мужчин и 44 % женщин) после ревизионных операций по поводу перипротезной инфекции тазобедренного сустава. Возраст пациентов составил (54,7 ± 12,7) г. Число образцов исследования — 294. У 105 (71 %) пациентов наблюдали свищевую форму ППИ сустава, у 29 (20 %) отмечали гиперемию, отек в области послеоперационного шва, в 13 (9 %) случаях имелись открытые раны. У 28 (19 %) пациентов наблюдали острое течение инфекционного процесса (продолжительность инфекции в среднем 21,8 дн., Me — 22; 95 % ДИ от 19,7 до 24,0) и у 119 (81 %) — хроническое (продолжительность инфекции в среднем 26,3 мес., Me — 13; 95 % ДИ от 20,5 до 32,3).
В 114 (78 %) случаях гнойно-воспалительное осложнение развилось после первичного эндопротезирования и лишь в 33 (22 %) случаях — после ревизионного вмешательства. Лечебный процесс в значительной степени усложняло тяжелое коморбидное состояние пациентов по шкале ASA ( англ .: American Society of Anesthesiology), выявленное у 82 (56 %) больных.
Объектом исследования служили образцы костных и мягких тканей, полученных при иссечении инфицированного сустава, а также удаленные элементы эндопротеза пациентов с ППИ тазобедренного сустава. На основе рекомендованных методов, посев производили на плотные питательные среды (желчно-солевой агаp, агаp Cабуpо, среда Левина, колумбийский агаp и питательный агаp с 5 % бараньей крови). Образцы помещали в термостат и инкубировали при 37 °C в течение 24–48 ч. Подсчитывали количество колоний в чашках Петри, полученный результат переводили в десятичный логарифм, выражая в КОЕ/мл. Для создания анаэробных условий использовали газогенераторные пакеты «Анаэ-рогаз», выращивая грибковую флору в течение 5 сут. при температуре 30 °С.
Изучая бактериальные культуры, их идентифицировали общепринятыми методами, а также используя бактериологические анализаторы TB Expression (BioMerieux, Франция) и Walk Away 40 (США).
Статистическая обработка данных выполнена с помощью пакета программ Statistica for Windows, v. 13.0 (Stat Soft Inc., США) и Microsoft Excel (Microsoft, США). Для характеристики микробиологического спектра выполнены процентные расчеты. Описательные статистические результаты представляли собой среднее значение ± стандартная ошибка (SЕ) для количественных данных. Распределение данных анализировали с помощью тестов нормальности Шапиро – Уилка и Колмогорова – Смирнова. Сравнение между несвязанными выборками проводили с использованием критерия Манна – Уитни. Различия считали значимыми при p < 0,05.
РЕЗУЛЬТАТЫ
В интраоперационном биологическом материале выделено 196 штаммов патогенных микроорганизмов, спектр которых представлен на рис. 1. Доминирование семейства Staphyloсoссaсeae было отмечено в 64 % случаев, значительную часть выделенных штаммов составляли также Enterobacteriaсeae (10 %), Enteroсoссaсeae (9 %) и Рseudomonadaсeae (9 %).
В 39 наблюдениях (20 %) выявлены MRSA и MRSE, в 17 (9 %) — Р. aeruginosa (рис. 1).
Идентификация микроорганизмов для верификации таксономической принадлежности патогенных бактерий показала, что среди выделенных и идентифицированных бактерий основную часть микрофлоры составило семейство Staphylococcaceae с преобладанием штаммов Staphylococcus aureus , Staphylococcus epidermidis и Staphylococcus saprophyticus .
У 137 пациентов (93 %) микрофлора идентифицирована, однако у 10 пациентов идентифицировать возбудителей не удалось. У 76 пациентов (52 %) определяли изоляты грамположительной микрофлоры, у 15 пациентов (10 %) — грамотрицательная микрофлора в монокультуре. У 46 пациентов (31 %) наблюдали наличие микробных ассоциаций (рис. 2).
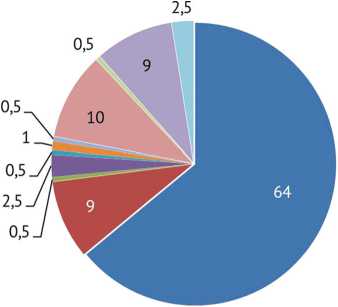
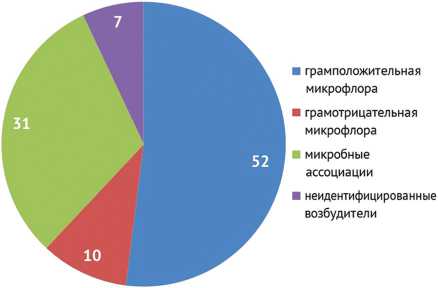
Рис. 2. Выявленные микрофлоры
-
■ Staphylococcaceae
-
■ Enterococcaceae
-
■ Actinomycetaceae
-
■ Corynebacterioceae
-
■ Micrococcaceae
-
■ Peptostreptococcaceae
: i Streptococcaceae
-
■ Entero bacteriaceae
Vibrionoceae
-
■ Pseudomonodaceoe
Moraxellaceae
Рис. 1. Спектр возбудителей ППИ тазобедренного сустава
Следует отметить, что в 22 % случаев, т.е. у 17 из 76 пациентов с изолированной грамположительной микрофлорой (доминирующим штаммом золотистого, а также эпидермальным стафилококком) произошел рецидив гнойно-воспалительного процесса. Повторное нагноение у 15 пациентов с грамо-трицательной микрофлорой (представленной преимущественно штаммами Pseudomonas aeruginosa ) отмечено только в двух случаях (13 %). Наиболее часто в составе полимикробной инфекции выделялись семейства Staphylococcaceae (78 %), Enterobacteriaceae (28 %), Enterocоccaceae (26 %), Pseudomоnadaceae (15 %) и Moraxellaceae (6,5 %).
Очевидно в результате предшествующей терапии антибактериальными препаратами, у пациентов с ППИ достаточно распространены и занимают второе место после грампозитивной микрофлоры по-лимикробные ассоциации. Микробная ассоциация из двух агентов выявлена у 34 пациентов (74 %), из трех агентов — у 11 (24 %). Рост четырех микроорганизмов выявлен у одного больного.
Общее количество пациентов с рецидивом инфекционного процесса при наличии микробных ассоциаций составило 19 человек (41 % наблюдений), что было самым высоким числом осложнений. С целью купирования воспалительного процесса шести пациентам с рецидивированием инфекции проводили повторную хирургическую обработку, восьми пациентам осуществили замену спейсера, остальным — резекционную артропластику.
При не идентифицированном составе микрофлоры у двух из 10 пациентов произошло повторное нагноение в период нахождения в стационаре. Этим пациентам проведено двухэтапное ревизионное вмешательство.
Сравнительная оценка результатов интраоперационного исследования микробиологического спектра возбудителей у пациентов с острой и хронической формами имплант-ассоциированной инфекции представлена на рис. 3.
В структуре оперативных вмешательств по поводу ППИ у 28 (19 %) пациентов манифестация инфекции составила 22 дн. (МКИ-17 — 27,5 дн.), а у 119 пациентов продолжительность гнойного процесса составила 26 мес. (8–35 мес.).
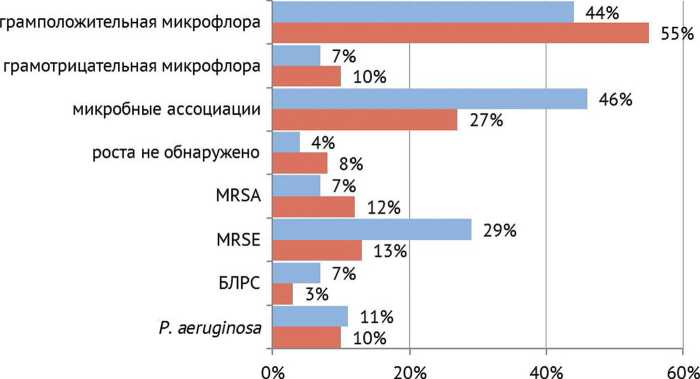
В структуре микробного пейзажа пациентов с острой и хронической формами инфекционного процесса вклад изолированной грамположительной (44 % и 55 %) и грамотрицательной (7 % и 10 %) микрофлоры был сопоставим (рис. 3). Однако отмечено, что микробные ассоциации и MRSE штаммы статистически значимо ( p < 0,05) чаще встречались у пациентов с острой формой инфекционного процесса. Метициллин-резистентные штаммы эпидермального стафилококка являлись причиной развития острого инфекционного процесса практически в каждом третьем случае (29 %). В целом, рецидив случился у 7 (25 %) пациентов с острым и у 39 (33 %) пациентов с хроническим вариантом течения инфекционного процесса ППИ.
■ острая форма ■ хроническая форма
Рис. 3. Микробиологическая характеристика посевного материала больных с острой и хронической формами ППИ тазобедренного сустава
ОБСУЖДЕНИЕ
Оценивая микробный пейзаж пациентов с имплант-ассоциированной инфекцией, следует заметить, что клетки микроорганизмов, особенно в условиях биопленок, приобретают все более выраженную резистентность к противомикробным препаратам. Это, в свою очередь, требует новых подходов к оценке рисков и лечению инфекционного процесса, развившегося после эндопротезирования тазобедренных суставов. В течение всего срока нахождения в организме ортопедического импланта сохраняется риск развития ППИ, основными возбудителями которой являются грамположительные бактерии (чаще всего золотистый и эпидермальный стафилококки), характеризующиеся ростом резистентных штаммов [23–26]. Отсутствие мишеней для проявления действия антимикробной терапии у многих грамположительных микроорганизмов приводит к отсутствию контроля над резистентными штаммами, вызывая закономерную тревогу лечащих врачей, что нашло свое отражение, как в отечественных, так и в зарубежных публикациях [27–30].
Второй по значимости этиологической причиной нагноения эндопротезов является полими-кробная инфекция. Частота встречаемости полимикробной инфекции имеет тенденцию к росту, мы наблюдали ее в 31 % случаев. Полимикробная инфекция у наших пациентов представлена предсказуемым спектром: Staphylococcaceae — 78 %, Enterobacteriaceae — 28 %, Enterococcaceae — 26 %, Pseudomonadaceae — 15 % и Moraxellaceae — 6,5 %. Такая клиническая ситуация усложняет выбор адекватного режима антибиотикотерапии и, зачастую, приводит к худшим исходам в сравнении с ППИ с мономикробной микрофлорой, что отмечалось и в литературных источниках [31, 32]. Ряд исследователей указывают на необходимость учитывать экспрессию патогенности микроорганизмов, а также их способность к биопленкообразованию [33–37], в связи с чем определение спектра возбудителей ППИ приобретает большое значение.
У больных в нашем исследовании не выявлена грибковая микрофлора, но в зарубежных публикациях уделяется внимание грибковым инфекциям, которые встречаются в 1–4 % случаев, подавляющую их часть (80 %) составляют грибы рода Candida [38, 39]. Данная проблема характерна для иммуноком-проментированных больных [40, 41].
Проведенное микробиологическое исследование перипротезных тканей выявило этиологию инфекционного процесса в подавляющем большинстве (93 %) исследованных случаев. Наиболее частой причиной неидентификации возбудителя, очевидно, являлся прием антибактериальных препаратов до обнаружения патогена.
ЗАКЛЮЧЕНИЕ
Преимущественной причиной развития ППИ являются грампозитивная микрофлора и микробные ассоциации. Достоверные различия у больных с острым и хроническим типом ППИ отмечались по уровню микробных ассоциаций и присутствию штаммов MRSE c трендом на доминирование в группе с острым характером воспаления.


