Анализ мутации T315I в гене BCR-ABL1 у больных хроническим миелолейкозом из Республики Башкортостан
Автор: Минниахметов Илдар Рамилевич, Исламгулов Денис Владимирович, Рябчикова Наира Рафаэлевна, Карунас Александра Станиславовна, Хуснутдинова Эльза Камилевна
Журнал: Известия Самарского научного центра Российской академии наук @izvestiya-ssc
Рубрика: Генетика
Статья в выпуске: 5-3 т.13, 2011 года.
Бесплатный доступ
Провели скрининг мутации T315I, приводящей к полной потере чувствительности при лечении больных хроническим миелолейкозом ингибиторами тирозинкиназ. Обнаружили 7 мутаций T315I методом прямого секвенирования и подтвердили их последующим методом ПДРФ-анализа. Частота мутации T315I у больных из Республики Башкортостан составила 14%.
Хронический миелолейкоз, ингибиторы тирозинкиназ, мутации
Короткий адрес: https://sciup.org/148200463
IDR: 148200463 | УДК: 575.113:616.248
Текст научной статьи Анализ мутации T315I в гене BCR-ABL1 у больных хроническим миелолейкозом из Республики Башкортостан
ХМЛ характеризуется прогрессирующим течением, в соответствии с которым выделяют 3 стадии заболевания: хроническая фаза, характеризующаяся экспансией терминально дифференцированных нейтрофилов; фаза акселерации с последующим бластным кризом, характеризующиеся недифференцированными миелоидными или лимфоидными клетками-предшественниками. По данным исследователей заболеваемость ХМЛ в мире составляет 1-2 случая на 100 тыс. населения. В странах Европы и Северной Америки ХМЛ по частоте занимает 3 место среди лейкозов (после острых лейкозов и хронического лимфолейкоза), в азиатских странах, где заболеваемость хроническим лимфолейкозом очень низка, - 2 место [1]. В России ХМЛ страдают порядка 7 000 пациентов, ежегодно заболеваемость ХМЛ растет и составляет в нашей стране 1-3 новых случая на 100 тыс. населения в год. Заболевание выявляется в основном у людей социально активного возраста, что серьезно усугубляет проблему и делает ее крайне актуальной [8].
В результате интенсивного разностороннего изучения патогенеза ХМЛ стало очевидным, что транслокация t(9;22)(q34;q11), приводящая к обра-
зованию тирозинкиназы BCR-ABL1 с повышенной активностью, является пусковым механизмом развития заболевания. C начала 1990-х гг. началась разработка препарата, ингибирующего эффект действия тирозинкиназы. В результате был создан препарат STI571 (signal trunsduction inhibitor), получивший название иматиниб. Появление препарата направленного патогенетического действия ознаменовало начало новой эры в терапии ХМЛ [2].
Иматиниб мезилат на сегодняшний день является самым эффективным лекарственным средством, применяемым в качестве препарата первой линии при хроническом миелоидном лейкозе. Исключительная эффективность таргетной терапии имати-нибом ХМЛ доказана в рандомизированном исследовании IRIS (International Randomized Study of IFN vs STI571), где за 5 лет наблюдений общая выживаемость пациентов, получавших иматиниб, составила 88%, а выживаемость без прогрессии в фазу акселерации и бластный криз – 93%. Однако у некоторых больных наблюдается резистентность к проводимой терапии, что приблизительно в 7% случаев приводит к прогрессии заболевания в фазу акселерации и бластного криза [6].
Возникновение устойчивости к иматинибу является следствием взаимодействия многих факторов. Эти факторы включают в себя схему лечения, фармакодинамику ингибиторов тирозинкиназ (ИТК), генетические изменения, мутации BCR-ABL киназного домена или комбинацию из этих факторов [11].
Частота мутаций в гене BCR-ABL1 у больных, резистентных к иматинибу, колеблется от 15% до 90% и зависит от критериев определения резистентности, методов обнаружения мутаций и фазы течения ХМЛ [7]. Эти мутации делают тирозинки-назу нечувствительной к действию иматиниба, при этом сохраняя трансформирующую активность фермента. На сегодняшний день разработаны ингибиторы тирозинкиназ 2-го поколения, более эффективные по сравнению с иматинибом, два из ко- торых уже зарегистрированы в России в начале 2008 г. – нилотиниб и дазатиниб.
Применение ингибиторов тирозинкиназ 2-го поколения позволяет преодолеть проблемы с резистентностью и непереносимостью иматиниба у ряда больных, однако в некоторых случаях даже применение новых препаратов не приводит к улучшению ответа на лечение, и является неэффективным [1]. Наиболее распространенной мутацией, вызывающей резистентность ко всем известным ингибиторам тирозинкиназ, является замена треонина в положении 315 на изолейцин (T315I), возникающая в результате замены цитозина на тимин в 944 позиции. Резистентность при этой мутации гена BCR-ABL невозможно преодолеть увеличением дозы иматиниба, так же как и терапией ингибиторами тирозинкиназ II поколения, поэтому при наличии совместимого донора пациентам с мутацией T315I показана аллогенная трансплантация костного мозга [4]. Своевременное выявление этой мутации позволяет откорректировать тактику лечения пациентов с ХМЛ.
Целью нашего исследования являлся поиск и анализ частоты встречаемости мутации T315I в гене BCR-ABL1 у больных хроническим миелолейкозом из Республики Башкортостан (РБ).
МАТЕРИАЛ И МЕТОДЫ
Материалом исследования послужили образцы РНК и кДНК, выделенные из периферической крови 50 больных, с клинически и цитогенетически установленным диагнозом «Хронический миелолейкоз», проходивших обследование в Республиканской клинической больнице им. Куватова. Все больные дали информированное согласие на уча- стие в исследовании в соответствии со стандартами биоэтического комитета, разработанных в рамках Хельсинской декларации. Все включенные в исследование больные получали лечение препаратом ингибитором тирозинкиназ (ИТК) иматинибом в дозе 400, 600 или 800 мг/сут согласно рекомендациям Европейского общества по лечению лейкозов ELN [5].
Тотальную РНК выделяли из 5-7 мл венозной крови реагентом TriZol (Invitrogene) в соответствии с рекомендациями изготовителя. Эффективность выделения мРНК определяли с использованием спектрофотометра NanoDrop. Качество препаратов РНК оценивали по соотношению оптических плотностей А260/A280 и электрофорезом в 1%-ном агарозном геле по соотношению количества 28S и 18S рРНК. Выделенную РНК обрабатывали ДНКазой I, свободной от РНКазы (“Sigma”). Наличие в образце РНК примесей ДНК определяли с помощью полимеразной цепной реакции (ПЦР) со специфическими праймерами к гену домашнего хозяйства GAPDH (Fermentas).
Обратная транскрипция проводилась с использованием набора «RevertAid™ First Strand cDNA» (Fermentas) с использованием гекса- и дексанукле-отидных праймеров, руководствуясь рекомендациями производителя.
ПЦР-реакция проводилась в 2 этапа, с целью амплификации мутантного транскрипта ABL, согласно рекомендациям Soverini et al. [15]. На 1-м этапе амплифицировали участок гена BCR-ABL , длиной в 1,2 т.п.о. (тысяч пар оснований), с использованием следующих праймеров: F-BCR-A и R-ABL-A (табл.).
Таблица. Праймеры для ПЦР
|
Название праймера |
Последовательность, 5'–3' |
Позиция |
Длина ампликона |
|
F-BCR-A |
GAG CAG CAG AAG AAG TGT TTC AGA |
BCR (3075–3098) |
A 1475 п.о. (b3a2) или 1401 п.о. (b2a2) |
|
R-ABL-A |
CTC TAG CAG CTC ATA CAC CTG GG |
ABL (1484–1506) |
|
|
F-ABL-B |
CAT CAT TCA ACG TGT GCC GAC GG |
ABL (748–770) |
B (393 п.о.) |
|
R-ABL-B |
GTT GCA CTC CCT CAG GTA GTC |
ABL (1120–1140) |
|
|
F-ABL-C |
GAA GAA ATA CAG CCT GAC GGT G |
ABL (930–951) |
|
|
R-ABL-C |
CGT CGG ACT TGA TGG AGA A |
ABL (1393–1411) |
C (482 п.о.) |
На 2-м этапе проводили реамплификацию, используя в качестве матрицы амплификат от первого этапа, с использованием двух пар внутренних праймеров F-ABL-B/R-ABL-B и F-ABL-С/R-ABL-С, которые разделяли изучаемый фрагмент на участки длиной 393 п.н. и 482 п.н., соответственно.
Для амплификации использовали реакционную смесь объёмом 25 мкл, содержащую 2,5 мкл
10хTaq-буфера, 0,5 единиц Taq полимеразы, смесь dNTP (dATP, dGTP, dCTP, dTTP по 200 мкМ каждого), 2,5mM MgCl 2 и по 5 пM каждого праймера. В реакцию брали 1-3мкг кДНК.
Использовали следующие условия ПЦР: для первого раунда, после денатурации (94°С, 5 мин) проводили 30 циклов амплификации в режиме 94°С/40с; 60°С/60с; 72°С/60с; финальная достройка
72°С/7 мин. Реамплификация проводилась при следующих условиях: после первичной денатурации (94°С, 5 мин) проводили 35 циклов амплификации в режиме 94°С/30с; 55°С/40с; 72°С/40с; финальная достройка 72°С/7 мин.
Реакция секвенирования фрагмента гена ABL осуществлялась с использованием комплекта «BigDye terminator sequencing kit» («Applied Biosys-tems», США) согласно протоколу производителя. Определение нуклеотидной последовательности выполнялось с помощью автоматического секвенатора ABI PRISM модель 310 («Applied Biosystems») с использованием набора для флюоресцентного мечения DYEnamicTM ET, согласно протоколу фирмы производителя («Amersham Pharmacia Biotech» DYEnamicTMET Terminator Cycle Sequencing Kit).
Наличие мутации подтверждалось ПДРФ-анализом: фрагменты гена ABL подвергались рестрикции специфической эндонуклеазой Dde I. Реакцию проводили согласно протоколу фирмы-производителя (Fermentas). Продукты реакции и рестрикции анализировали в 7% полиакриламидном геле с последующей окраской в растворе бромистого этидия (конечная концентрация 0,1 мкг/мл) и визуализацией в проходящем УФ-свете при длине волны 312 нм.
Статистическая обработка данных осуществлялась с использованием программы Microsoft Excel.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Критерием к началу мутационного анализа является появление резистентности к терапии, выражающееся появлением гематологической или цитогенетической ремиссии, а также увеличение уровня транскриптов BCR-ABL при анализе уровня экспрессии у больных ХМЛ в 10 раз (1 log). В соответствии с этими требованиями в нашем исследовании мы сформировали группу из 50 больных ХМЛ, отобранных из общей выборки после определения уровня экспрессии химерного гена с помощью набора «ОНКОСКРИН-1-1-Q» (ООО «ГеноТехноло-гия»), являющегося информативным объективным методом определения эффективности действия иматиниба.
С целью идентификации мутации T315I в гене BCR-ABL1 у 50 пациентов с ХМЛ из РБ проведен анализ изменений нуклеотидной последовательности тирозинкиназного домена гена BCR-ABL путем прямого секвенирования кДНК (рис. 1).
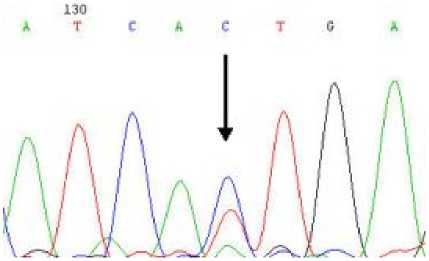
Рис. 1. Секвенирование двух образцов кДНК с мутацией T315I.
У больных с выявленными при секвенировании изменениями последовательности нуклеотидов для подтверждения наличия мутации проводился рестрикционный анализ с помощью эндонуклеазы Dde I (рис. 2, А, B). Мутация T315I выявлялась при потере одного из сайтов рестрикции для эндонуклеазы Dde I. Анализ проводился после амплификации фрагмента кДНК длиной 482 п.о. и сравнивался с контрольным образцом без мутации. В норме этот фрагмент содержит 4 сайта рестрикции для эндонуклеазы Dde I, который гидролизует кДНК на фрагменты длиной 35, 55, 114, 116, 162 п.о. При возникновении замены цитозина на тимин теряется один из сайтов рестрикции (отмечен звездочкой на рис. 2В) и мутантный вариант ABL транскрипта образует не гидролизованный фрагмент в 197 п.о.
Таким образом, под действием эндонуклеазы DdeI мутантные образцы гидролизируются с образованием 4 фрагментов, длиной 55, 114, 116 и 197 п.о. Наличие в образцах с мутацией полос длиной в 162 и 35 п.о. свидетельствует о клоновом характере мутаций, т.е. мутантные образцы представлены разным соотношением транскриптов дикого и мутантного типов B. Рестрикционная карта фрагмента кДНК длиной 482 п.о. для эндонуклеазы DdeI. Сайты рестрикции показаны стрелками. При мутации T315I теряется один из сайтов узнавания для рест-риктазы DdeI (отмечен звездочкой), с образованием фрагмента в 197 п.о.
В результате проведенного нами исследования у пациентов с высокой экспрессией гена BCR-ABL1 из РБ мутация T315I была обнаружена у 7 больных из 50 (14%).
Впервые эта мутация была описана в работе Gorre et al., в которой было установлено, что наличие у пациентов данной мутации приводит к развитию резистентности к лечению иматинибом. Треонин в положении 315 находится на периферии нуклеотид связывающего сайта ABL1 и формирует ключевое взаимодействие через водородную связь с иматинибом [10]. Мутация T315I разрывает это взаимодействие, ослабляет связывание иматиниба и приводит к полной нечувствительности к имати-нибу. Чувствительность к препарату снижается более чем в 200 раз по данным биохимического теста фосфорилирующей активности изолированной ABL-киназы и более чем в 33 раза по данным теста на пролиферативную активность по сравнению с чувствительностью к иматинибу ABL-тирозинкиназы дикого типа [4].
A B
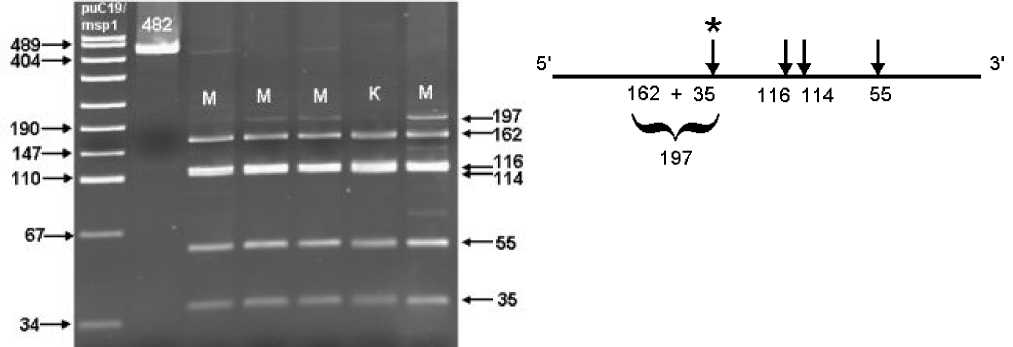
1 2 3 4 5 6 7
Рис. 2. А. Электрофореграмма ПДРФ-анализа гена BCR-ABL1 с помощью эндонуклеазы рестрикции Dde I. Дорожка 1 – маркер молекулярного веса pUC19/ Msp I; 2 – контрольный образец, не обработанный рестриктазой; 3, 4, 5, 7 – образцы кДНК с мутацией T315I; 6- образец кДНК без мутации T315I.
По современным данным, частота мутаций в гене BCR-ABL1 в разных групп больных колеблется от 15% до 90% и зависит от критериев определения резистентности, методов обнаружения мутаций и фазы течения ХМЛ [7].
Частоты мутаций, приводящих к резистентности при лечении иматинибом, варьируют в разных популяциях и зависят от фазы заболевания. В исследованиях группы GIMEMA (Italian Group for Hematologic Malignancies of the Adult) [14] было обнаружено, что частота мутаций у пациентов с первичной и вторичной резистентностью составляет 43%. Мутации встречались у 27% больных в хронической фазе, у 52% - в фазе акселерации, у 75% - в фазе миелоидного бластного криза и у 82% - с лимфоидным бластным кризом [3, 14].
Различные мутации встречаются у резистентных к иматинибу пациентов с неодинаковой частотой. Чаще всего у резистентных пациентов с ХМЛ и Ph-позитивным острым лимфобластным лейкозом обнаруживают мутации E255K/V, М351Т и T315I. По данным S. Soverini и соавт., мутации M244V, G250E, Y253F/H, E255K/V, T315I, M351T и F359V составляют 85 % всех мутаций, ассоциированных с резистентностью к иматинибу [14].
Частота мутации T315I, приводящей к резистентности к ингибиторам тирозинкиназ различается в разных популяциях. Так, в упомянутом выше исследовании итальянской группы GIMEMA, частота данной мутации составила 12%, что коррелирует с результатами исследований в нашей популяции.
В другом, менее репрезентативном исследовании Catherine Roche-Lestienne, в выборке больных ХМЛ из Франции частота мутации T315I составила 12,5% [12]. При исследовании мутаций у больных из России (г. Ростов) было обнаружено, что частота мутации T315I составляет 4%. Низкий процент частоты этой мутации, возможно, связан с тем, что в исследование были отобраны только больные, проявляющие первичную резистентность к иматинибу (рефрактерность) [3].
Таким образом, в результате проведенного анализа впервые установлено, что мутация T315I в гене BCR-ABL1 , приводящая к резистентности к терапии ингибиторами тирозинкиназ, встречается у больных с хроническим миелолейкозом из РБ с достаточно высокой частотой 14%, что свидетельствует о необходимости проведения скрининга данной мутации у пациентов с ХМЛ из РБ.
Раннее и своевременное обнаружение мутации T315I позволит своевременно начать поиск подходящих доноров и назначить трансплантацию костного мозга.
Список литературы Анализ мутации T315I в гене BCR-ABL1 у больных хроническим миелолейкозом из Республики Башкортостан
- Виноградова О.Ю., Туркина А.Г., Хорошко Н.Д. Организация терапии хронического миелолейкоза. Первый общероссийский регистр больных хроническим миелолейкозом: анализ и перспективы//Гематология и трансфузиология. 2008. Т. 53. № 5. С. 54-58.
- Волкова М.А. Гливек -революция в терапии хронического миелолейкоза//Фарматека. 2003. T. 77. № 14. C. 39-47.
- Куцев С.И., Вельченко М.В., Морданов С.В. Роль мутаций гена BCR-ABL в развитии рефрактерности к иматинибу у пациентов с хроническим миелолейкозом//Клиническая онкогематология. 2008. Т. 1. № 4. С. 303-309.
- Куцев С.И., Вельченко М.В. Значение анализа мутаций гена BCR-ABL в оптимизации таргетной терапии хронического миелолейкоза//Клиническая онкогематология. 2008. Т. 1. № 3. С. 190-199.
- Baccarani M., Saglio G., Goldman J. et al. Evolving concepts in the management of chronic myeloid leukemia. Recommendations from an expert panel on behalf of the European LeukemiaNet//Blood. 2006. V. 108. P. 1809-1820.
- Jones D., Kamel-Reid S., Bahler D. et al. Laboratory practice guidelines for detecting and reporting BCR-ABL drug resistance mutations in chronic myelogenous leukemia and acute lymphoblastic leukemia: a report of the Association for Molecular Pathology//J. Mol. Diagn. 2009. V. 11(1). P. 4-11.
- Hochhaus A., Kreil S., Corbin A.S. et al. Molecular and chromosomal mechanisms of resistance to imatinib (STI571) therapy//Leukemia. 2002. V. 16. № 11. P. 2190-2196.
- http://remedium.ru/news/detail.php?ID=44694&sphrase_id =461141
- Kurzrock R., Kantarjian H., Druker B., Talpaz M. Philadelphia chromosome-positive leukemias: from basic mechanisms to molecular therapeutics//Ann. Intern. Medicine. 2003. V. 138. P. 819-830.
- Nagar B., Bornmann W.G., Pellicena P. et al. Crystal structures of the kinase domain of c-Abl in complex with the small molecule inhibitors PD173955 and imatinib (STI-571)//Cancer Res. 2002. V. 62. № 15. P. 4236-4243.
- Quintas-Cardama A., Kantarjian H., Cortes J. Mechanisms of Primary and Secondary Resistance to Imatinib in Chronic Myeloid Leukemia//Cancer Control. 2009. V. 16. № 2. P. 122-131.
- Roche-Lestienne C., Soenen-Cornu V., Grardel-Duflos N. at al. Several types of mutations of the Abl gene can be found in chronic myeloid leukemia patients resistant to STI571, and they can pre-exist to the onset of treatment//Blood. 2002. V. 100. P. 1014-1018.
- Savona M., Talpaz M. Getting to the stem of chronic myeloid leukaemia//Nat. Rev. Cancer. 2008. V. 8. P. 341-350.
- Soverini S., Colarossi S., Gnan A. et al. Contribution of ABL Kinase DomainMutations to Imatinib Resistance in Different Subsets of Philadelphia-Positive Patients: By the GIMEMAWorking Party on Chronic Myeloid Leukemia//Clin. Cancer Res. 2006. V. 12 (24). P. 7374-7379.
- Soverini S, Martinelli G, Amabile M. et al. Denaturing-HPLC-based assay for detection of ABL mutations in chronic myeloid leukemia patients resistant to Imatinib//Clin. Chem. 2004. V. 50. P. 1205-1213.


