Анализ осложнений комбинированного лечения немелкоклеточного рака легкого
Автор: Миллер С.В., Тузиков С.А., Завьялов А.А., Авдеев С.В., Тропин С.В., Афанасьева А.Н., Ванданов А.С., Добродеев А.Ю.
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Клинические исследования
Статья в выпуске: 4 (24), 2007 года.
Бесплатный доступ
Проведен анализ осложнений, возникающих у больных местно-распространенным немелкоклеточным раком легкого III стадии при комбинированном лечении с использованием химиотерапии в неоадъювантном режиме, радикальной операции с интраоперационным облучением в дозе 15 Гр. По разработанной программе лечение проведено у 36 больных. Послеоперационные осложнения возникли в 16,7 ± 3,4 % случаев, послеоперационная летальность составила 5,5 ± 2,4 %.
Рак легкого, неоадъювантная химиотерапия, интраоперационная лучевая терапия
Короткий адрес: https://sciup.org/14054607
IDR: 14054607 | УДК: 616.24-006.6-059
Текст научной статьи Анализ осложнений комбинированного лечения немелкоклеточного рака легкого
Рак легкого в последние 20 лет, прочно занимая лидирующее положение в структуре онкологической заболеваемости в России, остается на 1-м месте по смертности у мужчин, составляя 30,1 %, и на 4-м месте у женщин – в 6,7 % случаев [8, 11]. При установлении диагноза более 75 % всех больных раком легкого имеют обширный местно-распространенный или метастатический процесс, когда результаты лечения с использованием стандартных подходов остаются малоэффективными [4]. Низкая выживаемость больных немелкоклеточным раком легкого (НМРЛ) III стадии после традиционно проводимого у данной категории пациентов хирургического метода является основанием для разработки комбинированных методов лечения [9, 14, 16].
Анализ неудач хирургического лечения показал, что в 30–40 % случаев прогрессирование заболевания приходится на рецидивы в локо-регионарной зоне. Это определило поиск новых вариантов лучевой терапии. Активно развивается метод комбинированного лечения больных НМРЛ с применением интраоперационной лучевой терапии (ИОЛТ) [12]. Основным преимуществом ИОЛТ является возможность использования больших однократных доз облучения при фактически полном экранировании нормальных тканей. Применение интраоперационного облучения снижает количество рецидивов, достоверно повышает 5-летнюю выживаемость пациентов [4, 10]. Использование ИОЛТ позволяет осуществлять локо-реги-онарный контроль, но не оказывает влияния на отдаленные микрометастазы, которые зачастую остаются распознанными на момент проводимого лечения.
Перспективным подходом для улучшения результатов хирургического лечения местнораспространенного НМРЛ явилось применение новых химиотерапевтических агентов в качестве неоадъювантного режима. В последние годы в клиническую практику внедрены противоопухолевые препараты с уникальным механизмом действия и высокой противоопухолевой активностью в отношении распространенного НМРЛ. Такие препараты, как гемцитабин и паклитаксел, в монотерапии НМРЛ оказались весьма эффективными и малотоксичными, что послужило основанием использования их в раз- личных комбинациях с другими цитостатиками [7, 13, 15].
С нашей точки зрения, перспективным подходом к повышению эффективности хирургического лечения рака легкого с ИОЛТ является предоперационное использование цитостатиков с целью локо-регионарного циторедуктивного эффекта с воздействием на медиастинальные лимфоузлы при III стадии, с возможностью раннего воздействия на отдаленные нераспознанные микрометастазы. По мере изучения эффективности гемцитабина в сочетании с другими противоопухолевыми препаратами выяснилось, что его комбинация с цисплатином является перспективной по числу объективных эффектов, увеличивает время до прогрессирования и обладает прогнозируемой и контролируемой приемлемой токсичностью [7, 16], что делает особенно привлекательным изучение данной схемы химиотерапии в сочетании с радикальной операцией и ИОЛТ.
Цель исследования. Изучить переносимость комбинированного лечения, выявить роль эндогенной интоксикации и нарушений системы гемостаза в генезе послеоперационных осложнений.
Материал и методы
С 2002 г. в ГУ «НИИ онкологии ТНЦ СО РАМН» разработан и используется способ комбинированного лечения НМРЛ, включающий предоперационную химиотерапию (гемцитабин 1250 мг/м2 в/в – 1-й, 8-й дни, цисплатин 120 мг/м2 в/в – 2-й день), количество курсов 2–3, радикальную операцию с ИОЛТ 15 Гр. Лечение в этом режиме проведено 36 больным НМРЛ III стадии, 41 больному контрольной группы выполнена радикальная операция с ИОЛТ 15 Гр, что по изоэффекту составляет 46 Гр стандартного курса дистанционной лучевой терапии. Сочетание радикальной операции с ИОЛТ и предоперационной химиотерапией является достаточно агрессивным видом воздействия, что определило необходимость оценки течения послеоперационного периода и переносимости проводимого комбинированного лечения.
Учитывая особенности течения послеоперационного периода при использовании ИОЛТ, неоадъювантной химиотерапии (НХТ), посчитали важным изучить влияние проводимого лечения в рамках концепции «послеоперационного синдрома» [5]. Степень выраженности «послеоперационного синдрома» изучали на основании нарушений систем регуляции агрегатного состояния крови и эндогенной детоксикации. Синдром эндогенной интоксикации оценивали по уровням общей и эффективной концентрации альбумина (ОКА, ЭКА), свидетельствующим о гидрофобном компоненте токсичности. О гидрофильном компоненте токсичности судили на основании молекул средней массы. Для интегральной оценки выраженности эндогенной интоксикации на этапах комбинированного лечения рака легкого использовались также расчетные индексы на основе лейкоцитарной формулы, альбумина. Лейкоцитарный индекс интоксикации определяли по следующей формуле [6]:
ЛИИ = (4Мн+3Ю+2Пал+Сегм)×
×(Плазм.кл.+1) / (Мц+Лц)×(Эоз+1), где ЛИИ – лейкоцитарный индекс интоксикации,
Мн – моноциты,
Ю – юные,
Пал – палочкоядерные лейкоциты, Сегм – сегментоядерные,
Плазм.кл. – плазматические клетки, Мц – моноциты,
Лц – лимфоциты.
Индекс токсичности рассчитывали по следующей формуле [1]:
ИТ=ОКА/ЭКА–1, где ИТ – индекс токсичности,
ОКА – общая концентрация альбумина,
ЭКА – эффективная концентрация альбумина.
Так как явления эндогенной интоксикации неразрывно связаны с функционированием другой интегративной системы организма – системы регуляции агрегатного состояния крови, мы посчитали необходимым оценить следующие параметры: количество тромбоцитов (Tr), которое определяли в капиллярной крови микроскопическим методом, что позволяло судить о тромбоцитарно–сосудистом звене РАСК. Коагуляционное звено изучали в стабилизированной цитратом натрия крови и определяли протромбиновое время (ПТВ), тромбиновое время, фибриноген (ФГ) – гравиметрическим методом по
Р.А. Рутберг, растворимые фибрин-мономерные комплексы (РФМК) – фенантролиновым тестом. Уровень тромбинемии оценивали по наличию D-димеров [2, 3].
Исследования проводили за сутки до хирургического этапа, во время оперативного вмешательства после удаления опухоли и проведения ИОЛТ, в первые и третьи сутки послеоперационного периода. Такой подход позволил изучить значение каждого из этапов проводимого лечения.
Результаты и обсуждение
На первом этапе комбинированного лечения больным проведена неоадъювантная химиотерапия. Непосредственные результаты химиотерапии оценивались с использованием шкалы RECIST – полная регрессия, частичная регрессия, стабилизация процесса, прогрессирование (по результатам рентгенологического, КТ, ФБС исследований). Токсичность химиотерапии оценена по шкале CTC-NCIC. Количество проведенных курсов предоперационной химиотерапии у больных исследуемой группы составило – 82. В зависимости от наблюдаемого после 2 курсов эффекта, 3-й курс неоадъювантной химиотерапии проводился в случаях частичной регрессии опухоли или стабилизации процесса.
При оценке переносимости неоадъювантной химиотерапии отмечено, что чаще всего наблюдалась тошнота/рвота – в 59,7 % случаев, что связано с фармакологическими особенностями цисплатина. Помимо этого, у больных преобладала гематологическая токсичность (анемия, лейкопения, нейтропения и особенно была выражена тромбоцитопения) – в 48,8 % случаев. Аллергические реакции в виде гриппоподобных явлений отмечены в 42,7 % случаев. Гепатотоксичность встречалась достаточно редко, так же как и нефротоксичность, однако последняя отмечена в 24,4 % случаев, что, более вероятно, обусловлено использованием цисплатина. Алопеция встречалась в 25,6 % случаев. В целом, осложнения, возникающие при проведении химиотерапии с использованием гемзара в сочетании с цисплатином, носили кратковременный и нестойкий характер и достаточно хорошо купировались назначением соответствующей терапии сопровождения.
Вторым этапом лечения больным проводилось радикальное хирургическое вмешательство с интраоперационным облучением. Учитывая высокую травматичность выполняемых при раке легкого операций, любое дополнительное воздействие накладывает серьезный отпечаток на течение послеоперационного периода. Операции в объеме пневмонэктомии и лобэктомии выполнялись с систематической медиастинальной ипсилатеральной лимфодиссекцией, позволяющей повысить радикальность хирургического вмешательства, а также объективизирующей распространенность опухолевого процесса. Во время оперативного вмешательства во всех случаях отмечалась повышенная диффузная кровоточивость тканей, что вызывало необходимость повышенного внимания к гемостазу во время оперативного вмешательства. Данные особенности хирургического этапа комбинированного лечения трактуются нами как исход тромбоцитопении, развившейся после предоперационной химиотерапии. Повышенная кровоточивость во время операции обусловливала проведение интенсивной гемостатической терапии в 1-е сут послеоперационного периода. В двух наблюдениях (5,6 %) повышенная кровоточивость из клетчатки средостения, не купирующаяся консервативными гемостатическими методами, привела к необходимости повторной торакотомии и остановки диффузного кровотечения из клетчатки средостения на 2-е сут после операции.
Характер и степень выраженности послеоперационных осложнений, как правило, обусловлены возрастом пациента, наличием сопутствующих заболеваний, общим состоянием больного перед операцией, объемом оперативного вмешательства, а также состоянием системы иммунитета и факторов неспецифической резистентности и рядом других причин. Структура послеоперационных осложнений в исследуемых группах представлена в табл. 1. В контрольной группе послеоперационные осложнения возникли у 10 пациентов из 41 (24,4 %), в основной – у 6 больных из 36 (16,7 %). Различия в количестве осложнений в изучаемых группах статистически не достоверны (р>0,05). При анализе структуры и характера осложнений отмечено, что наиболее часто встречающимся осложнением явилась послеоперационная
Таблица 1
Осложнения послеоперационного периода, абс.ч. (%)
|
Вид осложнений |
Основная группа (НХТ + ИОЛТ) |
Контроль (ИОЛТ) |
Всего |
|
Больные с осложнениями |
6 (16,7) |
10 (24,4) |
16 (20,8) |
|
Эмпиема |
– |
1 (2,4) |
1 (1,3) |
|
Бронхиальный свищ |
– |
2 (4,9) |
2 (2,6) |
|
Пневмония |
2 (5,6) |
3 (7,3) |
5 (6,5) |
|
Гемоторакс |
2 (5,6) |
1 (2,4) |
3 (3,9) |
|
Кровотечение |
1 (2,8) |
1 (2,4) |
2 (2,6) |
|
Нагноение раны |
1 (2,8) |
2 (4,9) |
3 (3,9) |
Таблица 2
Состояние системы детоксикации в раннем послеоперационном периоде у больных раком легкого в зависимости от вида комбинированного лечения
|
Показатель |
Группа |
Сроки исследования |
|||
|
До операции |
Операция |
1-е сут после операции |
3-и сут после операции |
||
|
ОКА |
ИОЛТ |
45,48 ± 0,65 |
43,45 ± 1,19 |
41,52 ± 1,05 |
42,09 ± 1,27 |
|
НХТ + ИОЛТ |
46,59 ± 1,89 |
44,08 ± 1,12 |
40,06 ± 1,71 |
38,02 ± 1,99 |
|
|
ЭКА |
ИОЛТ |
36,57 ± 0,73** |
31,55 ± 1,25 |
31,43 ± 0,98* |
31,57 ± 1,29* |
|
НХТ + ИОЛТ |
46,82 ± 2,13** |
33,52 ± 4,53 |
27,41 ± 1,77* |
26,35 ± 2,04* |
|
|
МСМ |
ИОЛТ |
267,13 ± 11,45 |
358,64 ± 19,2 |
375,22 ± 19,65* |
322,00 ± 16,66* |
|
НХТ + ИОЛТ |
281,18 ± 13,35 |
415,51 ± 40,57 |
509,25 ± 25,76* |
415,45 ± 51,25* |
|
Примечание: различия статистически достоверны, * – р<0,05; ** – р<0,01.
пневмония оставшейся доли легкого. Среди больных исследуемой группы она развилась у 2 пациентов (5,6 %), в контрольной – у 3 пациентов (7,3 %). Со стороны послеоперационной раны нарушений репаративных процессов не выявлено. Раны заживали первичным натяжением, послеоперационные швы снимали на 10–12-е сут. Нагноение раны отмечено у 2 больных контрольной группы, что составило 4,9 %, и у 1 пациента исследуемой группы (2,8 %). Другие осложнения по частоте и тяжести развития достоверных отличий в сравниваемых группах не имели.
В раннем послеоперационном периоде умерло 2 (5,6 %) пациента в исследуемой группе и 3 (7,3 %) в группе контроля. Основными причинами смерти больных явились острая сердечно-сосудистая недостаточность вследствие развившегося в 1-е сут острого инфаркта миокарда, тромбоэмболии легочной артерии.
В связи с тем, что анализ непосредственных результатов комбинированного лечения, с включением неоадъювантной химиотерапии, выявил некоторые особенности течения послеоперационного периода, а цитостатическая терапия, возможно, оказала влияние на формирование осложнений, была изучена динамика синдрома эндогенной интоксикации и изменений гемореалогии в периоперационном периоде. Результаты анализа представлены в табл. 2.
Очевидно, что схема лечения с включением неоадъювантной химиотерапии и ИОЛТ токсичнее, чем только с ИОЛТ. Реализация синдрома эндогенной интоксикации связана непосредственно с оперативным вмешательством, которое можно расценивать как стресс-инду-цирующий фактор. Развитие эндотоксикоза в первые послеоперационные сутки связано с гидрофобным компонентом, а далее в третьи сутки послеоперационного периода – с гидрофильным компонентом токсичности. Интегративные показатели нагрузки на детоксикационные систе-
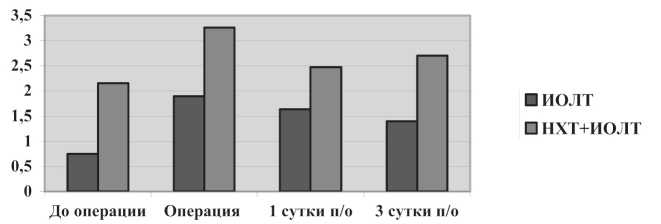
Рис. 1. Динамика индекса лейкоцитарного интоксикации у больных раком легкого в раннем послеоперационного периоде
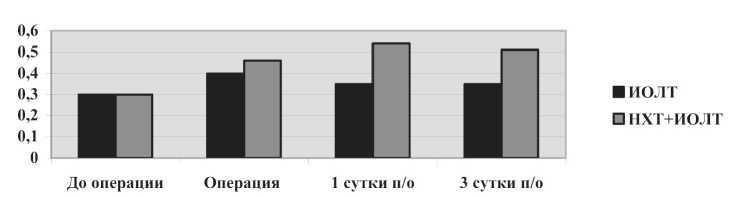
Рис. 2. Динамика индекса токсичности у больных раком легкого в раннем послеоперационного периоде
мы, такие как ЛИИ и ИТ, выявили подобные нарушения (рис. 1, 2).
В целом, можно заключить, что использование химиотерапии по предложенной схеме в неоадъювантном режиме не оказывает значительного влияния на функционирование систем детоксикации, но за счет миелотоксичности воздействует на лейкоцитарные реакции. Оперативное вмешательство в сочетании с ИОЛТ, в свою очередь, является основным фактором, вызывающим эндотоксикоз. Необходимо отметить, что степень выраженности синдрома эндогенной интоксикации (СЭИ) в группе с НХТ более выражена, чем в контроле. Динамика нарастания СЭИ в послеоперационном периоде также связана с неоадъювантной химиотерапией и более значительна у больных этой группы.
Учитывая наличие в пуле молекул средней массы значительной части эйкосанойдов и других биологически активных веществ, оказывающих влияние на функционирование системы регуляции агрегатного состояния крови, была изучена динамика гемостазиологических показателей на этапах комбинированного лечения с целью выявления их влияния на формирование послеоперационных осложнений (табл. 3).
Анализ динамики показателей коагулограммы выявил, что дооперационные изменения в группах сравнения однонаправлены, соответствуют состоянию нормокоагуляции и не имеют достоверных различий. Однако обращает на себя внимание факт появления D-димеров в группе больных, получавших неоадъювантную химиотерапию, что указывает на активацию системы гемостаза, отражая внутрисосудистую генерацию тромбина, повышенное образование и лизис фибрина. Последующая операция, в свою очередь, является дальнейшим инициирующим фактором активации каскада свертывания, о чем свидетельствует достоверное укорочение I и II фаз свертывания, более низкие значения ПТВ и ТВ, чем при использовании ИОЛТ в монорежиме. В послеоперационном периоде сохраняется тенденция увеличения числа больных с положительным тестом на D-димер в группе с НХТ, хотя в анализируемый период этот показатель начинает регистрироваться и в группе контроля. Первые сутки послеоперационного периода в целом характеризуются стабилизацией хронометрических констант коагуляции в обеих группах, но обращают на себя внимание достоверные различия по уровню фибриногена и РФМК. Эти изменения указывают на формирование признаков ДВС-синдрома в группе больных, получавших НХТ, поскольку высокие значения РФМК в сочетании со снижением
Таблица 3
Состояние системы гемостаза в раннем послеоперационном периоде у больных раком легкого в зависимости от вида комбинированного лечения
|
Показатель |
Группа |
Сроки исследования |
|||
|
До операции |
Операция |
1-е сут после операции |
3-и сут после операции |
||
|
Тромбоциты (х109/л) |
ИОЛТ |
274,6 ± 10,5 |
221,4 ± 13,1 |
259,0 ± 16,2 |
298,2 ± 12,2* |
|
НХТ+ ИОЛТ |
260,4 ± 24,9 |
217,6 ± 17,5 |
266,6 ± 26,1 |
248,5 ± 17,5* |
|
|
ПТВ (с) |
ИОЛТ |
14,3 ± 0,3 |
15,5 ± 0,3** |
15,0 ± 0,4 |
15,3 ± 0,4* |
|
НХТ+ ИОЛТ |
13,8 ± 0,6 |
13,4 ± 0,4** |
14,4 ± 0,5 |
16,3 ± 0,4* |
|
|
ТВ (с) |
ИОЛТ |
15,2 ± 0,4 |
15,1 ± 0,3* |
14,8 ± 0,3 |
15,0 ± 0,4* |
|
НХТ+ ИОЛТ |
14,8 ± 0,4 |
13,9 ± 0,5* |
14,6 ± 0,5 |
17,5 ± 1,9* |
|
|
АПТВ (с) |
ИОЛТ |
32,0 ± 1,3 |
32,5 ± 1,4 |
32,6 ± 1,4 |
32,3 ± 1,0 |
|
НХТ+ ИОЛТ |
31,8 ± 2,0 |
31,1 ± 1,2 |
32,2 ± 1,5 |
35,2 ± 3,1 |
|
|
Фибриноген (г/л) |
ИОЛТ |
4,5 ± 0,3 |
5,4 ± 0,3 |
7,4 ± 0,4** |
7,7 ± 0,4 |
|
НХТ+ ИОЛТ |
4,6 ± 0,3 |
4,7 ± 0,4 |
5,6 ± 0,5** |
6,4 ± 0,5 |
|
|
РФМК (мг/100 мл) |
ИОЛТ |
5,0 ± 0,8 |
10,8 ± 1,6 |
8,3 ± 1,5** |
12,5 ± 2,1* |
|
НХТ+ ИОЛТ |
5,3 ± 1,2 |
9,7 ± 1,8 |
21,4 ± 3,3** |
25,5 ± 5,3* |
|
|
D-димер |
ИОЛТ |
- |
+ 3 (7,32 %) |
+ 2 (4,88 %) |
+ 6 (14,63 %) |
|
НХТ+ ИОЛТ |
+ 2 (5,56 %) |
+ 6 (16,67 %) |
+ 8 (22,22 %) |
+ 11(30,56%) |
|
Примечание: различия статистически достоверны, * – р<0,05; ** – р<0,01.
количества фибриногена свидетельствуют об активации внутрисосудистого свертывания, на фоне высокой степени генерации тромбина, подтверждаемой увеличением уровня D-димера. Состояние больных на 3-и сут после операции закономерно характеризуется истощением компонентов коагуляционного звена гомеостаза, на что указывает удлинение ПТВ и ТВ, в сочетании с дальнейшим ростом РФМК и D-димера в основной группе. Кроме того, появляются достоверные различия количества тромбоцитов, причем в группе контроля они значительно выше. Снижение числа тромбоцитов у больных, получавших НХТ, в сочетании с ранее представленными коагуляционными нарушениями, указывает на истощение компенсаторных механизмов системы регуляции агрегатного состояния крови. Разумеется, выявленные нарушения в системах детоксикации и гемокоагуляции в значительной степени влияют на течение послеоперационного периода, определяя частоту развития, характер и выраженность послеоперационных осложнений.
Таким образом, на достаточном клиническом материале показано, что, несмотря на сложность и агрессивность комбинированного лечения, включающего неоадъювантную химиотерапию, радикальную операцию с ИОЛТ, предложенная программа лечения не вызывает тяжелых и необратимых изменений со стороны органов и функциональных систем организма. Интраоперационное облучение в дозе 15 Гр с предоперационной химиотерапией не нарушает процессы репарации в послеоперационном периоде, а послеоперационная летальность обусловлена развившимися «нехирургическими осложнениями». Выявленные нарушения гемостаза, наряду с нарастанием степени тяжести синдрома эндогенной интоксикации, требуют проведения корригирующей терапии.


