Анализ продуктов гидролиза сульфата иттрия золь-гель методом с различными гидролитическими агентами
Автор: Трунова Валерия Владимировна, Авдин Вячеслав Викторович
Журнал: Вестник Южно-Уральского государственного университета. Серия: Химия @vestnik-susu-chemistry
Рубрика: Краткие сообщения
Статья в выпуске: 1 т.8, 2016 года.
Бесплатный доступ
Исследовано влияние гидролитических агентов на состав и свойства продуктов гидролиза сульфата иттрия. Установлено, что гидролиз сульфатов иттрия приводит к формированию образцов, содержащих значительные примеси сульфатов. Продукты гидролиза полностью аморфные. Применение водного аммиака в качестве гидролитического агента позволяет получить образцы, содержащие незначительные количества поровой и кристаллизационной воды.
Короткий адрес: https://sciup.org/147160350
IDR: 147160350 | УДК: 544.77+546.05 | DOI: 10.14529/chem160112
Текст краткого сообщения Анализ продуктов гидролиза сульфата иттрия золь-гель методом с различными гидролитическими агентами
Оксиды иттрия являются основой современных катализаторов, керамических изделий, применяемых для работы в инфракрасном диапазоне и люминофоров [1, 2]. Существенной проблемой при получении данных изделий является необходимость придания оксиду иттрия требуемой структуры на наноразмерном уровне. Известно, что кристаллический наноструктурированный оксид иттрия формируется при гидролизе его солей с образованием слоистой структуры [3–6]. Но вопросы управления структурообразованием продуктов гидролиза солей иттрия, влияния противоиона исходной соли на состав и свойства этих продуктов остаются малоизученными.
Гидролиз сульфата иттрия малоизучен в силу того, что сульфаты иттрия имеют невысокую растворимость в воде, а данные процессы как правило проводят в водной среде. Несколько работ, посвящённых гидролизу сульфатов иттрия, относятся к получению смешанных металлоксидных материалов [7, 8]. Таким образом, изучение свойств продуктов гидролиза сульфата иттрия является актуальной задачей.
Экспериментальная часть
Для синтеза образцов использовали сульфат иттрия с концентрацией 0,1 моль/л, полученный растворением оксида иттрия в серной кислоте с концентрацией 3 моль/л. Концентрацию раствора сульфата иттрия устанавливали титрованием стандартным раствором ЭДТА с индикатором ксиленоловым оранжевым и аммиачно-ацетатным буферным раствором. Гидролитические агенты – водный раствор гидроксида натрия с концентрацией 1 моль/л и водный аммиак с концентрацией 1 моль/л. Синтез проводили при рН 9. Время смешения реагентов составило около 5 минут. Образцы пятикратно отмывали дистиллированной водой (до отсутствия в промывных водах противоионов), затем сушили при 70 ºC под вакуумом (8 мм рт. ст.) до постоянной массы.
Рентгеновские дифрактограммы записали на порошковом дифрактометре Rigaku Ultima IV с использованием медной трубки (Cu K α = 1,541 Å). Термоаналитические кривые получены на термоанализаторе Netzsch 449F1 в платиновых тиглях в атмосфере аргона (40 мл/мин) при скорости нагрева 5K/мин, масс-спектры сняты на масс-спектрометре Aёolos QMS 403C.
Обсуждение результатов
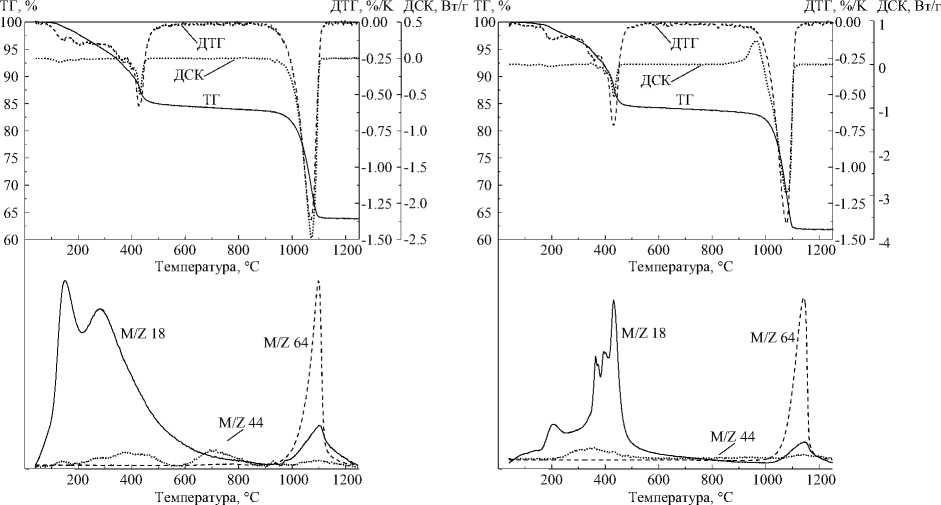
На рис. 1 показаны характерные термоаналитические кривые, а также масс-спектры газообразных продуктов термолиза для образцов, полученных с разными гидролитическими агентами. Согласно данным, представленным в работе [5], масс-спектр для массового числа M/Z = 18 соответствует выделению паров воды, для M/Z = 44 – углекислому газу. Очевидно, что масс-спектр для M/Z = 64 соответствует SO 2 , то есть характеризует разложение сульфатов.
Трунова В.В., Авдин В.В.
При использовании в качестве гидролитических агентов как гидроксида натрия, так и водного аммиака продукты гидролиза содержат значительные примеси сульфатов, разрушение которых происходит при температуре около 1100 °С. Примеси карбонатов в обоих видах образцов незначительные, но при использовании в качестве гидролитического агента едкого натра углекислый газ выделяется в три этапа – при температуре около 400, 700 и 1100 °С, а при применении водного аммиака – только при температуре около 400 °С.
а)
б)
Рис. 1. Термоаналитические и масс-спектрометрические кривые продуктов гидролиза сульфата иттрия при помощи едкого натра (а) и водного аммиака (б)
Дегидратация в образцах, полученных с использованием разных гидролитических агентов также протекает по-разному. В образцах, полученных с использованием гидроксида натрия, пре валирует вода, удаляющаяся при температуре около 200 °С, а в образцах, синтезированных с ис пользованием водного аммиака – вода, образующаяся при температуре около 400 °С. Кроме того в последнем случае образцы практически не содержат поровой и кристаллизационной воды.
Если пренебречь небольшим количеством содержащихся в образцах карбонатов, то при ис пользовании гидроксида натрия примерный брутто-состав продуктов гидролиза Y2O3∙3,17H2O∙0,61SO4, а при использовании водного аммиака – Y2O3∙3,35H2O∙0,83SO4. То есть при применении водного аммиака продукты гидролиза содержат больше и воды, и сульфатов. Кроме того, в последнем случае при температуре около 1000 °С наблюдается экзоэффект, не сопровождающийся потерей массы, и возможно соответствующий образованию кристаллического продукта.
Анализ рентгеновских дифрактограмм (рис. 2) показывает, что при гидролизе сульфата иттрия образуются аморфные соединения.
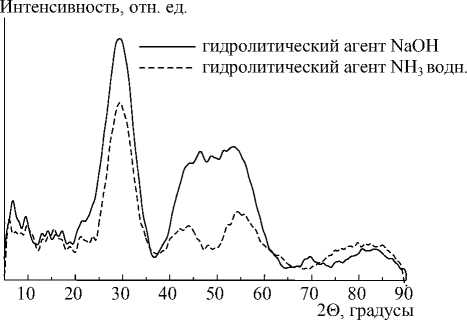
Рис. 2. Рентгеновские дифрактограммы образцов, полученных с разными гидролитическими агентами
Краткие сообщения
Заключение
Установлено, что гидролиз сульфатов иттрия приводит к формированию образцов, содержащих значительные (до 20 % масс.) количества сульфатов. Продукты гидролиза полностью аморфные. Применение водного аммиака в качестве гидролитического агента позволяет получить образцы, содержащие незначительные количества поровой и кристаллизационной воды (не более 2 % масс.).
Работа выполнена в рамках проектной части Государственного задания Министерства образования и науки Российской Федерации (грант № 16.2674.2014/K).
Список литературы Анализ продуктов гидролиза сульфата иттрия золь-гель методом с различными гидролитическими агентами
- Stephan J., Neville E. Yttrium and Rare Earth Compounds Catalyzed Lactone Polymerization. United States Patent № 5028667. Application Number 07/414964. Publication date 07.02.1991.
- Lenin R., Raju R. M., Venkateswarlu Y. . International Journal of Scientific & Engineering Research, 2015, vol. 6, pp. 1788-1791.
- Li N., Yanagisawa K. Journal of Solid State Chemistry, 2008, no. 181, pp. 1738-1743. DOI: DOI: 10.1016/j.jssc.2008.03.031
- Yuanzhou X., Davis R.J. Inorg. Chem, 2010, no. 49, pp. 3888-3895. DOI: DOI: 10.1012/ic1000478
- Dupont A., Parent C., Le Garrec B., Heintz J.M. J. Solid State Chemistry, 2008, vol. 171, pp. 152-160. DOI: DOI: 10.1016/S0022-4596(02)00202-5
- Avdin V.V., Yudina E.P., Krivtsov I.V. Materials Science Forum, 2016, vol. 843. pp. 10-15. DOI: DOI: 10.4028/www.scientific.net/MSF.843.10
- Wang X., Liu L., Jacobson A.J. J. Solid State Chemistry, 1999, vol. 147, pp. 641-646. DOI: DOI: 10.1006/jssc.1999.8432
- Wang X., Liu L., Ross K., Jacobson A.J. Solid State Sciences, 1998, vol. 2, pp. 109-118. DOI: DOI: 10.1016/S1293-2558(00)00107-2


