Анализ прогнозирования выявления каротидного атеросклероза в зависимости от градаций уровня липопротеина (а)
Автор: Гайснок Олег Владимирович
Журнал: Анализ риска здоровью @journal-fcrisk
Рубрика: Оценка риска в организации здравоохранения
Статья в выпуске: 3 (39), 2022 года.
Бесплатный доступ
Осуществлена оценка наличия взаимосвязи градаций уровня липопротеина (а) (Лп(а)) со стенозирующим каротидным атеросклерозом (КАС). Для данного исследования была использована база данных «Регистра Дуплекс». КАС верифицировался дуплексным сканированием при наличии атеросклеротической бляшки (АБ), стенозирующей просвет сонной артерии (СА) на 20 % и более. В исследование отобраны пациенты, которым был выполнен анализ крови на Лп(а), и его результаты были занесены в базу данных регистра. Уровень Лп(а) определялся иммунотурбодиметрическим методом в мг/дл. В окончательный анализ были включены данные 51 пациента (66,6 % - мужчины): медиана возраста - 49,0 [46,0; 59], общий холестерин (ОХС) - 5,93 [5,13; 6,56], Лп(а) - 26,5 [14,2; 76,0]. Корреляционный анализ по Спирмену показал наличие значимых взаимосвязей (р 30 мг/дл, ОШ = 1,42; 95 % ДИ: [0,44; 4,58], p = 0,27. Распространенность КАС в группе со значениями Лп(а) 100 мг/дл - 37,5 %. Модель множественного регрессионного анализа Лп(а) с ОХС в отношении прогнозирования наличия стеноза правой внутренней СА показала R = 0,51, F = 8,4, p = 0,0007. Статистика 3М-модели логистической функции прогнозирования КАС на основании данных Лп(а) и ОХС: -2·log (правдоподобия) = 57,16, χ2 = 8,17 (сс = 2), p = 0,016. В настоящем исследовании подтверждено наличие взаимосвязи уровня Лп(а) с КАС и его аддитивное влияние в сочетании с ОХС в отношении КАС. Определена референсная роль градации Лп(а) на уровне 30 мг/дл как значимая в отношении прогнозирования выявления КАС.
Липопротеин (а), градация, анализ рисков, каротидный атеросклероз, стеноз, дуплексное сканирование, прогнозирование
Короткий адрес: https://sciup.org/142236517
IDR: 142236517 | УДК: 616.133 | DOI: 10.21668/health.risk/2022.3.13
Текст научной статьи Анализ прогнозирования выявления каротидного атеросклероза в зависимости от градаций уровня липопротеина (а)
Гайсёнок Олег Владимирович – кандидат медицинских наук, заведующий терапевтическим отделением с кардиологическими койками, главный специалист терапевтической службы (e-mail: ; тел.: 8 (499) 147-82-21; ORCID: .
раста была подвергнута сомнению [10]. Возможную роль в этом могла сыграть стратификация того значения Лп(а), которое определялось как граница нормы. Несмотря на то что ранее отмечаемый уровень Лп(а) > 50 мг/дл считался референсным [11, 12], в других исследованиях было отмечено, что наибольшее значение имеет градация уровня Лп(а), начиная со значения 30 мг/дл [13].
Цель исследования – оценить наличие взаимосвязи градаций уровня Лп(а) со стенозирующим каротидным атеросклерозом, верифицированным на основании дуплексного сканирования сонных артерий в рамках локального регистра.
Материалы и методы. Для данного исследования была использована база данных «Регистра Дуплекс», подробная методология проведения которого описана ранее в предыдущих публикациях [14, 15]. Каротидный атеросклероз верифицировался на основании данных дуплексного сканирования при наличии атеросклеротической бляшки, стенозирующей просвет сонной артерии на 20 % и более. Дуплексное сканирование (ДС) выполнялось на аппаратах Vivid 7 (GE) по стандартной методике c применением мультичастотных линейных датчиков L9, L12 (9–12 МГц). Исследовались обе общие сонные артерии и их бифуркации, внутренние (ВСА) и наружные сонные артерии с целью определения сечения, где атеросклеротическая бляшка (АБ) имела наибольший размер. Процент стеноза определяли в зоне максимального сужения просвета артерии по диаметру и площади просвета сосуда по критериям ECST в соответствии с методическими рекомендациями по выполнению ДС1 [16, 17]. Формализованным минимальным значением стеноза, связанного с атеросклеротической бляшкой, которое можно корректно выразить в процентах в соответствии с данными протоколами и рекомендациями, было принято значение 20 % при формировании описания результатов дуплексного сканирования.
Для включения в настоящее исследование отобраны пациенты, которым был выполнен анализ крови на Лп(а), и его результаты были занесены в базу данных регистра. Уровень Лп(а) определялся имму-нотурбодиметрическим методом с использованием биохимического анализатора Beckman Coulter 5800. Направление пациентов на данное исследование кардиологом и / или липидологом клиники исходно базировалось на строгих показаниях: ранний семейный или собственный сердечно-сосудистый анамнез в сочетании с подтвержденной гиперлипидемией, что позволяло заподозрить наследственную предрасположенность к данной патологии.
Статистический анализ. Статистическую обработку данных проводили с использованием программного пакета Statistica 10.0 (StatSoft). Данные по группам представлены в виде среднего и стандартного отклонения, медианы, 25 % и 75 % процентиля либо в виде абсолютного числа и процентов. Для определения наличия значимых взаимосвязей между изучаемыми признаками применен корреляционный анализ по Спирмену. При сравнении групп по качественному признаку использовали критерий хи-квадрат. В качестве модели для анализа межуровневых взаимодействий в зависимости от градации качественного признака использовали расширенный хи-квадрат Мантеля – Хензеля для линейного тренда с p-значением для одной степени свободы2. Отношение шансов (ОШ) и 95%-ный доверительный интервал (95 % ДИ) были рассчитаны для определения влияния различных градаций Лп(а) на вероятность выявления стенозирующего каротидного атеросклероза. Множественный регрессионный анализ для количественного признака был применен для построения моделей, включающих Лп(а) в отношении прогнозирования степени стеноза ВСА. Метод логистического регрессионного анализа с использованием квази-ньютоновского метода оценивания был применен для построения модели функции прогнозирования выявления стенозирующего каротидного атеросклероза на основании данных Лп(а) и ОХС (3М-модель функции). Для оценки классификатора прогнозирования КАС как диагностического теста на основании полученной формулы логистической функции классификации применен ROC-анализ (Receiver Operator Characteristic) с построением ROC-кривой и оценкой показателя площади под кривой (Area Under Curve). Различия считали статистически значимыми при p < 0,05.
Результаты и их обсуждение. В окончательный анализ были включены данные 51-го пациента. Средний возраст пациентов составил 50,2 ± 6,5 г.; 2/3 из них принадлежали к мужскому полу ( n = 34). Артериальная гипертония зарегистрирована у 37 % пациентов ( n = 19), у четверых из них также был верифицирован диагноз ИБС (ишемическая болезнь сердца) (один из них перенес инфаркт миокарда (ИМ) в анамнезе). У 19 пациентов (37,3 %) из группы исследования ( n = 51) выявлен каротидный атеросклероз (по критерию АБ ≥ 20 %). Распределение пациентов группы исследования по уровню Лп(а) представлено на рис. 1. Подробные описательные клинико-лабораторные и ультразвуковые характеристики пациентов, включенных в настоящее исследование, представлены в табл. 1.
Корреляционный анализ по Спирмену показал наличие значимых взаимосвязей ( р < 0,05) между следующими признаками. Возраст коррелировал с ТИМ ( r = 0,3), наличием АБ в бифуркации СА, ВСА
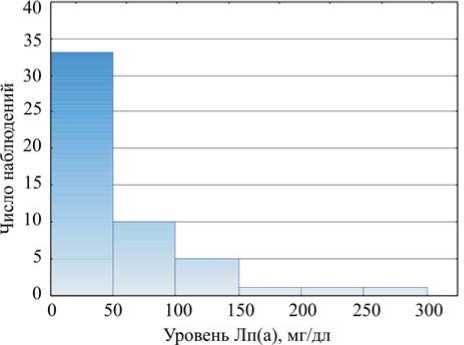
Рис.1. Распределение пациентов группы исследования по уровню Лп(а)
и правой Пкла (r = 0,3), с градацией КАС (r = 0,45), гиполипидемической терапией (ГЛТ) (r = -0,12), Лп(а) (r = 0,3). АБ правой ВСА показала корреляционные связи с возрастом (r = 0,34), полом (r = -0,12), уровнем ОХС в динамике (r = -0,13), уровнем ЛНП в динамике (r = -0,12), уровнем Лп(а) (r = 0,5); в то время как АБ левой ВСА – с возрастом (r = 0,33), полом (r = -0,12), уровнем ОХС в динамике (OХС2) (r = -0,15), уровнем ЛНП в динамике (ЛНП2) (r = -0,16). Градация выраженности КАС коррелировала с возрастом (r = 0,45), полом (r = -0,13), уровнем ОХС в динамике (ОХС2) (r = -0,13), уровнем ЛНП в динамике (ЛНП2) (r = -0,14), ГЛТ (r = -0,08). Уровень Лп(а) коррелировал с возрастом (r = 0,3), полом (r = 0,3), наличием АБ в правой ВСА (r = 0,5), уровнем ЛВП исходно (r = 0,3) и в динамике (ЛВП2) (r = 0,4).
В качестве модели для анализа межуровневых взаимодействий в зависимости от градации сывороточных уровней Лп(а) и каротидного атеросклероза использовали расширенный хи-квадрат Мантеля – Хензеля для линейного тренда. Полученные данные представлены в табл. 2.
С учетом выявленной сильной корреляционной связи между Лп(а) и наличием стеноза правой ВСА множественный регрессионный анализ был применен для построения моделей, включающих Лп(а) в отношении прогнозирования степени стеноза ВСА, с пошаговым включением в модели липидных факторов. Результаты множественного регрессионного анализа представлены в табл. 3.
Отношение шансов (ОШ) и 95%-ный доверительный интервал (95 % ДИ) были рассчитаны для определения влияния различных градаций Лп(а) на вероятность выявления стенозирующего каротидного атеросклероза. Были проанализированы модели, включающие градации Лп(а) менее 30 мг/дл, более 30 мг/дл и более 50 мг/дл (табл. 4). Уровень Лп(а) менее 30 мг/дл достоверно уменьшал вероятность выявления КАС. Лп(а) более 30 мг/дл в настоящей модели увеличивал шансы выявления КАС в 1,4 раза, не достигая при этом уровня статистической значимости. Применение уровня Лп(а) более 50 мг/дл как референсного не улучшило статистики модели. Таким образом, полученные данные подтверждают целесообразность использования в качестве референсного уровня Лп(а) значение 30 мг/дл.
Таблица 1
Клинико-лабораторные и ультразвуковые характеристики пациентов, включенных в настоящее исследование
|
Показатель |
Mean ± SD |
Med [ Q 25 ; Q 75 %] |
Min; Max |
|
Возраст, лет |
50,2 ± 6,5 |
49,0 [46,0; 59,0] |
37,0; 60,0 |
|
ОХС, ммоль/л |
5,93 ± 0,2 |
5,93 [5,13; 6,56] |
3,5; 10,1 |
|
ЛВП, ммоль/л |
1,55 ± 0,47 |
1,47 [1,18; 1,95] |
0,84; 2,52 |
|
ТГ, ммоль/л |
1,58 ± 0,9 |
1,42 [0,91; 1,84] |
0,56; 4,79 |
|
ЛНП, ммоль/л |
3,65 ± 1,03 |
3,53 [3,02; 4,17] |
1,7; 7,22 |
|
Лп(a), мг/дл |
52,8 ± 61,4 |
26,5 [14,2; 76,0] |
0,1; 298,4 |
|
ТИМ правой ОСА, мм |
1,04 ± 0,2 |
1,0 [0,9; 1,2] |
0,7; 1,5 |
|
ТИМ левой ОСА, мм |
1,06 ± 0,2 |
1,0 [0,9; 1,2] |
0,7; 1,5 |
|
ТИМ бифуркации правой ОСА, мм |
1,35 ± 0,2 |
1,4 [1,2; 1,7] |
0,9; 1,7 |
|
ТИМ бифуркации левой ОСА, мм |
1,39 ± 0,3 |
1,4 [1,2; 1,6] |
0,7; 2,1 |
|
ТИМ правой Пкла, мм |
1,46 ± 0,2 |
1,5 [1,3; 1,6] |
0,7; 1,9 |
|
АБ бифуркации правой ОСА > 20 %, % (7/51) |
4,16 ± 11,5 |
0,0 [0,0; 0,0] |
0,0; 59,0 |
|
АБ бифуркации левой ОСА > 20 %, % (7/51) |
4,37 ± 11,8 |
0,0 [0,0; 0,0] |
0,0; 48,0 |
|
АБ правой ВСА > 20 %, % (3/51) |
1,56 ± 6,4 |
0,0 [0,0; 0,0] |
0,0; 30,0 |
|
АБ левой ВСА > 20 %, % (3/51) |
1,96 ± 8,2 |
0,0 [0,0; 0,0] |
0,0; 46,0 |
|
АБ правой Пкла > 20 %, % (11/51) |
5,74 ± 11,2 |
0,0 [0,0; 0,0] |
0,0; 45,0 |
П р и м е ч а н и е : ОХС – общий холестерин, ЛВП – липопротеины высокой плотности, ТГ – триглицериды, ЛНП – липопротеины низкой плотности, Лп(а) – липопротеин (а), ТИМ – толщина интима-медиа, ОСА – общая сонная артерия, АБ – атеросклеротическая бляшка, ВСА – внутренняя сонная артерия, Пкла – подключичная артерия, КАС – каротидный атеросклероз.
Таблица 2
Анализ ассоциаций КАС и градаций уровня Лп(а) в сравнении с нормальным уровнем (расширенный хи-квадрат Мантеля – Хензеля для линейного тренда)
|
Градация уровней |
Значение Лп(а) для уровня |
Случай |
Контроль |
Всего |
Межгрупповое соотношение |
Отношение шансов |
Межуровневые сравнения |
|
0 |
< 30 |
9 |
18 |
27 |
0,5 |
1,0 |
0 vs 0 |
|
1 |
30–50 |
3 |
3 |
6 |
1 |
2,0 |
1 vs 0 |
|
2 |
50–100 |
4 |
6 |
10 |
0,67 |
1,3 |
2 vs 0 |
|
3 |
> 100 |
3 |
5 |
8 |
0,6 |
1,2 |
3 vs 0 |
|
Всего |
– |
19 |
32 |
51 |
– |
– |
– |
Таблица 3
Анализ моделей множественного регрессионного анализа с Лп(а) и липидными факторами в отношении прогнозирования степени стеноза правой ВСА
|
Модель |
R |
R2 |
Скорректированный R 2 |
F |
B |
p -уровень |
|
ЛП(а) |
0,50 |
0,25 |
0,23 |
16,7 |
0,0001 |
|
|
ЛП(а) |
0,504895 |
0,0001 |
||||
|
ЛП(а) ± ОХС |
0,51 |
0,26 |
0,23 \ |
8,4 |
0,0007 |
|
|
ЛП(а) |
0,495155 |
0,0002 |
||||
|
ОХС |
-0,101269 |
0,42 |
||||
|
ЛП(а) ± ЛНП |
0,52 |
0,27 |
0,24 \ |
8,5 |
0,0007 |
|
|
ЛП(а) |
0,502232 |
0,0004 |
||||
|
ЛНП |
-0,086074 |
0,51 |
||||
|
ЛП(а) ± ОХС ± ОХС2 ± ЛНП ± ЛНП2 |
0,66 |
0,44 |
0,35 \ |
4,7 |
0,002 |
|
|
ЛП(а) |
0,617684 |
0,0002 |
||||
|
ОХС |
-0,380122 |
0,33 |
||||
|
ОХС2 |
-0,145181 |
0,77 |
||||
|
ЛНП |
0,281620 |
0,47 |
||||
|
ЛНП2 |
-0,014816 |
0,97 |
||||
Таблица 4
Прогнозирование выявления КАС в зависимости от уровня Лп(а)
|
Уровень Лп(а) |
Отношение шансов |
95 % ДИ |
р -уровень |
|
< 30 мг/дл |
0,36 |
[0,11; 1,14] |
0,04 |
|
> 30 мг/дл |
1,42 |
[0,44; 4,58] |
0,27 |
|
> 50 мг/дл |
1,11 |
[0,32; 3,70] |
0,48 |
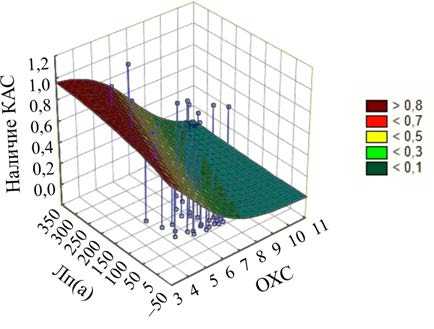
Так как в предыдущих работах была отмечена значимая связь совместного влияния повышенного уровня ОХС и Лп(а) в отношении развития атеросклероза [9], ОХС и Лп(а) были включены в модель логистической регрессии. Метод логистического регрессионного анализа с использованием квази-ньютоновского метода оценивания был применен для построения 3М-модели функции прогнозирования КАС на основании данных Лп(а) и ОХС (рис. 2). В проведенном анализе получена формула логистической функции классификации:
Наличие КАС = exp (3,4922341454018 ±
± (-0,7584332031152 )· ОХС ± (0,00571548810893)·
Лп(а) ) / (1 ± exp (3,4922341454018) ±
± (-0,7584332031152)· ОХС ±
± (0,00571548810893)· Лп(а) ).
Статистика модели: -2·log (правдоподобия) для данной модели = 57,16 (только со свободным членом = 65,34), χ2 = 8,17 (сс = 2), p = 0,016. Параметры оценивания модели представлены в табл. 5.
Для оценки классификатора прогнозирования КАС как диагностического теста с использованием полученной формулы логистической функции классификации на основании данных Лп(а) и ОХС применен ROC-анализ (Receiver Operator Characteristic) с построением ROC-кривой и оценкой показателя площади под кривой – AUC (Area Under Curve). В проведенном анализе получено значение AUC 0,7 (рис. 3).
Стоит обсудить интересные стороны и ограничения настоящего исследования. В отличие от ранее выполненного финского исследования, в котором роль Лп(а) в развитии раннего атеросклероза сонных
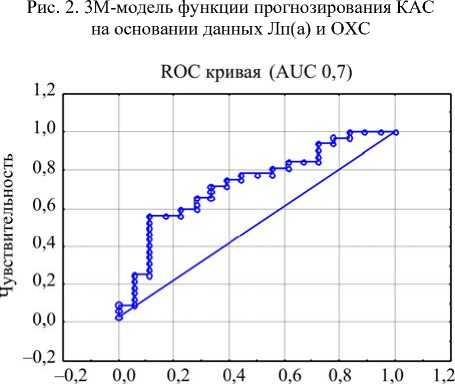
1 -Специфичность
Рис. 3. Результаты ROC-анализа артерий у пациентов молодого возраста была подвернута сомнению [10], в настоящей работе были подтверждены их ассоциации. Несмотря на то что ранее отмечаемый уровень Лп(а) > 50 мг/дл считался референсным [11, 12], в большинстве последних исследований отмечено, что наибольшее значение имеет градация уровня Лп(а) начиная со значения 30 мг/дл [18], что также было подтверждено в нашем исследовании. Однако в нашей работе медианное значение Лп(а) в группе исследования было зарегистрировано на более высоком уровне (26,5 [14,2; 76,0]), в сравнении с другими недавно выполненными исследованиями, изучавшими Лп(а) у больных с изолированным стенозирующим атеросклерозом сонных артерий (Н.А. Тмоян с соавт. – 20 [8; 55]; J.E. Jun et al. – 14 [3; 35]) [18, 19]. Это может быть связано с различиями клинических характеристик пациентов, включенных в исследования. В работе Н.А. Тмоян с соавт. средний возраст пациентов был 60 ± 14 лет (60 [47; 74]), принадлежность мужскому полу – 53 %, распространенность АГ – 57 % [17]. В нашем исследовании средний возраст пациентов составил 50,2 ± 6,5 г. (49 [46; 59]), мужской пол – 66 %, распространенность АГ – 37 %. Настоящее исследование по клиническим характеристикам пациентов было ближе к работе N. Nasr et al. [20], в которой средний возраст пациентов составил 44,3 ± 8,6 г., мужской пол – 60,7 %, распространенность АГ – 28 %. Но средний уровень Лп(а) в исследовании N. Nasr et al. был также ниже, чем в нашем (35,0 ± 38,0 против 52,8 ± 61,4). Объяснением этому может также служить целенаправленное назначение врачом анализа на Лп(а) в настоящем исследовании при подозрении на наличие у пациента наследственной (семейной) предрасположенности к данной патологии (ранний семейный или собственный сердечно-сосудистый анамнез в сочетании с подтвержденной гиперлипидемией), что регламентировано существующими клиническими рекомендациями [3, 4, 6, 21]. При этом анализ данных пациентов, включенных в настоящее исследование, показал аналогичное распределение их по уровням Лп(а), как и в уже ставшем классическим Копенгагенском исследовании (см. рис. 1) [22].
Большее внимание стоит уделять раннему скринингу в отношении наследственных форм гиперлипидемий (в том числе гиперЛп(а)емии) не только среди взрослых, но и среди подростков, что отражено в актуальных клинических рекомендациях [21], в которых отмечено, что целевой уровень ЛНП для детей старше 10 лет составляет < 3,5 ммоль/л (особое значение это имеет при очень высоком уровне ЛПНП, повышенном уровне Лп(а) и / или семейном анамнезе преждевременного развития ИБС или других ССЗ).
Так же, как и в ранее выполненных работах [9, 19], в настоящем исследовании было отмечено аддитивное влияние высоких уровней Лп(a) в cочетании с другими липидными факторами на раннее развитие атеросклероза и связь Лп(а) со степенью стеноза сонных артерий [23]. Наглядным клиническим примером из когорты данного исследования является пациент в возрасте 47 лет без собственного анамнеза артериальной гипертонии и табакокурения, у которого был диагностирован синдром позвоночно-подключичного обкрадывания
Таблица 5
Параметры оценивания логистической регрессионной модели КАС на основании данных Лп(а) и ОХС (ОШ для модели = 2,7)
Интересные параллели можно провести с исследованием F. van Buuren et al., в котором был осуществлен анализ частоты распространенности каротидного атеросклероза в зависимости от уровней Лп(a) [25]. В группе со значениями Лп(а) < 2 мг/дл распространенность каротидного атеросклероза составила 2,8 %, в группе с Лп(а) = 23–29 мг/дл – 6,1 %, 30–60 мг/дл – 8,3 %, 60–91 мг/дл – 7,9 %, 91–110 мг/дл – 6,0 % и > 110 мг/дл – 10,9 %. В нашем исследовании распространенность каротидного атеросклероза в группе со значениями Лп(а) < 30 мг/дл составила 33,3 %, 30–50 мг/дл – 50 %, 50–100 мг/дл – 40 %, > 100 мг/дл – 37,5 %.
Стоит уделить внимание особенностям диагностики Лп(а) методом турбодиметрии. Иммунотур-бодиметрический метод – это высокоточная диагностическая метoдика, преднaзнaченная для измерения концентрации белка по изменению интенсивности светорассеивания исследуемого раствора (сыворотки) при прохождении через него светового потока3. В основе методики лежит определение концентрации изучаемого белка при образовании с ним комплекса «антиген – антитело», что приводит к повышению мутности раствора. Для избежания погрешности получаемых результатов выполняется построение калибровочного графика с использованием нескольких концентраций калибратора (от трех до пяти). C этим может быть связано получение разных результатов при исследовании одной и той же сыворотки крови на разных диагностических системах. Современные коммерческие иммунологические тесты для измерения концентрации Лп(a) калиброваны по-разному, и их погрешности значительно различаются в клинически значимом диапазоне концентраций нелинейным образом. Это и послужило целью проведения исследования H. Schar-nagl et al. [26] по сравнению разных коммерческих иммунохимических анализаторов для определения более надежных методов количественного определения Лп(а) для клинической практики. Исследователи определяли концентрации Лп(a) в сыворотке с использованием шести основных коммерческих анализаторов, представляя результаты Лп(a) в мг/дл (Denka Seiken, Abbott Quantia, Beckman, Diasys 21FS, Siemens N Latex) или в нмоль/л (Roche Tina-Quant, Diasys 21 FS). Все исследования осуществлялись с применением пятиточечной калибровки с использованием калибраторов, предоставленных производителями. Было констатировано, что по сравнению с установленным эталонным материалом результаты различных анализаторов отличались от целевых значений (43,3 мг/дл или 96,6 нмоль/л): на -8 % (Siemens N Latex) и на ± 22 % (Abbott Quantia). Разделение образцов на пять групп с возрастающими концентрациями Лп(a) и графики различий показали, что различия между анализами зависели от концентрации Лп(а). Некоторые анализаторы завышали значение Лп(a) при его высоких сывороточных концентрациях по сравнению с анализатором Denka Seiken. В нашем исследовании уровень Лп(а) определялся при помощи анализатора Beckman, который не был скомпрометирован в исследовании H. Scharnagl et al. [26]. Однако при проведении будущих исследований по изучению Лп(а) их авторам стоит учитывать данный факт. Для решения этого вопроса необходимы дальнейшие международные исследования и усилия, направленные на единую стандартизацию и гармонизацию по интерпретации результатов анализов Лп(a).
В завершение хотелось бы отметить ограничения данного исследования, которые характерны для наблюдательных регистров и всех исследований, основанных на анализе электронных баз медицинских данных [27]. Основным ограничением данного исследования можно считать малый объем выборки и небольшой процент в ней пациентов с подтвержденным каротидным атеросклерозом, что могло сказаться на полученных результатах статистического анализа. В представленных регрессионных моделях коэффициенты регрессии для Лп(а) и липидных факторов имеют противоположный знак, который меняется на противоположный при логарифмическом преобразовании данных при проведении логистического регрессионного анализа. Это может быть также объяснено разным типом распределения признаков, с одной стороны (для Лп(а) – распределение Пуассона; а для ОХС и ЛНП – Гауссово распределение); а с другой стороны – более значимой отрицательной прогностической значимостью нормального уровня Лп(а) (менее 30 мг/дл) в отношении вероятности выявления КАС. Однако стоить отметить, что это объединение предикторов не ослабило полученные модели и привело к увеличению коэффициентов корреляции R в моделях множественной регрессии с 0,5 до 0,66 при сохранении высокого уровня достоверности ( р = 0,002), а также увеличению шансов выявления каротидного атеросклероза при построении модели логистической регрессии с Лп(а) и ОХС (ОШ = 2,76, p = 0,016).
Выводы. В настоящем исследовании подтверждено наличие взаимосвязи градаций уровня Лп(а) со стенозирующим каротидным атеросклерозом и его аддитивное влияние в cочетании с другими ли- пидными факторами на развитие атеросклероза сонных артерий. Определена референсная роль градации Лп(а) на уровне 30 мг/дл как значимая в отношении прогнозирования выявления стенозирующего каротидного атеросклероза. Несмотря на то что Лп(а) является установленным фактором риска развития ССЗ, сохраняются неизученные вопросы в отношении его применения в реальной клинической практике [28]. Cуществует потребность в надежных методах количественного определения Лп(а) в клинической лабораторной практике [26], которая должна быть направлена на гармонизацию в интер- претации результатов его лабораторных исследований. Большее внимание стоит уделять раннему скринингу в отношении наследственных форм гиперлипидемий (в том числе гиперЛп(а)емии) не только среди взрослых, но и среди подростков, что отражено в актуальных клинических рекомендациях [3, 4, 6, 21].
Финансирование. Исследование не имело спонсорской поддержки.
Список литературы Анализ прогнозирования выявления каротидного атеросклероза в зависимости от градаций уровня липопротеина (а)
- Rhainds D., Brodeur M.R., Tardif J.-C. Lipoprotein (a): When to Measure and How to Treat? // Curr. Atheroscler. Rep. - 2021. - Vol. 23, № 9. - P. 51. DOI: 10.1007/s11883-021-00951-2
- Handhle A., Viljoen A., Wierzbicki A.S. Elevated Lipoprotein (a): Background, Current Insights and Future Potential Therapies // Vasc. Health Risk Manag. - 2021. - Vol. 7. - P. 527-542. DOI: 10.2147/VHRM.S266244
- Lipoprotein(a): A Genetically Determined, Causal, and Prevalent Risk Factor for Atherosclerotic Cardiovascular Disease: A Scientific Statement From the American Heart Association / G. Reyes-Soffer, H.N. Ginsberg, L. Berglund, P.B. Duell, S.P. Heffron, P.R. Kamstrup, D.M. Lloyd-Jones, S.M. Marcovina [et al.] // Arterioscler. Thromb. Vasc. Biol. - 2022. - Vol. 42, № 1. - P. e48-e60. DOI: 10.1161/ATV.0000000000000147
- HEART UK consensus statement on Lipoprotein(a): A call to action / J. Cegla, R.D.G. Neely, M. France, G. Ferns, C.D. Byrne, J. Halcox, D. Datta, N. Capps [et al.] // Atherosclerosis. - 2019. - Vol. 291. - P. 62-70. DOI: 10.1016/j.atherosclerosis.2019.10.011
- Kohn B., Ashraf A.P., Wilson D.P. Should Lipoprotein(a) be Measured in Youth? // J. Pediatr. - 2021. - Vol. 228. -P. 285-289. DOI: 10.1016/j.jpeds.2020.08.042
- Use of Lipoprotein(a) in clinical practice: A biomarker whose time has come. A scientific statement from the National Lipid Association / D.P. Wilson, T.A. Jacobson, P.H. Jones, M.L. Koschinsky, C.J. McNeal, B.G. Nordestgaard, C.E. Orringer // J. Clin. Lipidol. - 2019. - Vol. 13, № 3. - P. 374-392. DOI: 10.1016/jjacl.2019.04.010
- Lipoprotein(a) is an independent risk factor for myocardial infarction at a young age / M. Sandkamp, H. Funke, H. Schulte, E. Köhler, G. Assmann // Clin. Chem. - 1990. - Vol. 36, № 1. - P. 20-23.
- Lipoprotein(a) serum concentration and apolipoprotein(a) phenotype correlate with severity and presence of ischemic cerebrovascular disease / G. Jürgens, W.C. Taddei-Peters, P. Költringer, W. Petek, Q. Chen, J. Greilberger, P.F. Macomber, B.T. Butman [et al.] // Stroke. - 1995. - Vol. 26, № 10. - P. 1841-1848. DOI: 10.1161/01.str.26.10.1841
- Lipoprotein(a) interactions with lipid and non-lipid risk factors in patients with early onset coronary artery disease: results from the NHLBI Family Heart Study / P.N. Hopkins, S.C. Hunt, P.J. Schreiner, J.H. Eckfeldt, I.B. Borecki, C.R. Ellison, R.R. Williams, K.D. Siegmund // Atherosclerosis. - 1998. - Vol. 141, № 2. - P. 333-345. DOI: 10.1016/s0021-9150(98)00174-9
- Conventional and Mendelian randomization analyses suggest no association between lipoprotein(a) and early atherosclerosis: the Young Finns Study / M. Kivimäki, C.G. Magnussen, M. Juonala, M. Kähönen, J. Kettunen, B.-M. Loo, T. Lehtimäki, J. Viikari, O.T. Raitakari // Int. J. Epidemiol. - 2011. - Vol. 40, № 2. - P. 470-478. DOI: 10.1093/ije/dyq205
- Lipoprotein(a) levels in familial hypercholesterolemia: an important predictor of cardiovascular disease independent of the type of LDL receptor mutation / R. Alonso, E. Andres, N. Mata, F. Fuentes-Jiménez, L. Badimón, J. López-Miranda, T. Padró, O. Muñiz [et al.] // J. Am. Coll. Cardiol. - 2014. - Vol. 63, № 19. - P. 1982-1989. DOI: 10.1016/jjacc.2014.01.063
- Race is a key variable in assigning lipoprotein(a) cutoff values for coronary heart disease risk assessment: the MultiEthnic Study of Atherosclerosis / W. Guan, J. Cao, B.T. Steffen, W.S. Post, J.H. Stein, M.C. Tattersall, J.D. Kaufman, J.P. McCon-nell [et al.] // Arterioscler. Thromb. Vasc. Biol. - 2015. - Vol. 35, № 4. - P. 996-1001. DOI: 10.1161/ATVBAHA.114.304785
- Increased serum lipoprotein(a) concentrations and low molecular weight phenotypes of apolipoprotein(a) are associated with symptomatic peripheral arterial disease / B. Dieplinger, A. Lingenhel, N. Baumgartner, W. Poelz, H. Dieplinger, M. Haltmayer, F. Kronenberg, T. Mueller // Clin. Chem. - 2007. - Vol. 53, № 7. - P. 1298-1305. DOI: 10.1373/clinchem.2007.088013
- Скрининг семейной гиперхолестеринемии среди пациентов в возрасте до 40 лет, подвергнутых дуплексному сканированию тонных артерий, по данным локального регистра / О.В. Гайсёнок, П.А. Курносов, А.С. Леонов, Д.А. Затейщиков // Терапевтический архив. - 2018. - Т. 90, № 9. - C. 37-41. DOI: 10.26442/terarkh201890937-41
- Gaisenok O., Drapkina O. Gender differences in the detection of carotid atherosclerosis: DUPLEX registry cross-sectional study results // Monaldi Arch. Chest Dis. - 2022. DOI: 10.4081/monaldi.2022.2128
- Randomised trial of endarterectomy for recently symptomatic carotid stenosis: final results of the MRC European Carotid Surgery Trial (ECST) // Lancet. - 1998. - Vol. 351, № 9113. - P. 1379-1387.
- Zwiebel W.J., Pellerito J.S. Introduction to Vascular Ultrasonography. - 5th ed. - Philadelphia: Saunders, 2004. - 752 p.
- Связь липопротеидa(a) с ишемическим инсультом и стенозирующим aтеросклерозом сонных aртерий / Н.А. Тмоян, М.В. Ежов, О.И. Афанасьева, Е.А. Клесарева, М.И. Афанасьева, Т.В. Балахонова, С.Н. Покровский // Журнал неврологии и психиатрии им. С.С. Корсакова. Спецвыпуски. - 2020. - T. 120, № 3-2. - C. 42-48. DOI: 10.17116/jnevro202012003242
- The association between lipoprotein(a) and carotid atherosclerosis in patients with type 2 diabetes without preexisting cardiovascular disease: A cross-sectional study / J.E. Jun, H. Kang, Y.-C. Hwang, K.J. Ahn, H.-Y. Chung, I.-K. Jeong // Diabetes Res. Clin. Pract. - 2021. - Vol. 171. - P. 108622. DOI: 10.1016/j.diabres.2020.108622
- Lipoprotein (a) and carotid atherosclerosis in young patients with stroke / N. Nasr, J.B. Ruidavets, A. Farghali, B. Guidolin, B. Perret, V. Larrue // Stroke. - 2011. - Vol. 42, № 12. - P. 3616-3618. DOI: 10.1161/STR0KEAHA.111.624684
- Familial hypercholesterolemia in children and adolescents: gaining decades of life by optimizing detection and treatment / A. Wiegman, S.S. Gidding, G.F. Watts, M.J. Chapman, H.N. Ginsberg, M. Cuchel, L. Ose, M. Averna [et al.] // Eur. Heart J. - 2015. - Vol. 36, № 36. - P. 2425-2437. DOI: 10.1093/eurheartj/ehv157
- Extreme lipoprotein(a) levels and risk of myocardial infarction in the general population: the Copenhagen City Heart Study / P.R. Kamstrup, M. Benn, A. Tybjaerg-Hansen, B.G. Nordestgaard // Circulation. - 2008. - Vol. 117, № 2. - P. 176-184. DOI: 10.1161/CIRCULATIONAHA.107.715698
- Lipoprotein(a) levels and atherosclerotic plaque characteristics in the carotid artery: The Plaque at RISK (PARISK) study / D.H.K. van Dam-Nolen, A.C. van Dijk, G.A.J.C. Crombag, C. Lucci, M.E. Kooi, J. Hendrikse, P.J. Nederkoorn, M.J.A.P. Daemen [et al.] // Atherosclerosis. - 2021. - Vol. 329. - P. 22-29. DOI: 10.1016/j.atherosclerosis.2021.06.004
- Синдром позвоночно-подключичного обкрадывания (steal-синдром): описание клинического случая, патогенеза заболевания и подходов к лечению / O.B. Гайсёнок, С.А. Бернс, В.Б. Бошков, П.И. Медведев // Российский электронный журнал лучевой диагностики. - 2019. - T. 9, № 4. - C. 177-184. DOI: 10.21569/2222-7415-2019-9-4-177-184
- Extracardiac manifestation of elevated lipoprotein(a) levels—cumulative incidence of peripheral arterial disease and stenosis of the carotid artery / F. van Buuren, J.A. Sommer, T. Kottmann, D. Horstkotte, K.P. Mellwig // Clin. Res. Cardiol. Suppl. - 2015. - Vol. 10. - P. 39-45. DOI: 10.1007/s11789-015-0069-x (in German).
- Comparison of lipoprotein(a) serum concentrations measured by six commercially available immunoassays / H. Scharnagl, T. Stojakovic, B. Dieplinger, H. Dieplinger, G. Erhart, G.M. Kostner, M. Herrmann, W. März [et al.] // Atherosclerosis. - 2019. - Vol. 289. - P. 206-213. DOI: 10.1016/j.atherosclerosis.2019.08.015
- Наблюдательные исследования и регистры. Их качество и роль в современной доказательной медицине / C.Ю. Марцевич, Н.П. Кутишенко, Ю.В. Лукина, М.М. Лукьянов, О.М. Драпкина // Кардиоваскулярная терапия и профилактика. - 2021. - T. 20, № 2. - C. 2786. DOI: 10.15829/1728-8800-2021-2786
- Lipoprotein(a): Knowns, unknowns and uncertainties / M. Ruscica, C.R. Sirtori, A. Corsini, G.F. Watts, A. Sahebkar // Pharmacol. Res. - 2021. - Vol. 173. - P. 105812. DOI: 10.1016/j.phrs.2021.105812


