Анализ результатов коррекции коарктации с гипоплазией дуги аорты: «ascending sliding» против пластики дуги аорты заплатой из легочного гомографта
Автор: Сойнов И.А., Горбатых Ю.Н., Рзаева К.А., Кулябин Ю.Ю., Ничай Н.Р., Войтов А.В., Велюханов И.А., Архипов А.Н., Богачев-Прокофьев А.В., Чернявский А.М.
Журнал: Сибирский журнал клинической и экспериментальной медицины @cardiotomsk
Рубрика: Клинические исследования
Статья в выпуске: 2 т.39, 2024 года.
Бесплатный доступ
Основными осложнениями в отдаленном периоде у детей после устранения обструктивной патологии дуги аорты являются артериальная гипертензия и рекоарктация аорты. Возможно, что персистирующая артериальная гипертензия связана с архитектоникой дуги аорты и характером кровотока в ней. Цель исследования: оценка ближайших и отдаленных результатов после реконструкции дуги аорты в условиях искусственного кровообращения двумя методами: аортопластика методом «ascending sliding» (техника нативными тканями) и аортопластика с помощью заплаты из легочного гомографта (техника с использованием чужеродного материала). Материал и методы. В представленном одноцентровом, пилотном, проспективном рандомизированном исследовании выполнена оценка результатов хирургического лечения коарктации с гипоплазией дуги аорты в условиях искусственного кровообращения. Согласно дизайну исследования, в зависимости от способа коррекции коарктации аорты все пациенты разделены на две группы: аортопластика методом «ascending sliding» (30 пациентов); аортопластика заплатой из легочного гомографта (30 пациентов). Результаты. Летальности в госпитальном периоде не было. В раннем послеоперационном периоде компрессия бронхов или трахеи в группе «ascending sliding» составила 20% против 0% в группе аортопластики с помощью заплаты из легочного гомографта. Рекоарктация аорты в группе аортопластики с помощью заплаты из легочного гомографта составила 30%, в то время как в группе «ascending sliding» рекоарктация отсутствовала. Артериальная гипертензия в группе «ascending sliding» составила 13,3%, а в группе аортопластики с помощью заплаты из легочного гомографта - 56,6%. Заключение. Пациенты после коррекции методом «ascending sliding» имеют выше шанс компрессии бронхов и трахеи в раннем послеоперационном периоде, в то время как пациенты после коррекции методом аортопластики заплатой из легочного гомографта имели более высокую частоту артериальной гипертензии и рекоарткации аорты.
Коарктация, гипоплазия дуги аорты, аортопластика, легочный гомографт, ascending sliding
Короткий адрес: https://sciup.org/149145641
IDR: 149145641 | DOI: 10.29001/2073-8552-2022-625
Текст научной статьи Анализ результатов коррекции коарктации с гипоплазией дуги аорты: «ascending sliding» против пластики дуги аорты заплатой из легочного гомографта
УДК 616.132.1-007.271-007.21-06-089.15
the study was performed in accordance with the standards of clinical practice and the principles of the Declaration of Helsinki and was approved by the Ethics Committee of the Meshalkin National Medical Research Center, Ministry of Health of Russian Federation (No. 10, 2016) Soynov I.A., Gorbatykh Yu.N., Rzaeva K.A., Kulyabin Yu.Y., Nichay N.R., Voitov A.V., Velyukhanov I.A., Arkhipov A.N., Bogachev-Prokophiev A.V., Chernyavsky A.M. Results of correction of coarctation with hypoplasia of the aortic arch: “ascending sliding” against plasty of the aortic arch with a patch from the pulmonary homograph. Siberian Journal of Clinical and Experimental Medicine. 2024;39(2):122–132.
Основными осложнениями в отдаленном периоде у детей после устранения обструктивной патологии дуги аорты являются артериальная гипертензия и рекоарктация аорты [1]. Большинство авторов соотносят высокую распространенность артериальной гипертензии и рекоарктации с выбранной методикой реконструкции и вариантом формирования анастомоза [2, 3]. В последнее время предпочтение отдавалось вариантам аорто-пластики, исключающим применение чужеродных материалов, для снижения частоты отдаленных осложнений [2]. Однако M. Lee и соавт. в своем исследовании определили, что применение нативных тканей не только не снижает частоту осложнений, но и показывает высокую частоту артериальной гипертензии в сравнении с чужеродными материалами [4]. D.M. Seo и коллеги предполагают, что высокая частота артериальной гипертензии может быть связана с сильным натяжением тканей и, как следствие, ремоделированием дуги аорты в готическую форму [5].
Цель исследования: оценка ближайших и отдаленных результатов после реконструкции дуги аорты в условиях искусственного кровообращения двумя методами: аор-топластика методом «ascending sliding» (техника нативными тканями) и аортопластика с помощью заплаты из легочного гомографта (техника с использованием чужеродного материала).
Материал и методы
В представленном одноцентровом, пилотном, проспективном рандомизированном исследовании выполнена оценка результатов хирургического лечения коарктации с гипоплазией дуги аорты в условиях искусственного кровообращения. Всем пациентам выполнено хирургическое вмешательство с октября 2016 по июнь 2022 гг. в ФГБУ «НМИЦ им. акад. Е.Н. Мешалкина» Минздрава России. Проведение клинического исследования было одобрено локальным этическим комитетом института.
Согласно дизайну исследования (рис. 1), в зависимости от способа коррекции коарктации аорты все пациенты разделены на две группы:
– I группа: аортопластика методом «ascending sliding» (30 пациентов);
– II группа: аортопластика заплатой из легочного гомографта (30 пациентов).
Первичная конечная точка:
– Артериальная гипертензия
Вторичная конечная точка:
– Изменения эластических свойств аорты (по эхокардиографии оценивались два показателя: растяжимость (D) и индекс ригидности стенки аорты (SI)).
– Ремоделирование дуги аорты (с помощью муль-тиспиральной компьютерной томографии (МСКТ исследования)).
– Рекоарктация аорты (с помощью МСКТ исследования).
Критерии включения: новорожденные и младенцы с коарктацией и гипоплазией дуги аорты, коррекция которой возможна только в условиях искусственного кровообращения.
Критерии исключения: унивентрикулярная гемодинамика; активный инфекционный процесс; любая патология почек; тяжелая неврологическая патология; полиор-ганная недостаточность; гестационный возраст < 32 нед.; отказ родителей от участия в исследовании.
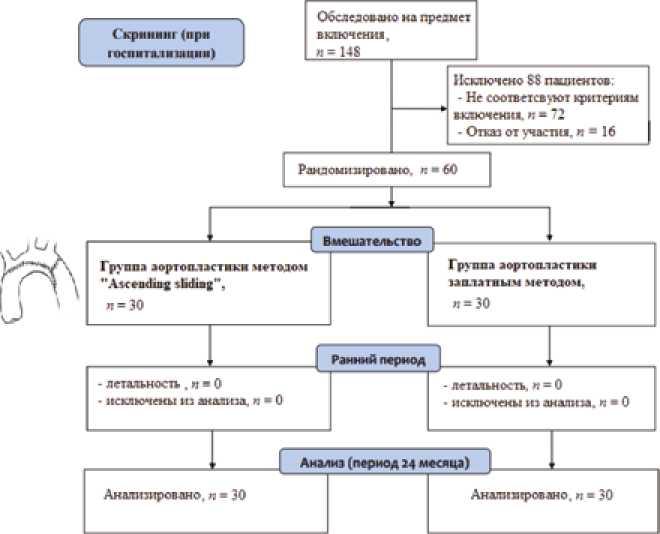

Рис. 1. Дизайн исследования
Fig. 1. Study design
Методы исследования
Полиорганная недостаточность была оценена как острое поражение двух и более органов.
Абдоминальный синдром устанавливался как любое проявление интестинальной недостаточности, включая как обратимые проявления некротизирующего энтеро- колита новорожденных, так и необратимые, требующие хирургического вмешательства.
Парадоксальная артериальная гипертензия устанавливалась как повышение артериального давления выше 95-го перцентиля распределений этих параметров для соответствующих ростовых показателей в первые 24– 48 ч.
Повреждение возвратного нерва устанавливалась как парез левой голосовой связки с помощью бронхоскопии аппаратом Olympus XP 60 (Olympus Medical Systems Corp., Japan).
Компрессия бронхов или трахеи устанавливалась как любое сужение бронха или трахеи, возникшее после оперативного вмешательства с помощью бронхоскопии, и подтверждалось с помощью МСКТ исследования.
Артериальная гипертензия устанавливалась после трехкратного измерения артериального давления на приеме у детского кардиолога и подтверждалась с помощью суточного мониторирования артериального давления. Критериями диагностики артериальной гипертензии, по данным суточного мониторирования, являются повышение средних значений систолического и / или диастолического артериального давления выше 95-го перцентиля распределений этих параметров для соответствующих ростовых показателей.
Индекс массы миокарда рассчитывался путем деления массы миокарда левого желудочка на площадь поверхности тела. Гипертрофия левого желудочка диагностировалась в тех случаях, когда индекс массы миокарда превышал 95%-й процентиль для соответствующих ростовых показателей; повышение выше нормативных значений.
Эластические свойства аорты оценивались в М-ре-жиме на двух уровнях: 1 – проксимальный отдел восходящей аорты – на 5 мм дистальнее синотубулярного гребня; 2 – нисходящая брюшная аорта, дистальнее диафрагмы, но проксимальнее чревного ствола. Курсор устанавливался строго перпендикулярно центральной линии аорты. Производились измерения максимальных и минимальных размеров движения стенки аорты. Параллельно производились измерения давления на правой верхней конечности.
Оценивались два показателя: растяжимость (D) и индекс ригидности стенки Ао (SI) по формулам:
D = ((Аs– Аd)/ (Аd × (Ps– Pd) × 1333) × 107 (10–3 кРа–1),
SI = (ln(Ps/ Pd))/(Ds– Dd)/ Dd), где A = (D/2)2 × π;
где Аs и Аd – площадь в систолу и диастолу, мм2 Ps и
Pd – систолическое и диастолическое артериальное давление, мм рт. ст.
Рекоарктация аорты устанавливалась как повторное сужение дуги аорты при значении Z-value < –2 и более.
Ремоделирование дуги аорты оценивались в левой передне-косой проекции. Производилось вычисление горизонтальной части аорты, которое было определено как максимальное расстояние между серединами восходящей и нисходящей аорты, проходящей по осевой плоскости правой легочной артерии, и высота дуги аорты, которая определялась линией между максимальной точкой дуги аорты и горизонтальной частью.
Готическая дуга аорты характеризуется острым углом между восходящей и нисходящей аортой, при этом горизонтальная часть дуги аорты должна быть укорочена или должна полностью отсутствовать. Амбразурная дуга характеризуется прямоугольной формой с нормальной горизонтальной частью дуги. Романическая дуга аорты характеризуется обычной формой дуги с нормальной горизонтальной частью.
Статистический анализ
Количественные показатели представлены медианой и межквартильным интервалом, Ме ( Q 1 ; Q 3 ), категориальные показатели описываются абсолютными ( n ) и относительными (%) частотами, n (%). Сравнение количественных показателей в двух независимых группах выполнено по критерию Манна – Уитни. Для выявления статистически значимых предикторов ранних и поздних послеоперационных осложнений строились однофакторные и многофакторные модели логистической регрессии. Для сравнения категориальных показателей в независимых группах использовался χ 2 -критерий Пирсона или точный критерий Фишера. Критическое значение уровня статистической значимости при проверке гипотез составляло 0,05. Статистическая обработка полученных данных проводилась с использованием пакета прикладных программ STATA 14 (StataCorp LP, College Station, USA).
Характеристика пациентов
Таблица 1. Базовые и антропометрические характеристики пациентов до операции
Table 1. Basic and anthropometric characteristics of patients before surgery
|
Параметры |
Аортопластика заплатой из легочного гомографта, n = 30 |
Аортопластика методом «ascending sliding», n = 30 |
P |
|
Возраст, дни |
18,5 (7; 35) |
11 (8; 15) |
0,19 |
|
Рост, см |
52 (49; 56) |
52 (50; 54) |
0,93 |
|
Вес, кг |
3,2 (2,7; 3,8) |
3,5 (3; 3,85) |
0,33 |
|
Площадь поверхности тела |
0,22 (0,2; 0,24) |
0,22 (0,2;0,23) |
0,73 |
|
Пол (муж), n (%) |
17 (56,6) |
17 (56,6) |
>0,99 |
|
Искусственная вентиляция легких до операции, n (%) |
7 (23,3) |
9 (30) |
0,77 |
|
Фиброэластоз, n (%) |
7 (23,3) |
4 (13,3) |
0,50 |
|
Сердечно-легочный коэффициент до операции |
59,5 (56; 61) |
59,5 (58; 62) |
0,44 |
|
Фракция выброса левого желудочка до операции, % |
68 (60; 71) |
66,5 (59; 71) |
0,65 |
|
Индекс конечно-диастолического объема левого желудочка до операции, мл/м2 |
41,6 (31,8; 50) |
36,6 (27,2; 45) |
0,13 |
|
Z-score проксимальной дуги |
–3 (–3,7; –2,3) |
–3,75 (–4,5; –3) |
0,02 |
|
Z-score дистальной дуги |
–3,1 (–4; –2,6) |
–3,28 (–4,5; –2,8) |
0,31 |
|
Z-score перешейка аорты |
–5,2 (–6; 4,5) |
–5,9 (–7,6; –5,2) |
0,06 |
|
Дефект межпредсердной перегородки, n (%) |
18 (60) |
21 (70) |
0,83 |
|
Дефект межжелудочковой перегородки, n (%) |
14 (46,6) |
18 (60) |
0,43 |
|
Двустворчатый клапан, n (%) |
13 (43,3) |
11 (36,6) |
0,79 |
|
Простагландин Е1, n (%) |
22 (73,3) |
21 (70) |
> 0,99 |
|
Продолжительность инфузии простагландина Е1, дни |
4 (2; 9) |
3 (1,8; 8,5) |
0,78 |
Как видно из таблицы 1, значимым отличием между группами был только z-score проксимальной дуги аорты, который был достоверно выше в группе «ascending sliding». Другие показатели не отличалась между группами.
Хирургическая процедура
Хирургический доступ к аорте осуществлялся через срединную стернотомию с использованием искусственного кровообращения с использованием одного из трех методов органопротекции: глубокой гипотермической остановки кровообращения, селективной антеградной перфузии головного мозга или полнопоточной перфузии.
Хирургическая коррекция методом «ascending sliding»
Устранение коарктации аорты с гипоплазией дуги аорты выполнялась методом «ascending sliding», которая была предложена E.D. McKenzie и соавт. [6].
Первым этапом выполняли резекцию коарктации аорты и накладывали анастомоз по типу «конец в конец» на три четверти диаметра аорты между проксимальной частью нисходящей аорты и дистальной дугой. Дистальный отдел восходящей аорты пересекали на уровне проксимальной части дуги аорты и продольно рассекали восходящую аорту в переднебоковой области, создавая лоскут. Затем выполнялся разрез по внутренней кривизне дуги аорты, формировался анастомоз между лоскутом восходящей аорты и дугой аорты (рис. 2).
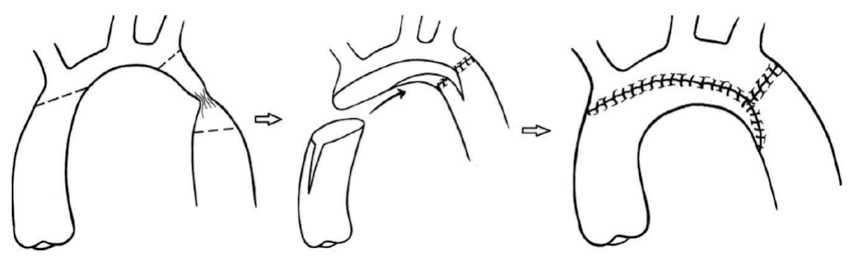
Рис. 2. Схема процедуры «ascending sliding», E.D. McKenzie et al. [6]
Fig. 2. Scheme of the “ascending sliding” procedure, E.D. McKenzie et al. [6]
Хирургическая коррекция методом аортопластики заплатой из легочного гомографта
Основной этап оперативного вмешательства начинался с резекции суженного участка аорты. По малой кривезне рассекалась дуга аорты и проксимальная часть восходящей аорты. Первым этапом формировался анастомоз по типу «конец в конец» на три четверти диаметра аорты между проксимальной частью нисходящей аорты и дистальной дугой. Вторым этапом выполнялась пластика дуги аорты заплатой из легочного гомографта (рис. 3).
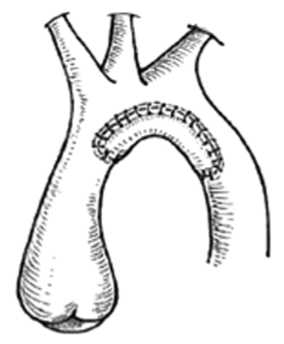
Рис. 3. Схема аортопластики заплатой из легочного гомографта
Fig. 3. Diagram of aortoplasty with a patch from a pulmonary homograph
Результаты
Ранний послеоперационный период
В раннем послеоперационном периоде летальных исходов не было в обеих группах.
Результаты раннего послеоперационного периода представлены в таблице 2.
Как видно из таблицы 2, статистически значимо выше в группе аортопластики заплатой из легочного гомографта были период наблюдения в отделении реанимации и интенсивной терапии и Z-score дистальной дуги аорты, в то время как компрессия бронхов и трахеи была статистически значимо выше в группе аортопластики методом
«ascending sliding». Другие параметры не отличались статистически значимо между группами.
Для выявления предикторов ранних послеоперационных осложнений строились однофакторные модели логистической регрессии.
Единственным выявленным статистически значимым фактором риска ранних послеоперационных осложнений в общей группе пациентов был вес, ОШ = 0,06; ДИ ОШ (0,005;0,71), p = 0,026.
Всем пациентам с компрессией бронха или трахеи выполнена процедура аортопексии, 3 пациента (50%) были выписаны с трахеостомой.
Эластические свойства аорты представлены в таблице 3.
Таблица 2. Результаты раннего послеоперационного периода
Table 2. Results of the early postoperative period
|
Параметры |
Аортопластика заплатой из легочного гомографта, n = 30 |
Аортопластика методом «ascending sliding», n = 30 |
P |
|
Индекс кардиотонической поддержки в первые 24 ч |
7,5 (3,5; 15) |
5,5 (2,5; 9,5) |
0,39 |
|
Продолжительность искусственной вентиляции легких, ч |
84,5 (38; 168) |
72 (48; 120) |
0,33 |
|
Период наблюдения в отделении реанимации и интенсивной терапии, дни |
7 (5; 11) |
5 (4; 9) |
0,02 |
|
Сердечно-легочный коэффициент после операции |
54 (52; 58) |
54 (52; 57) |
0,84 |
|
Фракция выброса левого желудочка после операции, % |
70 (63; 76) |
72,5 (70; 78) |
0,14 |
|
Индекс конечно-диастолического объема левого желудочка после операции, мл/м2 |
40,1 (31,2; 47,9) |
38,5 (30,8; 46,5) |
0,62 |
|
Z-score проксимальной дуги после операции |
0,3 (–0,4; 0,9) |
0,2 (–0,5; 0,7) |
0,51 |
|
Z-score дистальной дуги после операции |
0,6 (0; 1,2) |
0,39 (–0,15; 0,58) |
0,03 |
|
Осложнения раннего п/о периода, n (%) |
25 (83,3) |
25 (83,3) |
> 0,99 |
|
Повреждение возвратного нерва, n (%) |
6 (20) |
7 (23,3) |
> 0,99 |
|
Пневмония, n(%) |
5 (16,6) |
2 (6,6) |
0,42 |
|
Абдоминальный синдром, n (%) |
8 (26,6) |
5 (16,6) |
0,53 |
|
Острая почечная недостаточность, n (%) |
11 (36,6) |
9 (30) |
0,78 |
|
Нагноение мягких тканей, n (%) |
2 (6,6) |
1 (3,3) |
> 0,99 |
|
Тромбоз бедренных артерий, n (%) |
1 (3,3) |
1 (3,3) |
> 0,99 |
|
Полиорганная недостаточноть, n (%) |
5 (16,6) |
2 (6,6) |
0,42 |
|
Хилоторакс, n (%) |
4 (13,3) |
2 (6,6) |
0,67 |
|
Компрессия бронхов или трахеи, n (%) |
0 (0) |
6 (20) |
0,024 |
|
Парадоксальная гипертензия, n (%) |
14 (46,6) |
16 (51,3) |
0,79 |
|
Время госпитального периода, дни |
22,5 (18; 28) |
23 (19; 29) |
0,66 |
Таблица 3. Эластические свойства восходящей и нисходящей аорты
Table 3. Elastic properties of the ascending and descending aorta
|
Параметры |
Аортопластика заплатой из легочного гомографта, n = 30 |
Аортопластика методом «ascending sliding», n = 30 |
P |
|
|
Восходящая аорта |
||||
|
До операции |
Ригидность |
5,65 (4,8; 6,4) |
5,4 (4,7; 6,5) |
0,67 |
|
Растяжимость |
40 (32; 47) |
44 (37; 52) |
0,056 |
|
|
После операции |
Ригидность |
2,2 (2; 2,4) |
2,5 (2,3; 2,9) |
< 0,01 |
|
Растяжимость |
103 (98; 119) |
85,5 (71; 100) |
< 0,01 |
|
|
12 мес. |
Ригидность |
4,05 (3,3; 5,4) |
3,25 (2,65; 3,5) |
< 0,01 |
|
Растяжимость |
42 (35; 59) |
64,5 (54; 81) |
< 0,01 |
|
|
24 мес. |
Ригидность |
4,65 (3,9; 6,1) |
3,35 (3; 4,1) |
< 0,01 |
|
Растяжимость |
35,5 (29; 54) |
62,5 (49; 69) |
< 0,01 |
|
|
Нисходящая аорта |
||||
|
До операции |
Ригидность |
2 (1,7; 2,2) |
2,1 (1,7; 2,2) |
0,56 |
|
Растяжимость |
143 (109; 170) |
132,5 (92; 174) |
0,46 |
|
|
После операции |
Ригидность |
1,9 (1,7; 2) |
1,95 (1,5; 2,1) |
0,46 |
|
Растяжимость |
125 (109; 156) |
115 (100; 139) |
0,1 |
|
|
12 мес. |
Ригидность |
2,55 (2,4; 3) |
2,25 (2; 2,5) |
< 0,01 |
|
Растяжимость |
77 (68; 93) |
92,5 (72; 114) |
0,01 |
|
|
24 мес. |
Ригидность |
3,5 (3; 4,4) |
2,5 (2,2; 2,7) |
< 0,01 |
|
Растяжимость |
58,5 (40; 74) |
86,5 (76; 100) |
< 0,01 |
|
Как видно из таблицы 3, сразу после операции эластические свойства аорты выше в группе аортопластики заплатой из легочного гомографта, однако в отдаленном периоде через 12 и 24 мес. эластические свойства лучше в группе аортопластики методом «ascending sliding».
Ремоделирование дуги аорты оценивалось с помощью МСКТ исследования на контрольные точки 24 мес.
Анализ отдаленных осложнений
Летальности в отдаленном периоде не было. Отдаленные осложнения были у 4 (13,3%) пациентов в группе «ascending sliding» и у 18 (60%) пациентов в группе аор-топластики заплатой из легочного гомографта, p < 0,01
(табл. 4).
Как видно из таблицы 4, количество случаев артериальной гипертензии и рекоарктации аорты было достоверно выше в группе аортопластики заплатой из легочного гомографта, в то время как количество романических дуг аорты было выше в группе «ascending sliding».
Предикторы отдаленных осложнений представлены в таблице 5.
Как видно из таблицы 5, предикторами рекоарктации аорты являются романическая дуга аорты, которая снижает риск рекоарктации аорты на 93%, в то время как рассасывающийся шовный материал увеличивал риск рекоарктации аорты в 29,1 раза.
Таблица 4. Осложнения отдаленного периода
Table 4. Complications of the long-term period
|
Параметры |
Аортопластика заплатой из легочного гомографта, n = 30 |
Аортопластика методом «ascending sliding», n = 30 |
P |
|
Артериальная гипертензия, n (%) |
17 (56,6) |
4 (13,3) |
0,001 |
|
Скрытая артериальная гипертензия, n (%) |
7 (23,3) |
3 (10) |
0,299 |
|
Явная артериальная гипертензия, n (%) |
10 (33,3) |
1 (3,3) |
0,018 |
|
Аневризмы аорты, n (%) |
0 (0) |
0 (0) |
> 0,99 |
|
Рекоарктация аорты, n (%) |
9 (30) |
0 (0) |
0,002 |
Ремоделирование дуги аорты
|
Готическая дуга аорты, n (%) |
1 (3,3) |
0 (0) |
> 0,99 |
|
Амбразурная дуга аорты, n (%) |
11 (36,7) |
5 (16,6) |
0,14 |
|
Романическая дуга аорты, n (%) |
18 (60) |
25 (84) |
0,047 |
Таблица 5. Модели логистической регрессии для отдаленных осложнений
Table 5. Logit-regression models for long-term complications
|
Модели логистической регрессии для рекоарктаций |
||||
|
Параметры |
Однофакторный анализ |
Многофакторный анализ |
||
|
ОР (95% ДИ) |
P |
ОР (95% ДИ) |
P |
|
|
Вес |
0,61 (0,19; 1,8) |
0,382 |
0,23 (0,03; 1,4) |
0,141 |
|
Возраст |
1,09 (0,98; 1,05) |
0,303 |
1,06 (0,99; 1,14) |
0,052 |
|
Романическая дуга |
0,07 (0,01; 0,44) |
0,003 |
0,06 (0,004; 0,99) |
0,049 |
|
Рассасывающийся шовный материал |
41,1 (6,3; 267,9) |
0,001 |
29,1 (3,4; 203,8) |
0,003 |
|
Модели логистической регрессии для артериальной гипертензии |
||||
|
Фиброэластоз |
7,4 (1,7; 32,2) |
0,008 |
35,2 (1,8; 67) |
0,029 |
|
Возраст |
1,04 (1,01; 1,08) |
0,027 |
1,1 (0,99; 1,37) |
0,056 |
|
Амбразурная дуга |
37 (6,85; 200) |
0,001 |
43,1 (3,2; 162) |
0,021 |
|
Ригидность восходящей аорты через 12 мес. |
10,2 (2,9; 35,9) |
0,001 |
14,8 (1,4; 155) |
0,024 |
|
Индекс массы миокарда левого желудочка |
4,5 (1,4; 14,9) |
0,012 |
5,6 (0,99; 0,29) |
0,061 |
Факторами риска артериальной гипертензии были фиброэластоз эндокарда левого желудочка, увеличивающий шансы артериальной гипертензии в 35,2 раза, амбразурная дуга, увеличивающая шансы артериальной гипертензии в 43,1 раза, ригидность восходящей аорты через 12 мес. после операции, увеличивающая риск артериальной гипертензии в 14,8 раза.
Лечение рекоарктации аорты в 33,3% (3 пациента) осуществлялось с помощью баллонной дилатации и в 66,7% (6 пациентов) осуществлялось открытым хирургическим методом (в 3 случаях – резекция рекоарктации с формированием косого расширенного анастомоза, в 3 случаях – непрямая исмопластика заплатой из гомографта).
Обсуждение
С момента первой операции по коррекции коарктации аорты, выполненной C. Crafoord и G. Nylin, реконструктивная хирургия аорты претерпела большие изменения
[1]. Одни авторы модифицировали методы коррекции коарктации с использованием только своих тканей, другие же активно применяли чужеродный материал (аутоперикард, ксеноперикард, дакрон или гомографт) [2, 4, 5, 7]. Сторонники использования собственных тканей аргументировали свой выбор низкой частотой отдаленных осложнений (аневризм аорты, артериальной гипертензии, рекоарктации аорты), в то время как приверженцы применения чужеродного материала ссылались на отсутствие компрессии трахеи и бронхов из-за излишнего натяжения тканей [2, 5]. В 2012 г. M.G. Lee опубликовала работу, где показала, что использование аутотканей не снижает частоту артериальной гипертензии, а, наоборот, увеличивает частоту артериальной гипертензии по сравнению с использованием чужеродных заплат [4]. D.M. Seo и соавт. предположили, что использование аутопластических реконструкций дуги аорты приводит к излишнему натяжению тканей и, как следствие, к ангуляции дуги аорты [5].
Как профилактику готической дуги аорты D.M. Seo и со-авт. предложили использовать аортопластику заплатой из легочного гомографта [5]. L.E. De León и E.D. McKenzie предположили, что это может происходить из-за перекручивания аорты, что приводит как к ангуляции дуги аорты, так и к артериальной гипертензии [8]. Решением данной проблемы авторы считают использование техники «ascending sliding». На основании двух теорий было построено наше пилотное исследование, которое включало комплексное обследование пациентов на разных этапах наблюдения пациентов.
В нашем исследовании отсутствовала летальность как на госпитальном этапе, так и в отдаленном периоде времени. В настоящее время летальность при плановых операциях не превышает 10%, а основными факторами риска летального исхода являются прогрессирующая сердечная недостаточность, острое повреждение почек, септический процесс (включая пневмонию и некротические энтероколит), а также тяжелая сопутствующая патология. В нашем исследовании мы исключили септических пациентов и пациентов с тяжелой сопутствующей патологией, что, возможно, повлияло на выживаемость пациентов.
Осложнения в раннем послеоперационном периоде имели 83,3% пациентов. Большая часть пациентов имела парадоксальную артериальную гипертензию (повышение артериального давления в первые 24–48 ч), которая в зависимости от возраста может сопровождать до 100% пациентов [9]. В нашем исследовании в зависимости от метода коррекции частота парадоксальной гипертензии составила от 46,6 до 51,3%. Причинами парадоксальной артериальной гипертензии являются повышение катехоламинов вследствие хирургического стресса и увеличение уровня ангиотензина вследствие реперфузионного синдрома почек после восстановления нормального кровотока по аорте [9]. Лечение парадоксальной гипертензии начинают (в зависимости от частоты сердечных сокращений) либо с β-блокаторов, либо с ингибиторов АПФ, при необходимости используют комбинацию этих препаратов.
Еще одним частым осложнением было повреждение возвратного нерва, которое в зависимости от метода коррекции присутствовало у 20–23,3% пациентов. По литературным данным, частота паралича голосовых связок после коррекции коарктации аорты колеблется в широких пределах от 1,7 до 67%, однако большинство исследований показывают, что этот показатель составляет менее 9% [10, 11]. Эта разница в значительной степени связана с тем, проводится ли рутинное клиническое ларингоскопическое исследование, или же диагноз устанавливается на основании клинических данных. Существует два наиболее распространенных механизма повреждения возвратного гортанного нерва: прямое во время операции или непрямое повреждение нерва при интубации [10, 11]. Как правило, в большинстве случаев симптомы стридора после операции связаны с отеком окружающих тканей, а процент восстановления работы голосовых связок составляет более 82%. В нашем исследовании восстановление работы голосовых связок составило 100%.
В группе «ascending sliding» мы обнаружили у 20% пациентов разной степени компрессию левого бронха или трахеи, потребовавшую впоследствии выполнения повторной операции – аортопексии. E.D. McKenzie указывает на излишнее натяжение тканей аорты у маловесных пациентов как на причину компрессии бронхов и трахеи. С целью профилактики сдавления E.D. McKenzie пред- лагает на большом протяжении мобилизировать восходящую и нисходящую аорту, а также брахиоцефальные сосуды, не использовать методику «ascending sliding» у маловесных пациентов. [8]. Проведя анализ факторов риска, было выявлено, что единственным фактором риска был малый вес пациента. Поэтому, согласно результатам нашего исследования, как и в работе E.D. McKenzie, для профилактики компрессии левого бронха и трахеи не рекомендуем использовать метод «ascending sliding» у пациентов менее 2,8 кг.
Хилоторакс в нашем исследовании присутствовал в зависимости от метода коррекции в 6,6–13,3%. В большинстве случаев травме подвергаются относительно небольшие притоки грудного протока. Многие авторы в своих исследованиях показали, что первоначально проводится консервативная терапия диетой, обогащенной среднецепочечными триглицеридами [12]. В нашем исследовании консервативное лечение помогло большинству пациентов, однако одному пациенту выполнялась рестернотомия для устранения источника лимфореи.
Абдоминальный синдром в зависимости от группы встречался в 16,6–26,6% случаев. Абдоминальный синдром возникает в первые 48 ч после операции. У детей старшего возраста абдоминальный синдром возникает вследствие пульсирующего кровотока после длительного дефицита кровообращения, в то время как у новорожденных детей он появляется вследствие длительного использования препаратов простагландинов Е1, Простагландин Е1 снижает диастолическое давление в сосудах желудочно-кишечного тракта (ЖКТ), что может способствовать ишемизации стенки кишечника. Ухудшает состояние ЖКТ и поступающая кровь с низким уровнем насыщения кислорода из открытого артериального протока в нисходящую аорту [13]. В нашем исследовании консервативное лечение позволило всем пациентам восстановить функцию ЖКТ в раннем послеоперационном периоде.
В отдаленном периоде осложнения были у 13,3% пациентов в группе «ascending sliding» и у 60% пациентов в группе аортопластики заплатой из легочного гомографта. Наиболее частым осложнением отдаленного периода была артериальная гипертензия, которая в общей когорте составила 35%. Согласно данным разных исследований, артериальная гипертензия может достигать 90% из числа оперированных пациентов, даже если эти пациенты были оперированы в младенчестве. Часто артериальная гипертензия может зависеть от способа реконструкции дуги аорты; так, некоторые авторы показывают преимущество аутопластических операций над операциями с использованием чужеродного материала. В то же время M.G. Lee и P. Luijendijk в своих исследованиях показали, что аутопластические операции и использование чужеродного материала при реконструкции дуги аорты применяются одинаково широко [4, 14].
В нашем исследовании мы выявили, что частота артериальной гипертензии в группе реконструкции дуги аорты с применением заплаты из легочного гомографта была значительно выше, чем в группе аутопластической операции методом «ascending sliding» – 56,6 против 13,3%. Такая разница может быть объяснена кальцификацией заплаты из легочного гомографта и снижением эластических свойств аорты или ангуляцией дуги аорты. В нашем исследовании мы обнаружили, что ангуляция дуги аорты (готическая и амбразурная дуги аорты) чаще встречается в группе аортопластики заплатой из легочного гомографта.
Избыточное расширение аорты с помощью заплат из чужеродного материала может приводить к формированию абразурных дуг, а неправильное моделирование заплаты – к формированию готических дуг аорты. При использовании собственных тканей также существует высокий риск образования готических дуг аорты из-за сильного натяжения тканей. Поэтому многие авторы рекомендуют широко мобилизовать восходящую и нисходящую аорту и на большом протяжение мобилизовать брахиоцефальные сосуды [8].
Мы считаем, что ангуляция дуги аорты может выступать пусковым механизмом увеличения активности матриксных металлопротеаз II и IX типа, трансформирующего фактора роста, который приводит к повышению распада эластина и снижению эластичности стенки, в то время как уменьшение активности тканевых ингибиторов металлопротеаз приводит к хаотичному накоплению коллагена [15]. Также матриксные металлопротеазы провоцируют повышение артериального давления через прямое взаимодействие с фармакологическими рецепторами или вазореактивными регуляторными белками. Хотя исследования продолжаются, но уже определено, что металлопротеазы могут разрушать многие субстраты, включая внутриклеточные компоненты сердечно-сосудистой системы [15].
Подтверждает нашу теорию и проведенный многофакторный анализ, который выявил ригидность восходящей аорты через 12 мес. и амбразурную дугу как факторы риска. Помимо этого, большинство пациентов с артериальной гипертензией приходятся на срок от 10 до 20 мес. после операции. Именно такой временной срок требуется для полного ремоделирования дуги аорты и увеличения активности металлопротеаз и трансформирующего фактора роста.
Еще одним фактором риска является фиброэластоз эндокарда. Фиброэластоз сопровождает коарктацию аорты в 50% случаев. Влияние фиброэластоза эндокарда на артериальную гипертензия описано во многих исследованиях [2, 15]. Фиброэластоз эндокарда приводит в той или иной степени к дисфункции левого желудочка, вызывая его концентрическую гипертрофию. R. Crepaz и соавт., P. Ou и соавт. показали достоверное увеличение артериального давления при гипертрофии левого желудочка [16, 17]. Поэтому фиброэластоз эндокарда является дополнительным фактором артериальной гипертензии, даже если у пациента отсутствуют внешние факторы, связанные с дугой аорты.
Мы также установили, что 47% пациентов имели скрытую гипертензию или гипертонический ответ на физическую нагрузку, 53% пациентов имели стойкую гипертензию, требующую приема гипотензивных препаратов. A. Hager и соавт. показали, что лишь 25% имели скрытую гипертензию, однако их когорта больных включала как детей раннего возраста, так и взрослых пациентов [18]. Мы считаем, что с ростом ребенка скрытая гипертензия может переходить в стойкую форму. Этому может способствовать ремоделирование дуги аорты или снижение эластических свойств аорты, как мы описывали это ранее. При выявлении артериальной гипертензии назначалась или корректировалась антигипертензионная терапия. При назначении терапии учитывался характер артериальной гипертензии и гипертрофия левого желудочка. Базовым препаратом являлся капотен, который улучшал функцию эндотелия, снижал экспрессию провоспали-тельных цитокинов. Он также дополнялся анаприлином, который снижал постнагрузку на левый желудочек [15].
Еще одним отдаленным осложнением была рекоарктация аорты, частота рекоарктации аорты варьирует от 0 до 50% в зависимости от метода реконструкции дуги аорты [3]. В нашем исследовании не было рекоарктации аорты при реконструкции дуги аорты методом «ascending sliding», в то время как при коррекции гипоплазии дуги аорты методом аортопластики заплатой из легочного гомографта частота рекоарктации аорты составила 30%. В зависимости от факторов рекоарктация аорты появляется в сроки от 2 до 12 мес. В нашем исследовании большинство пациентов с рекоарктацией аорты приходились на срок менее 6 мес. после операции. Факторами риска рекоарктации аорты может быть остаточная дуктальная ткань, остаточная гипоплазия аорты, низкая масса тела на момент первичной операции, или же это может быть тип коррекции обструкции дуги аорты [3].
В нашем исследовании одним из факторов риска был рассасывающийся шовный материал, используемый при реконструкции дуги аорты. Шовный материал уже описывали как фактор риска рекоарктации аорты. Основной механизм заключается в асептическом воспалении при рассасывании шовного материала, который приводит к грубому фиброзу на линии шва и разрастанию неоинтимы. Вторым фактром риска была романическая дуга аорты, которая снижала риск рекоарктации аорты. L. Olivieri и соавт. показали гемодинамические изменения по данным магнитно-резонансной томографии с использованием программы 4D flow [19]. По данным авторов, ангуляция дуги аорты (готическая и амбразурная дуги аорты) из-за геометрических неровностей или «углов на дуге аорты» приводит к локальному напряжению стенки аорты, где может формироваться фиброз. Фиброз будет препятствовать нормальному росту аорты.
Лечение рекоарктации мы всегда начинали с баллонной ангиопластики, согласно клиническим рекомендациям [20]. Однако из-за выраженного фиброза баллонная ангиопластика была не эффективна в 66,7% случаев. Поэтому у этих пациентов выполнялась отрытая хирургическая операция либо резекция суженного участка аорты с формированием косого расширенного анастомоза либо пластика заплатой из легочного гомографта. При хирургической коррекции у всех пациентов был выраженный фиброз с разрастанием неоинтимы. После хирургических коррекции рекоарктации аорты во всех случаях был хороший гемодинамический результат.
Ограничения исследования
Исследование выполнено в одном центре, что является ограничением. Малое количество пациентов также могло повлиять на результаты.
Заключение
Пациенты после коррекции методом «ascending sliding» имеют выше шанс компрессии бронхов и трахеи в раннем послеоперационном периоде, в то время как пациенты после коррекции методом аортопластики заплатой из легочного гомографта имели более высокую частоту артериальной гипертензии и рекоарктации аорты.
Независимыми факторами риска артериальной гипертензии были фиброэластоз эндокарда, амбразурная дуга аорты, ригидность восходящей аорты через 12 мес. Фактором риска рекоарктации аорты были романическая дуга аорты и рассасывающийся шовный материал.
Список литературы Анализ результатов коррекции коарктации с гипоплазией дуги аорты: «ascending sliding» против пластики дуги аорты заплатой из легочного гомографта
- Chetan D., Mertens L.L. Challenges in diagnosis and management of coarctation of the aorta. Curr. Opin. Cardiol. 2022;37(1):115-122. https://doi.org/10.1097/HCO.0000000000000934.
- Soynov I., Sinelnikov Y., Gorbatykh Y., Omelchenko A., Kornilov I., Nichay N. et al. Modified reverse aortoplasty versus extended anastomosis in patients with coarctation of the aorta and distal arch hypoplasia. Eur. J. Cardiothorac. Surg. 2018;53(1):254-261. https://doi.org/10.1093/ejcts/ezx249.
- Dias M.Q., Barros A., Leite-Moreira A., Miranda J.O. Risk Factors for recoarctation and mortality in infants submitted to aortic coarctation repair: a systematic review. Pediatr. Cardiol. 2020;41(3):561-575. https://doi.org/10.1007/s00246-020-02319-w.
- Lee M.G., Kowalski R., Galati J.C., Cheung M.M., Jones B., Koleff J. et al. Twenty-four-hour ambulatory blood pressure monitoring detects a high prevalence of hypertension late after coarctation repair in patients with hypoplastic arches. J. Thorac. Cardiovasc. Surg. 2012;144(5):1110-1116. https://doi.org/10.1016/j.jtcvs.2012.08.013.
- Seo D.M., Park J., Goo H.W., Kim Y.H., Ko J.K., Jhang W.K. Surgical modification for preventing a gothic arch after aortic arch repair without the use of foreign material. Interact. Cardiovasc. Thorac. Surg. 2015;20:504-509. https://doi.org/10.1093/icvts/ivu442.
- McKenzie E.D., Klysik M., Morales D.L., Heinle J.S., Fraser C.D., Kovalchin J. Ascending sliding arch aortoplasty: a novel technique for repair of arch hypoplasia. Ann. Thorac. Surg. 2011;91(3):805-810. https://doi.org/10.1016/j.athoracsur.2010.10.038.
- Kulyabin Y.Y., Voitov A.V., Nichay N.R., Soynov I.A., Zubritskiy A.V., Bogachev-Prokophiev A.V. Single-stage off-pump repair of coarctation of the aorta and ventricular septal defects in children. Interact. Cardiovasc. Thorac. Surg. 2022;35(2):ivac186. https://doi.org/10.1093/icvts/ivac186.
- De León L.E., McKenzie E.D. Aortic arch advancement and ascending sliding arch aortoplasty for repair of complex primary and recurrent aortic arch obstruction. Semin. Thorac. Cardiovasc. Surg. Pediatr. Card. Surg. Annu. 2017:63-66. https://doi.org/10.1053/j.pcsu.2016.09.007.
- Jonas R.A. Comprehensive surgical management of congenital heart disease; 2nd ed. CRC Press/Taylor & Franic Group; 2014. https://doi.org/10.1201/b13497.
- Alfares F.A., Hynes C.F., Ansari G., Chounoune R., Ramadan M., Shaughnessy C. et al. Outcomes of recurrent laryngeal nerve injury following congenital heart surgery: A contemporary experience. J. Saudi Heart Assoc. 2016;28(1):1-6. https://doi.org/10.1016/j.jsha.2015.05.002.
- Fürniss H.E., Hummel J., Stiller B., Grohmann J. Left recurrent laryngeal nerve palsy following aortic arch stenting: A case report. World J. Cardiol. 2019;11(12):316-321. https://doi.org/10.4330/wjc.v11.i12.316.
- Christofe N.M., Pessotti C.F.X., Paiva L., Jatene I.B. incidence and treatment of chylothorax in children undergoing corrective surgery for congenital heart diseases. Braz. J. Cardiovasc. Surg. 2017;32(5):390-393. https://doi.org/10.21470/1678-9741-2017-0011.
- Рзаева К.А., Сойнов И.А., Горбатых А.В., Кулябин Ю.Ю., Войтов А.В., Иванцов С.М. и др. Критическая коарктация аорты. Возможности диагностики и методов хирургической коррекции коарктации аорты у новорожденных. Патология кровообращения и кардиохирургия. 2020;24(2):46-62. https://doi.org/10.21688/1681-3472-2020-2-46-62.
- Luijendijk P., Bouma B.J., Vriend J.W., Vliegen H.W., Groenink M., Mulder B.J. Usefulness of exerciseinduced hypertension as predictor of chronic hypertension in adults after operative therapy for aortic isthmic coarctation in childhood. Am. J. Cardiol. 2011;108(3):435-439. https://doi.org/10.1016/j.amjcard.2011.03.063.
- Сойнов И.А., Архипов А.Н., Кулябин Ю.Ю., Горбатых Ю.Н., Корнилов И.А., Омельченко А.Ю. и др. Артериальная гипертензия у детей после коррекции коарктации аорты: проблемы диагностики и лечения. Патология кровообращения и кардиохирургия. 2018;22(4):21-34. https://doi.org/10.21688/1681-3472-2018-4-21-34.
- Crepaz R., Cemin R., Romeo C., Bonsante E., Gentili L., Trevisan D. et al. Factors affecting left ventricular re-modelling and mechanics in the long term follow-up after successful repair of coarctation of the aorta. Cardiol. Young. 2005;15(2):160-167. https://doi.org/10.1017/S104795110500034X.
- Ou P., Celermajer D., Jolivet O., Buyens F., Herment A., Sidi D. et al. Increased central aortic stiffness and left ventricular mass in normotensive young subjects after successful coarctation repair. Am. Heart. J. 2008;155(1):187-193. https://doi.org/10.1016/j.ahj.2007.09.008.
- Hager A., Kanz S., Kaemmerer H., Schreiber C., Hess J. Coarctation long-term follow up: significance of arterial hypertension in a cohort of 404 patients up to 27 years after surgical resection of isolated coarctationevenin the absence of recordation and prosthetic material. J. Thorac. Cardiovasc. Surg. 2007;134(3):738-745. https://doi.org/10.1016/j.jtcvs.2007.04.027.
- Olivieri L., de Zélicourt D., Haggerty C., Ratnayaka K., Cross R.R., Yoganathan A.P. Hemodynamic modeling of surgically repaired coarctation of the aorta. Cardiovasc. Eng. Technol. 2011;2(4):288-295. https://doi.org/10.1007/s13239-011-0059-1.
- Feltes T.F., Bacha E., Beekman R.H. 3rd, Cheatham J.P., Feinstein J.A., Gomes A.S. et al. American Heart Association Congenital Cardiac Defects Committee of the Council on Cardiovascular Disease in the Young; Council on Clinical Cardiology; Council on Cardiovascular Radiology and Intervention; American Heart Association. Indications for cardiac catheterization and intervention in pediatric cardiac disease: a scientific statement from the American Heart Association. Circulation. 2011;123(22):2607-2652. https://doi.org/10.1161/CIR.0b013e31821b1f10.


