Анализ результатов лечения пациентов с культура‑негативной перипротезной инфекцией тазобедренного и коленного суставов в зависимости от подхода к ее определению
Автор: Олейник Ю.В., Божкова С.А.
Журнал: Гений ортопедии @geniy-ortopedii
Рубрика: Обзорная статья
Статья в выпуске: 5 т.31, 2025 года.
Бесплатный доступ
Введение. Одним из наиболее частых и разрушительных осложнений после тотального эндопротезирования тазобедренного сустава является перипротезная инфекция (ППИ). Эффективность лечебного процесса определяет рациональный выбор хирургической операции и возможность назначения этиотропной антибактериальной терапии в послеоперационном периоде. В 5–30 % случаев имеет место культура-негативная инфекция (КНИ), при которой этиология инфекционного процесса остается неустановленной на протяжении всего периода лечения. На сегодняшний день в профессиональном сообществе отсутствует единый подход к определению изучаемого феномена. Цель работы — оценить результаты лечения пациентов с культура-негативной перипротезной инфекцией тазобедренного и коленного суставов в зависимости от подхода к ее определению, а также сформулировать возможные пути снижения частоты встречаемости данной патологии. Материалы и методы. Поиск литературных источников осуществляли в электронных базах данных eLIBRARY, PubMed (MEDLINE), ScienceDirect, Google Scholar согласно рекомендациям PRISMA. В исследование включены оригинальные статьи и серии случаев на русском и английском языках, посвященные лечению хронической культура-негативной ППИ тазобедренного и/или коленного суставов у пациентов старше 18 лет с применением любых хирургических операций, в которых имелся хотя бы один показатель эффективности лечения. Проанализированы существующие подходы к определению перипротезной КНИ коленного и тазобедренного суставов и исходы лечения пациентов с данной патологией, а также сформулированы возможные пути снижения доли пациентов с неизвестной этиологией инфекционного процесса. Результаты и обсуждение. Проведенный анализ научных публикаций не позволил сделать вывод об очевидной разнице эффективности купирования инфекции в зависимости от подхода к определению культура-негативной ППИ. Впервые эффективность лечения больных с КНИ рассмотрена в зависимости от подхода к определению данной патологии. Выявлена значительная неоднородность как в трактовках КНИ, так и в выборе хирургических методик. Высокая доля благоприятных исходов указывает на важность корректного выбора препаратов для эмпирической антибиотикотерапии (АБТ) и регулярного мониторинга спектра внутрибольничных возбудителей. Предложены возможные пути снижения частоты встречаемости отрицательных результатов микробиологических исследований. Заключение. Значимые различия в эффективности лечения пациентов с КНИ в зависимости от подхода к определению данного термина не были обнаружены. Пути снижения частоты встречаемости данной патологии направлены на модификацию факторов, которые обуславливают отрицательные результаты МБИ образцов биоматериалов и удаленных конструкций.
Хроническая перипротезная инфекция, дооперационное обследование, микробиологическое исследование, ревизионное эндопротезирование
Короткий адрес: https://sciup.org/142246018
IDR: 142246018 | УДК: [616.728.2+616.728.3]:616.71-089.843-06:616.022.1-036.8 | DOI: 10.18019/1028-4427-2025-31-5-678-689
Текст научной статьи Анализ результатов лечения пациентов с культура‑негативной перипротезной инфекцией тазобедренного и коленного суставов в зависимости от подхода к ее определению
Перипротезную инфекцию (ППИ) справедливо называют одним из наиболее разрушительных осложнений после тотального эндопротезирования тазобедренного сустава (ТБС), ухудшающего качество и общую продолжительность жизни пациентов [1, 2]. Инфекционные осложнения в эндопротезировании ложатся тяжелым социально-экономическим бременем на систему здравоохранения [3, 4], при этом риск неудач остается достаточно высоким, находясь в пределах 10–29 % при выполнении операции двухэтапного ревизионного эндопротезирования, которую до настоящего времени считают «золотым стандартом» [5, 6].
Одним из ключевых факторов, значимо влияющих на эффективность лечения, является этиология инфекционного процесса, — вид микробного возбудителя и его антибиотикочувствительность [7]. Повсеместно увеличивается доля больных, у которых микробиологический диагноз не был поставлен по результатам дооперационных исследований, а в некоторых случаях и по результатам интраоперационных посевов. Данный феномен известен как культура-негативная ППИ, частота которой достигает 5–30 % [8, 9]. В качестве основных причин культура-негативной ППИ часто указывают прием антимикробных препаратов менее чем за две недели до выполнения микробиологических исследований, наличие низковирулентных или труднокультивируемых возбудителей ППИ [10], а также особенности патогенеза инфекционного процесса, ассоциированного с ортопедическими имплантатами (наличие в организме пациента депо бактерий, к которым относят биопленки, внутриклеточно расположенные бактерии и колонизированные остеоцитарно-лакунарные канальцы) [11]. Все эти факторы делают практически невозможным рутинное назначение этиотропной антибиотикотерапии (АБТ) на момент выполнения санирующей операции пациенту с ППИ.
В профессиональном сообществе отсутствует единство взглядов в отношении данного феномена. Некоторые авторы под культура-негативной ППИ понимают отсутствие роста возбудителя по данным дооперационных микробиологических исследований (МБИ), при этом возбудитель может быть обнаружен в интраоперационно взятых материалах [12–17]. Другие авторы под этим термином понимают полное отсутствие данных о патогене [18–22]. Описанные различия обуславливают разброс частоты встречаемости данной патологии, и, как следствие, невозможность разработки единых рекомендаций по лечению профильных пациентов.
Цель работы — оценить результаты лечения пациентов с культура-негативной перипротезной инфекцией тазобедренного и коленного суставов в зависимости от подхода к ее определению, а также сформулировать возможные пути снижения частоты встречаемости данной патологии.
МАТЕРИАЛЫ И МЕТОДЫ
Систематический обзор выполнен в соответствии с международными требованиями PRISMA ( англ .: Preferred Reporting Items for Systematic Reviews and Meta-Analyses) [23].
Поиск литературных источников осуществлен в электронных базах данных eLIBRARY, PubMed (MEDLINE), ScienceDirect, Google Scholar.
Запрос для поиска в базах данных PubMed (MEDLINE), ScienceDirect, Google Scholar, Ovid, на основании рекомендаций E. Aromataris, D. Riitano [24], включал комбинацию ключевых слов: ("periprosthetic joint infection" or "prosthetic joint infection" or PJI) and ("single-stage" or "one-stage" or "two-stage" or "2-stage" or "revision" or "revisions") and ("culture negative" or "negative") and ("culture positive" or "positive").
Запрос для поиска в базе данных eLIBRARY включал следующую комбинацию ключевых слов: «культуронегативная инфекция», «культуро-негативная инфекция», «культуронегативная перипротезная инфекция», «хроническая перипротезная инфекция тазобедренного сустава ИЛИ хроническая пери-протезная инфекция коленного сустава». Ретроспективно поиск не был ограничен, дата последнего запроса — 04.02.2025. Поисковые запросы в перечисленных базах данных использовали в различных комбинациях в качестве предварительной возможности.
На первом этапе определены критерии включения и исключения статей в исследование.
Критерии включения :
-
— статьи на русском и английском языках;
-
— оригинальные статьи и серии случаев, включающие пять и более наблюдений, посвященные лечению хронической культура-негативной перипротезной инфекции тазобедренного и/или коленного суставов, инфекционных осложнений после эндопротезирования тазобедренного и/или коленного суставов;
-
— возраст пациентов — старше 18 лет;
-
— наличие хотя бы одного показателя эффективности лечения (доли благоприятных, неблагоприятных исходов, уровень выживаемости);
-
— любые хирургические операции по поводу ППИ.
Критерии невключения :
-
— статьи по ветеринарии;
-
— работы, посвященные последствиям кокситов;
-
— обзоры литературы, метаанализы, учебники, главы книг, письма, мнения экспертов;
-
— статьи, посвященные лечению исключительно острой ППИ;
-
— статьи, посвященные диагностике ППИ;
-
— клинические случаи;
-
— отсутствие в исследовании групп сравнения (культура-негативной и культура-позитивной групп);
-
— отсутствие четко описанного определения культура-негативной ППИ в публикации.
В обнаруженных статьях проведен ручной поиск ссылок для обнаружения дополнительных публикаций, которые могли быть включены в исследование. Далее проверены резюме публикаций на предмет соответствия критериям включения и невключения, осуществлен поиск дублирующих работ с целью их элиминации. На заключительном этапе изучены полнотекстовые статьи.
В ходе анализа включенных работ оценены следующие показатели:
-
— общая информация об исследовании (авторы, страна и год публикации, тип и длительность исследования, длительность наблюдения, диагностические критерии, численность клинических групп, вовлеченные суставы, типы хирургических вмешательств и антибиотикотерапия);
-
— результаты исследования, включающие уровень благоприятных и неблагоприятных исходов лечения.
Под рецидивом инфекции понимали наличие общих или системных признаков ППИ, повторные санирующие операции на том же суставе по поводу инфекционного процесса, летальный исход, развившийся вследствие ППИ. Для определения благоприятного исхода лечения пациентов с ППИ использовали международные рекомендации, основанные на методе Делфи ( англ .: Delphi-based international multidisciplinary consensus) [25].
Дизайн исследования
В ходе первоначального поиска выявлено 850 публикаций, из которых 640 (комментарии, главы из книг, статьи, неподходящие по тематике, дубликаты) исключены. После анализа названий и рефератов на соответствие тематике поиска отобрано 50 публикаций. После проверки наличия полных текстов статей в открытом доступе, а также их соответствия критериям включения и исключения в окончательную выборку вошли 26 исследований (рис. 1).
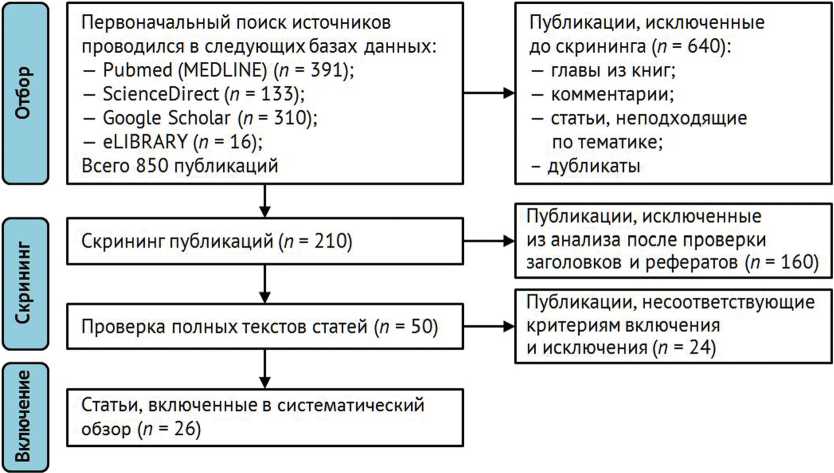
Рис. 1. Блок-схема включения статей в исследование с использованием предпочтительных элементов отчетности (протокол PRISMA)
Отобранные исследования опубликованы в период 2007–2024 гг., включают 7 713 случаев ППИ. Длительность наблюдения составляла от 12 до 120 месяцев. Для диагностики ППИ критерии MSIS ( англ .: Musculoskeletal Infection Society) [26] использованы в 17 исследованиях, критерии ICM ( англ .: International Consensus Meeting) [27] — в пяти исследованиях, критерии IDSA ( англ .: Infectious Diseases Society of America) [28] — в одном исследовании, критерии EBJIS ( англ .: European Bone and Joint Infection Society) [29] — в одном исследовании. В четырех исследованиях использованы критерии, разработанные отдельными авторами, еще в трех публикациях данные отсутствовали.
Риск систематической ошибки
Проведена методологическая оценка качества каждого исследования в соответствии с критериями CEBM ( англ .: Oxford Center for EvidenceBased Medicine) с целью определения уровня доказательности исследования. Как для анализа серий случаев, так и для когортных исследований применен чек-лист JBI ( англ .: Joanna Briggs Institute Critical Appraisal tools), состоящий из 11 вопросов (рис. 2).
Статистический анализ
В статистический анализ включены данные всех 26 статей. Анализ проводили с использованием программы IBM SPSS Statistics v.26 (IBM Corporation). Для описания количественных показателей применена проверка на нормальность распределения по критериям Шапиро – Уилка и Колмогорова – Смирнова. Для описания количественных переменных использовали медиану (Ме), в качестве мер рассеяния — нижний (Q1) и верхний (Q3) квартили (25–75 % МКИ). Сравнение в исследуемых группах осуществляли по критерию Манна – Уитни. Различия между группами считали статистически значимыми при p < 0,05.
Все исследования распределены в две
Авторы
Л.В. Любимова с соавт. [9] M.S. Ibrahim MS etaL [12] BJ. Greenfield et al. [13]
L Zanna etal. [14]
L.C. T. de Araujo et al. [15]
-
G. Bori etal. [16]
D. Karczewski etal. [17]
-
H. Lu etal. [18]
Z. Xu etal. [19]
-
A. Santos о etal. [20]
-
H. Li etal. [37] J.S. Kang etal. [38]
J. Wang etal. [39] T.LTanetal. [40]
B.Jietal. [41]
J. Bongers et al. [42]
N. Razii etal. [43]
M. van Sloten et al. [44]
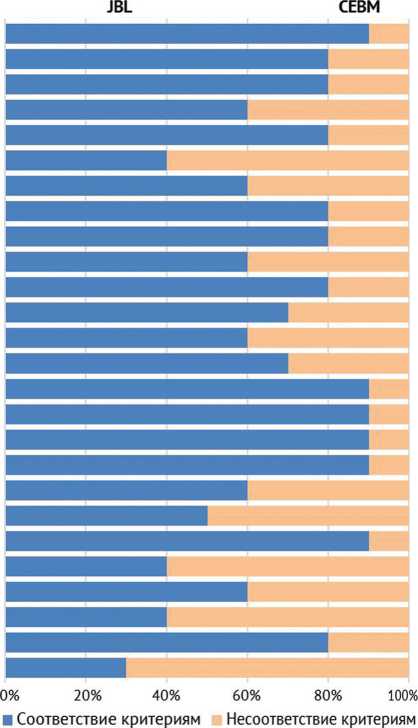
Рис. 2. Результаты методологической оценки качества включенных в исследование статей
группы в зависимости от подхода к определению КНИ. В первую группу, в которой авторы рассматривали КНИ как отсутствие роста возбудителя во всех образцах, включены 20 публикаций. Во вторую группу, в которой учитывали отсутствие роста микроорганизмов только в дооперационных исследованиях, включены шесть публикаций. Для каждого исследования учтена доля благоприятных исходов лечения КНИ. Далее рассчитывали средний уровень купирования инфекции в каждой группе (Ме, МКИ). С применением критерия Манна – Уитни выполнена проверка наличия статистически значимых различий между группами.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Изучение результатов лечения больных в зависимости от подхода к определению культура-негатив-ной ППИ не позволяет сделать вывод об очевидной разнице в эффективности купирования инфекции. Так, в первой группе (КНИ как отсутствие роста возбудителя во всех образцах) эрадикация инфекции достигнута в среднем в 91,5 % случаев (МКИ = 78,0–95,5 %), распределение данных не было нормальным ( р = 0,03). Во второй группе (отсутствие роста микроорганизмов только в дооперационных исследованиях) доля благоприятных исходов лечения КНИ в среднем составила 92,0 % наблюдений (МКИ = 86,0–97,0 %), распределение результатов не отличалось от нормального ( р = 0,326).
Между двумя группами исследований не обнаружено статистически значимой разницы в эффективности лечения ППИ (р = 0,582). Обращает на себя внимание факт, что исследования, в которых авторы описывали КНИ как отсутствие роста возбудителя только до операции, включают малое число наблю- дений и не во всех случаях имеют группу сравнения, а в ряде публикаций не указано, какие критерии использовали авторы для подтверждения диагноза перипротезной инфекции (табл. 1). Все анализируемые исследования были ретроспективными.
Таблица 1
Характеристики исследований, посвященных лечению пациентов с культура-негативной ППИ, в зависимости от подхода к ее определению
|
Авторы [№ источника] |
Сустав, % |
Анализ. период |
Критерии ППИ |
Определение КНИ |
Всего случаев |
КНИ |
Операции |
||
|
КС |
ТБС |
абс. |
% |
||||||
|
Л.В. Любимова с соавт. [9] |
100 |
2017–2021 |
ICM (2018) |
До + интра |
103 |
30 |
29,1 |
2э реЭП |
|
|
M.S. Ibrahim MS et al. [12] |
100 |
2007–2012 |
Berbari EF et al. [22] |
До + интра |
100 |
50 |
50 |
2э реЭП |
|
|
B.J. Greenfield et al. [13] |
100 |
2006–2015 |
MSIS (2011) |
До |
105 |
28 |
26,7 |
1э реЭП |
|
|
L. Zanna et al. [14] |
45,5 |
54,5 |
2016–2018 |
НД |
До |
640 |
22 |
3,4 |
1э реЭП |
|
L.C. T. de Araujo et al. [15] |
50,0 |
50,0 |
2003–2020 |
ICM (2018) |
До + интра |
53 |
6 |
11,1 |
DAIR, 2э реЭП, 1э реЭП, РА, ампутация, экзартикуляция, артродез |
|
G. Bori et al. [16] |
100 |
1998–2007 |
НД |
До |
24 |
6 |
15,8 |
1э реЭП |
|
|
D. Karczewski et al. [17] |
100 |
2011–2021 |
EBJIS (2021) |
До |
30 |
10 |
33,3 |
1э реЭП |
|
|
H. Lu et al. [18] |
34,5 |
65,5 |
2008–2020 |
MSIS (2013) |
До + интра |
87 |
24 |
27,6 |
2э реЭП |
|
Z. Xu et al. [19] |
41,6 |
58,4 |
2012–2017 |
ICM (2018), MSIS (2011) |
До + интра |
77 |
24 |
31,2 |
DAIR, 2э реЭП, 1э реЭП |
|
A. Santoso et al. [20] |
100 |
2010–2015 |
MSIS (2011) |
До + интра |
84 |
27 |
32,1 |
2э реЭП |
|
|
H.R. Choi et al. [21] |
50,0 |
50,0 |
2000–2009 |
MSIS (2013) |
До + интра |
175 |
40 |
23 |
2э реЭП |
|
E.F. Berbari et al. [22] |
55,0 |
45,0 |
1990–1999 |
НД |
До + интра |
897 |
60 |
7 |
DAIR, 2э реЭП, РА |
|
D. Malekzadeh et al. [30] |
50,0 |
50,0 |
1985–2000 |
НД |
До + интра |
270 |
135 |
50 |
DAIR, 2э реЭП, 1э реЭП, РА, ампутация |
|
R. Huang et al. [31] |
44,0 |
56,0 |
2000–2007 |
MSIS (2011) |
До + интра |
250 |
48 |
19,2 |
DAIR, 2э реЭП |
|
Y.H. Kim et al. [32] |
100 |
1991–2008 |
McPherson et al. [33] |
До + интра |
191 |
51 |
26,7 |
DAIR, 2э реЭП |
|
|
Y.H. Kim et al. [34] |
100 |
2001–2008 |
MSIS (2011) |
До + интра |
242 |
102 |
42,1 |
DAIR, 2э реЭП |
|
|
M.S. Cha et al. [35] |
100 |
1998–2011 |
MSIS (2011) |
До + интра |
76 |
22 |
29,0 |
2э реЭП |
|
|
T.L. Tan et al. [36] |
62,9 |
37,1 |
2000–2014 |
MSIS (2013) |
До + интра |
1045 |
159 |
15,2 |
2э реЭП |
|
H. Li et al. [37] |
100 |
2003–2014 |
MSIS (2011) |
До + интра |
129 |
18 |
13,9 |
1э реЭП, 2э реЭП |
|
|
J.S. Kang et al. [38] |
100 |
1996–2015 |
MSIS (2011) |
До + интра |
85 |
15 |
17,6 |
2э реЭП |
|
|
J. Wang et al. [39] |
100 |
2003–2006 |
MSIS (2011) |
До + интра |
58 |
19 |
32,7 |
2э реЭП |
|
|
T.L. Tan et al. [40] |
37,0 |
63,0 |
2000–2014 |
MSIS (2013) |
До + интра |
996 |
219 |
22 |
DAIR, 2э реЭП, 1э реЭП |
|
B. Ji et al. [41] |
100 |
2009–2016 |
McPherson et al. [33], MSIS (2011) |
До + интра |
243 |
51 |
21 |
1э реЭП |
|
|
J. Bongers et al. [42] |
100 |
2003–2013 |
MSIS (2013) |
До |
113 |
53 |
46,9 |
2э реЭП |
|
|
N. Razii et al. [43] |
100 |
2006–2016 |
MSIS (2011), IDSA, ICM (2013, 2018) |
До |
84 |
16 |
19 |
1э реЭП |
|
|
M. van Sloten et al. [44] |
74,3 |
25,7 |
2013–2018 |
EBJIS (2021), ICM (2018), MSIS (2013) |
До + интра |
1556 |
70 |
4,5 |
DAIR, 2э реЭП, 1э реЭП |
Примечание : 1э — одноэтапное; 2э — двухэтапное; реЭП — реэндопротезирование; DAIR — обработка раны, антибиотики и фиксация имплантата; РА — резекционная артропластика
Существующие подходы к определению культура-негативной ППИ
На данный момент в сообществе травматологов-ортопедов отсутствует единое мнение о том, в каком именно случае перипротезная инфекция может быть названа культура-негативной. Впервые термин "culture-negative PJI" был описан E.F. Berbari et al., как отсутствие роста аэробных или анаэробных возбудителей при микробиологическом исследовании образцов тканей, окружающих эндопротез. Авторы перечисляли следующие диагностические критерии: наличие гноя в области эндопротеза, увеличение количества лейкоцитов (> 1,7 × 103/мл) и/или доли полиморфоноядерных нейтрофилов (> 65 %) в синовиальной жидкости, наличие острого воспаления по данным гистологического исследования, наличие свищевого хода, сообщающегося с эндопротезом [22]. Частота встречаемости культура-негативной ППИ в данном исследовании составила 7 % (60/897), при этом более чем у половины (53 %) пациентов в анамнезе имелись указания на предшествующий прием антибактериальных препаратов. J. Palan et al. указывают на необходимость дифференцировки «истинно-негативного» результата предоперационного МБИ (7–15 % наблюдений), когда речь, скорее, идет об асептическом расшатывании, и «ложно-негативного», когда по ряду причин невозможно выделить возбудитель инфекционного процесса, однако его наличие не вызывает сомнений [45]. В соответствии с этим все случаи предполагаемой культура-негативной ППИ могут быть разделены на две большие группы. В первую группу включены пациенты с достоверной перипротезной инфекцией, этиология которой в данный момент не может быть установлена. Ко второй группе авторы предлагают отнести пациентов с предполагаемой перипротезной инфекцией, когда результаты МБИ тканей из области пораженного сустава отрицательны, и отсутствуют однозначные признаки инфекции (видимое нагноение или наличие функционирующего свищевого хода). Описанная клиническая картина может указывать на наличие низковирулентных или атипичных возбудителей, например грибов или бактерий рода Mycobacterium spp., Propionibacterium spp. и др. Такое разделение представляется обоснованным и целесообразным, так как пациенты обеих групп значительно отличаются по степени выраженности симптомов и по х рактеру течения инфекции. Необходимо отметить, что не во всех публикациях, посвященных культура-негативной ППИ, четко прописаны критерии КНИ для включения пациентов в исследование.
Чаще всего под термином "culture-negative PJI" понимают отсутствие роста аэробных и анаэробных возбудителей во всех образцах, взятых как в дооперационном периоде, так и в ходе оперативного вмешательства [9, 17–22]. В публикациях, в которых авторы использовали описанный подход, частота встречаемости культура-негативной ППИ составляет 7–30,8 % случаев. Так, в исследовании H. Lu et al. доля пациентов с неизвестной этиологией инфекции составила 27,6 %, при этом в 25,0 % наблюдений описан функционирующий свищевой ход, в 91,7 % случаев наличие воспаления подтверждено данными гистопатологического исследования, в 70,8 % случаев в ходе операции обнаружен гной в области эндопротеза [19]. В работе Л.В. Любимовой с соавт. доля пациентов без роста патогена составила 29,1 %, при этом только у 76,6 % пациентов инфекционный процесс подтвержден согласно критериям ICM (2018), тогда как в группе культура-позитивной ППИ данный показатель составил 98,6 % ( р = 0,0006) [9]. И хотя клиническая картина в группах была сопоставима, в предоперационном периоде показатели СОЭ, СРБ крови, а также уровень лейкоцитов в синовиальной жидкости были значимо выше в группе, где возбудитель ППИ был идентифицирован ( p < 0,05). С этими данными соотносятся результаты H.R. Choi et al., согласно которым доля больных с КНИ составила 23 % в анализируемой выборке, при этом показатели СОЭ у них были значимо ниже, чем в группе пациентов с положительными культурами [19]. Предшествующее госпитализации лечение антибактериальными препаратами значительно чаще встречалось в группе без роста возбудителя ( p = 0,005).
В ряде научных работ можно встретить иной подход, когда термин "culture-negative" применяют в тех случаях, когда рост возбудителя отсутствует только в предоперационном периоде. Так, M.S. Ibrahim et al., основываясь на наличии или отсутствии роста до выполнения хирургического вмешательства, выделили две равные группы пациентов, наличие перипротезной инфекции было подтверждено критериями E.F. Berbari et al. [18]. В то же время авторы указывают, что результаты МБИ образцов биоматериалов от пациентов с культура-негативной ППИ были отрицательны на всех этапах лечения. По мнению авторов, наибольшее влияние на увеличение вероятности отсутствия роста возбудителя оказывал прием антибактериальных препаратов в предоперационном периоде ( p = 0,003, OR 4.1), а также предшествующее лечение перипротезной инфекции в других стационарах ( p = 0,001, OR 3.1).
B.J. Greenfield et al. оценивали степень влияния наличия данных о возбудителе в дооперационном периоде на эффективность применения одноэтапного реэндопротезирования. Необходимо отметить, что авторы не вводили понятие культура-негативной инфекции как таковое, а разделяли пациентов на две группы в зависимости от того, был результат МБИ до операции положительным или отрицательным [13]. Так, этиология ППИ на момент оперативного вмешательства была известна всего в 27 % наблюдений.
Иной подход к вопросу расширения показаний для одноэтапной методики продемонстрирован в работе L. Zanna et al., — в изучаемую выборку включены те пациенты, у которых результаты МБИ были отрицательными только в дооперационном периоде, их доля составила 3,4 % [14]. Отсутствием роста возбудителя авторы считали отрицательные результаты двух микробиологических исследований синовиальной жидкости и одной открытой биопсии. Примечательно, что в половине наблюдений, включенных в исследование, из интраоперационно взятых тканевых биоптатов выделены микробные ассоциации. G. Bori et al. при изучении эффективности одноэтапного реэндопротезирования с применением бедренных компонентов бесцементной фиксации установили, что у шести (15,8 %) пациентов отсутствовали данные о возбудителе на момент хирургического вмешательства [16]. Однако в последующем в пяти случаях из интраоперационно взятых биоптатов был получен рост коагулазо-негативных стафилококков и в одном наблюдении — рост Peptostreptococcus spp .
Группа ученых из клиники Charité в Берлине выдвинула в своем исследовании более радикальную гипотезу о том, что определение патогена перед выполнением одноэтапного реэндопротезирования не является обязательным [17]. По мнению авторов, применение одноэтапной методики может в боль- шей степени зависеть от состояния мягких тканей и кости, соматического статуса пациента и анамнеза заболевания, чем от данных о возбудителе инфекционного процесса. Необходимо подчеркнуть, что авторы не вводят понятие "culture-negative PJI", однако в ходе обсуждения неоднократно ссылаются на работы, посвященные данной патологии.
Существующие подходы к лечению пациентов с культура-негативной ППИ
На данный момент в профессиональном сообществе травматологов-ортопедов накоплен определенный опыт лечения пациентов с культура-негативной ППИ, позволяющий анализировать исходы применения различных методик хирургического лечения, в том числе в сравнении с результатами лечения пациентов с культура-позитивной инфекцией. По результатам метаанализа Y. H. Lai et al., включающего 11 исследований, в среднем у 32,5 % пациентов (9,9–73,3 %) этиология инфекционного процесса не установлена [46]. При этом исходы лечения культура-негативной и культура-позитивной ППИ значимо не различались (OR = 1,20, 95 % ДИ: 0,84–1,70). Эффективность двухэтапного реэндопротезирования составила 82,5 % в каждой из групп, эффективность одноэтапного реэндопротезирования — 90,6 % и 94,5 % соответственно. Обращает на себя внимание, что в метаанализ включены исследования, посвященные лечению пациентов с острой ППИ [32; 47], что предполагает проведение периоперационной антибиотикопрофилактики, которая может повлиять на результаты МБИ суставной жидкости. В частности, в работе Y.H. Kim et al. более половины (51 %) наблюдений в культура-негативной группе классифицированы как острая (ранняя) инфекция [32]. Кроме того, нельзя исключить влияние анти-биотико-содержащего костного цемента, который применяли для фиксации компонентов эндопротеза. Помимо указанных факторов, к ограничениям этого исследования относят преимущественно ретроспективный характер включенных работ, использование в них различных диагностических критериев как самой перипротезной инфекции, так и понятий рецидива и реинфекции, а также включение в изучаемые выборки пациентов с патологией как коленного, так и тазобедренного суставов.
С приведенными данными соотносятся результаты другого метаанализа 30 исследований, посвященных сравнению эффективности лечения пациентов с ППИ известной и неизвестной этиологий [48]. Исходы лечения пациентов с хронической ППИ после выполнения двухэтапного реэндопротезирования были значимо лучше у пациентов с неизвестным возбудителем инфекции, чем в случаях с идентифицированным патогеном, — купирование инфекции достигнуто в 83,9 % и 79,6 % соответственно ( р = 0,002). Эффективность одноэтапного реэндопротезирования не имела значимых отличий между сравниваемыми группами, — 88,5 % и 92,4 % соответственно ( р = 0,23). Примечательно, что авторы не дают однозначного определения термину "culture-negative" и не проводят отбор публикаций по данному принципу, что может негативно сказываться на достоверности полученных результатов. Несмотря на целый ряд ограничений, данный метаанализ представляет собой одну из наиболее масштабных работ по данной теме.
Необходимо отметить, что отсутствие данных о возбудителе длительное время считалось противопоказанием для применения одноэтапной методики, так как в таком случае возможность назначения этиотропной АБТ сразу после операции исключена [49]. В то же время данное вмешательство является крайне привлекательным как для врача, так и для пациента, позволяя избежать повторной госпитализации, операции, а значит и повторных курсов АБТ, сократить период реабилитации, что позволит пациенту скорее вернуться к привычному образу жизни. В связи с этим в последнее время появляется все больше работ, посвященных успешному расширению показаний к данному вмешательству [19, 41, 50 51]. Большинство авторов сообщают о сопоставимых результатах применения одноэтапной методики в группах культура-негативной и культура-позитивной ППИ [17, 19, 41, 50, 51]. Крайне высокая эффективность продемонстрирована при сочетании одноэтапного реэндопротезирования с внутрисуставным введением ванкомицина пациентам с неизвестной этиологией ППИ, — в 90,2 % случаев инфекция была купирована [50]. Как утверждают авторы, внутрисуставное введение антимикробных препаратов позволяет добиться высоких концентраций в очаге инфекции при отсутствии системных токсических эффектов, которые характерны для классической системной высокодозной терапии [52]. В то же время Z. Xu et al. сообщают о меньшей эффективности одноэтапной методики у пациентов в культура-негативной группе, нежели в культура-позитивной, при этом частота развития осложнений системной антибиотикотерапии значимо отличается, — 58,3 % и 11,3 % соответственно ( p < 0,05) [19]. Пациенты из группы КНИ получали в послеоперационном периоде комбинацию ванкомицина с цефалоспорином третьего поколения или карбапенемом, длительность внутривенной АБТ составляла две–четыре недели. И хотя авторы не указывают режим дозирования антимикробных препаратов, можно предположить, что столь высокий процент осложнений связан с назначением значительно больших доз антибиотиков, чем у пациентов культура-позитивной группы.
Двухэтапное ревизионное эндопротезирование считается «золотым стандартом» лечения пациентов с культура-негативной ППИ, так как назначение этиотропной АБТ в таких случаях невозможно, а вероятность обнаружения в интраоперационных биоптатах трудных для эрадикации возбудителей всегда сохраняется. Кроме того, преимуществами этапного лечения является возможность подготовки мягких тканей и кости к последующей реимплантации эндопротеза, возможность повторной установки спейсера с длительным курсом АБТ в случае развития рецидива инфекции. Многие публикации, посвященные данной теме, сообщают о хороших и даже отличных результатах применения двухэтапной методики у пациентов с неустановленной этиологией инфекционного процесса, при этом эффективность лечения сопоставима, а в некоторых случаях даже значимо выше таковой у пациентов с идентифицированным возбудителем [12, 18, 20, 21, 53]. Так, в исследовании H.R. Choi et al. неблагоприятные исходы отмечены в 15 % случаев у пациентов без роста патогена, тогда как в группе с идентифицированным возбудителем данный показатель составил 39 % (р = 0,006), однако в первом случае значимо чаще в ходе лечения применяли «операции отчаяния» (например, артродез тазобедренного сустава) (р = 0,003) [21].
В ходе данного исследования мы уделили пристальное внимание существующим подходам к определению культура-негативной ППИ. Результаты лечения больных с данной патологией изучены в разрезе трактовки термина "culture-negative PJI". Так, доля благоприятных исходов лечения больных как в группе, где были учтены только результаты дооперационных МБИ, так и в группе, где учитывали и до-, и интраоперационные посевы, превышала 90 % и не имела статистически значимых отличий ( р = 0,582). Необходимо отметить, что столь высокая эффективность купирования инфекции достигнута при отсутствии возможности назначения этиотропной АБТ в раннем послеоперационном периоде, что указывает на важность своевременного и регулярного мониторинга спектра внутрибольничных возбудителей для корректного выбора препаратов для эмпирической АБТ. Таким образом, уменьшение доли пациентов с КНИ может быть достигнуто за счет модификации факторов, предопределяющих отрицательные результаты МБИ.
Возможные пути снижения доли пациентов с неизвестной этиологией перипротезной инфекции
Лечение больных с инфекционными осложнениями после эндопротезирования крупных суставов нижней конечности является трудоемкой задачей, для решения которой необходимо участие мульти-дисциплинарной бригады специалистов. Лечебный процесс можно условно разделить на два больших блока, первый из которых включает предоперационный период и само хирургическое вмешательство, а второй — послеоперационный период.
Результаты МБИ биоматериалов, взятых до операции, оказывают значительное влияние на выбор того или иного вмешательства, при этом в большинстве случаев пациенты в раннем послеоперационном периоде получают эмпирическую АБТ, тогда как результаты МБИ образцов, взятых интраоперационно, определяют характер этиотропной антибиотикотерапии, которая будет продолжена после выписки больного на амбулаторный этап лечения. Соответственно, можно выделить ряд факторов, модификация которых способствовала бы снижению частоты встречаемости отрицательных результатов посевов (рис. 3).
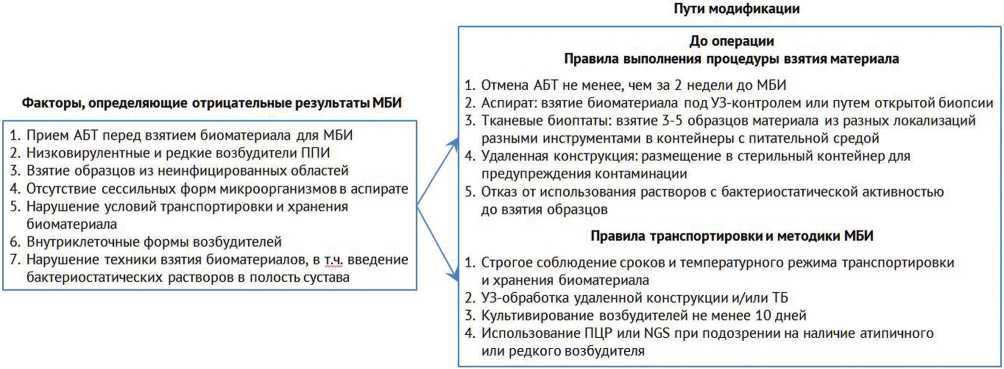
Рис. 3. Факторы, влияющие на идентификацию возбудителя ППИ, и пути их модификации
Рекомендации в отношении микробиологической диагностики при лечении имплантат-ассоцииро-ванной инфекции подробно описаны и обобщены L. Drago et al. [54]. Так, в предоперационном периоде ключевая роль отводится отмене АБТ перед выполнением диагностических исследований, а также увеличению срока культивирования посевов в случаях, когда предполагаемыми возбудителями являются низковирулентные или редкие бактерии. При проведении чрескожной биопсии рекомендовано использование УЗ-навигации, так как вероятность обнаружения патогена неодинакова в разных ана- томических областях. По данным L.C. Walker et al., для тазобедренного сустава предпочтительными локализациями взятия образцов тканей являются суставная сумка (специфичность — 100 %) и капсула сустава (чувствительность — 68 %), а предпочтительными типами тканей — синовиальная оболочка (специфичность — 93 %) и гной (чувствительность — 83 %) [55]. При наличии у больного свищевого хода, ведущего в полость сустава, не рекомендуется отправлять на исследование свищевое отделяемое из-за его контаминации кожной микрофлорой. Группой отечественных ученых разработана и запатентована методика взятия биоптатов из глубины свищевого хода (RU 2 698 175 C1), позволяющая в значительной степени повысить эффективность дооперационных МБИ. В ходе оперативного вмешательства рекомендовано брать ткани, прилежащие к эндопротезу, или ткани с макроскопическими признаками инфицирования, для взятия образцов использовать чистый стерильный инструментарий, избегая контактов с кожными покровами, при этом объем биоптата должен быть не менее 1 см3. Также и при экстракции компонентов эндопротеза рекомендовано использовать щадящие хирургические техники, избегать контактов с кожей, помещать каждый компонент в отдельную емкость. В случае если доставка материалов в лабораторию происходит не сразу, а в отложенном порядке, то хранить тканевые биоптаты и металлоконструкции нужно при температуре 4 °C, для синовиальной жидкости допустимо хранение в специализированных флаконах при комнатной температуре не дольше 48 час. Значительно повышает эффективность микробиологических исследований использование соникации [56, 57], а при отсутствии такой возможности — в качестве альтернативы использование ДТТ (англ.: dithiothreitol, DTT) [58].
Молекулярные методы, такие как полимеразная цепная реакция и секвенирование нового поколения ( англ .: next-generation sequencing; NGS), показаны в случаях, когда определение возбудителя привычными методами неэффективно (например, при инфекции, вызванной Abiotrophia defectiva, Granulicatella adiacens ), клиническая картина неочевидна, и диагноз перипротезной инфекции ставится под вопросом. Согласно данным литературы, у 4–13 % пациентов с асептическим расшатыванием применение молекулярных методов позволило идентифицировать патоген [59]. Во многих публикациях, посвященных NGS, продемонстрирована крайне высокая чувствительность метода в сравнении со стандартными культуральными исследованиями [60–63]. По данным M. Tarabichi et al., в 82 % случаев культура-негативной ППИ использование секвенирования нового поколения позволяет установить этиологию инфекционного процесса [63].
К ограничениям данного систематического обзора относится ретроспективный характер, а также дизайн включенных статей (случай-контроль или когортные исследования), отсутствие рандомизированных контролируемых исследований. В различных публикациях использованы отличные критерии ППИ, рецидива и купирования инфекции, также в ряде публикаций не указан ряд клинических параметров, таких как продолжительность хирургического вмешательства, объем интраоперационной кровопотери, длительность антибиотикотерапии и др. Кроме того, существенным ограничением является малочисленность и значительная разнородность исследований, в которых учтены только результаты дооперационных посевов. По этим причинам авторы решили отказаться от выполнения метаанализа. Таким образом, полученные результаты будут иметь лишь ограниченное практическое применение, однако увеличение числа исследований, посвященных данной теме, позволит разработать универсальные рекомендации лечения профильных пациентов.
ЗАКЛЮЧЕНИЕ
Согласно полученным данным, значимые различия в эффективности лечения пациентов с КНИ в зависимости от подхода к определению данного термина не были обнаружены. Наибольшие затруднения при лечении профильных больных вызывает невозможность назначения этиотропной АБТ в раннем послеоперационном периоде, что может оказывать негативное влияние на течение всего лечебного процесса. Предложенные пути снижения частоты встречаемости КНИ направлены на модификацию факторов, которые обуславливают отрицательные результаты МБИ образцов биоматериалов и удаленных конструкций.


