Анализ связи между нейротрофическим фактором головного мозга (BDNF) и хронической болезнью почек (ХБП) в терминальной стадии
Автор: Холиков Алишер Юсупович, Урманова Юлдуз Махкамовна
Журнал: Re-health journal @re-health
Рубрика: Нефроэндокринология
Статья в выпуске: 4 (20), 2023 года.
Бесплатный доступ
Актуальность. Вопросы связи между нейромаркером BDNF и различными показателями у пациентов с ХБП являются актуальными и мало изученными. Методология раскрытия проблемы исследования. Были обследованы 150 больных с СД 2 типа и ХБП в терминальной стадии на гемодиализе. Методы исследования включали в себя: общеклинические, биохимические и инструментальные исследования и др. Результаты исследования. ИМТ, уровни систолического и диастолического давления и частота гипертонии возрастали достоверно от 1 группы к третьей, а уровни глюкозы и инсулина натощак существенно не отличались по группам. Средние значения BDNF в крови натощак были меньше в 3 группе – с наиболее выраженной ХИМ. После проведения ОГТТ во всех группах имелась достоверно значимая разница в значениях BDNF: она снижалась на 30 и 10 минуте, особенно у больных с ХИМ 3 степени (3 группа). Основным результатом нашего исследования было то, что более высокий уровень BDNF в сыворотке натощак был связан со значительно более низкой распространенностью ХБП.
Сахарный диабет 2 типа, хроническая болезнь почек, нейромаркер BDNF, биохимические показатели
Короткий адрес: https://sciup.org/14130720
IDR: 14130720
Текст научной статьи Анализ связи между нейротрофическим фактором головного мозга (BDNF) и хронической болезнью почек (ХБП) в терминальной стадии
Введение. Хроническая болезнь почек (ХБП) связана с высоким риском смертности и инвалидности [ 1 , 2 ]. ХБП стала глобальным бременем для здравоохранения , и оценка ее факторов риска важна для предотвращения осложнений, связанных с ХБП [ 25 ] . Нарушение энергетического гомеостаза и резистентность к инсулину играют важную роль в развитии ХБП и связаны с дальнейшей заболеваемостью пациентов с ХБП [ 6 , 7 ]. Гипергликемия приводит к дополнительным затратам энергии для удовлетворения потребности повышенной канальцевой реабсорбции [ 8].. Соответственно, было показано, что изменения в митохондриальной активности, обнаруженные в первичных гломерулярных мезангиальных клетках человека , культивируемых в условиях гипергликемии, способствуют резистентности к инсулину и патогенезу ХБП [ 9-11 ]. В свою очередь, ХБП может вызвать атрофию скелетных мышц, что может вызвать резистентность к инсулину и еще больше усугубить ХБП [ 8 , 12 ].
Анализ литературы по теме. Нейротрофический фактор головного мозга (BDNF) является членом семейства нейротрофинов, связанных с энергетическим гомеостазом [ 13 , 14 ]. Сообщалось, что изменения уровня BDNF в сыворотке крови в ответ на пероральный прием глюкозы связаны с массой тела [ 15 ]. Huber LJ и др. [ 16 ] сообщили, что BDNF может быть вовлечен в почечный тубулогенез и что рецептор тирозинкиназы B (TrkB), рецептор BDNF, экспрессируется во время развития почек человека. В исследовании на модели грызунов BDNF предотвращал повреждение подоцитов клубочков посредством передачи сигналов TrkB [ 17 ]. Следует отметить, что в продольном исследовании низкий уровень BDNF в крови был значимым предиктором возникновения ХБП [ 18] . Была установлена обратная корреляция между выработкой провоспалительных цитокинов, связанных с ХБП, и экспрессией BDNF [ 6 , 19 ]. Однако, степень связи между уровнем BDNF в сыворотке и распространенностью ХБП остается неясной.
Исследование на молодых здоровых добровольцах показало, что резистентность к инсулину, вызванная инфузией интралипида/гепарина, вызывает снижение уровня BDNF в сыворотке [ 20 ]. Было показано, что BDNF защищает функцию эндотелия, а снижение уровня BDNF в сыворотке может быть связано с хроническим воспалением и долгосрочной смертностью [ 19 , 21 ]. Взаимосвязь между регуляцией глюкозы и BDNF подтверждается данными о том, что уровни BDNF в сыворотке крови, измеренные во время перорального глюкозотолерантного теста (OГTT), являются лучшим предиктором сердечно-сосудистых исходов, чем уровень BDNF натощак [22 ] . Индексы инсулинорезистентности, полученные с помощью ОГТТ, полезны для оценки чувствительности к инсулину у пациентов с ХБП, но не имеют существенной связи с отдаленной смертностью [23 ] . Поэтому авторы предположили, что уровень BDNF в сыворотке будет обратно пропорционален распространенности ХБП. Интересно, что несколько однонуклеотидных полиморфизмов (ОНП) в гене BDNF были связаны с составом мышечных волокон и сердечно-сосудистыми исходами [ 24-26 ] . Однако потенциальное влияние BDNF-ассоциированных ОНП на ХБП остается в значительной степени неопределенным.
Вышеуказанное послужило причиной для настоящего исследования.
Цель исследования – выполнить анализ связи между нейротрофическим фактором головного мозга (BDNF) и хронической болезнью почек (ХБП) в терминальной стадии у больных с сахарным диабетом 2 типа.
Методология исследования: Нами было осмотрено и обследовано 150 пациентов, страдающих сахарным диабетом 2 типа, с ХПН V ст. на программном гемодиализе Из них женщин было-55, мужчин -95. Средний возраст мужчин составил 67 ± 4,2 лет, а средний возраст женщин – 64 ± 5,6 лет. 20 больных с СД2 с ХБП 1-2 ст соответствующего возраста составили группу контроля.
Всем 150 пациентам выполнялись все исследования, включавшие общеклинические (общий анализ крови, общий анализ мочи и по Нечипоренко), биохимические (глюкоза крови, гликемический профиль, HbA1C, мочевина, креатинин, СРБ, СКФ, электролиты крови, липидный спектр, коагулограмма и др.), гормональные исследования крови (С-пептид, инсулин, нейромаркеры крови BDNF, S100b, NSE) лаборатории исследований РСНПМЦ Эндокринологии МЗ РУз, а также инструментальные - ЭКГ, УЗИ внутренних органов, допллерография магистральных артерий головы, при необходимости пациенты направлялись на дообследование- рентгенологические, УЗИ внутренних и половых органов, консультация кардиолога, невролога, нефролога, окулиста, хирурга, и др. исследования.
Мы исследовали корреляцию между уровнями BDNF в сыворотке крови как натощак, так и после перорального приема глюкозы, и распространенностью ХБП. Образцы крови собирали в 0 (статус натощак), 30 и 120 минут во время OGTT. Образцы крови натощак использовались для измерения BDNF, глюкозы, гемоглобина A1c (HbA1c), креатинина и липидного профиля. Образцы крови через 30 и 120 минут использовали для измерения уровней BDNF, глюкозы и инсулина.
Статистические расчеты проведены в программной среде Microsoft Windows с использованием пакетов программ Microsoft Excel-2007 и Statistica version 6.0, 2003. Полученные данные отражены в диссертации в виде М±m, где М — среднее значение вариационного ряда, m — стандартная ошибка среднего значения. Достоверность различий между независимыми выборками определялась по методу Манна-Уитни и Стьюденту.
По степени хронической ишемии мозга (ХИМ) больные были разделены на 3 группы: 1 гр. – 50 (33,3%) больных с ХИМ 1 степени; 2 гр. – 50 (33,3%) больных с ХИМ 2 степени; 3 гр. - 50 (33.3%) больных с ХИМ 3 степени.
Анализ и результаты. На рис.1 дано распределение осмотренных пациентов по полу и возрасту.
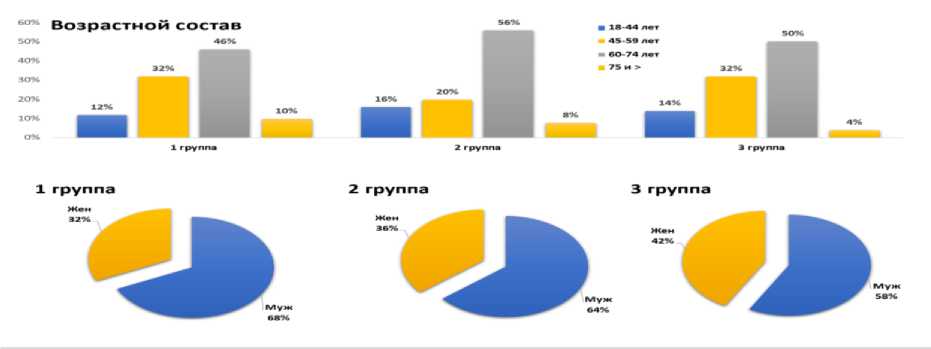
Рис.1.Распределение больных по полу и возрасту (ВОЗ, 2017 г)
Как видно из рис. 1, преобладали пациенты в возрастной категории от 60 до 74 лет как среди мужчин, так и женщин: 46%, 56% и 50% случаев соответственно в 3х группах пациентов.
В таблице 1 приведены исходные данные пациентов по группам. Как видно из таблицы 1, ИМТ, уровни систолического и диастолического давления и частота гипертонии возрастали достоверно от 1 группы к третьей, а уровни глюкозы и инсулина натощак существенно не отличались по группам. Средние значения BDNF в крови натощак были меньше в 3 группе – с наиболее выраженной ХИМ. После проведения ОГТТ во всех группах имелась достоверно значимая разница в значениях BDNF: она снижалась на 30 и 10 минуте, особенно у больных с ХИМ 3 степени (3 группа).
Основным результатом нашего исследования было то, что более высокий уровень BDNF в сыворотке натощак был связан со значительно более низкой распространенностью ХБП. Обратная связь между BDNF натощак и ХБП предполагает, что BDNF может оказывать ренопротективное действие у участников без известного СД. В соответствии с нашими результатами, Kurajoh Мю et al. [ 18 ] сообщили, что более низкий уровень BDNF в крови был независимым предиктором возникновения ХБП среди пациентов с риском сердечно-сосудистых заболеваний в продольном исследовании.
Таблица 1.
Исходные характеристики участников исследования по статусу ХБП
|
Показатели |
1 группа п=50 |
2 группа п=50 |
3 группа п=50 |
р |
|
Возраст (лет) |
61 ± 2,9 |
59 ± 3,4 |
65 ± 3,5 |
< 0,001 |
|
ИМТ (кг/м 2 ) |
30,2 ± 3,3 |
31,4 ± 4,2 |
33,2 ± 3,8 |
<0,068 |
|
Гипертония (n, %) |
25 (50%)* |
32 (64%)* |
50 (100%)* |
< 0,001 |
|
Систолическое АД (мм рт.ст.) |
146 ± 12,4* |
152 ± 18,9* |
164 ± 11,2* |
<0,002 |
|
Диастолическое АД (мм рт.ст.) |
94 ± 6,2 |
93 ± 5,4 |
96 ± 4,9 |
<0,100 |
|
BDNF натощак (нг/мл) |
0,8± 0,04* |
0,5±0,09* |
0,2±0,06* |
< 0,001 |
|
Глюкоза натощак (ммоль/л) |
7,2 ± 1,3 |
8,4 ± 1,2 |
8,2 ± 1,8 |
0,990 |
|
Инсулин натощак (мкМЕ/мл) |
12,1 ± 1,7 |
11,2 ± 1,3 |
13,5 ± 1,6 |
0,560 |
|
ОГТТ через 30 минут |
||||
|
BDNF (нг/мл) |
0,2± 0,07* |
0,3±0,05* |
0,07±0,005* |
0,120 |
|
Глюкоза (ммоль/л) |
9,3 1 ± 1,2 |
9,1 1 ± 2,2 |
9,4 1 ± 1,8 |
0,430 |
|
Инсулин (мкМЕ/мл) |
79,0 ± 4,7 |
71,8 ± 5,6 |
71,8 ± 5,3 |
0,430 |
|
ОГТТ через 120 минут |
||||
|
BDNF (нг/мл) |
0,03± 0,009* |
0,04±0,009* |
0,01±0,008* |
0,004 |
|
Глюкоза (ммоль/л) |
8,1 ± 2,2 |
8,7 ± 2,7 |
8,9 ± 2,8 |
0,052 |
|
Инсулин (мкМЕ/мл) |
81,9 ± 6,4 |
88,4 ± 5,2 |
87,8 ± 6,8 |
0,480 |
Примечание: , р – коэффициент достоверности, в норме BDNF от 1,5 до 2,4 нг/мл
Далее нами были выполнены расчеты корреляции между рСКФ и BDNF в ходе выполнения ОГТТ (таблица 2).
Таблица 3.
Корреляция между расчетной скоростью клубочковой фильтрации (рСКФ) и профилем нейротрофического фактора головного мозга (BDNF)
|
рСКФ R |
р |
|
|
BDNF натощак |
0.195 |
< 0.001 |
|
BDNF на 30 мин |
0.065 |
0.176 |
|
BDNF на 120 мин |
0.078 |
0.098 |
Примечание: R-коэффициент корреляции, р – коэффициент достоверности
Как видно из таблицы 3, между BDNF в крови и рСКФ имелась обратная связь.
Таким образом, результаты настоящего исследования показали, что динамические уровни BDNF в сыворотке после перорального приема глюкозы не дают больше информации о ХБП, чем уровни BDNF натощак.
Несколько работ указывают на то, что уровни циркулирующего BDNF обратно связаны с неблагоприятными сердечно-сосудистыми исходами. Более низкий уровень BDNF в сыворотке предсказывал больший сердечно-сосудистый риск [ 21 ], в то время как несколько генотипических вариантов BDNF были четко связаны с ишемическим инсультом [ 24 ].
Таким образом, BDNF может предотвратить кардиоренальный синдром [ 27]. Интересно, что, поскольку было показано, что ингибирование TrkB вызывает дедифференцировку подоцитов и была обнаружена сильная корреляция между уровнями мРНК BDNF в клетках мочи и различными показателями повреждения почек у пациентов с ХБП, было высказано предположение, что BDNF в клетках мочи может служить биомаркером ХБП [ 28 ]. По сравнению с контрольной группой того же возраста, пациенты с терминальной стадией почечной недостаточности имели значительно более низкий уровень BDNF в сыворотке из-за более высокого воспаления и окислительного стресса после диализа [28 ]
Выводы и рекомендации. Средние значения BDNF в крови натощак были меньше в 3 группе – с наиболее выраженной ХИМ. После проведения ОГТТ во всех группах имелась достоверно значимая разница в значениях BDNF: она снижалась на 30 и 10 минуте, особенно у больных с ХИМ 3 степени (3 группа).
Список литературы Анализ связи между нейротрофическим фактором головного мозга (BDNF) и хронической болезнью почек (ХБП) в терминальной стадии
- Go AS, Chertow GM, Fan D, McCulloch CE, Hsu CY. Chronic kidney disease and the risks of death, cardiovascular events, and hospitalization. //N Engl J Med. 2004;351(13):1296–1305. doi: 10.1056/NEJMoa041031.
- Cockwell P, Fisher L-A. Collaboration GBDCKD: global, regional, and national burden of chronic kidney disease, 1990–2017: a systematic analysis for the global burden of disease study 2017. //Lancet. 2020;395(10225):709–733. doi: 10.1016/S0140-6736(20)30045-3.
- Xie Y, Bowe B, Mokdad AH, Xian H, Yan Y, Li T, Maddukuri G, Tsai CY, Floyd T, Al- Aly Z. Analysis of the global burden of disease study highlights the global, regional, and national trends of chronic kidney disease epidemiology from 1990 to 2016. //Kidney Int. 2018;94(3):567–581. doi: 10.1016/j.kint.2018.04.011.
- Bowe B, Xie Y, Li T, Mokdad AH, Xian H, Yan Y, Maddukuri G, Al-Aly Z. Changes in the US burden of chronic kidney disease from 2002 to 2016: an analysis of the global burden of disease study. //JAMA Netw Open. 2018;1(7):e184412. doi: 10.1001/jamanetworkopen.2018.4412.
- Stenvinkel P, Ketteler M, Johnson RJ, Lindholm B, Pecoits-Filho R, Riella M, Heimburger O, Cederholm T, Girndt M. IL-10, IL-6, and TNF-alpha: central factors in the altered cytokine network of uremia–the good, the bad, and the ugly. //Kidney Int. 2005;67(4):1216–1233. doi: 10.1111/j.1523-1755.2005.00200.x.
- Barreto Silva MI, Klein M, Cardoso ES, Costa MS, Martins CJM, Bregman R. Synergistic effect of inflammatory cytokines and body adiposity on insulin resistance and endothelial markers in patients with stages 3–5 chronic kidney disease. //J Ren Nutr. 2020;30(1):36–45. doi: 10.1053/j.jrn.2019.02.001.
- Koppe L, Pelletier CC, Alix PM, Kalbacher E, Fouque D, Soulage CO, Guebre-Egziabher F. Insulin resistance in chronic kidney disease: new lessons from experimental models//. Nephrol Dial Transplant. 2014;29(9):1666–1674. doi: 10.1093/ndt/gft435.
- Carré JE, Affourtit C. Mitochondrial activity and skeletal muscle insulin resistance in kidney disease. //Int J Mol Sci. 2019;20(11):2751. doi: 10.3390/ijms20112751.
- Czajka A, Ajaz S, Gnudi L, Parsade CK, Jones P, Reid F, Malik AN. Altered mitochondrial function, mitochondrial DNA and reduced metabolic flexibility in patients with diabetic nephropathy. // EBioMedicine. 2015;2(6):499–512. doi: 10.1016/j.ebiom.2015.04.002.
- Stieger N, Worthmann K, Teng B, Engeli S, Das AM, Haller H, Schiffer M. Impact of high glucose and transforming growth factor-β on bioenergetic profiles in podocytes. //Metabolism. 2012;61(8):1073–1086. doi: 10.1016/j.metabol.2011.12.003.
- Forbes JM, Thorburn DR. Mitochondrial dysfunction in diabetic kidney disease. Nat Rev Nephrol. 2018;14(5):291–312. doi: 10.1038/nrneph.2018.9.
- Wang XH, Mitch WE, Price SR. Pathophysiological mechanisms leading to muscle loss in chronic kidney disease. //Nat Rev Nephrol. 2022;18(3):138–152. doi: 10.1038/s41581-021-00498-0.
- Nakagawa T, Tsuchida A, Itakura Y, Nonomura T, Ono M, Hirota F, Inoue T, Nakayama C, Taiji M, Noguchi H. Brain-derived neurotrophic factor regulates glucose metabolism by modulating energy balance in diabetic mice. //Diabetes. 2000;49(3):436–444. doi: 10.2337/diabetes.49.3.436.
- Rothman SM, Griffioen KJ, Wan R, Mattson MP. Brain-derived neurotrophic factor as a regulator of systemic and brain energy metabolism and cardiovascular health. //Ann N Y Acad Sci. 2012;1264:49–63. doi: 10.1111/j.1749-6632.2012.06525.x.
- Lee IT, Wang JS, Fu CP, Lin SY, Sheu WH. Relationship between body weight and the increment in serum brain-derived neurotrophic factor after oral glucose challenge in men with obesity and metabolic syndrome: a prospective study. //Med (Baltimore) 2016;95(43):e5260. doi: 10.1097/MD.0000000000005260.
- Huber LJ, Hempstead B, Donovan MJ. Neurotrophin and neurotrophin receptors in human fetal kidney. //Dev Biol. 1996;179(2):369–381. doi: 10.1006/dbio.1996.0268
- Li M, Armelloni S, Zennaro C, Wei C, Corbelli A, Ikehata M, Berra S, Giardino L, Mattinzoli D, Watanabe S, et al. BDNF repairs podocyte damage by microRNA-mediated increase of actin polymerization. //J Pathol. 2015;235(5):731–744. doi: 10.1002/path.4484.
- Kurajoh M, Kadoya M, Morimoto A, Miyoshi A, Kanzaki A, Kakutani-Hatayama M, Hamamoto K, Shoji T, Moriwaki Y, Yamamoto T, et al. Plasma brain-derived neurotrophic factor concentration is a predictor of chronic kidney disease in patients with cardiovascular risk factors—hyogo sleep cardio-autonomic atherosclerosis study. //PLoS ONE. 2017;12(6):e0178686. doi: 10.1371/journal.pone.0178686.
- Lee IT, Lee WJ, Tsai IC, Liang KW, Lin SY, Wan CJ, Fu CP, Sheu WH. Brain-derived neurotrophic factor not associated with metabolic syndrome but inversely correlated with vascular cell adhesion molecule-1 in men without diabetes. //Clin Chim Acta. 2012;413(9–10):944–948. doi: 10.1016/j.cca.2012.02.013
- Karczewska-Kupczewska M, Kowalska I, Nikolajuk A, Adamska A, Zielinska M, Kaminska N, Otziomek E, Gorska M, Straczkowski M. Circulating brain-derived neurotrophic factor concentration is downregulated by intralipid/heparin infusion or high-fat meal in young healthy male subjects. //Diabetes Care. 2012;35(2):358–362. doi: 10.2337/dc11-1295.
- Kaess BM, Preis SR, Lieb W, Beiser AS, Yang Q, Chen TC, Hengstenberg C, Erdmann J, Schunkert H, Seshadri S, et al. Circulating brain-derived neurotrophic factor concentrations and the risk of cardiovascular disease in the community. //J Am Heart Assoc. 2015;4(3):e001544. doi: 10.1161/JAHA.114.001544.
- Lee IT, Li YH, Sheu WH. Brain-derived neurotrophic factor during oral glucose tolerance test predicts cardiovascular outcomes. Int J Mol Sci. 2020;21(14):5008. doi: 10.3390/ijms21145008.
- Jia T, Huang X, Qureshi AR, Xu H, Arnlov J, Lindholm B, Cederholm T, Stenvinkel P, Riserus U, Carrero JJ. Validation of insulin sensitivity surrogate indices and prediction of clinical outcomes in individuals with and without impaired renal function. //Kidney Int. 2014;86(2):383–391. doi: 10.1038/ki.2014.1
- Zhou J, Ma MM, Fang JH, Zhao L, Zhou MK, Guo J, He L. Differences in brain-derived neurotrophic factor gene polymorphisms between acute ischemic stroke patients and healthy controls in the Han population of southwest China. Neural Regen Res. 2019;14(8):1404–1411. doi: 10.4103/1673-5374.253525
- Guilherme JPLF, Semenova EA, Borisov OV, Kostryukova ES, Vepkhvadze TF, Lysenko EA, Andryushchenko ON, Andryushchenko LB, Lednev EM, Larin AK, et al. The BDNFincreasing allele is associated with increased proportion of fast-twitch muscle fibers, handgrip strength, and power athlete status. //J Strength Cond Res. 2022;36(7):1884–1889. doi: 10.1519/JSC.0000000000003756.
- Jiang R, Babyak MA, Brummett BH, Hauser ER, Shah SH, Becker RC, Siegler IC, Singh A, Haynes C, Chryst-Ladd M, et al. Brain-derived neurotrophic factor rs6265 (Val66Met) polymorphism is associated with disease severity and incidence of cardiovascular events in a patient cohort. //Am Heart J. 2017;190:40–45. doi: 10.1016/j.ahj.2017.05.002.
- Ronco C, Haapio M, House AA, Anavekar N, Bellomo R. Cardiorenal syndrome. J Am Coll Cardiol. 2008;52(19):1527–39.
- Endlich N, Lange T, Kuhn J, Klemm P, Kotb AM, Siegerist F, Kindt F, Lindenmeyer MT, Cohen CD, Kuss AW, et al. BDNF: mRNA expression in urine cells of patients with chronic kidney disease and its role in kidney function. J Cell Mol Med. 2018;22(11):5265–77.


