Анастомотические билиарные стриктуры после трансплантации печени
Автор: Попов М.В., Восканян С.Э., Дунаев А.П., Башков А.Н., Мальцева А.П.
Журнал: Саратовский научно-медицинский журнал @ssmj
Рубрика: Хирургия
Статья в выпуске: 2 т.15, 2019 года.
Бесплатный доступ
В обзоре литературы представлены данные о современном состоянии проблемы анастомотических стриктур желчных протоков у пациентов после трансплантации печени от живого близкородственного донора, именуемой «ахиллесовой пятой» трансплантологии. Приведены данные о частоте и сроках развития стриктур, их причинах и факторах риска. Показана роль лучевых методов в диагностике данной группы осложнений. Описаны методики лечения билиарных посттрансплантационных стриктур: антеградная, ретроградная и открытая. Затронуты также темы перспектив развития чрескожной и эндоскопической техник и выбора методики лечения стриктур.
Билиарные стриктуры, стриктуры билиарного анастомоза, трансплантация печени
Короткий адрес: https://sciup.org/149135292
IDR: 149135292 | УДК: 616.36-089+616.361-089
Текст научной статьи Анастомотические билиарные стриктуры после трансплантации печени
1 Введение. Несмотря на совершенствование хирургической техники выполнения операций трансплантации печени, билиарные осложнения до сих пор остаются одной из наиболее значимых проблем, именуясь даже «ахиллесовой пятой» хирургии печени. Так, данные осложнения, по сведениям различных авторов, у реципиентов после родственной и трупной трансплантации встречаются в 18-37% и в <10% случаев соответственно [1-3]. Ранняя и точная диагностика и надлежащее лечение билиарных осложнений в целом и стриктур в частности являются значимыми задачами современной гепато-трансплантологии.
Типы посттрансплантационных стриктур. Билиарные стриктуры у реципиентов в зависимости от локализации подразделяются на анастомотические (АС) и неанастомотические (НАС). Первый тип (анастомотические стриктуры) наблюдается в зоне и в пределах 5 мм от наложенного в процессе операции билиарного анастомоза [2]. Второй тип стриктур — это обычно множественные сужения различных сегментов желчных протоков. НАС, как правило, связаны с ишемическим поражением желчных протоков при нарушении артериального кровоснабжения
трансплантата, но среди этиологических факторов отмечается иммунологическое и цитотоксическое воздействие на эпителий протоков, а также факторами риска являются наличие вируса гепатита С или цитомегаловируса [4, 5].
Частота и сроки развития. Частота ранних и поздних билиарных осложнений после трансплантации печени снизилась с 30%, регистрируемых в первые годы становления такого типа операций, приблизительно до 20% в 1980-х гг. и в настоящее время не превышает 10% [2, 3]. При этом подавляющее большинство осложнений данного типа встречаются после трансплантации печени от живого донора (ТПЖД), развиваясь практически у 37% реципиентов [1]. После трансплантации печени от трупного донора (ТПТД) стриктуры развиваются значительно реже: в 5-15% случаев [6]. Важно отметить и тот факт, что билиарные стриктуры осложняют ТПЖД в 4–5 раз чаще, чем подтекания желчи [7]. Относительно типов билиарных стриктур различные авторы указывают, что после ТПЖД анастомотические стриктуры встречаются в 10 раз чаще неанастомотических [2, 8]. Примечательно, что после родственной трансплантации правой доли печени билиарные осложнения встречаются чаще, чем при трансплантации левой доли [3].
Представляется интересным мнение некоторых авторов о том, что частота развития билиарных стриктур не снижается значимо с увеличением хи- рургического опыта центра и конкретного хирурга [9–11]. Так, группа исследователей из крупного центра трансплантологии Киотского университета, основываясь на опыте выполненных ими 335 ТПЖД, поделила результаты пересадок на три группы: первые 100 выполненных трансплантаций, вторые 100 выполненных трансплантаций и заключительные на момент исследования 135 трансплантаций. Подводя итог, исследователи не обнаружили статистической значимости в частоте развития билиарных стриктур в данных трех группах (19, 28 и 26% соответственно, p=0,29) [10].
Билиарные стриктуры в среднем наблюдаются через 5–8 месяцев после трансплантации [9, 12]. Ряд авторов отмечают, что 70-87% наблюдаемых стриктур развиваются в течение первого посттрансплантационного года, а частота их встречаемости резко снижается через 12 месяцев после операции [8, 12, 13]. НАС обычно развиваются раньше АС и регистрируются в среднем через 3–6 месяцев после трансплантации [5].
Причины и факторы риска. В первую очередь следует заметить, что желчные протоки кровоснаб-жаются артериальной системой печени [14]. Клетки эпителия желчных протоков гораздо более восприимчивы к ишемии, чем клетки сосудистого эпителия и гепатоциты, поэтому какие-либо нарушения артериального кровоснабжения (как скелетизация протоков в процессе наложения анастомоза, так и общие нарушения артериального кровоснабжения всего трансплантата) незамедлительно ведут к ишемии эпителия протоков и повышенному риску последующего развития стриктур. Стоит отметить также, что холангиоциты не только чувствительны к ишемии, но и еще более чувствительны к повреждению реперфузией [15].
Независимыми факторами риска развития билиарных стриктур после трансплантации печени считаются следующие: возраст донора более 50 лет, сложная билиарная реконструкция или ее множественный характер, подтекание желчи в послеоперационном периоде, стеноз печеночной артерии, эпизоды острого или хронического отторжения трансплантата, иммунологическая несовместимость, более 35 баллов по шкале MELD у реципиента в дотрансплантацион-ном периоде [3, 9, 16].
Более высокая частота билиарных осложнений после родственной трансплантации, чем после трупной, связана в основном с техническими нюансами: относительно малый диаметр желчных протоков в формируемом анастомозе, нередко большее количество требуемых билиарных анастомозов, технически более сложное наложение и артериального анастомоза, а также возможные перегибы протока и артерии при последующей гипертрофии трансплантата. Среди технических погрешностей, которые могут привести к развитию анастомотических стриктур, многочисленные авторы наиболее значимыми считают следующие: чрезмерное использование электрокоагуляции как на донорском этапе, так и у реципиента; использование неподходящего шовного материала; чрезмерно обширную диссекцию перидуктальной ткани; большое несоответствие диаметров между накладываемыми протоками трансплантата и реципиента; перенатяжение сформированного анастомоза; малый диаметр (<4 мм) анастомозируемых протоков [2, 17].
Значимое снижение частоты развития АС у реципиентов после родственной трансплантации в последние годы связано во многом с совершенствованием хирургической техники, направленным на максимальное сохранение кровоснабжения желчных протоков, в том числе и микроциркуляции в зоне накладываемого анастомоза [2]. Например, T. Lin с соавт. отметили, что рутинное использование микрохирургической техники наложения билиарного анастомоза при ТПЖД снизило частоту развития билиарных осложнений до 7%, т. е. до средней частоты развития билиарных осложнений после трупной трансплантации [18].
Тип и количество наложенных билиарных анастомозов также могут влиять на частоту развития билиарных осложнений в послеоперационном периоде. Так, после наложения анастомоза по типу проток-в-проток (правый долевой проток трансплантата с общим желчным протоком реципиента), по данным ряда авторов, отмечается меньшее число подтеканий желчи, но большее число наблюдаемых поздних стриктур, чем при холедохоеюностомии с отключенной по Roux петлей кишечника [13, 19]. Меньшее число развития стриктур после холедохоеюностомии связывают во многом с тем, что при этом отмечается лучшая артериализация культи протока трансплантата [17]. Однако в ряде других работ не выявлено статистически значимой разницы в развитии анастомотических стриктур после ТПЖД в группах анастомозов методом холедохоеюностомиии и методом проток-в-проток [2, 17, 20].
Ряд вариантов анатомии желчных протоков трансплантата часто требует наложения множественных анастомозов, что является значимым фактором риска развития билиарных осложнений [21, 22]. Так, R. Kashyap с соавт. (2008) отметили, что риск развития билиарных осложнений практически в 6 раз выше при любом варианте анатомии желчных протоков трансплантата, отличном от стандартного [22]. Однако в работе P. Kim с соавт. не обнаружено корреляции между количеством наложенных анастомозов и частотой развития билиарных стриктур [12].
Интересен и вопрос использования Т-образного дренажа, ранее широко использовавшегося при анастомозе по типу проток-в-проток. Отмечается, что при использовании такого типа каркасного дренирования при трансплантации печени наблюдается большая частота развития желчного подтекания и холангита, но меньшая частота развития стриктур [23]. В своем метаанализе по вопросу использования Т-образного дренажа N. Sun с соавт. (на опыте формирования анастомозов при ТПТД) установили снижение частоты формирования билиарных стриктур и не выявили увеличения частоты развития холангита при использовании такого типа дренирования [24]. В выводах указанного метаанализа авторы указали на целесообразность использования такого типа дренирования во время трупной трансплантации лишь у пациентов с наличием факторов риска последующего развития билиарных стриктур [24]. Рутинное же использование такого типа дренажей само по себе является фактором риска развития стриктуры [3].
Лучевые методы диагностики. Диагностика билиарных стриктур часто затруднительна из-за низкой специфичности клинических и лабораторных данных. Симптоматика может варьироваться от умеренного повышения уровня печеночных ферментов до выраженного холангита и желтухи. Наиболее достоверными и информативными при выявлении данной патологии являются методы лучевой диагностики [25].
При подозрении на развитие посттрансплантационной стриктуры желчных протоков УЗИ является методом выбора первой линии ввиду доступности, низкой стоимости и относительно высокой чувствительности. При этом визуализируется неспецифический признак расширения желчных протоков проксимальнее зоны обструкции. Выявление точной локализации и причины затруднения оттока по данным УЗИ затруднительно. УЗИ может подтвердить наличие билиарной стриктуры лишь в 38-66% случаев [26]. Использование УЗ-допплерографии позволяет одновременно оценить и состояние сосудов печени, главным образом показатели кровотока в артериях трансплантата.
Важная роль в диагностике множества поражений трансплантата и его сосудистой системы отводится методу компьютерной томографии (КТ). Данный метод более актуален для диагностики билиарных подтеканий, нежели билиарных стриктур. Что касается вопроса билиарных стриктур, данные КТ значимы с точки зрения визуализации артериальной системы печени. Как указано ранее, нарушение артериального притока к трансплантату ведет к развитию стриктур желчных протоков; причем чем более проксимально расположено поражение протоков, тем выше шанс обнаружить проблемы со стороны артериальной системы печени во время КТ [27]. Чувствительность КТ в отношении диагностики билиарных стриктур может быть достаточно высокой при использовании специфических билиарных контрастных препаратов, однако их применение ограничено повышенным риском развития аллергических реакций [26].
МРХГ является наиболее достоверным неинвазивным методом диагностики билиарных стриктур с чувствительностью и специфичностью более 95% (рис. 1) [28, 29]. При этом высокая прогностическая ценность отрицательного результата у МРХГ позволяет избежать ненужных инвазивных вмешательств [26]. Недостатками данного метода лучевой диагно- стики являются его повышенные временные и экономические затраты для рутинного скринингового использования, а также относительно высокая частота ложноположительных результатов [2].
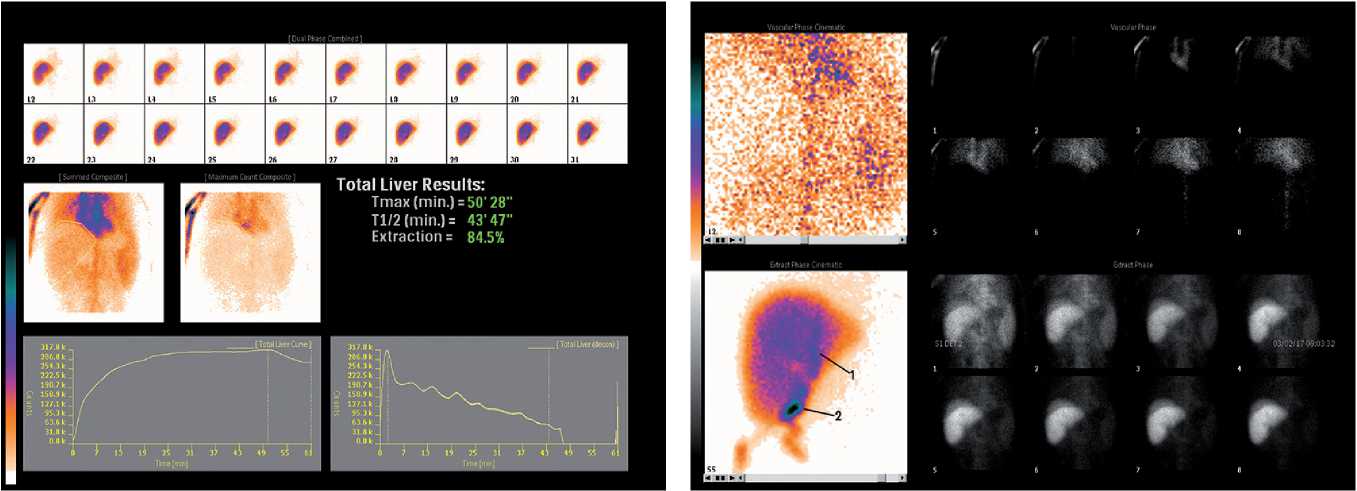
Гепатобилиарная сцинтиграфия с радиофармпрепаратами на основе 99mTc (изомер изотопа технеций-99) позволяет визуализировать не только анатомические характеристики желчного дерева трансплантата, но и ряд его функциональных характеристик (рис. 2).
Данный метод обладает чувствительностью в 60– 94% и специфичностью в 93% в плане диагностики всей группы посттрансплантационных билиарных осложнений [26, 30]. При этом высокая чувствительность данного метода соответствует диагностике желчных подтеканий, а низкая — диагностике стриктур. Относительно низкая, по данным ряда авторов, чувствительность ГБСГ и ее высокая специфичность позволяют рекомендовать данный метод диагностики стриктур как дополнительный.
В целом в плане диагностики посттрансплантационных стриктур чувствительность УЗИ, ГБСГ и МРХГ составляет 38-79%, 60-94% и 95-100% соответственно [25, 26, 31].
Возможность чрескожного чреспеченочного и эндоскопического доступа к желчным протокам позволяет выполнить прямую холангиографию и оценить все характеристики поражения желчных протоков, однако данные процедуры являются инвазивными с достаточно большим числом возможных осложнений, поэтому к ним следует прибегать не столько с целью диагностики наличия стриктур, сколько с целью декомпрессии и последующего антеградного лечения поражения [32].
Лечение. Своевременное выявление билиарной стриктуры в посттрансплантационном периоде является ключевым фактором эффективного лечения данного осложнения, успешность которого при этом достигает 60-90% [2]. Метод лечения анастомотиче-
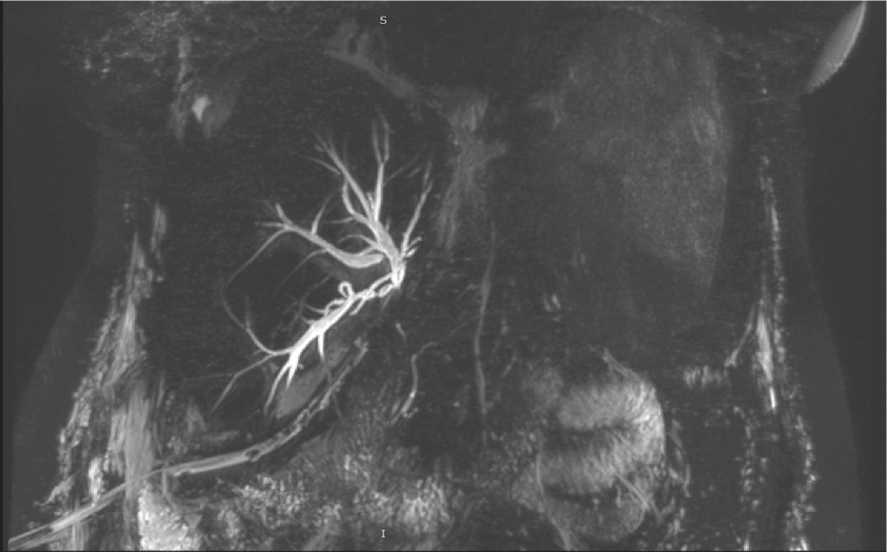
Рис. 1. Магнитно-резонансная холангиография трансплантата печени. Визуализируется стриктура желчных протоков в области их конфлюенса
а) б)
Рис. 2. Динамическая сцинтиграфия трансплантата печени. Значительное замедление поглотительной и выделительной функции трансплантата печени вследствие стриктуры билиарного анастомоза: а) графики активность-время, Т1/2=44мин; б) на фазе выведения визуализируется расширенный желчный проток ( 1 ) и билома вблизи предполагаемого анастомоза ( 2 )
ских билиарных стриктур зависит как от предпочтений конкретного центра, так и от анатомии поражения. Наиболее распространена тактика использования эндоскопического метода при поражении анастомоза типа проток-в-проток, чрескожного чреспеченочного метода при стриктуре гепатикоеюноанастомоза и открытой хирургии в случае безуспешности предыдущих методов.
Эндоскопическая методика (ретроградная) включает в себя папиллосфинктеротомию, реканализацию и баллонную пластику стриктуры с возможностью последующей установки стента в зону поражения. Возможность установки временного стента большого диаметра является ключевой отличительной особенностью данной методики. Минусом ретроградного подхода является то, что он применим в основном при лечении стриктур анастомоза типа проток-в-проток. Кроме того, при эндоскопическом подходе возможно развитие таких осложнений, как кровотечение после сфинктеротомии, развитие панкреатита, холангита, а также перфорация двенадцатиперстной кишки или желчных протоков [33]. Высок также последующий риск развития острого холангита с возможным летальным исходом у больных на иммуносупрессии, ограничивающий широкое применение ретроградной методики [47]. Технический успех эндоскопического лечения анастомотических билиарных стриктур значимо выше после трупной трансплантации печени (80-90%), чем после трансплантации от родственного донора (58-76%) [7, 9, 34]. Следует отметить и тот факт, что технический успех ретроградного подхода при лечении АС после ТПЖД значительно ниже при развитии стриктур в позднем посттрансплантационном периоде, чем в первые 1–2 месяца после трансплантации, когда основной вклад в сужение протока вносят реакции воспаления и отека [21].
Чрескожная чреспеченочная методика (антеградная) включает в себя пункцию желчных протоков под ультразвуковым и рентгеноскопическим контролем с последующей реканализацией, баллонной пластикой и последующим стентированием или каркасным дренированием зоны поражения (рис. 3).
Антеградная методика более применима, нежели ретроградная, при лечении ригидных поражений, стриктур с вовлечением зоны конфлюенса и с раздельным блоком желчных протоков, при поражении гепатикоеюноанастомоза с отключенной по Ру пет-
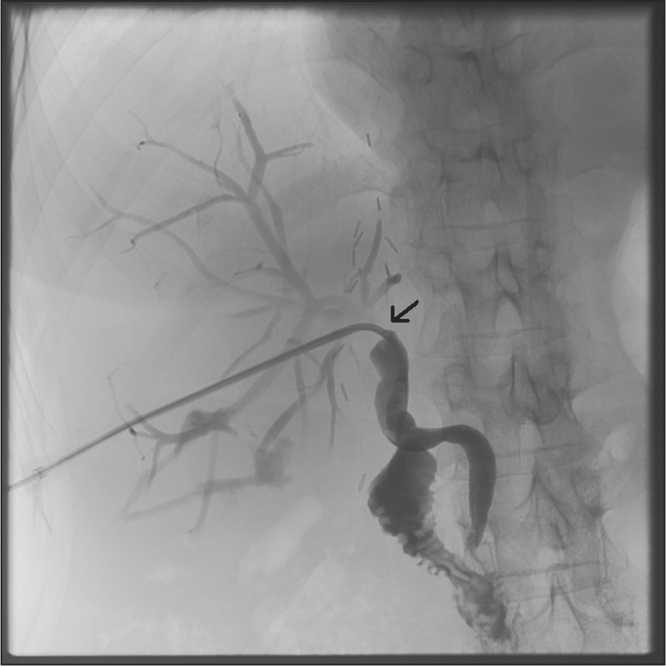
Рис. 3. Чрескожное чреспеченочное вмешательство по поводу наличия стриктуры гепатикохоледохоанастомоза после ТПЖД. Инструменты проведены через зону поражения в холедох, выполнена рентгенография с контрастированием; стрелкой указана зона стриктуры лей кишки. Данная методика может осложниться развитием внутрибрюшного кровотечения, гемобилией и перфорацией желчных протоков. По данным N. Fi-delman с соавт., риск травмы печеночной артерии при чрескожном билиарном вмешательстве составляет 2,2%, и этот риск еще выше при попытках пункции нерасширенных желчных протоков [35].
Важно учитывать и то, что именно антеградный метод доступа к желчным протокам с целью лечения стриктуры, в отличие от ретроградного, позволяет использовать весь широчайший на сегодняшний день ассортимент инструментов бурно развивающейся интервенционной радиологии: микрокатетеры и микропроводники с различным типом покрытий, кривизной кончиков, материалом сердечника, баллонные катетеры с различной степенью комплайнса и т. д.
В вопросе использования только баллонной пластики или пластики в сочетании с имплантацией стента единого мнения в литературе нет. С одной стороны, использование стента после баллонной пластики в 2 раза снижает риск развития рестеноза [36], однако при этом риск развития различных осложнений повышается с 4,3% в группе только баллонной пластики до 13,6% в группе стентирования (p<0,05) [37].
С. В. Готье с соавт. (2012) указывают, что предпочтительным подходом к лечению билиобилиарных стриктур является ретроградный эндоскопический метод, а при лечении стриктуры гепатикоеюноана-стомоза — чрескожный антеградный или открытый метод [48].
Стоит упомянуть и технику «rendezvous», которая является гибридной методикой с сочетанием чрескожного и эндоскопического подходов, когда оба метода используются одновременно, дополняя друг друга. При этом антеградно проведенный через зону стриктуры проводник захватывается эндоскопом и способствует ретроградному проведению канюли и последующему стентированию зоны поражения [38].
При безуспешности описанных методов лечения посттрансплантационной АС прибегают к открытой хирургии с реконструкцией билиарного анастомоза, конверсией анастомоза проток-в-проток в гепатикое-юноанастомоз или даже к ретрансплантации [7].
В отношении выбора метода лечения билиарных осложнений после ТПЖД и после ТПТД исследование A2ALL (Adult-to-Adult Living Donor Liver Transplantation Cohort Study) показало, что хотя частота билиарных осложнений после родственной трансплантации выше, чем после трупной, но подходы к лечению и его результаты аналогичны в обеих группах [39].
Результаты лечения АС, развившихся в первые 6 месяцев, превосходят таковые при лечении более ригидных стриктур с фиброзом, развившихся через 6 и более месяцев после трансплантации, как в плане технического успеха, так и в плане частоты развития рестенозов [40]. Частота рецидива анастомотических стриктур после родственной трансплантации, по данным T. Hsieh с соавт., составляет 21 % со средним временем развития рестеноза 9,5 месяца [1]. Интересна работа K. Chok с соавт., которые показали, что 1-, 3- и 5-летняя выживаемость у реципиентов с АС и без АС в анамнезе статистически значимо не различается (97,3 и 91,4%, 90 и 85,3%, 84,5 и 82,5% соответственно; p =0,574) [20].
Перспективы. Результаты лечения АС после трансплантации печени могут быть улучшены за счет применения новых инструментов и методов визуализации. Так, возможно использование современных режущих баллонных катетеров при пластике ригидных фиброзированных стриктур [41], баллонов с лекарственным покрытием для возможного снижения частоты рецидива стриктуры [42]. Появление и совершенствование съемных антеградно стентов позволит использовать их при чреспеченочном методе лечения вместо каркасного дренировния; интересен также вариант использования биоабсорбируемых стентов при лечении билиарных стриктур [43, 44]. Достижения в эндоскопической методике (двухбаллонная энтероскопия) позволяют ретроградно лечить анастомозы с отключенной по Ру петлей кишечника [45], а использование метода прямой холангиоско-пии — увеличить технический успех прохождения сложных стриктур [46].
Заключение. Таким образом, анастомотические стриктуры желчных протоков у реципиентов после трансплантации печени от живого донора являются «ахиллесовой пятой» современной трансплантологии, что требует совершенствования алгоритмов диагностики и лечения данной группы осложнений.
В диагностике анастомотических посттрансплантационных стриктур решающую роль играют методы неинвазивной лучевой диагностики, в то время как к эндоскопическому и чрескожному методам рекомендуется прибегать уже на этапе попытки лечения данной патологии. Методом диагностики первой линии является ультразвуковое исследование, а наибольшей чувствительностью в диагностике билиарных стриктур обладает МРХГ. Чувствительность неинвазивных методов лучевой диагностики не зависит от типа наложенного анастомоза.
В плане лечения посттрансплантационных стриктур возможно использование эндоскопической и чрескожной чреспеченочной методик первым этапом и открытой хирургии при их безуспешности. Выбор антеградного или ретроградного метода попытки лечения зависит от анатомических характеристик наложенного анастомоза и от навыков и предпочтений в конкретном медицинском центре. Предиктором успешности хирургического лечения такого типа осложнений является тщательная оценка состояния желчных протоков на предоперационном этапе.
Список литературы Анастомотические билиарные стриктуры после трансплантации печени
- Hsieh T, Mekeel K, Crowell M, et al. Endoscopic treatment of anastomotic biliary strictures after living donor liver transplantation: outcomes after maximal stent therapy. Gastrointest Endosc 2013; 77 (1): 47-54. 10.1016 / j. gie. 2012.08.034 DOI: 10.1016/j.gie.2012.08.034
- Chang J, Lee I, Choi M, Han S. Current diagnosis and treatment of benign biliary strictures after living donor liver transplantation. World J Gastroenterol 2016; 22 (4): 1593 10.3748 / wjg. v22. i4.1593 DOI: 10.3748/wjg.v22.i4.1593
- Shin M, Joh J. Advances in endoscopic management of biliary complications after living donor liver transplantation: Comprehensive review of the literature. World J Gastroenterol 2016; 22 (27): 6173 10.3748 / wjg. v22. i27.6173 DOI: 10.3748/wjg.v22.i27.6173
- Voskanyan S, Artemyev A, Sushkov A, et al. Vascular reconstruction and outcomes of 220 adult-to-adult right lobe living donor liver transplantations. Almanac of Clinical Medicine 2018; 46 (6): 598-608. 10.18786 / 2072- 0505-2018-46-6-598-608 DOI: 10.18786/2072-0505-2018-46-6-598-608
- Forrest EA, Reiling J, Lipka G, Fawcett J. Risk factors and clinical indicators for the development of biliary strictures post liver transplant: Signifcance of bilirubin. World J transplant 2017; 7 (6): 349-58. DOI: 10.55 / wjt. v7. i6.349
- Saraireh H, Sundaram L, John B. Biliary Strictures after Liver Transplantation with Grafts from Donors after Cardiac Death: Narrowing Down the Etiologies. Dig Dis Sci 2019 10.1007 / s10620-019-05589-4 DOI: 10.1007/s10620-019-05589-4
- Wang S, Huang Z, Chen X. Biliary complications after living donor liver transplantation. liver transplantation 2011; 17 (10): 1127-36. 10.1002 / lt. 22381 DOI: 10.1002/lt.22381
- Chang J, Lee I, Choi J, et al. Biliary Stricture after Adult Right-Lobe Living-Donor Liver Transplantation with Duct-to-Duct Anastomosis: Long-Term Outcome and Its Related Factors after Endoscopic Treatment. Gut Liver 2010; 4 (2): 226-33. 10.5009 / gnl. 2010.4.2.226. DOI: 10.5009/gnl.2010.4.2.226


