Анатомические особенности проводящих тканей растений сои, препятствующих проникновению возбудителей семядольного бактериоза в семена
Автор: Зеленцов Сергей Викторович, Саенко Галина Михайловна, Мошненко Елена Валентиновна
Рубрика: Селекция и семеноводство сельскохозяйственных растений
Статья в выпуске: 4 (188), 2021 года.
Бесплатный доступ
Пути проникновения патогенных бактерий с поражённых вегетативных частей растений в семена сои остаются практически не изученными. При этом широко распространено мнение, что семена сои заражаются через сосудистую систему от уже поражённых участков вегетативных частей. Целью настоящих исследований было изучение возможности проникновения возбудителей семядольного бактериоза в семена сои через проводящие ткани растений. Исследования проводили в 2019-2021 гг. в ФГБНУ ФНЦ ВНИИМК на растениях и семенах сои сорта Вилана. Установлено, что размеры устьичных щелей у листьев сои составляют 8-12 мкм. Это обеспечивает свободное проникновение бактерий диаметром 1,3-1,7 мкм в мезофилл листа. Размеры пор ситовидных пластинок флоэмы составляют от 0,40,7 до 0,8-1,6 мкм в зависимости от возраста растений. Самые крупные поры ситовидных пластинок флоэмы сравнимы с диаметрами патогенных бактерий. Однако большое количество ситовидных пластинок, расположенных во флоэме через каждые 0,05-0,1 мм, будут фильтровать и частично задерживать бактерии в каждой ситовидной трубке по ходу водотока во флоэме. Поэтому свободное перемещение патогенных бактерий через всю флоэму, от поражённых бактериозом листьев до бобов, физически маловероятно. В бобах сосудистая система заканчивается в зоне прикрепления семяножек к рубчикам семян. В рубчике семени проводящие ткани отсутствуют, а дальнейшее поступление воды и питательных веществ в семя осуществляется диффузно через плазмодесмы стенок клеток. Установлено, что анатомическое строение флоэмы сои препятствует свободному передвижению патогенных бактерий по проводящей системе непосредственно во внутренние ткани семян. Поэтому гипотезу инфицирования семян сои возбудителями семядольного бактериоза через проводящую систему растения следует признать несостоятельной.
Соя, семядольный бактериоз, флоэма, ситовидные трубки, поры ситовидных пластинок
Короткий адрес: https://sciup.org/142231747
IDR: 142231747 | УДК: 633.853.52:581.8:632 | DOI: 10.25230/2412-608X-2021-4-188-25-34
Текст научной статьи Анатомические особенности проводящих тканей растений сои, препятствующих проникновению возбудителей семядольного бактериоза в семена
Введение. Проблема контроля бактериальных болезней сои во всём мире стоит очень давно. Отечественные и зарубежные статьи и монографии, посвящённые биологии, идентификации, таксономии, методам выделения и контроля возбудителей бактериоза этой культуры известны с середины XX века [1; 2; 3; 4]. Однако практическая значимость всех проведённых исследований в части контроля бактериоза у сои оказалась низкой. Риск неконтролируемого развития бактериоза сохраняется, особенно во влажных условиях вегетации (обильные осадки или орошение), независимо от распространённости возбудителей бактериоза на вегетирующих растениях, растительных остатках и семенах. При этом семена, полученные от здоровых растений, вполне могут иметь высокую поражённость бактериозом [5].
Можно констатировать, что ключевая проблема контроля и ограничения распространения семядольного бактериоза сои, на совокупной основе результатов более чем полувекового международного изучения, к настоящему времени так и не была решена. Поэтому до настоящего времени основным приёмом частичного контроля бактериоза сои является химическое протравливание партий семян перед посевом. Но и в этом случае реальный полевой эффект обеззараживания семян от возбудителей бактериоза с целью повышения их всхожести далеко не всегда эффективен [5].
Принято считать, что одним из основных источников первичного распространения инфекции являются растения, 26
выращенные из поражённых бактериозом семян. Из поражённых семян традиционно выделяются бактерии следующих видов: Pseudomonas savastanoi pv. glycinea (Coerper) Young et al.; Xanthomonas axonopodis pv. glycinea (Nacano) Vauterin et al.; Pseudomonas syringae pv. tabaci (Wolf & Ferster) Young et al.; Bacillus subtilis (Ehrenberg) Cohn.; Curtobacterium flaccumfaciens pv. flaccumfaciens (Hedges) Collins & Jones; Ralstonia solanacearum (E. F. Smith) Yabuuchi et al. [6; 7]. Бактерии этих видов представляют собой грамот-рицательные, подвижные посредством полярного жгутика палочки, обычно 1,2– 1,5 × 2,3–2,9 мкм [2].
При изучении и описании видового состава возбудителей бактериоза сои и других зернобобовых основное внимание как правило, уделялось бактериальному поражению вегетативных частей растений – побегов и листьев, реже створок бобов и семян. Довольно широко распространено мнение, что формирующиеся в бобах семена сои и других зернобобовых культур заражаются через распространение возбудителей бактериальной инфекции по проводящей сосудистой системе от уже поражённых участков вегетативных частей растений [2]. Однако такой путь проникновения патогенных бактерий – с поражённых листьев и стеблей в семена сои, до настоящего времени остаётся неподтверждённым. Поэтому изучение причин развития семядольного бактериоза сохраняет свою актуальность [5].
Для повышения эффективности контроля и разработки методов борьбы с бактериозом сои необходимо понимание и выявление реальных путей и способов проникновения инфекции в семена. Поэтому целью настоящей работы было изучение и оценка возможности проникновения возбудителей семядольного бактериоза от поражённых участков вегетативных частей сои в семена сои через проводящие ткани растений.
Материалы и методы . Исследования проводили в 2019–2021 гг. на экспериментальной базе ФГБНУ ФНЦ ВНИИМК, г. Краснодар. Объектом исследования служили растения, бобы и семена сои сорта Вилана.
Для этого на участке размножения сорта в фазы начала цветения и полного налива семян рендомизированно выбирали по 10 типичных растений для цитологических и анатомических исследований. Микроскопический анализ растительного материала проводили на световом бинокулярном микроскопе Motic BA310 с окуляром ×10 и объективами ×4 и ×40, обеспечивающими увеличение ×40 и ×400 соответственно.
Растительный материал для микроскопирования готовили из свежеотобранных в поле растений сои путём отделения скальпелем фрагментов длиной 1–4 см в средней части стебля. Подготовку растительного материала для проведения поперечных и продольных срезов выполняли по общепринятой методике в изложении И.А. Паламарчук и Т.Д. Веселовой (1969) [8].
Для получения поперечных срезов нарезали 20 фрагментов стебля длиной около 1 см и на 12 ч помещали их в фиксатор Карнуа. Фиксатор Карнуа готовили в пропорциях: ледяная уксусная кислота – 1 часть; хлороформ – 3 части; 96%-ный этиловый спирт – 6 частей. После фиксации растительный материал промывали в 70%-ном этиловом спирте до удаления запаха ледяной уксусной кислоты и хлороформа. Отмытый от фиксатора материал обезвоживали в этиловом спирте, последовательно повышая его концентрацию: 80 %, 90, 96 %. После обезвоживания растительный материал помещали в ёмкости со смесью 96%-ного этилового спирта и хлороформа, с постепенным, через каждый час, повышением концентрации хлороформа в последовательных пропорциях 3 : 1; 1 : 2 и 1 : 3. Затем материал помещали в чистый хлороформ. Заключение материала в парафин проводили в термостате при температурах 35–
40 °С путём постепенного замещения хлороформа добавлением парафина. Пропитанный парафином материал монтировали на деревянные блоки в виде парафиновых кубиков. Готовые парафиновые кубики резали на салазочном микротоме. На каждом кубике выполняли по 8–10 срезов. Полученные парафиновые ленты срезов приклеивали на предметные стёкла с использованием взбитого яичного белка и глицерина в пропорции 1 : 1 и переносили в сушильный шкаф на 12 ч, где выдерживали при температуре 35– 40 °С. Затем предметные стёкла с приклеенными срезами освобождали от парафина, помещая их в ёмкости с ксилолом, с его трёхкратной сменой через каждый час. Удаление ксилола из срезов на предметных стёклах проводили путём их замещения 96%-ным этиловым спиртом (2 смены по 10–15 мин). В дальнейшем спирт удаляли промывкой срезов в воде два раза по 15 мин. Полученные срезы помещали в каплю дистиллированной воды, накрывали покровным стеклом и рассматривали под микроскопом при увеличении ×400. Для учётов выделяли и анализировали срезы с хорошо различимыми в поле микроскопа ситовидными пластинками флоэмы. Диаметры микропор в ситовидных пластинках определяли путём их измерения на пяти пластинках.
Продольные срезы готовили из свежего, незафиксированного растительного материала. Для этого в средней части стеблей сои нарезали фрагменты длиной около 4 см общим количеством 20 шт. Для удержания материала в вертикальном положении при выполнении срезов использовали препаровальную иглу. Далее брали смоченную в воде бритву и делали срезы толщиной 1–2 мм, причём бритву держали вертикально и двигали её вниз медленным скользящим движением. Сделав 4–5 срезов в каждом образце стебля, переносили их на предметные стёкла. Далее на срезы добавляли небольшие капли воды и накрывали покровными стёклами. Готовые образцы рассматривали под 27
микроскопом при увеличении ×400. Для учётов выделяли и анализировали продольные срезы с хорошо различимыми в поле микроскопа поперечными сечениями ситовидных пластинок флоэмы. Диаметры микропор в ситовидных пластинках определяли путём их измерения на пяти пластинках.
Фотофиксацию размеров устьиц на нижней поверхности листовых пластинок сои проводили в 5-кратной повторности под микроскопом при увеличении ×400, помещая фрагменты живого материала площадью около 1 см2 на предметное стекло в каплю дистиллированной воды и накрывая покровным стеклом.
Для анатомического изучения бобов сои отбирали 10 бобов в фазе полного налива семян и лезвием бритвы выполняли их поперечные срезы толщиной 2–4 мм в зонах прикрепления семян к семяножкам. Полученные срезы изучали под микроскопом при увеличении ×40.
Выделение патогенных бактерий с некротических пятен семядолей проводили следующим способом: семена промывали в воде, затем поверхностно стерилизовали путём погружения на 1–2 мин в 96%-ный этиловый спирт. Стерилизованные семена помещали в чашки Петри с увлажнённой стерильной фильтровальной бумагой на 3 суток. Затем выделяли семена с видимыми бактериозными пятнами на семядолях, с поверхности которых мацерированную ткань с микроорганизмами с помощью бактериологической петли переносили в чашки Петри с питательной средой (КСА) для дальнейшего их роста. После получения колоний на питательной среде суспензию бактерий смешивали с каплей дистиллированной воды в пропорции 1 : 10 и наносили тонким слоем на фрагмент нижней стороны листовой пластинки сои. Полученные препараты просматривали под микроскопом при увеличении ×400. Дополнительно проводили фотофиксацию суспензии чистой культуры патогенных бактерий под микроскопом с теми же окулярами и объек-28
тивом при том же увеличении (×400) с целью сравнительного анализа диаметров бактерий с диаметрами пор ситовидных пластинок флоэмы сои. Средний диаметр бактерий определяли путём его подсчёта у 50 бактерий в трех полях микроскопа.
Результаты и обсуждение . Согласно нашим анатомическим исследованиям проводящих тканей у растений сои сорта Вилана, диаметр сосудов ксилемы варьирует от 5 до 40 мкм в зависимости от их типа и возраста. Исходя из того, что линейные размеры основных возбудителей бактериоза у сои обычно имеют диаметр 1,2–1,5 мкм и длину 2,3–2,9 мкм [2], можно утверждать, что вместе с восходящим током поступающей из корней воды эти виды бактерий вполне могут перемещаться по сосудам ксилемы растений в фазы начала цветения и полного налива семян. Однако, исходя из восходящего направления водотока в ксилеме от корней к надземным вегетативным и репродуктивным органам, бактериозом, в первую очередь, будут поражаться ткани, расположенные выше (относительно корневой системы) места проникновения патогенов в трахеиды ксилемы.
Наиболее часто бактериоз сои в виде некротических пятен наблюдается на листьях. Этот тип бактериоза является следствием проникновения в мезофилл листа патогенных бактерий через устьица или через механические повреждения тканей. Поскольку листовые пластинки сои, как и других двудольных растений, включают в себя образованные из проводящих пучков центральную и боковые жилки, сформировалась парадигма, что патогенные бактерии могут попадать в сосудистую систему и распространяться по проводящим тканям в другие части растений.
Рассмотрим гипотетическую возможность передвижения возбудителей семядольного бактериоза из инфицированных устьиц в семена.
Визуальный осмотр листовых пластинок под микроскопом свидетельствует о довольно высокой плотности размещения устьичных клеток на листьях сои, что увеличивает вероятность их контакта со случайно попавшими на лист патогенными бактериями. Так, по данным S. Makbul et al. (2011), на нижней поверхности листа сои их количество в среднем составляет около 94 шт./мм2, на верхней поверхности – до 25 шт./мм2. Размеры устьичной щели у листьев сои по длинной стороне в среднем составляют около 20 мкм [8]. По нашим наблюдениям, линейные размеры устьичных щелей у полностью сформировавшихся листьев сои сорта Вилана составляют 8–12 мкм. Это примерно в 8– 10 раз больше размеров патогенных бактерий рода Pseudomonas (рис. 1).
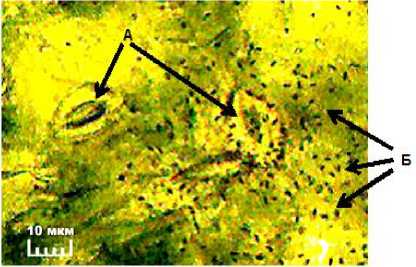
Рисунок 1 – Сравнительные размеры устьичных щелей у листовой пластинки сои и искусственно нанесённой на лист культуры возбудителя семядольного бактериоза рода Pseudomonas , ×400 (ориг.):
А – устьица листовой пластинки;
Б – патогенные бактерии
Поэтому в случае попадания таких бактерий на листья в зоне устьиц, они вполне могут проникнуть через них в подустьичную воздушную полость. Там, на фоне повышенной влажности, за счёт непрерывного диффузного испарения воды с поверхности окружающих клеток мезофилла, эти бактерии начинают размножаться, вызывая некроз прилегающих тканей листа. В этих случаях на инфицированных участках растений развиваются характерные бактериозные пятна, неред- ко затрагивающие боковые и центральные жилки листа с проводящими тканями. Соответственно, равновероятно проникновение патогена в полости сосудов ксилемы и флоэмы. Однако дальнейшее гипотетическое продвижение бактерий по проводящим тканям будет определяться направленностью транспорта воды в них. В сосудах ксилемы поток восходящий, от корней к верхушкам вегетативных и генеративных органов, в том числе и к листьям. Поэтому при проникновении в полости сосудов ксилемы, перемещение бактерий в них возможно только в направлении движения воды к верхушкам центральной и боковых жилок листьев. А водоток в сосудах флоэмы в листьях нисходящий, направленный в сторону стебля и плодов. И гипотетически, бактерии из флоэмы жилок листовых пластинок могут быть перемещены водотоком в сторону рахиса тройчатосложного листа и далее в сосудистую систему побега.
В отличие от почти сквозных, без перегородок или с крупными перфорациями, сосудов ксилемы, сосуды флоэмы представляет собой ряд вытянутых цилиндрических клеток с конечными (торцевыми) стенками. Эти торцевые стенки имеют мелкие ситовидные сквозные поры, благодаря которым эти торцевые стенки получили название ситовидных пластинок, а сами клетки получили название ситовидных трубок. Поры имеются и в боковых стенках ситовидных трубок, однако они не сквозные, а заполнены тяжами цитоплазмы – плазмодес-мами [9].
Поскольку бактериальная пятнистость листьев у сои может развиваться в течение всего вегетационного периода, то и гипотетическое перемещение патогенных бактерий по флоэме возможно на разных этапах онтогенеза растения. Микроскопическое исследование диаметров пор ситовидных пластинок во флоэме центрального побега сои в период начала цветения показало, что их размеры варьируют в диапазоне 0,4–0,7 мкм (рис. 2).

А Б
Рисунок 2 – Продольный разрез ситовидной трубки флоэмы в начале цветения растения сои (А) и фрагмент разреза в зоне ситовидной пластинки со сквозными порами (Б), ×400 (ориг.)
В фазе налива семян диаметр пор ситовидных пластинок флоэмы главного побега сои увеличился до величин 0,8– 1,6 мкм (рис. 3). Примерно такой же диаметр пор у поперечных перегородок ситовидных трубок флоэмы сои (0,6– 1,5 мкм) был показан D.B. Fisher в 1975 г. [10].
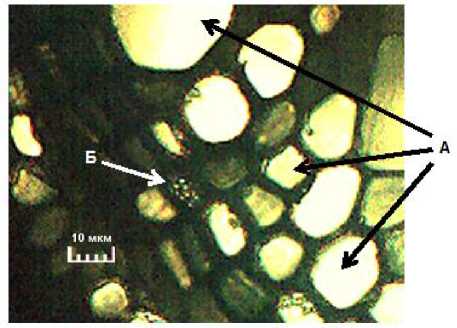
Рисунок 3 – Поперечный разрез проводящих тканей растения сои в фазе налива семян, ×400 (ориг.): А – сосуды ксилемы; Б – флоэма в области ситовидной перегородки с порами
Анализ литературы показывает, что примерно такие же размеры пор ситовид- ных пластинок характерны для многих видов цветковых растений. Так, диаметр пор поперечных ситовидных пластинок у фасоли обыкновенной составляет 0,48– 1,46 мкм [11]. В монографии R. Buvat (1989) приведены электронные изображения продольных срезов микропор поперечных стенок ситовидных трубок флоэмы и некоторых видов сем. Cucurbitaceae и Fabaceae, диаметры которых варьируют от 0,5 до 1,5 мкм [12]. По данным K. Esau et al. (1959) [цит. по: L. Kalmbach and Y. Helariutta, 2019] и P. Bussières (2014), среди цветковых растений известно большое количество видов из различных семейств с диаметрами пор в поперечных перегородках ситовидных трубок около и менее 1 мкм [13; 14].
Длина отдельных ситовидных трубок флоэмы, например, у фасоли обыкновенной, составляет 38–140 мкм (0,038– 0,14 мм) [11]. По нашим наблюдениям, средняя длина ситовидных трубок у сорта сои Вилана также имеет примерно такие же размеры. Так, в частном случае на рисунке 2А длина ситовидной трубки составляет около 50 мкм.
Помимо транспорта синтезированной в процессе фотосинтеза глюкозы, составляющей до 90 % от всех переносимых флоэмой пластических веществ, у ситовидных трубок есть дополнительная функция фильтрации инородных тел, в том числе микроорганизмов [15]. В связи с этим возникает вопрос: смогут ли патогенные бактерии свободно перемещаться по флоэме при наличии большого количества поперечных ситовидных пластинок между ситовидными трубками флоэмы, формирующихся с интервалом около 50–100 мкм (0,05–0,10 мм) или эти бактерии будут отфильтрованы и задержаны на ближайших к месту их проникновения в сосудистый пучок ситовидных пластинках?
Для сравнения диаметров микропор в ситовидных пластинках и линейных размеров патогенных бактерий из поражённых семядольным бактериозом семян сои нами был выделен и сфотографирован под микроскопом бактериальный экссудат. На полученное микроизображение бактерий, с сохранением масштаба, были наложены фрагменты изображений продольного и поперечного разрезов ситовидных трубок флоэмы (рис. 4).
Измерения линейных размеров бактерий, выделенных из пятен семядольного бактериоза, показали, что их средний диаметр составляет 1,3–1,7 мкм. Исходя из размеров пор ситовидных пластинок молодых растений сои (начало цветения), составляющих 0,4–0,7 мкм, более крупные патогенные бактерии, даже попав в полость ситовидных трубок, не смогут передвигаться по флоэме и будут отфильтрованы и задержаны уже на первой ситовидной пластинке. Диаметр пор ситовидных пластинок флоэмы у завершивших рост растений сои (фаза полного налива семян) более крупный, варьирующий в пределах 0,8–1,6 мкм, и сравним с поперечными диаметрами (1,2–1,5 мкм) бактерий основных возбудителей семядольного бактериоза сои. Но даже в этом случае перенос бактерий сквозь поры поперечных пластинок ситовидных трубок не будет свободным. А если учесть, что длина каждой из ситовидных трубок флоэмы, на примере сорта сои Вилана, составляет примерно 0,05–0,10 мм, то с таким же шагом патогенные бактерии будут, как минимум частично, задерживаться и отфильтровываться на внутренней поверхности каждой очередной ситовидной пластинки по ходу водотока во флоэме.
При среднем расстоянии между листовой пластинкой тройчатосложного листа сорта сои Вилана и бобом в этом же узле растения около 15 см, общее количество поперечных ситовидных пластинок с порами будет составлять не менее 1500– 3000 шт. Поэтому вероятность сквозного перемещения патогенных бактерий через всю флоэму на этом пути, с учётом их частичной фильтрации на каждой сито- видной пластинке, очень низка. А в случае выхода патогенных бактерий за пределы флоэмы за счёт бактериальной мацерации боковых стенок ситовидных трубок, они покинут русло нисходящего водотока и будут исключены из гипотетического пассивного переноса по флоэме в бобы и семена.

Рисунок 4 – Сравнительные размеры выделенных из бактериальных пятен патогенных бактерий рода Pseudomonas и микропор ситовидных пластинок флоэмы сои, ×400 (ориг.):
А – участок флоэмы с ситовидной пластинкой сои в начале цветения; Б – участок флоэмы с ситовидной пластинкой сои в период налива семян
Тем не менее допустим, что часть патогенных бактерий, вопреки многочисленным препятствиям в виде тысяч фильтрующих ситовидных пластинок флоэмы, всё же смогла проникнуть по проводящей ткани из поражённого листа в боб. Однако сосудистая система боба и её связь с семенами имеют ещё одно препятствие (рис. 5).
Обеспечение бобов водой, минеральными веществами, продуктами фотосинтеза и метаболизма осуществляется через сосудистую систему плодоножки и створок боба. Обеспечение зародышей семян водой, минеральными и пластическими веществами осуществляется по- следовательно через сосудистые системы брюшного шва створок боба, плаценты (семяножки) и ткани рубчика семени.
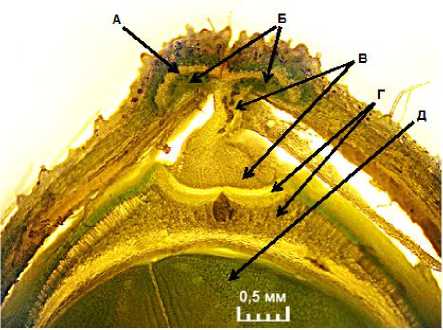
Рисунок 5 – Поперечный срез боба сои в фазе полного налива семян, ×40 (ориг.): А – вентральный (брюшной) склеренхимный пучок створки боба; Б – вентральные сосудистые пучки створок боба (ксилема и флоэма);
В – плацента (семяножка); Г – ткани рубчика семени; Д – ткани семядоли
Причём проводящая система боба заканчивается в зоне прикрепления семяножки к рубчику семени (см. рис. 5). В рубчике семени проводящих тканей уже нет. Поэтому дальнейшее поступление воды и питательных веществ в семя осуществляется диффузно, через плазмодес-мы клеток рубчика, семенной оболочки, семядолей и осевых органов зародыша. Причём диаметр плазмодесм составляет всего 30–60 нм (0,03–0,06 мкм) [16], что в 200–400 раз меньше диаметра бактерий.
Таким образом, даже в маловероятном случае проникновения патогенных бактерий в проводящие ткани боба сои их сосудистый способ перемещения завершится в семяножке. Проникнуть во внутренние ткани семени через не имеющие сосудистой системы ткани рубчика возбудители семядольного бактериоза гипотетически могут только при размножении и мацерации тканей рубчика.
Выводы . Линейные размеры устьичных щелей у листьев сои на примере сорта Вилана в среднем составляют 8– 32
12 мкм, что почти на порядок больше размеров патогенных бактерий. Это обеспечивает свободное проникновение бактерий в подустьичные полости и после мацерации окружающих эти полости клеток – в мезофилл листа.
У растений сои в фазе начала цветения свободное перемещению возбудителей бактериоза по нисходящему потоку в проводящих тканях флоэмы препятствуют размеры пор ситовидных пластинок элементов флоэмы, составляющие 0,4– 0,7 мкм, что в два раза меньше размеров патогенных бактерий.
У растений сои в фазе полного налива семян размеры микропор ситовидных пластинок элементов флоэмы могут увеличиться до 0,8–1,6 мкм, сравнимых с диаметрами патогенных бактерий (1,3– 1,7 мкм). Однако с учётом большого количества ситовидных пластинок в элементах флоэмы возбудители бактериоза, как минимум частично, будут задерживаться и отфильтровываться на поверхности каждой очередной ситовидной пластинки по ходу водотока во флоэме.
Таким образом, исходя из особенностей анатомии проводящих тканей растений сои бактериальные поражения листьев и стеблей не могут быть прямой и основной причиной инфицирования семян через сосудистую систему в силу того, что свободное перемещение патогенных бактерий из поражённых участков вегетативных частей по проводящей системе непосредственно во внутренние ткани семян имеет существенные ограничения.
Список литературы Анатомические особенности проводящих тканей растений сои, препятствующих проникновению возбудителей семядольного бактериоза в семена
- Горленко М.В. Бактериальные болезни растений (Основы учения о бактериозах растений). -М.: Высшая школа, 1966. - С. 198-203.
- Лазарев А.М., Мысник Е.Н., Варицев Ю.А. [и др.]. Ареалы и зоны вредоносности основных бактериозов растений на территории России и сопредельных стран. - С. 23-26; 27-32 // Сер 24. Приложения к журналу «Вестник защиты растений. - Санкт-Петербург: ВИЗР, 2017. - С. 136. DOI: 10.5281/zenodo.1018613.
- Каримова Е.В., Игнатьева И.М. Бактериозы -возбудители болезней зернобобовых культур и разработка методов их диагностики // Карантин растений. Наука и практика. - 2018. - № 4 (26). -С. 28-34.
- Кузьмина В.Г. Фитоэкспертиза семян сои в Хабаровском крае // ФГБНУ «Россельхозцентр», 2017: [Электронный ресурс]. - Режим доступа: https://rosselhoscenter.com/index.php/rosselkhoztsentr -glavnaya-4/724-regiony/dalnevos-tochnyj-federalnyj -okragkhabarovskij-kraj/otdel-zashchity-rastenij/8734-fitoekspertiza-semyan-soi-v-khabarovskomkrae (дата обращения: 22.10.2021).
- Зеленцов С.В., Саенко Г.М., Мошненко Е.В., Будников Е.Н. Первичная причина развития семядольного бактериоза у сои и других зернобобовых культур // Масличные культуры. - 2021. - Вып. 1 (185). - С. 73-89. DOI: 10.25230/2412-608X-2021-1-185-73-89.
- Hartman G.L. Diseases of soybean (Glycine max [L.] Merr.). - The American Phytopathological Society (APS), 2015: [Электронный ресурс]. - Режим доступа: https://www.apsnet.org/edcenter/ re-sources/commonnames/Pages/Soybean.aspx (дата обращения: 20.10.2021).
- Compendium of soybean diseases and pests / Ed. by G.L. Hartman, J.C. Rupe, E.J. Sikora, L.L. Domier, K.L. Steffey and J.A. Davis. - The American Phytopathological Society (APS), 2015. - P. 17-25.
- Паламарчук И.А., Веселова Т.Д. Изучение растительной клетки - М.: Просвещение, 1969. -С. 40-61.
- Makbul S., Saeruhan Guler N., Durmu§ N., Guven S. Changes in anatomical and physiological parameters of soybean under drought stress // Turkish Journal of Botany. - 2011. - Vol. 35. - P. 1-9: [Электронный ресурс]. - Режим доступа: https://www.research gate.net/publication/260404610 _Changes_in_anatomical_and_physiological_paramet ers_of_soybean_under_drought_stress (дата обращения: 22.10.2021). DOI: 10.3906/bot-1002-7
- Киселёва Н.С., Шелухин Н.В. Атлас по анатомии растений. - Минск: «Вышэйшая школа», 1969. - С. 112.
- Fisher D.B. Structure of functional soybean sieve elements // Plant Physiology. - 1975. - Vol. 56. - P. 555-569: [Электронный ресурс]. - Режим доступа: https://www.ncbi.nlm.nih.gov/pmc/artic-les/PMC541872/ (дата обращения: 20.10.2021). DOI: 10.1104/pp.56.5.555.
- Mullendore D.L., Windt C.W., Van As H., Knoblauch M. Sieve tube geometry in relation to phloem flow // The Plant Cell. - 2010. - Vol. 22. - P. 579-593: [Электронный ресурс]. - Режим доступа: www.plantcell.org/cgi/doi/10.1105/tpc.109.070094 (дата обращения: 20.10.2021).
- Buvat R. Phloem // In: Ontogeny, Cell Differentiation, and Structure of Vascular Plants - SpringerVerlag, Berlin, Heidelberg, 1989. Chapter 6. - P. 288-291: [Электронный ресурс]. - Режим доступа: https://link.springer.com/chapter/10.1007/978-3-642-73635-3_10 (дата обращения: 20.10.2021). DOI: 10.1007/978-3-642-73635-3
- Kalmbach L., Helariutta Y. Sieve plate pores in the phloem and the unknowns of their formation // Plants. - 2019. - Vol. 8 (2). - Р. 25: [Электронный ресурс]. - Режим доступа: https://www.mdpi. com/2223-7747/8/2/25 (дата обращения: 20.10.2021). DOI: 10.3390/plants8020025.
- Bussieres P. Estimating the number and size of phloem sieve plate pores using longitudinal views and geometric reconstruction // Scientific Reports, 2014. - Vol. 4. - Art. No 4929: [Электронный ресурс]. - Режим доступа: https://www.ncbi.nlm.nih. gov/pmc/articles/PMC5381363/ (дата обращения: 20.10.2021). DOI: 10.1038/srep04929/
- Jensen K.H., Mullendore D.L., Holbrook N.M., Bohr T., Knoblauch M., Bruus H. Modeling the hydrodynamics of phloem sieve plates // Frontiers in plant science. - 2012. - Vol. 3. - Art. 151. - P. 1-11: [Электронный ресурс]. - Режим доступа: https://www.researchgate.net/publication/229326755_ Mo-deing_the_Hydrodynamics_of_Phloem_Sieve_Plates (дата обращения: 20.10.2021). DOI: 10.3389/ fpls.2012.00151.
- Ehlers K., Kollmann R. Primary and secondary plasmodesmata: structure, origin, and functioning. // Protoplasma. - 2001. - Vol. 216 (1-2). - P. 1-30: [Электронный ресурс]. - Режим доступа: https://pubmed. ncbi.nlm.nih.gov/ 11732191/ (дата обращения: 12.11.2021). DOI: 10.1007/BF02680127.


