Анатомические предпосылки развития и особенности течения канцероматоза брюшины
Автор: Соломенный Сергей Владимирович, Ганцев Камиль Шамилевич, Кзыргалин Шамиль Римович, Минигазимов Рамиль Султанович
Журнал: Ульяновский медико-биологический журнал @medbio-ulsu
Рубрика: Клиническая медицина
Статья в выпуске: 3, 2016 года.
Бесплатный доступ
Цель исследования. Оценить состояние серозно-лимфатических люков париетальной брюшины и рассмотреть их роль в патогенезе диссеминации раковых клеток по брюшине с точки зрения альтернативной теории развития канцероматоза брюшины. Материалы и методы. Изучались анатомические материалы париетальной брюшины диафрагмальной и тазовой областей, взятые у скоропостижно скончавшихся пациентов. Исследование рельефа поверхности брюшины проводилось методом трехмерной световой микроскопии в объемном изображении с помощью 6-, 12- и 25-кратных объективов традиционным светооптическим микроскопом. В качестве инструмента для углубленного наноанатомического исследования использовался сканирующий растровый электронный микроскоп Tescan Vega-3SBH (Чехия). Сушка и чистка поверхности образцов от загрязнения осуществлялись ионно-плазменным травлением с помощью установки Fine coat Ion sputter JFC 1100 (JEOL, Япония). Результаты. В рамках исследования проведен анализ изображений интактной париетальной брюшины диафрагмальной и тазовой областей. Фокус внимания был направлен на оценку состояния серозно-лимфатических люков, субмезотелиальных рельефообразующих структур как наиболее значимых в патогенезе канцероматоза брюшины с точки зрения лимфогенной (альтернативной) теории метастазирования рака. Заключение. Проведенные исследования позволили более детально изучить анатомические особенности интактной париетальной брюшины и понять механизмы развития перитонеального кан-цероматоза с точки зрения альтернативной теории. Вышеописанная теория развития перитонеального канцероматоза, не исключающая имплантационный характер поражения брюшины при раке, позволяет несколько по-иному рассматривать процесс метастазирования рака органов брюшной полости.
Брюшина, канцероматоз, серозно-лимфатический люк, минерализация, растровая электронная микроскопия
Короткий адрес: https://sciup.org/14113182
IDR: 14113182 | УДК: 616-006.6-091
Текст научной статьи Анатомические предпосылки развития и особенности течения канцероматоза брюшины
Введение. Большинство исследователей при изучении брюшины сталкиваются с проблемами четкого определения функций этого органа. С морфологической точки зрения брюшина представляет собой защитную мембрану, анатомо-физиологические особенности которой обеспечивают наилучшую протективную функцию [1–4].
Значительное количество работ как отечественных, так и зарубежных авторов посвящено изучению строения и функции брюшины, при этом не найдено единого подхода к оценке некоторых особенностей ее строения и функции [1, 5].
Функция брюшины в организме полностью не изучена, однако она, несомненно, является жизненно важной системой. Брюшина имеет очень большую поверхность, которую можно сравнить с поверхностью кожи: по данным М.А. Барона (1949), общая площадь брюшины человека составляет примерно 21 986 см2, поверхности кожи – 22 167 см2. Различают висцеральный и париетальный листки брюшины. Первый из них имеет толщину 45–70 мкм, второй – 90–130 мкм [6]. При микроскопическом исследовании брюшины обнаруживается соединительнотканная основа из густой сети коллагеновых и эластических волокон. Полость брюшины (по площади ее стенок) представляет собой наибольшее внесосу-дистое пространство организма. Объем ее содержимого в физиологических условиях составляет всего до 50 мл прозрачной жидкости с удельным весом меньше 1016 и с содержанием белка около 3 г/л. Свойства брюшины определяются также ее микроциркуляторным руслом. Существуют различия между кровообращением и лимфооттоком. Особенность микроциркуляции лимфы заключается в том, что она является полуоткрытой системой. При этом лимфоотток на макроуровне тесно связан с венозным руслом. Взаимоотношения между кровеносной и лимфатической микроциркуляцией (соотношение фильтрации через венулы и резорбции через лимфатические капилляры) в брюшине подчиняются общим гидродинамическим закономерностям микроциркуляции, определяющим тканевой гомеостаз [7].
Особую роль в резорбции жидкости из брюшной полости играют лимфатические капилляры диафрагмальной брюшины – терминальные лимфатические лакуны. Диафрагмальная брюшина построена весьма своеобразно. В утолщенных участках коллагенововолокнистые пучки плотно сращены друг с другом. Истонченные участки соответствуют местам расхождения пучков глубокого коллагеново-эластического слоя. Они ограничивают овальной формы просветы, через которые к поверхности брюшины поднимаются лимфатические сосуды и лимфатические капилляры. Это серозно-лимфатические люки, определяющие специфическую резорбирующую способность диафрагмальной брюшины. Визуально поверхность брюшины в норме является относительно ровной, гладкой и блестящей. При световой микроскопии обнаруживаются истонченные участки брюшины, которые соответствуют местам расхождения пучков коллагеновых волокон поверхностного волнистого коллагенового слоя и глубокого коллагеново-эластического слоя. Они образуют овальноокруглой формы углубления поверхности брюшины размерами от 0,1 до 2 мм.
В построении рельефа поверхности как диафрагмальной, так и тазовой брюшины участвует поверхностный волнистый слой. Он отчетливо визуализируется на всем протяжении в виде высокоамплитудных коллагеновых волокон, консолидированных в отдельные пучки диаметром 5–20 мкм. Посредством люков осуществляется резорбционная функция брюшины, которая может изменяться при многих патологических состояниях. Немалое значение также имеет их количественное распределение в брюшине. По мере появления и увеличения этих отверстий проницаемость брюшины для различных веществ резко увеличивается. Общепризнанным фактом является всасывание кристаллоидов в кровеносные и лимфатические сосуды брюшины, а коллоидов и взвесей – только в лимфатические пути [8–10].
Перемещение жидкости и растворенных в ней веществ может происходить только при наличии механизмов резорбции этой жидкости. Для практической онкологии важным является ток биологических жидкостей в брюшине и около нее. Эти направления связаны со свойствами различных отделов мик-роциркуляторного русла и могут меняться при патологических состояниях. Кровеносная и лимфатическая микроциркуляторные системы брюшины функционируют в тесной связи друг с другом. Фильтрация жидкости из сосудов в ткань осуществляется в кровеносной системе брюшины, а реабсорбция – из тканей во внутреннюю среду, главным образом лимфатическими капиллярами. Вместе с тем в каждом участке брюшины существуют свои особые взаимоотношения между кровеносным и лимфатическим микроциркулятор-ными руслами [11]. Непосредственно под мезотелием имеется поверхностная сеть кровеносных капилляров. Крупные и мелкие артерии, вены, венулы и капилляры расположены в более глубоком – коллагеновом слое париетальной брюшины. Плотность кровеносных капилляров на поверхности брюшины превышает плотность лимфатических капилляров. Особое расположение эндотелиоцитов в капиллярах брюшины способствует тому, что ядросодержащие части этих клеток, находясь друг против друга, при набухании перекрывают просвет капилляра.
Брюшина имеет две сети лимфатических капилляров – поверхностную и глубокую. В пристеночной брюшине боковой стенки живота, диафрагмальной области и брюшине печени лимфатические капилляры лежат более поверхностно, чем кровеносные, а в брюшине передней и задней брюшных стенок кровеносные капилляры располагаются над лимфатическими. Эти соотношения важны для понимания функциональных свойств различных участков брюшины, в частности для объяснения механизмов преобладания процессов резорбции или транссудации жидкости, а также развития перитонеального канцероматоза [10, 13].
Весьма своеобразно построена диафрагмальная брюшина. В ней расположены многочисленные серозно-лимфатические люки, энергично всасывающие не только полостную жидкость, но и взвешенные в ней клеточные элементы и частицы. Их можно обнаружить невооруженным глазом в виде белесоватых участков. В утолщенных участках коллагеново-волокнистые пучки плотно сращены друг с другом. Истонченные участки соответствуют местам расхождения пучков глубокого коллагеново-эластического слоя. Они ограничивают овальной формы просветы, через которые к поверхности брюшины поднимаются лимфатические сосуды и лимфатические капилляры. Это серозно-лимфатические люки, описанные главным образом как «насасывающие люки», определяющие специфическую резорбирующую способность диафрагмальной брюшины [12].
Цель исследования. Оценить состояние серозно-лимфатических люков и субмезотелиальных рельефообразующих структур интактной диафрагмальной и тазовой брюшины по данным светооптической и электронной микроскопии и рассмотреть их роль в патогенезе диссеминации опухолевых клеток по брюшине с точки зрения альтернативной (лимфогенной) теории.
Материалы и методы. Для достижения поставленной цели были изучены анатомические материалы париетальной брюшины диафрагмальной и тазовой областей, взятые у скоропостижно скончавшихся пациентов (4 случая), не имевших в анамнезе онкологических заболеваний. Возраст пациентов составлял 55– 60 лет. Размеры исследуемых образцов для сканирующей электронной микроскопии, а также для световой микроскопии составляли 30 мм2, для трехмерной светооптической микроскопии – 1500 мм2. В качестве инструмента для углубленного наноанатомического исследования использовался сканирующий растровый электронный микроскоп Tescan Vega-3SBH (Чехия), управляемый через персональный компьютер с энергодисперсионной приставкой для элементного микроанализа и вакуу- мирования образцов. Сушка и чистка поверхности образцов от загрязнения осуществлялась ионно-плазменным травлением с помощью установки Fine coat Ion sputter JFC 1100 (JEOL, Япония). Исследование рельефа поверхности брюшины проводилось с помощью традиционного оптического светового микроскопа плоского поля в отраженном свете при одностороннем косом падающем освещении от источника света, установленного выше уровня поверхности предметного столика. Микрорельеф поверхности пленчатых препаратов изучался в объемном изображении с помощью 6-, 12- и 25-кратных объективов.
Результаты и обсуждение. Методами общегистологических исследований и трехмерной световой микроскопии с помощью светооптических микроскопов нами были обнаружены и изучены люки диафрагмальной и тазовой брюшины, имеющие разные формы и размеры, с консолидированными в трабекулы коллагеновыми волокнами (рис. 1, 2).
Лимфатические сосуды или лимфатические капилляры, формирующие люк, часто имеют значительные размеры (200–25 мкм в диаметре) и называются синусоидными капиллярами. Лимфатический капилляр люка по периферии окружен коллагеново-волокнистым каркасом. Значительная часть коллагеновых волокон стенок этого каркаса консолидирована в трабекулы, укрепляющие противоположные стенки люка (рис. 2). В свою очередь участки поверхностного коллагеново-эластического слоя брюшины, к которым примыкает лимфатический капилляр, имеют значительные изменения, адаптивные к функции люков. В частности, поверхностный коллагеново-эластический слой с плотно прилегающими друг к другу спиралевидными коллагеновыми волокнами приобретает окончатый вид. При этом одинарный ряд коллагеновых волокон, собираясь в пучки, создает «окна разряжения» поверхностного коллагеново-волнистого слоя. Данные образования определяются и при традиционной световой микроскопии, однако при электронной микроскопии, особенно при растровой, выявляются своеобразной формы отверстия разного диаметра, имеющие существенное морфофункциональное значение (рис. 3).
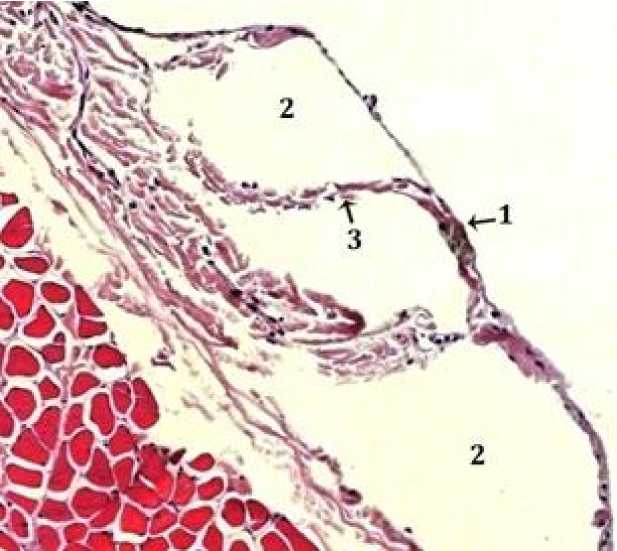
Рис. 1. Интактный участок левого купола диафрагмы:
1 – интимальная поверхность диафрагмальной брюшины;
2 – просвет серозно-лимфатического люка;
3 – трабекула, укрепляющая стенки люка. Окраска гематоксилин-эозином, ув. ×150

Рис. 2. Поверхность интактной диафрагмальной брюшины:
1 – cерозно-лимфатический люк; 2 – поверхностный волнистый коллагеновый слой. Пленочный препарат. Импрегнация аммиачным раствором нитрата серебра.
Падающее отраженное освещение, ув. ×150
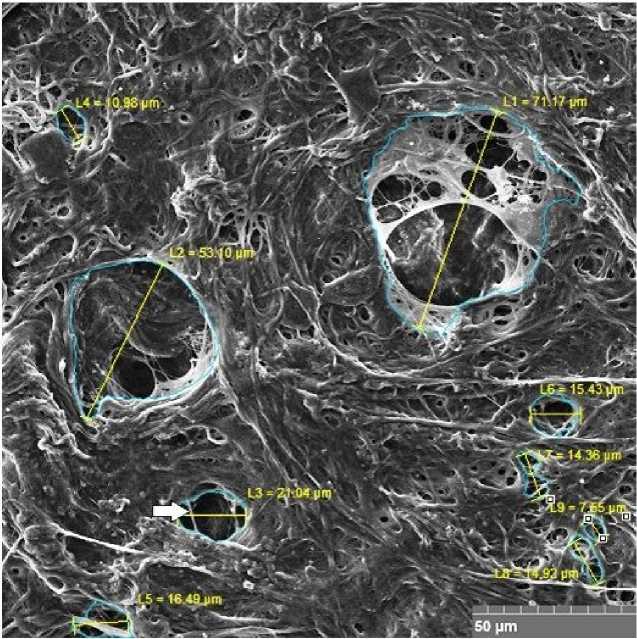
Рис. 3. Сканограмма участка интактной париетальной брюшины (диафрагмальная область) после слущивания мезотелиального покрова.
Маркированы множественные крупные серозно-лимфатические люки разных форм и размеров. Трабекула серозно-лимфатического люка (указана стрелкой). Ув. ×939
Принципиально важными предпосылками развития перитонеального канцероматоза в полости брюшины, с нашей точки зрения, являются серозно-лимфатические люки, через которые реализуется выход раковых клеток на поверхность брюшины. Движущей силой для перемещения раковых клеток являются дыхательные движения диафрагмы. Они сопровождаются попеременным сжатием и расширением лимфатических сосудов люков. Между клетками мезотелия образуются мельчайшие отверстия, способные значительно увеличиваться при некоторых состояниях брюшины. В перфорированной пограничной мембране количество отверстий возрастает. В поверхностном волнистом коллагеновом слое имеются крупных размеров «окна разряжения». Отверстия во всех этих трех слоях брюшины над люками дают возможность свободно проходить одиночным клеткам полостной жидкости и мелким частицам в лимфатические капилляры. В просветах люков лимфатические микрососуды непосредственно примыкают к перфорированным слоям истонченных участков брюшины.
Помимо диафрагмальной брюшины, подобные люки встречаются также в париетальной брюшине малого таза. В этих участках лимфатические сосуды располагаются непосредственно в подпокровных слоях брюшины, и при исследовании в объемном изображении их можно обнаружить на поверхности брюшины в виде слепо открывающихся крупных отверстий – люков. В данных участках серозно-лимфатические люки часто имеют разные формы и размеры. Встречаются люки малых размеров – до 5–10 мкм и относительно крупные – до 50 мкм и более. При этом в тазовой брюшине люки расположены более плотно, чем в диафрагмальной, и имеют значительно меньшие размеры. С точки зрения оценки факторов перитонеального канцероматоза необходимо учитывать, что в патологических условиях соотношение всасывания и транссудации может резко изменяться и «всасывающие» участки на какой-то период становятся «транссудирующими» и наоборот. В соответствии с движением лимфы от органов брюшной полости в грудной лимфатический проток человека и до места его впадения в венозные сосуды для удобства изучения вопроса перитонеального канцероматоза Ш.Х. Ганцевым была предложена классификация лимфатического оттока в брюшной полости по уровням (рис. 5) [4].
Данная классификация, исходящая из анатомических предпосылок, позволяет изучать распространение раковых клеток поэтапно на каждом из вышеназванных уровней в зависимости от локализации опухоли.
На рис. 5, 6 представлена схема развития и масштаб перитонеального канцероматоза в зависимости от уровня поражения лимфатического дренажа. Так, если лимфатический блок наступает на II уровне, то канцероматоз имеет практически местный масштаб. При блоке IV и особенно V уровня может наблюдаться тотальный канцероматоз. Безусловно, эта степень нарушения лимфоциркуляции имеет системный масштаб. Вышеописанная теория развития перитонеального канцерома-тоза, не исключающая имплантационный характер поражения брюшины при раке, позволяет несколько по-иному рассматривать процесс метастазирования рака органов брюшной полости.
Заключение. Анатомическая разнородность брюшины на всем ее протяжении обусловливает различия в ее функциональном «поведении», в т.ч. и при развитии канцеро-матоза. В этом плане строение и роль брюшины как компонента лимфатической системы, на наш взгляд, изучены недостаточно полно. Исследования в данном направлении позволят более детально понять механизмы развития перитонеального канцероматоза и разработать соответствующие методы для его предотвращения, а также лечения уже развивающегося процесса.

Рис. 4. Сканограмма участка интактной париетальной брюшины тазовой области. Множественные серозно-лимфатические люки (указаны стрелкой). Ув. ×939
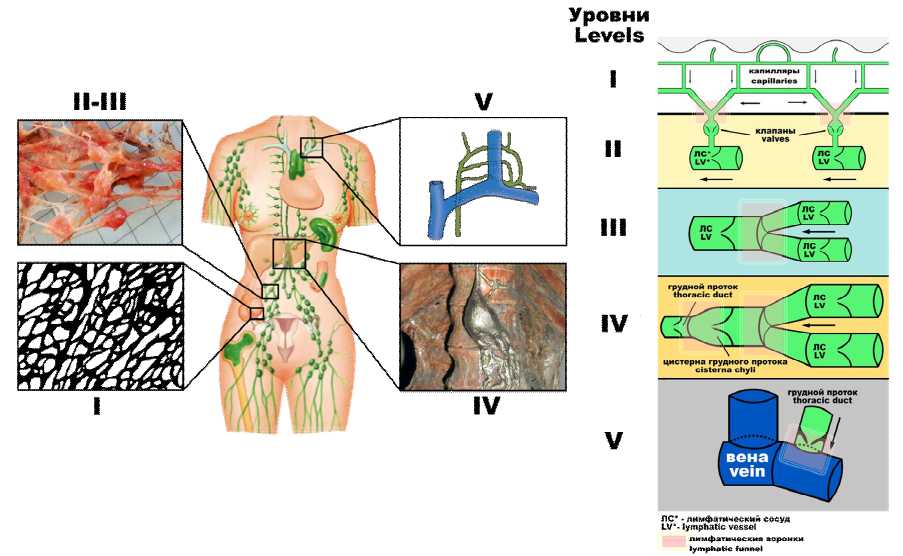
Рис. 5. Уровни лимфатического оттока от органов и систем органов брюшной полости [4]:
1 уровень (А) – локальная лимфатическая сеть органов;
2 уровень (B) – внеорганные лимфатические сосуды и лимфатические узлы звена оттока лимфы;
3 уровень (C) – «воронка», сформированная внеорганными лимфатическими сосудами брюшной полости, забрюшинного пространства;
4 уровень (D) – грудной лимфатический проток; 5 уровень (E) – лимфовенозный шлюз
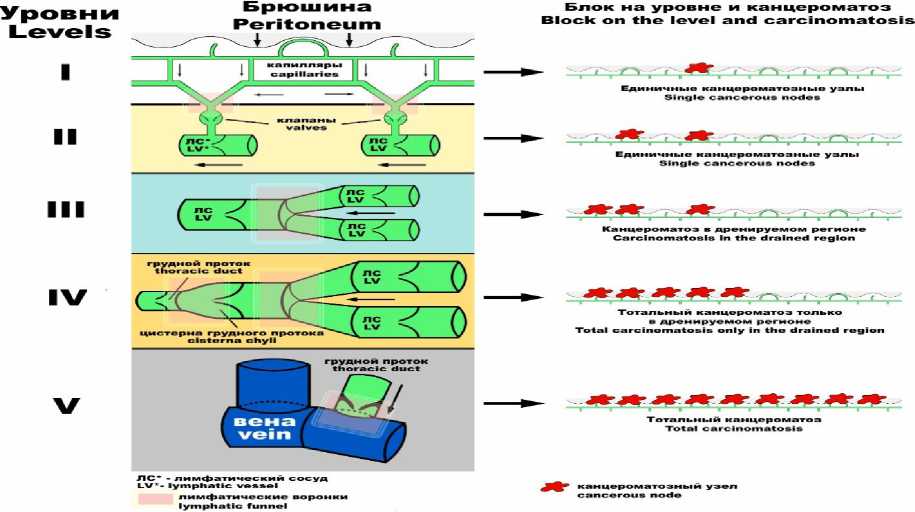
Рис. 6. Масштаб развития перитонеального канцероматоза в зависимости от уровня разгрома лимфатического дренажа органов и систем органов брюшной полости [4]
Список литературы Анатомические предпосылки развития и особенности течения канцероматоза брюшины
- Иванова В.Ф. Роль мезотелия париетальной брюшины в процессе всасывания истинных растворов и взвеси туши из брюшной полости. Бюллетень экспериментальной биологии и медицины. 1986; 10: 1258-1261.
- Димитров Н.Г. К микроскопической анатомии кровеносных сосудов диафрагмы. В кн.: Морфологические основы микроциркуляции. М.; 1965: 90-97.
- Кораблев А.В. Петлевидный рост сосудов как основополагающий принцип васкулогенеза. Архив АГЭ. 1990; 99 (10): 45-52.
- Ганцев Ш.Х. Перитонеальный канцероматоз -новый взгляд на проблему. Креативная онкология и хирургия. 2013; 1. URL: http://eoncosurg.com/?p=3294 (дата обращения: 13.09.2015).
- Baez S. Bayliss response in the microcirculation. Fed. Proc. 1968; 27: 1410-1415.
- Flessner M.F. The importance of the interstitium in peritoneal transport. Pent. Dial. Int. 1996; 16: 76-79.
- Healy J.C. The peritoneum, mesenteries and omenta: normal anatomy and pathological processes. Eur. Radiol. 1998; 8 (6): 886-900.
- Johnson P.C. The microcirculation and local and humoral control of the circulation. Cardiovascular physiology. 1974; 1 (2): 163-171.
- Tsilibary E.C., Wissing S.L. Lymphatic absorption from peritoneal cavity: regulation of patency of mesothelial stomata. Microvasc. Res. 1983; 25 (1): 22-39.
- Fedorko M.E. Studies on transport of macromolecules and small particles across mesothelial cells of the mouse omentum (I. Morphologiec aspects). Exp. Cell. Res. 1971; 69: 113-127.
- Shinohara H., Kominami R., Taniguchi Y. The distribution and morphology of lymphatic vessels on the peritoneal surface of the adult human diaphragm, as revealed by an ink-absorption method. Okajimas Folia Anat. Jpn. 2003; 79 (6): 175-183.
- Krediet R.T. Peritoneal membrane failure in peritoneal dialysis patients. Struijk Blood Purif. 2002; 20: 489-493.


