Антеградная церебральная перфузия у пациентов с разными анатомическими вариантами брахиоцефального ствола
Автор: Панфилов Д.С., Петракова Е.А., Афанасьева Н.Л., Козлов Б.Н.
Журнал: Сибирский журнал клинической и экспериментальной медицины @cardiotomsk
Рубрика: Клинические исследования
Статья в выпуске: 3 т.40, 2025 года.
Бесплатный доступ
Цель: проанализировать результаты проведения антеградной перфузии головного мозга через брахиоцефальный ствол при операциях «hemiarch» у пациентов с вариантной анатомией брахиоцефального ствола. Материал и методы. В ретроспективное исследование были включены 259 пациентов, которым было выполнено хирургическое вмешательство по поводу аневризмы восходящего отдела. Пациенты были разделены на две группы в зависимости от анатомии брахиоцефального ствола: с нормальной (группа No CILCA, n = 202) и вариантной анатомией сосуда (группа CILCA, n = 57). У пациентов обеих групп проведен анализ интраоперационных и ранних послеоперационных данных, включающих оценку неврологического и когнитивного статуса. Результаты. По данным инфракрасной спектроскопии, уровень оксигенации головного мозга у пациентов обеих групп не выходил за пределы нормальных значений в течение всей операции, включая период циркуляторного ареста (63–72%). В одном (0,49%) случае в группе с нормальной анатомией брахиоцефального ствола развился инсульт. Частота развития делириозного состояния в раннем послеоперационном периоде была выше в группе с нормальной анатомией брахиоцефального ствола – 8 (3,9%) против 1 (1,7%) случая в группе вариантной анатомии брахиоцефального ствола, но без статистически значимых различий (р = 0,414). Когнитивная функция в послеоперационном периоде у пациентов в группах с нормальной и вариантной анатомией брахиоцефального ствола не снижалась ниже нормального порога и составляла 25 и 23 балла соответственно (р = 0,11). Выводы. Антеградная перфузия головного мозга через брахиоцефальный ствол при операциях «hemiarch» как у пациентов с нормальной, так и с вариантной анатомией брахиоцефального ствола не ухудшает когнитивный статус, снижает частоту неврологических осложнений. Данный вид перфузии является безопасным и эффективным вне зависимости от анатомических особенностей брахиоцефального ствола.
Восходящая аорта, аневризма аорты, брахиоцефальный ствол, антеградная перфузия головного мозга
Короткий адрес: https://sciup.org/149149303
IDR: 149149303 | УДК: 616.132.13-007.64:612.824 | DOI: 10.29001/2073-8552-2025-40-3-140-147
Текст научной статьи Антеградная церебральная перфузия у пациентов с разными анатомическими вариантами брахиоцефального ствола
Панфилов Д.С., Петракова Е.А., Афанасьева Н.Л., Козлов Б.Н. Антеградная церебральная перфузия у пациентов с разными анатомическими вариантами брахиоцефального ствола. Сибирский журнал клинической и экспериментальной медицины. 2025;40(3):140– 147.
Согласно современным рекомендациям по ведению пациентов с патологией грудной аорты, антеградная перфузия головного мозга признается оптимальным вариантом церебральной защиты при операциях с циркуляторным арестом [1, 2]. Однако до сих пор остается дискутабельным вопрос о приоритетном варианте проведения перфузионной защиты головного мозга – унилатеральном или билатеральном [3, 4]. Необходимо отметить, что в публикациях авторы зачастую не фокусируются на анатомических особенностях супрааортальных сосудов, способных оказать критическое влияние на эффективность перфузионной церебропротекции.
На сегодняшний день недостаточно информации об особенностях перфузионной защиты головного мозга в условиях вариантной анатомии сосудов дуги аорты.
Цель данного исследования: проведение анализа результатов антеградной перфузии головного мозга при протезировании восходящего отдела аорты у пациентов с различной анатомией брахиоцефального ствола.
Материал и методы
Дефиниции
CILCA (common origin of the innominate and left carotid artery) – общее устье брахиоцефального ствола и левой общей сонной артерии: 1-й тип – общее устье брахиоцефального ствола и левой общей сонной артерии, 2-й тип – отхождение устья левой общей сонной артерии от брахиоцефального ствола, 3-й тип – отхождение сосудов дуги аорты одним стволом согласно классификации K.F. Layton и соавт. [5].
Преходящий неврологический дефицит (транзитор-ная ишемическая атака) – эпизод неврологической дисфункции вследствие фокальной ишемии головного мозга без формирования очага инфаркта, сохраняющийся менее 24 ч.
Делирий – острое психическое расстройство, характеризующееся нарушением сознания, ориентации и внимания, часто сопровождается бредом, галлюцинациями и паранойей.
Стойкий неврологический дефицит (инсульт) – новый фокальный неврологический дефицит, сохраняющийся более 72 ч, или новое фокальное повреждение головного мозга, выявленное с помощью компьютерной томографии.
Hemiarch – резекция тубулярной части восходящей аорты с захватом малой кривизны дуги аорты с протезированием, при которой формируется открытый дистальный косой анастомоз от проекции устья левой подключичной артерии до уровня брахиоцефального ствола.
Шкала МоСА (МоСА-тест, Montreal Cognitive Assessment) – инструмент для скрининга когнитивной дисфункции, который включает в себя оценку внимания, речи, памяти, исполнительных функций, визуально-пространственных навыков, знания предметов, ориентации и отсроченного воспроизведения символов. Тест используется для раннего выявления когнитивных нарушений, а также для определения необходимости дальнейшего обследования. При максимально возможном количестве 30 баллов нижней границей нормальных значений является ≥ 23 балла.
Исследуемая популяция
В ретроспективное исследование были включены пациенты с аневризмой восходящей аорты с нормальной и вариантной анатомией брахиоцефального ствола ( n = 259). Критериями исключения в исследование были: расслоение любого отдела грудной аорты, аневризмы дуги и / или нисходящего отдела аорты, а также аномалии сосудов дуги аорты, кроме аномалии развития брахиоцефального ствола (аберрантная правая подключичная артерия, самостоятельное отхождение позвоночной артерии от дуги аорты, аберрантная левая подключичная артерия в сочетании с правосторонней дугой и другие).
Оперированные пациенты были разделены на две группы в зависимости от анатомии брахиоцефального ствола. Пациенты с нормальной анатомией брахиоцефального ствола составили группу No CILCA ( n = 202), пациенты с вариантной анатомией брахиоцефального ствола сформировали группу CILCA ( n = 57). В свою очередь группа CILCA была разделена на подгруппы в зависимости от типа отхождения левой общей сонной артерии от брахиоцефального ствола: 1-й тип CILCA ( n = 29) и 2-й тип CILCA ( n = 28).
Для вычисления показателей деформации, размеров грудной аорты и анатомии брахиоцефального ствола всем пациентам выполняли мультиспиральную компьютерную томографию органов грудной клетки с контрастированием. Запись исследования проводили на кардиологической гибридной системе Discovery NM/CT 570C (GE Healthcare), оснащенной рентгеновским компьютерным томографом с 64 рядами детекторов. Для контрастирования грудной аорты использовали йодсодержащее рентгеноконтрастное средство с концентрацией йода 370– 400 мг йода/мл в дозе 1 мл/кг со скоростью 4–5,5 мл/с. Сканирование проводили в ретроспективном режиме ЭКГ-синхронизации для последующего реформатирования изображений в 10 фазах сердечного цикла. Параметры записи исследования: напряжение на трубке – 120 кВ, сила тока – 300–600 мА с ЭКГ-модуляцией, скорость вращения трубки – 0,4 с, питч – 0,20–0,22 (в зависимости от частоты сердечных сокращений. Изображения реконструировали по стандартным протоколам с толщиной срезов 0,625 мм. Обработку полученных изображений проводили на рабочей станции Advantage Workstations 4.3 (GE Healthcare) с последующим измерением размеров всех отделов грудной аорты и построением объемных реконструкций. До и после введения рентгеноконтрастного средства пациентам измеряли артериальное давление по методу Короткова. Для расширенной постпроцессинговой обработки использовали данные систолической (40% фаза сердечного цикла) и диастолической (90% фаза сердечного цикла) фаз.
Всем пациентам, включенным в исследование, было проведено протезирование восходящей аорты («hemiarch»). Во всех случаях операция выполнялась через срединную стернотомию в условиях легкой гипотермии (28–30 °С) и антеградной перфузии головного мозга через брахиоцефальный ствол [6]. Антеградную перфузию головного мозга осуществляли с использованием отдельного сосудистого протеза 10 мм, вшитого в брахиоцефальный ствол по типу «конец в бок», с последующим соединением с артериальной магистралью аппарата искусственного кровообращения.
Хирургическая техника проведения антеградной перфузии головного мозга имела особенности в анализируемых группах. Перед началом циркуляторного ареста у пациентов с 1-м типом CILCA отдельно блокировали кровоток в каждой из ветвей дуги аорты, обеспечивая унилатеральную антеградную перфузию головного мозга. У пациентов со 2-м типом CILCA блокировали кровоток отдельно в левой подключичной артерии и накладывали зажим на общее устье брахиоцефального ствола и левой общей сонной артерии, осуществляя билатеральную антеградную перфузию головного мозга (рис. 1). По достижении целевой температуры инициировали циркуляторный арест нижней части тела с антеградной перфузией головного мозга. В этих условиях формировали дистальный анастомоз между аортальным протезом и дугой аорты формировали. По завершению анастомоза возобновляли искусственное кровообращение с последующим постепенным согреванием пациента. Проксимальный аортальный анастомоз, а также сочетанные (протезирование аортального клапана, аортокоронарное шунтирование) вмешательства выполняли на этом же этапе операции.
В ходе хирургического вмешательства у всех пациентов регистрировали показатели церебральной оксиметрии правого и левого полушарий (rSO2, %) на основании значений инфракрасной спектроскопии (NIRS) с использованием аппарата INVOS 5100 (Somanetics, США) на следующих этапах операции: исходное значение, инициация искусственного кровообращения, циркуляторный арест, завершение искусственного кровообращения, окончание операции.
На госпитальном этапе послеоперационного периода регистрировали частоту развития преходящего и постоянного неврологического дефицита у пациентов обеих групп. Кроме этого, у всех пациентов до и после операции оценивали когнитивный статус, используя Монреальскую шкалу оценки когнитивных функций (МоСА-тест) [7]. Тест проводили на следующих этапах: при поступлении в стационар (исходные данные), а также в течение первых двух недель после проведенного хирургического вмешательства.
Статистический анализ проводили с использованием пакета программ STATISTICA 13.3 (США). Нормальность закона распределения количественных показателей про-
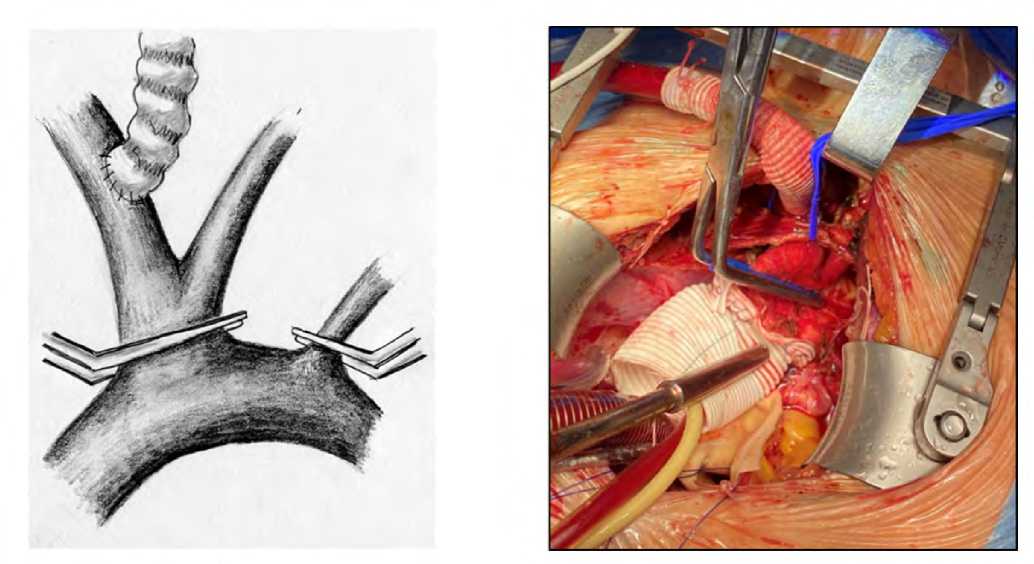
Рис. 1. Антеградная перфузия головного мозга у пациентов со 2-м типом CILCA. Слева – схема проведения церебральной перфузии, справа – интраоперационная фотография
Fig. 1. Antegrade perfusion of the brain in patients with type 2 CILCA. On the left is a diagram of cerebral perfusion, on the right is an intraoperative photograph
веряли с помощью критерия Шапиро – Уилка. Непрерывные переменные представлены медианой ( Ме ) и интерквартильным интервалом ( Q1 ; Q3 ). Категориальные переменные представлены абсолютными и относительными (в %) частотами, n (%). Межгрупповое сравнение категориальных величин проводили с использованием χ2-критерия Пирсона или точного критерия Фишера с поправкой Йейтса. Сравнительный анализ когнитивного статуса пациентов до и после операции выполняли с помощью критерия Уилкоксона. Критический уровень значимости при проверке статистических гипотез составлял 0,05.
Исследование выполнено с использованием оборудования Центра коллективного пользования «Медицинская геномика».
Результаты
Анализ церебральной оксигенации
Согласно данным инфракрасной спектроскопии, в группах CILCA и No CILCA средний уровень оксигенации головного мозга на всех этапах операции находился в пределах нормальных значений: в диапазоне от 63 до 72% (рис. 2).
Необходимо отметить, что в группе No CILCA в период циркуляторного ареста уровень церебральной оксигенации левого и правого полушарий составил 67 и 63% соответственно с уровнем межполушарной асимметрии не более 4%. В группе CILCA на аналогичном этапе вмешательства значения оксигенации левого и правого полушарий головного мозга достигли 66 и 62% соответственно. Межполушарная асимметрия в этой группе пациентов также не превышала 4%.
При этом в подгруппах CILCA наблюдалась следующая динамика: при стабильных показателях оксигенации головного мозга на всех этапах операции в подгруппе 1-го типа CILCA в период циркуляторного ареста межполушарная асимметрия составила 6%, тогда как в подгруппе 2-го типа CILCA достигла лишь 4% порога (рис. 3).
Анализ неврологического статуса
Анализ частоты неврологических осложнений в раннем послеоперационном периоде не выявил статистически значимых различий у пациентов в группах No CILCA и CILCA (табл. 1). Однако стоит отметить, что в группе No CILCA частота развития делириозного состояния была выше относительно пациентов группы CILCA – 8 (3,9%) против 1 (1,7%) случая ( p = 0,414).
Детальный анализ послеоперационных результатов в подгруппах CILCA выявил некоторые различия в отношении неврологического статуса оперированных пациентов (табл. 2). Так, в подгруппе 2-го типа CILCA отсутствовали эпизоды неврологической дисфункции со стороны головного мозга, в то время как в подгруппе 1-го типа CILCA были диагностированы случаи транзиторной ишемической атаки и делириозного состояния.
Анализ когнитивного статуса
При дооперационной оценке когнитивной функции сумма баллов у анализируемых пациентов в группе No CILCA составила 24 балла. При этом в группе CILCA этот показатель достиг уровня 26 баллов ( р = 0,49). В послеоперационном периоде не было отмечено статистически значимых различий по сумме баллов: 25 баллов в группе No CILCA и 23 балла в группе CILCA ( р = 0,11), рис. 4.
Обсуждение
Перфузионная защита головного мозга до сих пор является краеугольным камнем в вопросах органопротекции при операциях на грудной аорте [8–10]. Так, уни-
No CILCA
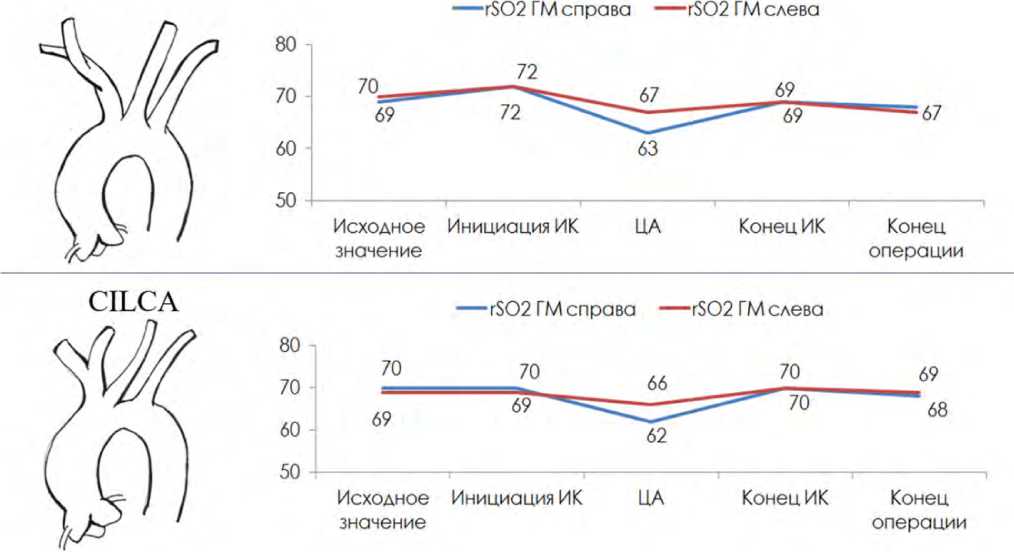
Рис. 2. Показатели церебральной оксиметрии (rSO2, %) полушарий головного мозга у пациентов в группах No CILCA и CILCA Примечание: ИК – искусственное кровообращение, ГМ – головной мозг, ЦА – циркуляторный арест (динамика средних значений). Fig. 2. Indicators of cerebral oximetry (rSO2, %) of the cerebral hemispheres in patients in the No CALCA and CALCA groups Note: IR – artificial blood circulation, GM – brain, CA – circulatory arrest (dynamics of averages).
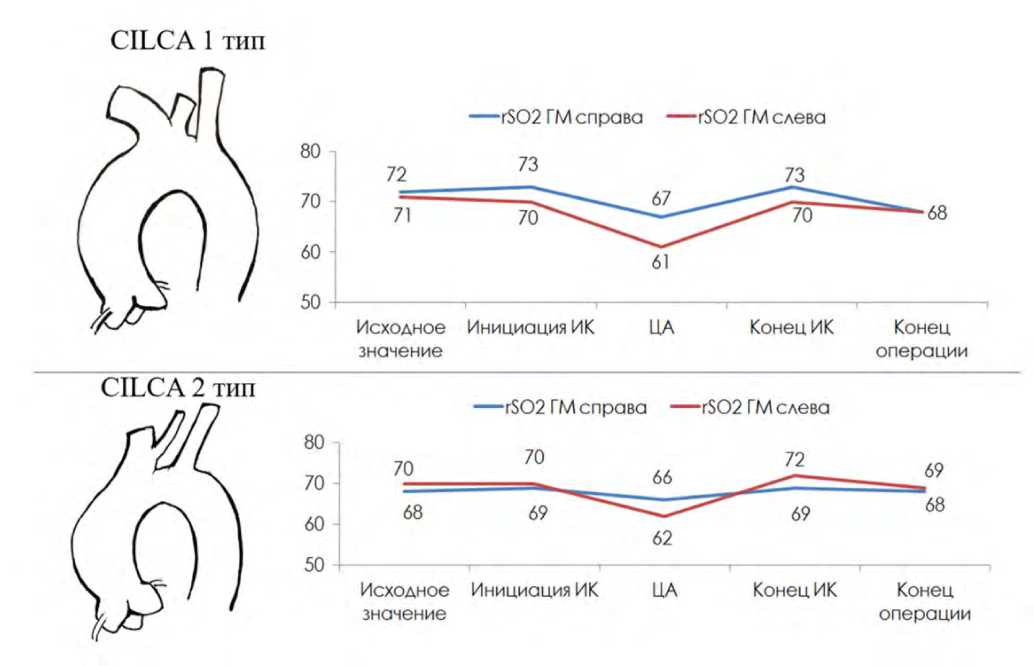
Рис. 3. Показатели инфракрасной спектроскопии полушарий головного мозга у пациентов в подгруппах CILCA 1-го типа и CILCA 2-го типа Примечание: ИК – искусственное кровообращение, ЦА – циркуляторный арест (динамика средних значений).
Fig. 3. Indicators of infrared spectroscopy of the cerebral hemispheres in patients in the CILCA type 1 and CILCA type 2 subgroups
Note: IC – artificial blood circulation, CA – circulatory arrest (dynamics of averages).
Таблица 1 . Неврологический статус в раннем послеоперационном периоде у пациентов в группах No CILCA и CILCA
Table 1 . Neurological status in the early postoperative period in patients in the No CILCA and CILCA groups
|
Показатели |
No CILCA, n = 202 |
CILCA, n = 57 |
p-value |
|
Инсульт, n (%) |
1 (0,49) |
0 |
0,449 |
|
Транзиторная ишемическая атака, n (%) |
1 (0,49) |
1 (1,7) |
0,345 |
|
Делирий, n (%) |
8 (3,9) |
1 (1,7) |
0,414 |
Примечание: BF (blood flow) – скорость кровотока, BV (blood volume) – объем кровотока, PS (permeability solution) – проницаемость сосудов, MTT (mean transit time) – среднее время прохождения контрастного вещества, TTP (time to peak) время до пикового накопления контрастного вещества.
Таблица 2 . Неврологический статус в раннем послеоперационном периоде у пациентов в подгруппах 1-го типа CILCA и 2-го типа CILCA
Table 2 . Neurological status in the early postoperative period in patients in subgroups type 1 CILCA and type 2 CILCA
|
Показатели |
1-й тип CILCA, n = 29 |
2-й тип CILCA, n = 28 |
p-value |
|
Инсульт, n (%) |
0 |
0 |
– |
|
Транзиторная ишемическая атака, n (%) |
1 (3,4) |
0 |
0,321 |
|
Делирий, n (%) |
1 (3,4) |
0 |
0,321 |
Примечание: BF (blood flow) – скорость кровотока, BV (blood volume) – объем кровотока, PS (permeability solution) – проницаемость сосудов, MTT (mean transit time) – среднее время прохождения контрастного вещества, TTP (time to peak) время до пикового накопления контрастного вещества.
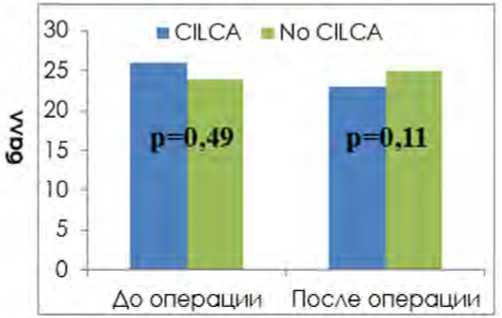
Рис. 4. Когнитивный статус анализируемых пациентов до и после операции (динамика средних величин)
Fig. 4. Cognitive status of the analyzed patients before and after surgery (dynamics of averages)
латеральная антеградная перфузия головного мозга характеризуется сниженным профилем безопасности при длительности редуцированного кровоснабжения головного мозга, превышающей 50 мин. При этом билатеральная антеградная перфузия головного мозга имеет больший запас «прочности», но вместе с тем ассоциируется с высокими рисками левосторонних инсультов, связанных с дополнительными хирургическими манипуляциями на левой общей артерии. Несмотря на приближенность к физиологичному потоку крови при билатеральном варианте перфузии головного мозга, относительно частое левостороннее повреждение головного мозга не позволяет считать данный вариант перфузии высокоэффективным и безопасным [11, 12]. Таким образом, продолжающиеся дебаты относительно вариантов антеградной церебральной перфузии не позволяют вывести этот вопрос из актуальной научной повестки.
Стоит подчеркнуть, что существующий на сегодняшний день взгляд на статус перфузионной церебральной защиты в основном базируется на результатах хирургического лечения пациентов с нормальной анатомией сосудов дуги аорты. Пациенты с вариантной анатомией супрааортальных артерий представляют иную категорию. Наиболее важной особенностью у этой когорты является необходимость изменения стандартных технических приемов при проведении перфузионной защиты головного мозга [13].
Согласно литературным данным, приблизительно в 3% случаев диагностируются аномалии строения и количества супрааортальных сосудов, обусловленных эмбриональными отклонениями, среди которых выделяют следующие: самостоятельное отхождение позвоночной артерии от дуги аорты (5%), arteria lusoria (25%), аберрантная левая подключичная артерия (16%), аберрантная левая подключичная артерия в сочетании с правосторонней дугой (12%). При этом установлено, что наиболее частой аномалией развития супрааортальных сосудов является общее отхождение брахиоцефального ствола и левой общей сонной артерии или, так называемая «бычья дуга» (до 58%) [14–16].
С учетом относительно высокой частоты встречаемости данного анатомического варианта сосудов дуги аорты предприняты попытки классификации этого состояния. Согласно отечественной классификации, выделяют следующие типы CILCA: 1-я группа – общее устье брахиоцефального ствола и левой общей сонной артерии с длинным стволом (длина общего ствола более 10 мм); 2-я группа – единое устье брахиоцефального ствола и левой общей сонной артерии с коротким стволом (длина общего ствола 5–10 мм); 3-я группа – общее устье брахиоцефального ствола и левой общей сонной артерии [17]. Применяя классификацию K.F. Layton и соавт., выделяют несколько типов CILCA: брахиоцефальный ствол и левая общая сонная артерия имеют общий ствол (I тип); устье левой общей сонной артерии отходит от брахиоцефального ствола (II тип); брахиоцефальный ствол, левая общая сонная артерия и левая подключичная артерия имеют общий ствол (III тип, истинная «бычья дуга»). Стоит отметить, что согласно наблюдениям, значительных различий по частоте встречаемости между I и II типами не наблюдается.
Проведение билатеральной церебральной перфузии в условиях вариантной анатомии брахиоцефального ствола может стать трудоемкой и небезопасной манипуляцией. С учетом этого важен поиск приемлемого сайта артериальной канюляции для проведения антеградной перфузии головного мозга. В этих условиях канюляция только брахиоцефального ствола может стать оптимальным вариантом для проведения антеградной перфузии головного мозга, имея целый ряд преимуществ перед рекомендованным сайтом артериальной канюляции – правой подключичной / подмышечной артерии: контроль за канюлей в ходе всей операции, адекватное обеспечение искусственного кровообращения без изменения места канюляции, достоверность показателей перфузионного давления в правой лучевой артерии и адекватная оценка перфузии головного мозга. Основываясь на опубликованных данных о периоперационной динамике нейрон-спец-ифической енолазы и когнитивного статуса оперированных пациентов, проведение антеградной перфузии головного мозга через брахиоцефальный ствол является эффективной и безопасной процедурой [18]. Другие исследователи также отмечают высокую эффективность и безопасность антеградной перфузии головного мозга, проводимую через брахиоцефальный ствол [19, 20].
В настоящем исследовании также была подтверждена эффективность антеградной перфузии головного мозга через брахиоцефальный ствол, в том числе у пациентов с вариантной анатомией этого сосуда. Так, анализируя показатели инфракрасной спектроскопии, полученные в ходе данного исследования, не было отмечено различий в этой группе больных относительно пациентов с нормальной анатомией сосуда в ходе всей операции, что косвенно свидетельствовало об адекватности перфузии головного мозга. Стоит подчеркнуть, что у пациентов подгруппы 2-го типа CILCA показатели межполушарной асимметрии были ниже относительно пациентов подгруппы 1-го типа CILCA, что может указывать на более эффективную церебральную перфузию.
Послеоперационные результаты, включившие оценку неврологического и когнитивного статуса у пациентов обеих групп, также не выявили статистически значимых межгрупповых различий. Однако стоит отметить факт того, что в подгруппе 2-го типа CILCA не было диагностировано ни одного эпизода преходящего или стойкого неврологического дефицита. Это обстоятельство в сочетании с показателями инфракрасной спектроскопии у этой подгруппы пациентов может свидетельствовать о лучшей эффективности перфузии головного мозга. Проводимая билатеральная церебральная перфузия с канюляцией брахиоцефального ствола представляется оптимальным вариантом антеградной перфузии головного мозга у пациентов со 2-м типом CILCA. Такая перфузия имеет все преимущества унилатеральной антеградной перфузии головного мозга без главных недостатков билатерального варианта (т. е. дополнительных манипуляций с левой общей сонной артерией). Важно отметить, что при канюляции брахиоцефального ствола у этой подгруппы пациентов артериальный поток направлен не только антеградно в головной мозг, но и ретроградно – в дугу аорты. Создаваемый гемодинамический барьер в дуге аорты теоретически является препятствием аэро- и материальной эмболии в зону каротидного бассейна при восстановлении сердечной деятельности после снятия аортального зажима. Это является еще одним из возможных объяснений отсутствия неврологических осложнений у этой когорты пациентов.
Таким образом, учитывая полученные данные, канюляция брахиоцефального ствола для проведения антеградной перфузии головного мозга является эффективной техникой даже у пациентов с вариантной анатомией брахиоцефального ствола. Более того, при наличии технической возможности у пациентов с «бычьей дугой» (особенно при 2-м типе CILCA) целесообразно накладывать зажим на общий ствол брахиоцефального ствола и левой общей сонной артерией с целью проведения билатеральной антеградной перфузии головного мозга.
Ограничения
Одним из главных ограничений исследования является относительно малый объем выборки пациентов и од-ноцентровый характер исследования.
Выводы
Антеградная перфузия головного мозга через брахиоцефальный ствол при операциях «hemiarch» у пациентов с нормальной и вариантной анатомией брахиоцефального ствола не ухудшает когнитивный статус, снижает частоту неврологических осложнений, тем самым данный вид перфузии является безопасным и эффективным.


