Антиген для иммунологических анализов
Автор: Хаертдинов К.С., Герасимов В.В., Уразов Н.Г., Вершинина В.И., Элдер Альфредо, Равилов Р.Х.
Статья в выпуске: 2 т.210, 2012 года.
Бесплатный доступ
В результате иммуноблотинга антигенов, полученных из культуральной среды, наиболее активным в иммунологических тестах оказался белок с молекулярной массой 38 кДа.
Антиген, ифа, культуральная среда, белковые фракции, иммуноблотинг
Короткий адрес: https://sciup.org/14287521
IDR: 14287521 | УДК: 619:616.9
Текст научной статьи Антиген для иммунологических анализов
Целью данной работы было определить возможность использования культуральной среды (КС) в качестве источника антигенов, пригодных для применения в иммуноблотинге и ИФА.
Клетки штамма «Академия» выращивали на твердой питательной среде Левинштейна-Йенсена в течение 40-60 дней, отмывали от питательной среды, переносили в жидкую питательную среду Сотона. Наращивание бактериальной массы в указанной среде проводили в аппарате «Bacteck» или на шейкере при 37°С в течение 14-28 суток. Клетки отделяли центрифугированием, а супернатант фильтровали через сэндвич из нитроцеллюлозных мембран Миллипор: 0,65 мкм, 0,45 мкм и 0,22 мкм под давлением 0,4 – 0,8 атмосфер, концентрировали в 10 раз в диализных мешках под струей воздуха или на концентраторе «Amicon» с использованием фильтров SM-1-10.
Полученная КС была исследована в ИФА с использованием положительных сывороток (сыворотки пациентов с установленным диагнозом – туберкулез) и отрицательных сывороток (сыворотки условно здоровых людей), а также контрольных сывороток, заимствованных из набора «Бест-туб-ИФА-стрип».
Полученные в ИФА показатели оптической плотности (ОП) с сыворотками больных туберкулезом были выше, чем с сыворотками условно здоровых людей. Однако показатели ОП с отрицательными сыворотками были также достаточно высоки (0,4-0,9 ед. оптической плотности).
Полагая, что присутствующие в КС метаболиты и прочие низкомолекулярные соединения могут конкурировать с белками, при сорбции на полистероле было проведено осаждение белков из КС этанолом.
Процедура была следующей: от спонтанного образовавшегося в во время хранения материала осадка освобождались центрифугированием при 6000 об/мин в течение 10 минут. К супернатанту приливали равный объем охлажденного до -20°С этанола и после 15 минутной экспозиции при -20°С отделяли осадок центрифугированием при 6000 об/мин в течение 10 минут. К полученному супернатанту повторно добавляли еще один, равный первоначальному объем этанола и повторно отделяли осадок. Дальнейшее добавление органического растворителя не приводило к выпадению осадка.
Полученные осадки, а также супернанант, после удаления этанола диализом против дистиллированной воды с последующим концентрированием в диализном мешке под струей воздуха были исследованы в ИФА. Иммобилизацию материалов в лунках полистеролового планшета проводили в забуференном физиологическом растворе (0,15М натрия хлористого в 0,05М натрий-фосфатном буфере, рН 7,2-7,4) при комнатной температуре в течение 18-20 часов.
Постановке ИФА использовали разведение положительной и отрицательной сывороток в разведение 1:100.
На рисунках 1 и 2 представлены показатели ОП антигенных препаратов: исходной КС, спонтанного выпавшего осадка, двух этанольных осадков и двух супернатантов. Первого – после удаления этанола, выдерживанием пробы в диализном мешке под струей воздуха, второго - после диализа против дистиллированной воды и последующего концентрирования в диализном мешке на воздухе. При проведении ИФА использовали положительную и отрицательную сыворотки в разведение 1:100.
Видно, что наиболее высокий коэффициент специфичности при сенсибилизации планшетов препаратами концентрацией в 120 мкг/мл проявляется на антигенном препарате, представляющем осадок, полученный при добавлении к КС равного объема этанола (наименьший коэффициент специфичности имеет препарат, представляющем осадок, полученный при добавлении к КС еще одного равного объема этанола).
На рисунке 3 представлены электрофоретические профили препаратов, которые были исследованы в ИФА. В качестве маркеров (белков с известной молекулярной массой) использовали набор белков с известной массой «Prestained SDS-PAGE Standarts High Range»(BIO-RAD) / Фракционирование проводили в пластинчатом 15% ПАГ по Леммли (1970). Белковые фракции выявляли с помощью красителя кумаси G-250.
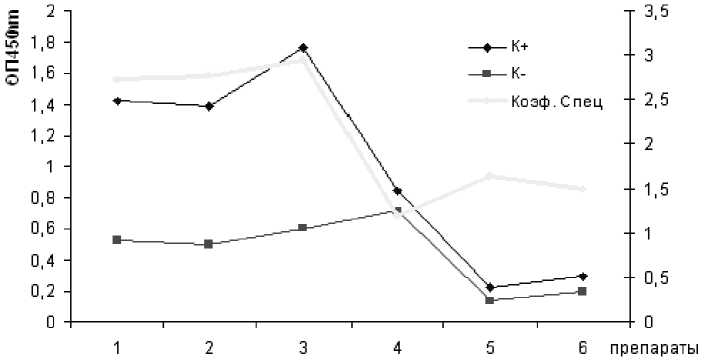
Рис.1. Показатели ОП антигенных препаратов выделенных из культуральной среды
Препараты: 1) исходная КС; 2) спонтанный осадок; 3) осадок, полученный после добавления к КС равного объема этанола; 4) осадок, полученный после повторного добавления к КС еще одного объема этанола; 5) супернатант, после удаления этанола и диализа; 6) супернатант, после удаления этанола.
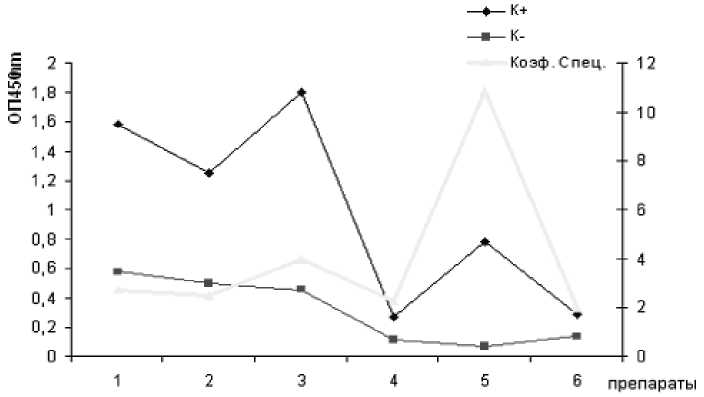
Рис. 2. Показатели ОП антигенных препаратов выделенных из культуральной среды
Препараты: 1) исходная КС; 2) спонтанный осадок; 3) осадок, полученный после добавления к КС равного объема этанола; 4) осадок, полученный после повторного добавления к КС еще одного объема этанола; 5) супернатант, после удаления этанола и диализа; 6) супернатант, после удаления этанола.
Треки: 1 2 3 4 5 М
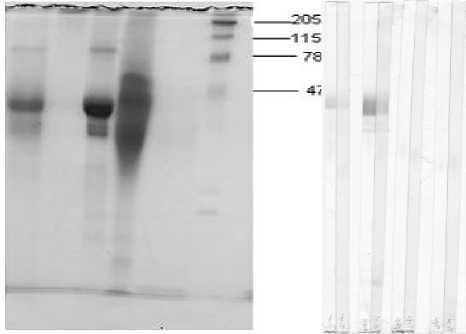
Рис. 3. Электрофоретические профили препаратов полученных из КС.
Треки: 1) исходная КС; 2) спонтанный осадок; 3) осадок, полученный после добавления к КС равного объема этанола; 4) осадок, полученный после повторного добавления к КС еще одного объема этанола; 5) супернатант.
На рисунке 3 видно, что в исходной КС львиная доля по белку приходится на фракцию с молекулярной массой в 39 кДа. Значительно меньшее количество содержится во фракциях с молекулярной массой в 29,5 кДа и 86 кДа. В ней присутствуют также и низкомолекулярные белки, которые мигрируют со скоростью лидирующего красителя -бромфенолового синего.
Основная доля белков спонтанно выпавшего в хранении КС осадка составляют высокомолекулярные белки, остановившиеся на границе концентрирующего и разделяющего гелей и упомянутых выше белков, мигрирующих со скоростью лидирующего красителя.
Видимые на треке исходной КС фракции четко проявляются в осадке, полученном при добавлении к КС равного объема этанола.
Обращает внимание резкое отличие белкового спектра осадка, полученного после повторного добавления еще одного объема этанола. Основное количество белка располагается в диапазоне молекулярных масс 60-20 кДа. В указанном диапазоне просматриваются 4 пика с молекулярными массами 56 кДа, 43 кДа, 29 кДа и 25 кДа. Следует отметить также появление двух минорных фракций имеющих несколько меньшую скорость миграции, чем упомянутая выше низкомолекулярная фракция.
Задачей следующей серии экспериментов состояла в определение наиболее активно реагирующих фракций содержащихся в КС с сыворотками пациентов, больных туберкулезом (рисунок 4).
А Б
1 2 3 4 М 1 2 3 4
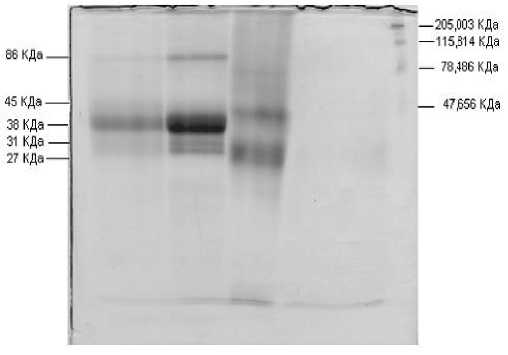
Рис.4. А) Гель, с которого был проведен электроперенос белков на нитроцеллюлозную мембрану и с которого были сняты денситограммы.
Треки: 1) исходная КС; 2) осадок, полученный после добавления к КС равного объема этанола; 3) осадок, полученный после повторного добавления к КС еще одного объема этанола; 4) супернатант.
Б) Иммуноблоты, полученные на антигенах № 1, 2, 3 и 4.
Сыворотки: слева положительная, справа – отрицательная
На рисунке 4 представлены последовательно гель с фракционированными в нем 4 антигенными препаратами, с которого был осуществлен элетроперенос белков на нитроцеллюлозную мембрану, 4 пары иммуноблотов, соответственно количеству фракционированных препаратов и денситограммы 3 антигенных препаратов которые были получены и этого гена. Фракционирование проводили в пластинчатом 15% ПАГ по Леммли (1970). Белковые фракции выявляли с помощью красителя кумаси G-250.
Результаты фракционирования антигенных препаратов (рис.4А) свидетельствуют, что в исходной КС основная доля белка приходится на белок с молекулярной массой 38 кДа и несколько меньшую долю составляют белки с молекулярными массами 30-32 кДа и 86 кДа. Более четкое проявление на электрофореграмме указанных белков в препарате, полученном при внесении в КС равного объема этанола, свидетельствует о том, что указанные белки являются наиболее гидрофобными белками КС.
Результаты иммуноблотинга, представленные не рис 4Б свидетельствуют о том, что серололически наиболее активными является белок с молекулярной массой 38 кДа, несколько уступает ему по активности белки с молекулярными массами 31-30 кДа. Следует также отметить, что указанные белки проявляют серологическую активность с сыворотками условно здоровых пациентов, но в меньшей степени, чем с сыворотками пациентов больных туберкулезом.
Выводы. 1. В исходной КС основная доля белка приходится на белок с молекулярной массой в 38 кДа, несколько меньшую долю составляют белки с молекулярными массами 30-32 кДа и 86 кДа. 2. Указанные белки являются одними из самых гидрофобных белков КС, поскольку первыми выпадают в осадок при внесении в КС органического растворителя. 3. Серололически наиболее активными является белок с молекулярной массой 38 кДа, несколько уступает ему по активности белки с молекулярными массами 31-30 кДа. 4. Указанные белки проявляют серологическую активность с сыворотками условно здоровых пациентов, но в меньшей степени, чем с сыворотками пациентов больных туберкулезом.
АНТИГЕН ДЛЯ ИММУНОЛОГИЧЕСКИХ АНАЛИЗОВ
Хаертдинов К.С., Герасимов В.В., Уразов Н.Г., Вершинина В.И., Альфредо Элдер, Равилов Р.Х.
Резюме
В результате иммуноблотинга антигенов, полученных из культуральной среды, наиболее активным в иммунологических тестах оказался белок с молекулярной массой 38 кДа.
ANTIGEN FOR IMMUNOLOGIC ANALYSES
Khaertdinov K.S., Gerasimov V.V., Urazov N.G., Vershinina V.I., Alfredo Elder, Ravilov R.Kh.


