Aнтигенная активность бактерий Salmonella сholeraesuis и Pasteurella multocida в ассоциированной вакцине при инактивации димером этиленимина
Автор: Прунтова О.В., Русалеев В.С., Гневашев В.М., Cеливерстов В.В., Потехин А.В., Колотилова Т.Г.
Журнал: Сельскохозяйственная биология @agrobiology
Рубрика: Иммунитет и ветеринария
Статья в выпуске: 6 т.38, 2003 года.
Бесплатный доступ
В образцах эмульсионных вакцин оценивали антигенную активность бактерий Salmonella сholeraesuis и Pasteurella multocida, инактивированных димером этиленимина. Определяли количество и динамику образования гуморальных и колостральных антител в сыворотке крови свиней крупной белой породы разного возраста при иммунизации антигенами в различных дозах.
Короткий адрес: https://sciup.org/142132938
IDR: 142132938 | УДК: 636.424:619:579.84:57.083:579.62
Текст научной статьи Aнтигенная активность бактерий Salmonella сholeraesuis и Pasteurella multocida в ассоциированной вакцине при инактивации димером этиленимина
Среди инактивированных вакцин наибольшее распространение получили сорбированные на гидроокиси алюминия антигены, инактивированные формалином, которые хорошо сохраняются и относительно просты в изготовлении, но имеют следующие недостатки: высокие прививные дозы препаратов; отрицательное влияние формалина на поверхностную структуру антигенов; раздражение подкожной клетчатки при парентеральном введении; недостаточная иммуногенность (9-10).
В последнее время для вакцинации свиней используют эмульсионные вакцины, в которых дисперсной фазой является суспензия инактивированных бактерий, а дисперсионной средой — минеральное масло с эмульгатором (11). При этом в качестве инактиванта кроме формалина применяют и другие вещества, например азиридинового ряда, оказывающие меньшее повреждающее действие на поверхностную структуру антигена (12). Так, во Всероссийском НИИ защиты животных (ВНИИЗЖ) разработана ассоциированная эмульсионная вакцина против пастереллеза и сальмонеллеза свиней, в состав которой входят Salmonella сholeraesuis и Pasteurella multocida , инактивированные димером этиленимина (ДЭИ) и эмульгированные в масляном адъюванте Мontanidae ISA-70 (6).
Титры постинфекционных или поствакцинальных антител к возбудителям бактериальных инфекций определяют по реакциям агглютинации (PA), гемагглютинации (РГА), непрямой гемагглютинации (РНГА) и другим серологическим тестам, а также с помощью иммуноферментного анализа (ИФА). Нами разработаны и впервые в России изготовлены наборы ИФА для выявления антител к антигенам P. multocida и жгутиковых бактерий рода Salmonella в сыворотках крови свиней. Один набор позволяет быстро протестировать 180 проб сыворотки в разведении 1:400, что достаточно сложно осуществить другими серологическими методами. При этом динамика и степень накопления антител, оцениваемых по РА, достоверно коррелируют с результатами ИФА ( r = 0,91), что позволяет использовать наборы ИФА для исследования проб сывороток крови от экспериментально инфицированных и вакцинированных животных (13).
В задачу нашей работы входило выявление специфических антител в сыворотке крови свиней посредством ИФА после парентерального введения ассоциированной вакцины, содержащей инактивированные ДЭИ бактерии S. choleraesuis и P. multocidа в различных дозах.
Методика. Объектом исследования служили свиньи крупной белой породы разного возраста. При изготовлении антигенов использовали полученные из Всерос- сийского государственного НИИ контроля стандартизации и сертификации ветеринарных препаратов штаммы S. choleraesuis (штамм 370) и P. multocida (серовар В, штамм 656), суспензионные культуры которых выращивали в аппаратах АК-210 до концентрации 10,6 lg КОЕ/см3. Концентрацию клеток бактерий определяли при помощи стандарта мутности Государственного НИИ стандартизации и контроля медицинских биологических препаратов им. Л.А. Тарасевича (ГИСК) и методом титрования в чашках Петри на мясопептонном (МПА) и кровяном (КА) агаре.
Инактивацию бактериальных суспензий ДЭИ проводили при температуре 37 оС и постоянном перемешивании, учитывая объем и концентрацию основного активного вещества в водном растворе инактиванта, pH которого предварительно доводили до 7,2-8,0 раствором уксусной кислоты (5 М) (12). Штаммы микроорганизмов инактивировали ДЭИ в концентрации 3 % ( P. multocida ) и 1 % ( S. choleraesuis ); эмульгирование проводили в масляном адъюванте Montanide ISA-70 (13).
Антигенную активность инактивированных бактерий определяли после однократной иммунизации 24-40-суточных поросят культурами антигенов в объеме 0,5 см3 и дозах 10,08; 9,60; 9,10; 8,47; 8,10; 7,47 lg КОЕ. Антигенную активность ассоциированной вакцины оценивали по титрам специфических антител в сыворотке крови вакцинированных 1,5-4-месячных поросят из благополучных по сальмонеллезу и пастереллезу хозяйств. При этом использовали наборы диагностикумов для непрямого твердофазного ИФА, разработанные во ВНИИЗЖ по традиционной методике.
Титры антител (в единицах обратных разведению сыворотки) рассчитывали по формулам lg Т = 1,5 ⋅ (lg S/P) + 3,8 и lg Т = 1,65 ⋅ (lg S/P) + + 3,623 соответственно для S. choleraesuis и P. multocida , где Т — титр, S и P — фотометрические значения оптической плотности соответственно исследуемой пробы сыворотки и стандартной гипе-риммуной сыворотки с известным титром антител ( λ = 492 нм); 1,5; 3,8 и 1,65; 3,623 — постоянные коэффициенты для наборов ИФА. В качестве детекторных антител использовали диагностические иммуноглобулины против IgG свиньи, меченные пероксидазой (производство НИИ эпидемиологии и микробиологии им. Н.Ф. Гамалеи). Пороговое (фоновое) количество антител, выше которого реакцию сыворотки на антигенную активность оценивали как положительную, составляло для S. choleraesuis и P. multocida соответственно 1000 и 560.
Поросят-сосунов 25-суточного возраста ( n = 250), полученных от невакцини-рованных свиноматок, условно разделили на три группы: I и II (по 100 гол. в каждой) — животных иммунизировали посредством внутримышечных инъекций ассоциированной вакцины в объеме 0,5 см3 в области шеи — соответственно одно- и двукратно с интервалом между прививками 20 сут; III (50 гол.) — контроль (не проводили иммунизацию). У всех животных отбирали пробы крови и определяли наличие специфических противопастереллезных и противосальмонеллезных антител методом ИФА до вакцинации, через 21 сут, а также через 3, 5 и 7 мес после вакцинации.
Напряженность иммунитета к соответствующему инфекционному агенту, то есть способность организма противостоять провоцирующему (контрольному) заражению патогенными бактериями в заведомо летальной дозе, определяли у новорожденных поросят, разделенных в зависимости от возраста (10, 20, 30 и 42 сут) на четыре группы по 8 гол. в каждой. При этом использовали односуточную бульонную культуру P. multocida (внутримышечные инъекции) и концентрированную агаровую культуру S. choleraesuis (внутрибрюшинные инъекции) соответственно в дозах 4,6 и 10,3 lg КОЕ.
Титр гуморальных антител в крови переболевших (реконвалесцентных) животных может служить критерием оценки напряженности специфического иммунитета при сравнении с поствакцинальным ответом при ИФА. Для определения количества гуморальных постинфекционных антител поросят, распределенных на пять групп (по 2 гол. в каждой), заражали односуточной бульонной культурой S. сholeraesuis в объеме 1 см3 (внутримышечные инъекции с внутренней стороны бедра) при различных концентрациях бактерий. Пробы сывороток отбирали еженедельно в течение 30 сут.
1. Титр гуморальных специфических антител в сыворотке крови свиней крупной белой породы в зависимости от дозы вирулентной культуры Salmonella choleraesuis (штамм 370)
|
Доза, lg КОЕ |
Через 21 сут после заражения |
|
0 (контроль) |
375 |
|
3 |
1500 |
|
6 |
8674 |
|
8 |
9000 |
|
10 |
9000 |
Для оценки динамики образования колостральных антител за 40-45 сут до опороса свиноматок ( n = 4) иммунизировали однократно ассоциированной вакциной, которую вводили в объеме 1 см3 внутримышечно в области верхней трети шеи. Контролем служили неим-мунизированные свиноматки ( n = 2) с аналогичным сроком супоросности. У потомства на 1, 10, 20, 30 и 42-е сут отбирали пробы крови и проводили ИФА.
Результаты. Титры сыворотки крови незараженных животных в контроле в течение всего периода наблюдения, а также в опыте в течение первых 2 нед после заражения S. choleraesuis в дозах 3 и 6 lg КОЕ не превышали
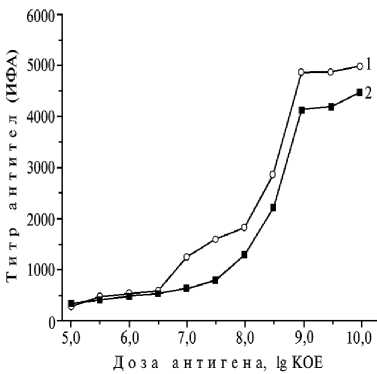
Рис. 1. Титр антител в сыворотке крови 40-суточных поросят крупной белой породы, иммунизированных инактивированными антигенами Pasteurella multocida (штамм 656) (1) и Salmonella choleraesuis (штамм 370) (2) в разных дозах .
пороговых значений. На 21-е сут титры существенно возрастали (табл. 1).
В течение первой недели после заражения культурой в дозе 8-10 lg КОЕ титр сыворотки крови поросят увеличивался от 0 до 3000 и выше, в последующие 3 нед — оставался неизменным ( ∼ 9000), что свидетельствует о защитной реакции организма животных. Содержание противосальмонеллезных и проти-вопастереллезных антител в сыворотке крови всех животных до иммунизации, которое определяли методами РА, РНГА и ИФА, не превышало фоновых значений. Через 21 сут после иммунизации инактивированными бактериями S. cho-leraesuis в дозах более 8,0 lg КОЕ количество проти-восальмонеллезных ан-тител повышалось, при дозе 9 lg КОЕ титр составлял 4500-4600 (рис. 1).
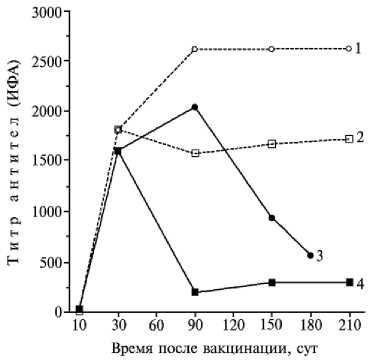
Рис. 2. Динамика образования специфических антител к Pasteurella multocida (1, 2) и Salmonella choleraesuis (3, 4) в сыворотке крови 25-суточных поросят крупной белой породы при одно- (2, 4) и двукратной (1, 3) иммунизации ассоциированной вакциной .
В сыворотке крови всех животных до и после иммунизации культурой инактивированных бактерий P. multocida в дозах 5,0-6,5 lg КОЕ титр антител не превышал фоновых значений; при дозах 9,0-10,0 lg КОЕ — составлял 1500-5800; > 10,0 lg КОЕ — количество антител не увеличивалось. При иммунизации животных препаратами в дозах 7,0-10,0 lg КОЕ содержание гуморальных противопастереллезных антител было выше, чем противосальмонеллезных.
При введении инактивированных бактерий S. choleraesuis и P. multocida в дозе 9,0 lg КОЕ титры гуморальных антител в сыворотке крови животных достигали максимальных значений, которые сохранялись и при более высоких дозах препаратов. Для иммунизации животных были изготовлены образцы ассоциированной вакци- ны, в которую входили P. multocida и S. choleraesuis в концентрации соответственно 9,3 и 9,6 lg КОЕ. При однократной иммунизации 25-суточных поросят-сосунов количество противопастереллезных антител в крови животных I группы через 21 сут после вакцинации составляло 1807, титр не снижался в течение всего периода наблюдений (7 мес) (рис. 2). Максимальный титр противосальмонеллезных антител достигал 1596, затем постепенно снижался и через 3 мес после вакцинации не превышал 296, что было ниже порогового значения. У поросят II группы (двукратная иммунизация) титр противопастерел-лезных и противосальмонеллезных антител составлял соответственно 1807 и 1596, через 3 мес — 2611 и 2033. При этом первый показатель не снижался в течение всего периода наблюдений (7 мес), второй — постепенно уменьшался и составлял через 5 и 7 мес соот-
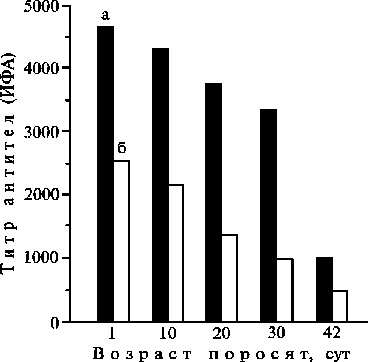
Рис. 3. Динамика образования колостральных антител к Salmonella choleraesuis (а) и Pasteurella multocida (б) в сыворотке крови поросят-сосунов крупной белой породы, рожденных от свиноматок, иммунизированных ассоциированной вакциной (0 – титр антител перед опоросом).
ветственно 935 и 564.
При иммунизации ассоциированной вакциной супоросных свиноматок не отмечено патоло-гических отклонений в период супоросности. Опорос прошел в ожидаемые сроки без осложнений как в контроле, так и в опыте; все новорожденные поросята были жизнеспособными и имели нормальное физиологическое развитие. Количество поросят в помете составляло в среднем 9 гол. на одну свиноматку. В сыворотке крови поросят в первые сутки жизни выявлено максимальное количество материнских антител против пастереллеза и сальмонеллеза
2. Оценка напряженности и продолжительности колострального иммунитета у поросят-сосунов крупной белой породы при контрольном заражении Pasteurella multocida (серовар В, штамм 656) и Salmonella choleraesuis (штамм 370)
|
Доза, |
Возраст поросят, сут |
|
|
lg КОЕ |
10 20 30 42 |
К о н т р о л ь
|
P. multocida |
4,6 |
0/2 |
0/2 |
0/2 |
0/2 |
|
S. choleraesuis |
10,3 |
0/2 |
0/2 |
0/2 |
0/2 |
|
О |
п ы т |
||||
|
P. multocida |
4,6 |
4/0 |
4/0 |
4/0 |
1/3 |
|
S. choleraesuis |
10,3 |
4/0 |
4/0 |
4/0 |
1/3 |
П р и м е ч а н и е. В числителе приведено количество выживших, в знаменателе — павших животных. Контроль — потомство невакцинированных самок.
(соответственно 2601 и 4685), в дальнейшем титры антител снижались и к 42-м сут достигали минимальных значений — соответственно 514 и 1037 (рис. 3).
При оценке напряженности и продолжительности колострального иммунитета животные, полученные от не-вакцинированных свиноматок (контроль), при заражении P. multocida погибали в течение 24-36 ч, S. choleraesuis — через 24 сут (табл. 2). Гибель поросят от пастереллеза и сальмонеллеза была подтверждена бактериологическими исследованиями. У поросят, полученных от однократно вакцинированных против пастереллеза и сальмонеллеза свиноматок, напряженность колострального иммунитета
сохранялась до 30-суточного возраста.
Таким образом, титры гуморальных антител свиней, иммунизированных
эмульсионными вакцинами, содержащими инактивированные димером этиленимина бактерии Salmonella choleraesuis (штамм 370) и Pasteurella multocida (серовар В, штамм 656), оказались ниже, чем у реконвалесцентов. При этом противопастереллез-ные антитела сохраняются в течение всего периода наблюдений (7 мес) при одно- и двукратной вакцинации, противосальмонеллезные антитела — в течение соответственно 90 и 150 сут. В крови поросят-сосунов в первые сутки жизни содержится такое же количество колостральных антител, как и у однократно вакцинированных свиноматок, что создает защиту от пастереллеза и сальмонеллеза в течение 30 сут.
Л И Т Е Р А Т У Р А
-
1. Г а р а е в И.М. Ассоциированные инфекции у свиней в промышленных комплексах. Сб. науч. тр. ВГНКИ, 1996, 59: 116-117.
-
2. Ш а п о ш н и к о в а Е.К. Этиология и вакцинопрофилактика пастереллеза свиней. В сб.: Совершенствование методов государственного контроля ветеринарных препаратов. М., 1991: 158-159.
-
3. B r i t o J.B., P i f f e r I.A., W e n t z I. e.a. Capsular types and toxin production by strains of P. multoci-da isolated from pigs in Southern Brazil. Rev. Micribiol., 1993, 24, 2: 94-97.
-
4. A b d u l l a h i V.Z., G i l m o u r N.J.L., P o x t o n I.R. Outer membrane protein of bovine strain of Pasteurella multocida type A and their doubtful role as protective antigens. J. Med. Microbiol., 1990, 32: 5561.
-
5. С т е п а н о в Г.В. Одновременная вакцинация телят против пастереллеза, сальмонеллеза и трихофитии. В сб.: Ветеринарная наука — производству. Минск, 1992, 30: 45-49.
-
6. Р у с а л е е в В.С. Разработка инактивированных вакцин против сальмонеллеза и пастереллеза свиней. В сб.: Современные аспекты патологии животных. Владимир, 1999: 141-144.
-
7. М а л а х о в Ю.А. Биопрепараты для специфической профилактики, диагностики и лечения при сальмонеллезе, лептоспирозе и эшерихиозе. В сб.: Совершенствование методов государственного контроля ветеринарных препаратов. М., 1991: 14-16.
-
8. Б у ш у е в а Н.Б., Р а е в с к и й А.А., А н и с и м о в а Л.В. и др. Разработка технологии культивирования и инактивации бактерий при изготовлении ассоциированной вакцины против стрептококко-за, гемофилеза и пастереллеза свиней (Полипневмовак). В сб.: Научные основы производства биологических препаратов. Щелково, 2000: 139-140.
-
9. Б о р и с е н к о в а А.Н. Производственные испытания инактивированной сорбированной вакцины ВНИВИП против пастереллеза птиц. В сб.: Система мероприятий по обеспечению эпизоотического благополучия и эффективности птицеводческих хозяйств промышленного типа. М., 1986: 51-52.
-
10. З а е р к о В.И., С и т ь к о в В.И., Т у т о в И.К. Совершенствование специфической профилактики пастереллеза. Ветеринария, 2000, 6: 20-22.
-
11. Р у с а л е е в В.С., Г н е в а ш е в В.М., П р у н т о в а О.В. Бактериальные вакцины в свиноводстве. Ветеринария, 2001, 6: 18-21.
-
12. П р у н т о в а О.В., Р у с а л е е в В.С., Г н е в а ш е в В.М. и др. Инактивация сальмонелл димером этиленимина. Биотехнология, 2001, 6: 43-46.
-
13. П р у н т о в а О.В., Р у с а л е е в В.С., Г н е в а ш е в В.М. Применение ИФА для выявления про-тивосальмонеллезных антител у свиней. Ветеринария, 2001, 12: 18-20.
Всероссийский НИИ защиты животных ,


