Антимикробная резистентность возбудителей осложненной инфекции верхних мочевых путей. Результаты ретроспективного исследования в национальном госпитале Кыргызской Республики
Автор: Усупбаев А.Ч., Кабаев Б.А., Иманкулова А.С., Садырбеков Н.Ж., Кожомкулова К.А., Кравцов А.А.
Журнал: Экспериментальная и клиническая урология @ecuro
Рубрика: Мировая урология
Статья в выпуске: 3, 2019 года.
Бесплатный доступ
Актуальность. Одной из актуальных проблем современной урологии и нефрологии является осложненная инфекция верхних мочевых путей (пиелонефрит) (ОИВМП), возникающая на фоне нарушения оттока мочи. Этиология ОИВМП характеризуется мультифакторностью. Материалы и методы. Проведенное ретроспективное исследование в Республиканском научном центре урологии при Национальном Госпитале Министерства Здравоохранения Кыргызской Республики (РНЦУ при НГ МЗ КР) показало, что основными возбудителями при ОИВМП являлись E. саИ (52,9%), Staphylococcus spp. (14,7%) и Enterococcus spp (9,2%). Проведен анализ фармакотерапии данного состояния. Результаты. В 85,7% случаев пациенты, до поступления в РНЦУ при НГ МЗ КР, получали в основном (52,9%) в-лактамные противомикробные препараты (ПМП), назначаемые нерационально. Это привело к тому, что у выделяемых E. coli, являющихся ведущим (52,9%) этиологическим патогеном осложненного пиелонефрита, был выявлен высокий уровень резистентности к ПМП, характеризующийся широкой распространенностью (61,1%) штаммов продуцентов в-лактамаз расширенного спектра (БЛРС). Наибольшую чувствительность выделенные возбудители осложненного пиелонефрита проявляли к фосфомицину и карбапенемам (меропенем и имипенем). Выводы. С целью профилактики нозокомиального распространения плазмидрезистентности в отделениях РНЦУ при НГ МЗ необходимо строгое соблюдение мер инфекционного контроля и применение принципов рациональной фармакотерапии.
Осложненный пиелонефрит, осложненная инфекция верхних мочевых путей, этиология возбудителей, антимикробная резистентность, противомикробные препаратов
Короткий адрес: https://sciup.org/142223155
IDR: 142223155 | DOI: 10.29188/2222-8543-2019-11-3-191-196
Текст научной статьи Антимикробная резистентность возбудителей осложненной инфекции верхних мочевых путей. Результаты ретроспективного исследования в национальном госпитале Кыргызской Республики
О Одной из актуальных проблем современной урологии и нефрологии являются инфекции мочевых путей (ИМП), и в особенности осложненная инфекция верхних мочевых путей (ОИВМП), возникающая на фоне нарушения оттока мочи любой этиологии – анатомических или структурных аномалий мочевой системы, сопутствующих хронических заболеваний (сахарный диабет, иммунодефицит, трансплантация почки и т.д.) [1-4]. В развитии осложненной инфекции мочевых путей (осложненного пиелонефрита) играют роль такие факторы, как камни любого отдела мочевых путей, новообразования, стриктуры лоханочно-мочеточникового сегмента и мочеточника, пузырно-мочеточниковый рефлюкс и др., инородные тела (уретральные и мочеточниковые катетеры и стенты, дренажи), предшествующие операции на почках и мочевыводящих путях или длительное нахождение в лечебном учреждении [4,5-7].
Этиология ОИВМП характеризуется мультифак-торностью, а основными возбудителями ее являются: E.coli (75–95%), Staphylococcus saprophyticus (5–10%), Enterobacteriaceae (кроме E. coli), реже Proteus mirabilis, Klebsiella pneumonia, Pseudomonas aeruginosa, а также другие коагулазоотрицательные стафилококки и грибы [1-4].
Лечение ОИВМП, как правило, начинают с эмпирического назначения противомикробных препаратов. Однако для того, чтобы начать противомикробную терапию необходимо полностью исключить и устранить окклюзию верхних мочевыводящих путей. Одним из грозных осложнений ОИВМП является уросепсис, который по данным N.M. Dreger и соавт. составляет 9-31% всех случаев сепсиса в Германии, со смертностью, равной 20-40%. Считается, что в связи со старением населения, смертность от уросепсиса будет расти [8].
При назначении антимикробной терапии при ОИВМП необходимо четко понимать, что антибиотики – это уникальный тип лекарственных средств, который имеет одну важную особенность – снижения клинической эффективности в течение определенного периода времени после начала применения, вследствие формирования устойчивости у возбудителей [9].
Резистентность к антимикробным препаратам может развиваться в результате естественного отбора посредством мутаций самих бактерий и выработки у них факторов защиты (продукция БЛРС – продукция бета-лактамаз расширенного спектра) и/или вследствие нерационального выбора антимикробного препарата. В настоящее время во всем мире устойчивость микробных агентов к антибактериальным препаратам принимает опасные масштабы и в ряде стран воздвигнута в ряд проблемы национального уровня [2,4,10].
Проблема антибиотикорезистентности в здравоохранении, и в урологии в частности, имеет несколько аспектов. Медицинский аспект связан с тем, что распро- странение резистентных микроорганизмов в стационарах приводит к ряду неблагоприятных для пациентов и системы здравоохранения последствий – увеличению сроков госпитализации и последующей реабилитации, повышению летальности, возрастанию затрат на лечение. Последний факт обуславливает внимание к экономическому аспекту, который требует применения резервных антибиотиков, стоимость которых выше традиционно используемых для лечения инфекций, вызванных чувствительными микроорганизмами. Социальный аспект заключается в росте заболеваемости, увеличении сроков нетрудоспособности лиц молодого и среднего возрастов, необходимостью дополнительного использования дорогостоящих препаратов на различных этапах лечения [4,5,9,10].
Всемирная организация здравоохранения (ВОЗ) для борьбы с резистентностью к антимикробным препаратам рекомендует организацию и рутинное проведение постоянного надзора в организациях здравоохранения [2,3,6,7,9,11,12]. На практике проведение такого рода надзора подразумевает использование микробиологических данных в конкретных регионах и в конкретном лечебном учреждении, получаемых на регулярной основе и направленных на выявление возбудителей инфекций у пациентов и определение чувствительности к антибиотикам.
Основной целью таких исследований является выявление приобретенной устойчивости к антимикробным препаратам, для решения двух основных задач – обоснование назначения оптимальной индивидуальной антимикробной терапии для конкретного больного и обоснование эмпирической антимикробной терапии для отдельных нозологических форм инфекционных болезней на основании данных надзора за антибиотикорези-стентностью.
Основной целью проведенного нами исследования являлось определение этиологической структуры возбудителей при осложненной инфекции верхних мочевых путей и их чувствительности к антимикробным препаратам для корректировки локальных протоколов их эмпирического назначения и в дальнейшем для снижения формирования антибиотикорезистентности.
МАТЕРИАЛЫ И МЕТОДЫ
Исследование, которое по дизайну являлось ретроспективным описательным, проводилось на базе Республиканского научного центра урологии Национального госпиталя при Министерстве здравоохранения Кыргызской Республики (РНЦУ НГ МЗ КР) в период с октября 2017 по март 2018 года. Данное исследование является начальным этапом внедрения в практику НГ МЗ КР системы надзора за антибиотикорезистентностью. Объектом исследования были данные бактериологических исследований мочи, взятых до начала противомик- робной терапии у 273 пациентов с ОИВМП, получавших консервативную противомикробную терапию в отделениях урологического профиля НГ МЗ КР. Данные были получены из сформированной в НГ МЗ КР в программе WHONET базы данных по резистентности возбудителей инфекций к антимикробным препаратам у пациентов РНЦУ НГ МЗ КР. Выделение бактерий и определение их чувствительности диско-диффузионным методом проводилось в аккредитованной бактериологической лаборатории Департамента профилактики заболеваний и Государственного санитарно-эпидемиологического надзора Кыргызской Республики. На всех пациентов, участвующих в исследовании, заполнялись индивидуальные регистрационные карты, в которых была отражена необходимая клиническая информация.
Для анализа полученных цифровых данных, использовали стандартные статистические методы [13].
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
В результате проведенного исследования нами было выявлено, что из 273 вошедших в исследование пациентов с ОИВМП, преобладали пациентки женского пола (84,9%), их средний возраст которых составлял 38,1 лет. Пациентов мужского пола было 15,1%, средний возраст составлял 39,4 лет.
Проведенный анализ факторов, способствующих развитию осложненной инфекции мочевых путей у 273 пациентов показал, что преобладающим фактором являлась обструкция мочевыводящей системы (МВС), на втором месте было наличие у пациентов постоянного стента/катетера, на третьем месте – хирургические вмешательства на органах ВМП в анамнезе (табл. 1).
Нами было выявлено, что 85,3% (233/273) пациентам, с диагнозом осложненной инфекции мочевых путей, назначалась противомикробная терапия до их поступления в РНЦУ НГ МЗ КР, так как они находились на амбулаторном или стационарном лечении в других медицинских учреждениях. Рациональность выбранной тактики оценить не удалось. При сборе анамнеза в момент поступления врачи РНЦУ НГ МЗ КР выясняли, какие антимикробные препараты получали пациенты. В ходе опроса было выявлено, что наиболее часто пациентам назначали β-лактамные антибиотики (55 пациентов получали – цефтриаксон, 27 – ампициллин, 23 – цефазолин, 19 – цефтриаксон/сульбактам), 59 пациентов получали нитрофурантоин и 19 пациентов получали гентамицин, а 31 утверждали, что получали антибиотики, однако затруднились ответить, какие именно (рис. 1).
При этом как видно из рисунка 1, наиболее часто (41,6%) в рутинной практике, как в стационарах, так и в поликлиниках назначались антибиотики из группы цефалоспоринов, которые при нерациональном их использовании наиболее часто приводят к формированию резистентности у условно-патогенных бактерий собственной флоры пациента, в основном являющихся возбудителями инфекций ВМП.
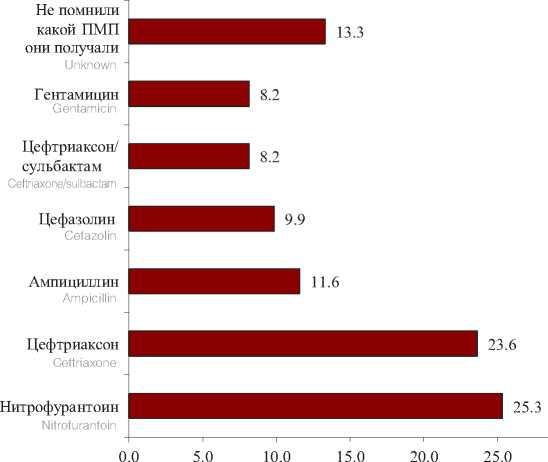
Рис. 1. Структура назначаемых ПМП, пациентам с ВОП до их поступления в РНЦУ НГ МЗ КР
Fig. 1. The structure of prescribed PMP for patients with GP before they are admitted to the RSCU NG MH KR
Таблица 1. Частота осложнений и факторов, способствующих развитию ВОП у исследуемых пациентов
Table 1. The influence of preoperative bacteriuria on the development of SSVR in the postoperative period
|
Осложнения / факторы, способствующие развитию острого пиелонефрита Complications / factors contributing to the development of acute pyelonephritis |
Количество пациентов Number of patients |
||
|
абс. abs. |
% |
||
|
Обструкция МПС |
Urinary tract obstruction |
84 |
30,8 |
|
Наличие постоянного катетера/стента |
Presence of a permanent catheter / stent |
51 |
18,7 |
|
В анамнезе операции на МПС |
History of surgery on urinary tract |
40 |
14,7 |
|
Аномалии развития МПС |
Anomalies in the development of urinary tract |
34 |
12,5 |
|
В анамнезе острый пиелонефрит в течение года |
A history of acute pyelonephritis during the year |
34 |
12,5 |
|
Сопутствующие заболевания (сахарный диабет и др.) Concomitant diseases (diabetes mellitus, etc.) |
30 |
11,0 |
|
|
Всего |
Total |
273 |
100,0 |
Далее нами были проанализированы данные бактериологического исследования мочи. В результате было выявлено, что наиболее часто из мочи пациентов с осложненной инфекцией верхних мочевых путей выделялись бактерии семейства Enterobacteriaceae 50,5% (138/273), на втором месте – 22,0% (60/273) находились грамположительные кокки (стафилококки, стрептококки и энтерококки), в 14,7% (40/273) выделялись синегнойная палочка – Pseudomonas aeruginosa, грибы рода Candida или ассоциации микроорганизмов, а в 12,8% (35/273) случаев микроорганизмы не были выделены. Таким образом, в этиологической структуре возбудителей ОИВМП лидирующее место занимала E. сoli, что согласуется с мировыми литературными данными [1,7]. Затем в этиологической структуре преобладали Staphylococcus spp. и Enterococcus spp. Менее значимыми являлись грибы рода Candida и Klebsiella spp. Реже выделись Ps. aeruginosa, Streptococcus spp. и S. aureus (табл. 2).
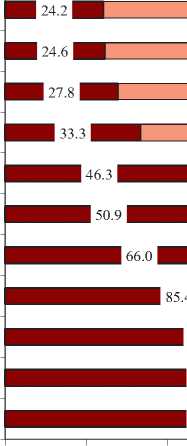
Нами был проведен анализ чувствительности к антибиотикам этиологически значимых возбудителей ОИВМП. В результате проведенного анализа чувствительности бактерий семейства Еnterobacteriaceae, как основных возбудителей, было выявлено, что наибольшую чувствительность выделенные штаммы E. coli проявляли к фосфомицину, меропенему и имипенему, и в меньшей степени к амикацину. При этом чувствительность к эр-тапенему, гентамицину и ципрофлоксацину была низкой и варьировала от 46,3% до 66,0%. Наименьшую чувствительность выделенные штаммы E. coli проявляли к β-лактамным антибиотикам, таким, как ампициллин, цефтазидим, цефепим, амоксициллин/клавулоновая кислота и цефотаксим (рис. 2).
Выявленная низкая чувствительность штаммов E. coli к β-лактамным антибиотикам обусловлена тем,
что 61,1% (77/126) выделенных штаммов являлись продуцентами β-лактамаз расширенного спектра (БЛРС).
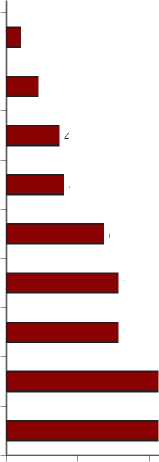
Штаммы Klebsiella spp., включая K. Pneumoniae, наибольшую чувствительность проявляли к меропенему и имипенему. В меньшей степени были чувствительны к амикацину, эртапенему, гентамицину и ципрофлоксацину. Аналогично штаммам кишечной палочки, выделенные Klebsiella spp. наименьшую чувствительность проявляли к β-лактамным антибиотикам, таким как ампициллин, цефепим, цефтазидим и амоксициллин/клавулановая
10.0
Эртапенем Еrtapenem
Имипенем Imipenem
Цефтазидим Ceftadizim
Фосфомицин
Fosfomycin
Амоксициллин/ клавуланавая кислота amoxicillin/ clavulanic acid
Ципрофлоксацин
Сiprofloxacin
96.6
100.0
100.0
R
S
90.0
75.8
75.4
72.2
66.7
53.7
49.1
34.0
14.6
3.4
0.0
0.0
Рис. 2. Чувствительность и резистентность к ПМП выделенных штаммов
E. coli (n=126)
Fig. 2. Sensitivity and risistance to PMP of isolated strains of E. coli (n = 126)
Таблица 2. Этиологическая структура возбудителей ОИВМП
Table 2. Etiological structure of pathogens of complicated infection of urinary tract infection
Количество выделенных штаммов The number of selected strains
|
абс. abs. |
% |
Микроорганизмы Microorganisms
E. coli 126 46,2
|
Staphylococcus spp. |
35 |
12,8 |
|
Enterococcus spp. |
22 |
8,1 |
|
Candida spp |
14 |
5,1 |
|
Klebsiella spp. (включая K. pneumoniae ) |
12 |
4,4 |
|
Ps. Аeruginosa |
5 |
1,8 |
|
Streptococcus spp. |
2 |
0,7 |
|
S. aureus |
1 |
0,4 |
|
Ассоциации микроорганизмов Association of microorganisms |
21 |
7,7 |
|
Отрицательные результаты исследования мочи Negative urine test results |
35 |
12,8 |
|
Всего Total |
273 |
100,0 |
ин
(рис. 3). При этом 16,7% (2/12) выделенных штаммов Klebsiella spp. продуцировали β-лактамазы расширенного спектра (БЛРС).
100.0
0.0
20.0
30.0
41.7
44.4
66.7
75.0
75.0
Цефепим Cefepim
Амоксициллин/ клавуланавая кислота amoxicillin/ clavulanic acid
Гентамицин
Gentamicin
Амикацин
Amiсacin
Меропенем Meropinem
100.0
100.0
80.0
70.0
58.3
55.6
33.3
25.0

25.0

0.0
0.0
SR
Рис. 3. Чувствительность и резистентность к ПМП выделенных штаммов
Klebsiella spp. (n=12)
Fig. 3. Sensitivity and risistance to PMP of isolated strains of Klebsiella spp. (n = 12)
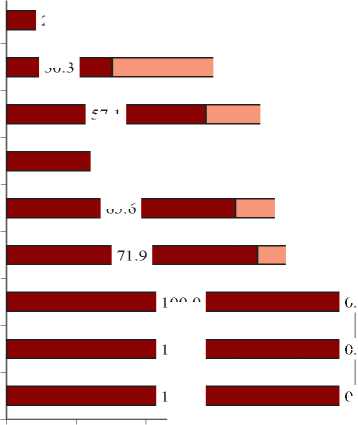
Анализ чувствительности к антибиотикам грамполо-жительных кокков, показал, что наибольшую чувствительность выделенные штаммы Staphylococcus spp. проявляли к меропенему, имипенему, и амоксициллину в комбинации с клавулановой кислотой. В меньшей степени штаммы Staphylococcus spp. проявляли чувствительность к клиндамицину, гентамицину, триметоприму и амикацину. Наименьшую чувствительность они проявляли к цефокситину и эритромицину (рис. 4).
Эритромицин Eritromicin
Цефокситин
Cefoxitin
Амикацин
Amicacin
Триметоприм Trimetoprim
Гентамицин
Gentamicin
Клиндамицин
Clindamicin
Имипенем
Imipenem
Амоксициллин/ клавуланавая кислота
Amoxicillin/clavulanic acid
Меропенем Meropenem
28.6
69.7
42.9
40.0
34.4
28.1
30.3
65.6
0.0
100.0
100.0
100.0
0.0
0 20 40 60 80 100
SR

71.4
57.1
60.0


0.0
Рис. 4. Чувствительность и резистентность к ПМП выделенных штаммов
Staphylococcus spp . (n=35)
Fig. 4. Sensitivity and risistance to PMP of isolated strains of Staphylococcus spp . (n = 35)
Выделенные Enterococcus spp. наибольшую чувствительность проявляли к гентамицину, тигециклинну и ванкомцину. При этом вызывает настороженность, что 4,8% штаммов Enterococcus spp. проявляли устойчивость к ванкомицину. Наименьшую чувствительность выделенные Enterococcus spp. проявляли к имипенему, норфлоксацину, ампициллину и триметоприму (рис. 5).
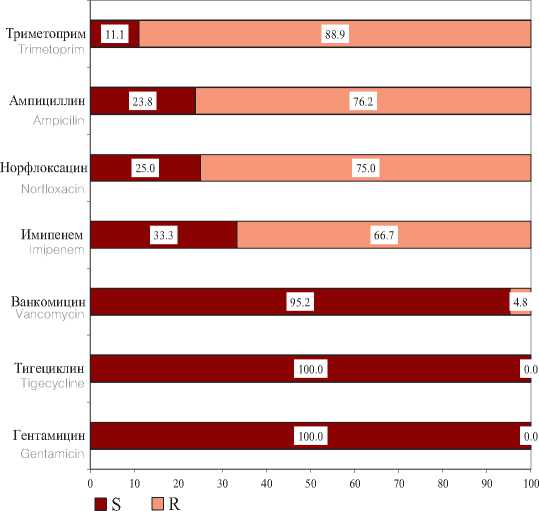
Рис. 5. Чувствительность и резистентность к ПМП выделенных штаммов Enterococcusspp. (n=22)
Fig. 5. Sensitivity and risistance to PMP of isolated Enterococcusspp strains. (n = 22)
Таким образом, проведенное ретроспективное исследование показало, что основными выделяемыми возбудителями при остром осложненном пиелонефрите являлись E. сoli, Staphylococcus spp. и Enterococcus spp.
Практически все пациенты до поступления в РНЦУ НГ МЗ КР получали противомикробную терапию, которую в основном (53,3%) проводили β-лактамными антибиотиками, которая не была расценена как рациональная, на что указывает высокий уровень антибиотико-резистентности, выявленный у основных возбудителей ОИВМП, а также выявленная продукция штаммами семейства Еnterobacteriaceae БЛРС.
ВЫВОДЫ
Опираясь на полученные данные, можно предположить, что для эмпирической противомикробной терапии ОИВМП, в РНЦУ НГ МЗ КР возможно использование фос-фомицина, а также карбапенемов (меропенем и имипенем). При этом необходимо с осторожностью использовать данную группу антимикробных препаратов, так как она является резервной и применяется для лечения тяжелых случаев инфекционно-воспалительных заболеваний. Для получения более точных данных, о формировании списка препаратов выбора и резерва, необходимо продолжать проводимый мониторинг резистентности к антимикробным
препаратам с ведением компьютерной базы WHONET.
В связи с выявленным высоким уровнем распространения среди штаммов Еnterobacteriaceae продуцентов БЛРС, в отделениях РНЦУ НГ МЗ КР необходимо строгое соблюдение мер инфекционного контроля, направленных на снижение нозокомиального распространения плаз-мид-противомикробной резистентности. Такими мерами могут считаться:
-
1. Изоляция пациентов при выявлении у них инфекции, возбудитель которой является продуцентом БЛРС;
-
2. При оказании медицинской помощи данным пациентам, медицинский персонал должен соблюдать контактные меры предосторожности (антисептика рук, перчатки, индивидуальные для пациента стетоскопы, дезинфекция приборов и поверхность с которыми контактировал пациент и др.);
-
3. Использовать специализированные экспресс-тесты для выявления БЛРС в биологических жидкостях для скрининга штаммов продуцентов БЛРС и определения тактики стартовой эмпирической противомикроб-ной терапии.
Список литературы Антимикробная резистентность возбудителей осложненной инфекции верхних мочевых путей. Результаты ретроспективного исследования в национальном госпитале Кыргызской Республики
- Перепанова Т.С., Козлов Р.С., Руднов В.А., Синякова Л.А. Антимикробная терапия и профилактика инфекций почек, мочевыводящих путей и мужских половых органов. Федеральные клинические рекомендации. М.: ООО «Прима-принт», 2017. 72 с
- Кулмагамбетов И.Р., Сарсенбаева С.С., Рамазанова Ш.Х., Есимова Н.К. Современные подходы к контролю и сдерживанию антибиотикорезистентности в мире. Международный журнал прикладных и фундаментальных исследований 2015; (9-1): 54-59
- Рафальский В.В., Страчунский Л.С., Кречикова О.И., Эйдельштейн И.А., Ахметова Л.И., Бабкин П.А., и др. Резистентность возбудителей амбулаторных инфекций мочевыводящих путей по данным многоцентровых микробиологических исследований UTIAP-I и UTIAP-II. Урология 2004;(2):1-5
- Урология. Российские клинические рекомендации [под ред. Аляева Б.Г., Глыбочко П.В., Пушкаря Д.Ю.]. М., Медфорум, 2017. С 475-488
- Zhanel GG, Hisanaga TL, Laing NM, DeCorby MR, Nichol KA, Palatnik LP, et al. Antibiotic resistance in outpatient urinary isolates: final results from the North American Urinary Tract Infection Collaborative Alliance (NAUTICA). Int J Antimicrob Agents 2005;26(5):380-8. DOI: 10.1016/j.ijantimicag.2005.08.003
- Lohr J.W., Gowda A., Nzerue Ch.M. Pyelonephritis chronic. 2005. URL: http: // WWW: emedicine. medscape.com/article/245464-overview (дата обращения: 04.11.2015).
- Schaeffer AJ. Infection of urinary tract. In book Campbell's Urology. 2016. Vol. 1, P.239.
- Dreger NM1, Degener S, Ahmad-Nejad P, Wobker G, Roth S. Urosepsis-Etiology, Diagnosis, and Treatment. Dtsch Arztebl Int. 2015 Dec 4;112(49):837-47;
- DOI: 10.3238/arztebl.2015.0837
- Яковлев С.В. Стратегия применения антибиотиков в стационаре. Клиническая антибиотикотерапия 2001;(5-6):3-10.
- Зуева Л.П., Колосовская Е.Н. Обоснование необходимости мониторинга за антибиотикорезистентностью микроорганизмов. Terra Medica Nova 2006;(3):62-6
- Tisher CC. Renal pathology with clinical and functional correlations. [Ed. Tisher C. Craig MD, Brenner BM.]. Lippicott Company, Philadelphia, 1994.
- Antimicrobial resistance: global report on surveillance 2014 https://www.who.int/ mediacentre/news/releases/2014/amr-report/ru
- Реброва О.Ю. Статистический анализ медицинских данных. Применение пакета прикладных программ STATISTICA. М.: Медиа Сфера, 2002. 312 с.


