Антиоксидантная терапия в коррекции ДНК-фрагментации сперматозоидов
Автор: Агавердиев Б.Н., Асфандияров Ф.Р., Круглов В.А., Сеидов К.С., Волынская Е.В.
Журнал: Экспериментальная и клиническая урология @ecuro
Рубрика: Андрология
Статья в выпуске: 2 т.17, 2024 года.
Бесплатный доступ
Введение. Прогрессирующее ухудшение репродуктивной функции, отмечаемое во всем мире в последние десятилетия, является крайне тревожной тенденцией, при этом частота мужского бесплодия увеличивается. Универсальным патогенетическим механизмом нарушений сперматогенеза, лежащим в основе практически всех форм мужского бесплодия, является окислительный стресс сперматозоидов. Он имеет различные проявления, суть которых, как правило, сводится к формированию митохондриальной дисфункции и фрагментации ДНК сперматозоидов. Установлено, что употребление в пищу антиоксидантов и микроэлементов способствует повышению шансов на зачатие у субфертильных пар, а также снижает риск репродуктивных потерь. Наибольший и вполне обоснованный интерес представляют лекарственные комплексы, призванные снижать уровень оксидативного стресса и фрагментацию ДНК сперматозоидов. Цель исследования оценить влияние антиоксидантной терапии на степень фрагментации ДНК сперматозоидов у мужчин, страдающих бесплодием.
Мужское бесплодие, окислительный стресс, фрагментация днк сперматозоидов, бестфертил-дгк, антиоксидантная терапия
Короткий адрес: https://sciup.org/142242614
IDR: 142242614 | DOI: 10.29188/2222-8543-2024-17-2-26-34
Текст научной статьи Антиоксидантная терапия в коррекции ДНК-фрагментации сперматозоидов
экспериментальная и клиническая урология № 2 2024
По определению Всемирной организации здравоохранения (ВОЗ), здоровье – это всеобъемлющее понятие, неотъемлемой составляющей которого, безусловно, является репродуктивный потенциал человека [1].
Прогрессирующее ухудшение репродуктивной функции, отмечаемое во всем мире в последние десяти-летия,является крайне тревожной тенденцией.
По данным доклада, опубликованного ВОЗ 4.04.2023 г., с проблемой бесплодия в течение жизни сталкивается очень большое число людей. Бесплодием страдает около 17,5% взрослого населения, то есть примерно каждый шестой человек в мире [2]. В России в 2023 г. было зарегистрировано 35820 мужчин (68,1 на 100000 населения) с диагнозом бесплодие в [3]. Данная ситуация выходит далеко за рамки сугубо медицинской проблемы, так как опасна значительным сокращением численности населения уже в краткосрочной перспективе [4].
В последние десятилетия произошло значительное переосмысление роли мужского фактора в структуре причин семейного бесплодия. Понимание важности мужского фактора специалистами-андрологами находит свое отражение в колоссальных усилиях, направленных на изучение и консервативную коррекцию мужской инфертильности. Однако результаты этой работы далеки от удовлетворительных [5, 6].
В повседневной врачебной практике нередко прослеживается достаточно поверхностное понимание проблемы, в силу чего преобладает узконаправленный взгляд на мужское бесплодие. Так, врачи достаточно успешно выявляют заболевания половой системы, которые ассоциируются с бесплодием, и проводят их лечение. Но это не дает должного эффекта, так как не учитываются глобальные факторы и механизмы, приводящие к мужскому бесплодию. По современным представлениям наиболее масштабным и универсальным патогенетическим механизмом,лежащим в основе подавляющего большинства форм мужского бесплодия, является окислительный стресс сперматозоидов [7].
Суть этого процесса заключается в нарушении баланса образования активных форм кислорода (АФК) и способности организма нейтрализовывать промежуточные продукты окислительных реакций. В результате возникают различные клеточные повреждения.Спер-матозоиды характеризуются повышенной чувствительностью к окислительному стрессу – их мембраны содержат большое количество жирных кислот, которые в первую очередь повреждаются при воздействии АФК Вследствие нарушения целостности и проницаемости мембран возникает митохондриальная дисфункция и повреждение ДНК (фрагментация ДНК). Это негативно влияет на оплодотворяющую способность сперматозоидов (которая может быть снижена даже при формальной сохранности показателей эякулята), а так же результаты протоколов экстракорпорального оплодо-творения/интрацитоплазматической инъекции сперматозоидов (ЭКО / ИКСИ) (рис. 1).
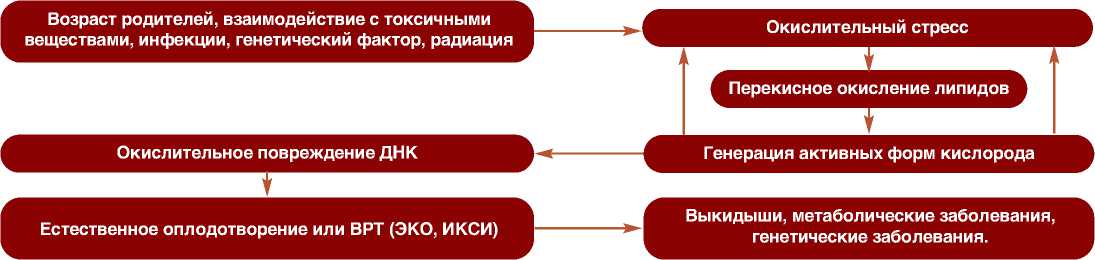
Рис. 1. Последствия окислительного стресса
Fig. 1. Сonsequences of oxidative stress
Кроме того,снижение оплодотворяющей способности сперматозоидов не исчерпывает проблему,т к. невынашивание беременности также входит в понятие бесплодия и также может быть обусловлено мужским фактором [8-10].
Сейчас становится очевидным, что повышение уровня фрагментации ДНК сперматозоидов на фоне окислительного стресса является одной из возможных причин прерывания беременности.
Фрагментация ДНК сперматозоидов,как относительно новая причина мужского бесплодия,привле-кает внимание исследователей в последнее десятилетие [11]. Повреждение ДНК проявляется возникновением разрывов одной или обеих цепей молекулы ДНК [12–14]. Очевидно, что процесс развития сперматозоидов – это сложный,многостадийный процесс,крайне чувствительный к воздействию гормональных,генети-ческих и целого ряда иных факторов и их комбинаций. В целом считается,что возникновение разрывов связано с изменением структуры хроматина в процессе сперматогенеза, хотя точные патофизиологические механизмы, лежащие в основе этих изменений, еще только изучаются [15-17].
Организация генетического материала сперматозоидов весьма существенно отличается от таковой во всех остальных клетках организма за счет присутствия негистоновых белков-протаминов, обеспечивающих значительно более высокую плотность упаковки хроматина [18]. Столь плотная упаковка приводит к меньшему в несколько раз объему ядра сперматозоида по сравнению с соматической клеткой.
Количество белков-протаминов, замещающих гистонные белки, оценивается в 85%. Оставшиеся 15% гистонных белков располагаются в последовательностях ДНК,которые доступны для транскрипции непосредственно сразу после оплодотворения [19].
Собственно, возникновение разрывов необходимо для раскручивания нитей ДНК и происходит с участием топоизомераз в процессе ремоделирования хроматина.Происходит этот процесс на этапе пост-мейотического созревания, но в последующем, в норме, происходит репарация разрывов ДНК и лигирование при участии транзиторных белков [20, 21]. Если этот механизм нарушается, то в процессе ремоделирования хроматина сохраняются нерепарированные разрывы ДНК, которые и являются главным источником фрагментации ДНК в зрелых сперматозоидах [22, 23].
При окислительном стрессе главной мишенью АФК является ДНК сперматозоида на различных этапах его созревания. Окисление оснований ДНК вносит модификации, дестабилизирующие структуру макромолекулы, что приводит к появлению/сохранению разрывов.
Хорошо известно,что для сперматозоида доминирующей является внеклеточная антиоксидантная за- щита, так как в силу высокой специализации сперматозоид обладает минимальным количеством цитоплазмы. Снижение уровня антиоксидантов в секретах половых желез ведет к нарастанию уровня окислительного стресса и увеличению количества повреждений структуры ДНК сперматозоидов и, как следствие, к снижению мужской фертильности [24].
Высокий уровень фрагментации ДНК сперматозоидов слабо соотносится с основными параметрами спермограммы – количество,подвижность и морфология сперматозоидов,но может критически влиять на начальные этапы эмбрионального развития,особенно на формирование бластоцисты и частоту наступления беременности в циклах ЭКО/ИКСИ [11, 12]. В силу этого использование классической процедуры анализа спермы, рекомендованной ВОЗ в 2010 г., не позволяет выявить ультраструктурные изменения сперматозоидов, ответственные за нарушения эмбрионального развития. В настоящее время необходима оценка дополнительных параметров эякулята и, в первую очередь, – уровня фрагментации ДНК сперматозоидов [14, 15].
Таким образом, повышение уровня фрагментации ДНК сперматозоидов имеет непосредственное отношение к проблеме мужского бесплодия.
В настоящее время на фармацевтическом рынке присутствует большое количество лекарственных комплексов, компоненты которых обладают антиоксидантной активностью и теоретически способны препятствовать фрагментации ДНК сперматозоидов. Известно, что употребление в пищу антиоксидантов и микроэлементов способствует повышению шансов на зачатие для субфертильных пар, а также снижает риск репродуктивных потерь [8, 9].
Цель настоящего исследования – оценить влияние антиоксидантной терапии на степень фрагментации ДНК сперматозоидов у мужчин, страдающих бесплодием.
МАТЕРИАЛЫ И МЕТОДЫ
В исследовании участвовали 42 мужчины в возрасте от 25 до 37 лет, проходившие лечение в ГБУЗ АО «Центр охраны здоровья семьи и репродукции» с диагнозом мужское бесплодие. Пациенты обращались с жалобами на отсутствие беременности,либо замершую на ранних сроках беременность у супруги (половой партнерши). В 6 случаях в анамнезе были неудачные попытки использования вспомогательных репродуктивных технологий.
Стандарт обследования включал:сбор анамнеза, клинический осмотр,оценку гормонального и инфекционного статуса (исследование мазка из уретры методом полимеразной цепной реакция – ПЦР), ультразвуковое исследование (УЗИ) органов мошонки, трансректальное УЗИ предстательной железы,биохи-мический анализ крови,консультацию генетика.
Сбор и анализ эякулята проводили в соответствии с рекомендациями ВОЗ 2010 г. [15]. Период воздержания от половых контактов составлял от 4 до 6 дней. За 2 недели до сдачи анализа исключались бани, сауны,употребление алкоголя и прием лекарственных препаратов. Сперму для исследования получали путем мастурбации.
Определялся качественный и количественный состав эякулята, включая морфологию сперматозоидов (определение доли нормальных форм сперматозоидов по строгим критериям Крюгера), уровень антиспермальных антител класса IgG методом прямого SpermMar-теста [14]. Также проводилось микробиологическое исследование эякулята.
Для оценки степени фрагментации ДНК была выбрана методика выявления дисперсии хроматина сперматозоидов (метод SCD – Sperm chromatin dispersion test).
Данный метод предполагает приготовление образца для исследования с количественной оценкой содержащихся в нем сперматозоидов,последовательную обработку образца реагентами с целью денатурации ДНК и экстракции ядерных белков, окрашивание образца красителем Райта и,наконец,микроскопическое исследование и оценку полученных результатов [16].
В SCD-тесте поврежденный фрагментацией хроматин сконцентрирован непосредственно вокруг ядра и имеет четкую границу. Неповрежденный хроматин распределяется вокруг ядра по большему радиусу, что при микроскопии окрашенного препарата проявляется характерными ореолами без четкой границы (рис. 2).
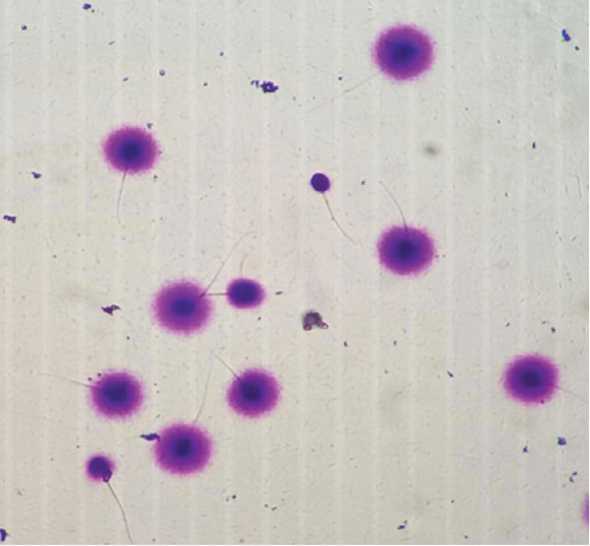
Рис. 2. Препарат эякулята, световая микроскопия. Сперматозоиды с целой ДНК (с ореолом дисперсии – «halo-эффект») и сперматозоиды с фрагментированной ДНК (без ореола)
Fig. 2. Ejaculate preparation, light microscopy. Spermatozoa with intact DNA (with a dispersion halo – «halo-effect») and sperm with fragmented DNA (without a halo)
Критериями включения в исследование явились: объем эякулята не менее 1,5 мл, концентрация сперматозоидов не ниже 15 млн/мл, подвижность сперматозоидов по категории «А+В» более 40%, нормальная морфология по Крюгеру более 4%.
Критериями исключения являлись воспалительные процессы и органические изменения в репродуктивной системе, андрогенодефицит, иные установленные формы бесплодия (MAR-test lgG <10%, синдром Клайнфельтера, микроделеции AZF-локуса, мутации гена CFTR), а также сопутствующие соматические заболевания в стадии декомпенсации.
Пациенты были разделены на 2 группы, сопоставимые по основным оцениваемым критериям.
Пациенты контрольной группы (12 человек, 29%) получали стандартную антиоксидантную терапию – витамин E по 34 мг (200 IU) в сутки, витамин А по 10000 МЕ в сутки и Убихинон (коэнзим Q10) – 100 мг в сутки.
Пациенты основной группы (30 человек, 71%) получали комплекс БЕСТФертил-ДГК®. Режим дозирования: 2 капсулы «УТРО» + 2 капсулы «ДГК» утром после завтрака и 2 капсулы «ВЕЧЕР» + 2 капсулы «ДГК» вечером после ужина. Курс лечения у пациентов обеих групп составлял 3 месяца.
Контрольные обследования проводились в сроки 1,5 и 3 месяца от начала терапии.
Основными критериями эффективности терапии являлись результаты оценки спермограммы по вышеописанной методике и степень фрагментации ДНК сперматозоидов методом SCD. Степень фрагментации ДНК менее 15% расценивали как норму.
Комплекс БЕСТФертил-ДГК® был выбран в качестве источника антиоксидантов,так как он характеризуется сбалансированным составом биологически активных веществ, микроэлементов и витаминов (табл. 1).
Важной особенностью комплекса БЕСТФертил-ДГК® является разделение компонентов на два приема: капсулы «УТРО»+«ДГК» и «ВЕЧЕР»+«ДГК» (табл. 2). Такой подход позволяем максимально оптимизировать эффекты комплекса за счет учета особенностей фармакокинетики и фармакодинамики компонентов,а также суточных ритмов организма человека.Например,жи-рорастворимые компоненты (токоферола ацетат, доко-загексаеновая кислота) могут нарушать всасывание в кишечнике минеральных веществ (цинк, селен), фолиевой и аскорбиновой кислот – поэтому их прием разделен по времени суток. С другой стороны, селен потенцирует действие коэнзима Q10, поэтому их целесообразно принимать одновременно. Гинсенозиды (экстракт женьшеня) обладают антиастеничеcким эффектом и их прием более целесообразен в первой половине дня.
Подобный учет нюансов взаимодействия компонентов не предусмотрен в других препаратах, использующихся при бесплодии.
Таблица 1. Содержание биологически активных компонентов в рекомендованной суточной дозе комплекса БЕСТФертил-ДГК ®
Table 1.Content of biologically active components in the recommended daily dose of the BESTFertil-DHA ® complex
|
Компонент Component |
Суточная доза (8 капсул), мг/мкг Daily dose (8 capsules), mg/mcg |
|
Сумма Омега-3 полиненасыщенных жирных кислот / Total Omega-3 polyunsaturated fatty acids |
2400,0 мг / mg |
|
Эйкозапентаеновая кислота Eicosapentaenoic acid |
1320,0 мг / mg |
|
Докозагексаеновая кислота Docosahexaenoic acid |
924,0 мг / mg |
|
L-карнитин L-carnitine |
не менее 480,0 мг not less than 480.0 mg |
|
L-аргинин L-arginine |
не менее 240,0 мг not less than 240.0 mg |
|
Токоферола ацетат Tocopherol acetate |
32,0 ± 6,0 мг / mg |
|
Глутатион Glutathione |
40,0 ± 6,0 мг / mg |
|
Гинсенозиды (Экстракт женьшеня) Ginsenosides (Ginseng Extract) |
не менее 26,0 мг not less than 26.0 mg |
|
Аскорбиновая кислота Ascorbic acid |
24,0 ± 6,0 мг / mg |
|
Коэнзим Q 10 Coenzyme Q 10 |
не менее 14,0 мг not less than 14.0 mg |
|
Фолиевая кислота Folic acid |
0,4 ± 0,14 мг / mg |
|
Цинк Zinc |
20,0 ± 4,0 мг / mg |
|
Селен Selenium |
30,0 ± 12,0 мкг / mcg |
РЕЗУЛЬТАТЫ
До лечения патологическую степень фрагментации ДНК в сперматозоидах (23-34%) диагностировали у 42 (100%) исследуемых пациентов.
У 16 пациентов (53%) после трех месяцев приема препарата БЕСТФертил-ДГК® степень фрагментации ДНК сперматозоидов уменьшилась до уровня менее 15%. На этом фоне у 5 пар произошла беременность естественным путем, у 4 пар – в результате проведения процедуры ЭКО.
В контрольной группе (n=12) степень фрагментации ДНК сперматозоидов в процессе лечения не претерпевала статистически значимых изменений.
Средний уровень фрагментации ДНК сперматозоидов через 3 месяца лечения снизился, был менее 13% ( р <0,05) и составил в среднем 10±1,8%. При этом снижение
Таблица 2. Качественный состав капсул комплекса БЕСТФертил-ДГК ®
Table 2.Qualitative composition of capsules of the BESTFertil-DHA ® complex
|
Компонент Component |
Капсула «УТРО» Capsule «MORNING» |
Капсула «ВЕЧЕР» Capsule «EVENING» |
Капсула «ДГК» DHA capsule |
|
L-аргинин L-arginine |
+ |
||
|
L-карнитин L-carnitine |
+ |
+ |
|
|
Аскорбиновая кислота Ascorbic acid |
+ |
||
|
Глутатион Glutathione |
+ |
||
|
Докозагексаеновая кислота Docosahexaenoic acid |
+ |
||
|
Коэнзим Q 10 Coenzyme Q 10 |
+ |
||
|
Омега-3 Omega-3 |
+ |
+ |
|
|
Селен Selenium |
+ |
||
|
Токоферола ацетат Tocopherol acetate |
+ |
||
|
Фолиевая кислота Folic acid |
+ |
||
|
Цинк Zinc |
+ |
||
|
Эйкозапентаеновая кислота Eicosapentaenoic acid |
+ |
||
|
Гинсенозиды (Экстракт женьшеня) Ginsenosides (Ginseng Extract) |
+ |
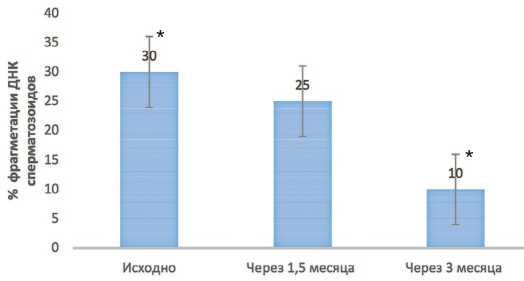
Рис. 3. Средний уровень фрагментации ДНК сперматозоидов до лечения, через 1,5 и 3 месяца лечения у пациентов основной группы. * р <0,05
Fig. 3. Average level of sperm DNA fragmentation before treatment, after 1.5 and 3 months of treatment in patients of the main group. * р <0,05
уровня фрагментации ДНК до 25% было отмечено у 53% больныхуже спустя 1,5 месяца приема БЕСТФертил-ДГК® Столь короткие сроки улучшения показателей особенно важны при подготовке пациентов к программам вспомогательных репродуктивных технологий (ВРТ), когда время лечения ограничено (рис. 3).
Также,у пациентов, принимающих БЕСТФертил-ДГК®, суммарная поступательная подвижность сперматозоидов «А+В»увеличилась на 28% ( р <0,05), а концентрация сперматозоидов в 1 мл эякулята – на 61% ( р <0,05).
Изменения показателей у пациентов контрольной группы были статистически недостоверны (табл. 3).
ОБСУЖДЕНИЕ
Полученные положительные результаты в отношении коррекции окислительного стресса сперматозоидов и степени фрагментации ДНК связаны с комплексным воздействием компонентов БЕСТФертил-ДГК® на процесс сперматогенеза.
L-карнитин является мощным ингибитором перекисного окисления липидов. Эпителий семенных канальцев и канальцев придатка яичка активно выделяет L-карнитин в просвет канальцев, что обуславливает создание в эпидидимальной плазме высокой его кон-центрации,в тысячи раз превышающей содержание в сыворотке крови. L-карнитин играет важнейшую роль в защите митохондрий сперматозоидов от продуктов свободнорадикального окисления. Результаты, содер- жащиеся в слепом рандомизированном контролируемом исследовании M. Plante и соавт., свидетельствуют, что L-карнитин значительно улучшает подвижность, морфологию и концентрацию сперматозоидов,одно-временно повышая уровни тестостерона и лютеинизирующего гормона [25].
L-аргинин является условно-незаменимой аминокислотой и обязательным компонентом NO-зависимых биологических механизмов,за счет чего играет роль положительного регулятора мужской репродуктивной функции. Физиологическая концентрация NO, создаваемая тестикулярными макрофагами, стимулирует стероидогенез в клетках Лейдига [18].
Коэнзим Q10 (Убихинон) – это жирорастворимый кофермент, представленный преимущественно в митохондриях эукариотических клеток, где он регулирует цепь переноса электронов. Обладает выраженным про-тективным действием в отношении АФК, предупреждая тем самым повреждения ДНК сперматозоидов. Кроме того, имеются данные о синергичном эффекте с другими антиоксидантами, такими как витамины Е и С, активность которых повышается в присутствии коэнзима Q10 Согласно литературным данным, уровни коэнзима Q10 в семенной плазме положительно линейно коррелируют с количеством сперматозоидов и их подвижностью [26].
Фолиевая кислота – это водорастворимый витамин, входящий в группу фолатов, которые могут иметь как натуральное,так и синтетическое происхождение При поступлении в организм фолиевая кислота и
Таблица 3. Показатели спермограммы и степень фрагментации ДНК у пациентов в процессе лечения Table 3. Spermogram indicators and the degree of DNA fragmentation in patients during treatment
|
Контрольная группа Control group |
Основная группа Main group |
||||
|
Показатель Index |
До лечения Before treatment |
Через 3 месяца наблюдения After 3 months of observation |
До лечения Before treatment |
Через 1,5 месяца от начала лечения After 1.5 months from the start of treatment |
Через 3 месяца от начала лечения After 3 months from the start of treatment |
|
Степень фрагментации ДНК сперматозоидов, % Degree of sperm DNA fragmentation, % |
28±4,6 |
26±3,8 |
28±4,6 |
19±1,6 |
10 ±1,8* |
|
Концентрация сперматозоидов, мл/мл Sperm concentration, ml/ml |
18,5 |
19,2 |
18,5 |
25,6 |
29,8* |
|
Доля сперматозоидов с поступательным движением (А+В), % Proportion of sperm with forward movement (A+B), % |
38,5 |
39,7 |
38,5 |
42,7 |
49,4* |
Примечание: * достоверность различия с исходными данными ( р <0,05)
Note: * reliability of difference with initial data ( р <0.05)
другие фолаты превращаются в биологически активные вещества, участвующие в метаболизме. Имеются данные об участии фолиевой кислоты в синтезе ДНК и предотвращении ее фрагментации.
Глутатион – еще один компонент комплекса с выраженными антиоксидантными свойствами. При этом глутатион не только защищает клетку от токсичных свободных радикалов, но и в целом определяет окислительно-восстановительные характеристики внутриклеточной среды. Применительно к рассматриваемой теме,содержание глутатиона ассоциируется с улучшением подвижности сперматозоидов и предотвращением повреждений их ДНК.
Селен – важнейший микроэлемент, участвующий в физиологических процессах,обеспечивающих антиоксидантную защиту. Недостаток селена ассоциируется с атрофией эпителия семенных канальцев, нарушениями сперматогенеза и созревания спермато-зоидов,снижением подвижности и ухудшением морфологии сперматозоидов. Ферменты, участвующие в синтезе тестостерона,содержат в своем составе селен. Клинические исследования у мужчин, страдающих бесплодием, показывают, что прием селена (50 мкг/день в течение 3 месяцев) значительно увеличивает количество и подвижность сперматозоидов, улучшают показатели их морфологии и жизнеспособность [27].
Аскорбиновая кислота способна нейтрализовать гидроксильные радикалы, а также радикалы супероксида и перекиси водорода,тем самым обеспечивая защиту от эндогенного окислительного повреждения.
Сравнительный анализ содержания аскорбиновой кислоты в семенной плазме продемонстрировал, что у фертильных и бесплодных мужчин оно существенно различается.Фертильные субъекты продемонстрировали более высокие уровни аскорбиновой кислоты в семенной жидкости,чем группа бесплодных мужчин.При этом уровень аскорбиновой кислоты в семенной жидкости у мужчин обеих групп положительно коррелировал с количеством морфологически нормальных сперматозоидов [28].
Витамин Е (α-токоферола ацетат) представляет собой жирорастворимое соединение, универсальный протектор клеточных мембран от окислительного повреждения. Его локализация в мембране препятствует контакту кислорода с ненасыщенными липидами мем-бран,что защищает их от перекисной деструкции.Ви-тамин Е играет важную роль в обеспечении взаимодействия между элементами антиоксидантной системы.
Необходимо отметить,что аналоги витамина Е, особенно токоферола сукцинат, который используется в некоторых других комплексах, могут оказывать неблагоприятное воздействие на межклеточную комму- никацию, что может объяснять их неоднозначное влияние на сперматогенез.
Цинк является важным микроэлементом, участвующим в метаболизме ДНК и РНК, экспрессии генов и регуляции апоптоза. Этот микроэлемент интегрируется в структуры хвоста сперматозоида во время сперматогенеза.Дефицит цинка индуцирует апоптоз клеток Лейдига,снижение уровня тестостерона и нарушение сперматогенеза.
Крупный метаанализ J. Zhao и соавт., обобщающий 20 исследований с общим количеством пациентов более 3000, демонстрирует снижение концентрации цинка в семенной плазме у бесплодных мужчин по сравнению с фертильными.Использование добавок цинка значительно увеличивало объем эякулята,по-движность сперматозоидов и процент нормальной морфологии сперматозоидов [29].
Докозагексаеновая кислота способствует нормализации состава клеточных мембран,что дает протек-тивный эффект в отношении фрагментации ДНК сперматозоидов и способствует увеличению их подвижности и выживаемости
Омега-3 полиненасыщенные жирные кислоты , в том числе эйкозапентаеновая и докозагексаеновая кис-лоты,входят в состав клеточных мембран всего организма человека и считаются одним из важнейших «кирпичиков» крепкого здоровья. Данные Омега-3 кислоты незаменимы,не вырабатываются в организме человека, и получить их можно только из пищи. Обладают противовоспалительным эффектом, увеличивают выработку мужских половых гормонов.
ЗАКЛЮЧЕНИЕ
В настоящем исследовании продемонстрирована высокая эффективность комплекса БЕСТФертил-ДГК® в отношении повышенного уровня фрагментации ДНК сперматозоидов.Средний уровень фрагментации снижался с 30% до 10% после 3-х месячного курса приема БЕСТФертил-ДГК®.
БЕСТФертил-ДГК® содержит все необходимые для повышения мужской фертильности активные ком-поненты.Разделение приема компонентов препарата позволяет в наибольшей степени реализовать положительное влияние биологически активных веществ, микроэлементов и витаминов на показатели спермо-граммы и степень фрагментации ДНК сперматозоидов
БЕСТФертил-ДГК® безопасен, не имеет побочных эффектов.
Полученные данные позволяют рекомендовать БЕСТФертил-ДГК® пациентам с бесплодием и повышенной степенью фрагментации ДНК сперматозоидов, в том числе в рамках прегравидарной подготовки к протоколам ЭКО и ИКСИ.
Список литературы Антиоксидантная терапия в коррекции ДНК-фрагментации сперматозоидов
- Grad FP. The Preamble of the Constitution of the World Health Organization. Bull World Health Organ 2002;80(12):981-4.
- Доклад ВОЗ от 23 апреля 2023 г. [WHO report of 23 April 2023] URL: https://www.who.int/ru/news/item/04-04-2023-1-in-6-people-globally-affected-by-infertility.
- Деев И.А., Кобякова О.С., Стародубов В.И., Александрова Г.А., Голубев Н.А., Оськов Ю.И., и др. М.: ФГБУ «ЦНИИОИЗ» Минздрава России, 2023. 168 с. Общая заболеваемость взрослого населения России в 2023 году. Статистические материалы. [Электронный ресурс] URL: https://mednet.rU/mediczinskaya-statistika#link-anchors-1. [Deev I.A., Kobyakova O.S., Starodubov V.I., Aleksandrova G.A., Golubev N.A., Oskov Yu.I., et al. M.: Federal State Budgetary Institution «TsNIIOIZ» of the Ministry of Health of Russia, 2023. 168 p. General morbidity rate of the adult population of Russia in 2023. Statistical materials. [Electronic resource] URL: https://mednet.ru/mediczinskaya-statistika#link-anchors-1. (In Russian)].
- Чалый М.Е., Ахвледиани Н.Д., Харчилава Р.Р. Мужское бесплодие. Урология 2016;(S1):2-17. [Chalyi M.E., Akhvlediani N.D., Kharchilava R.R. Male infertility. Urologiya = Urologiia 2016;(S1):2-17. (In Russian)].
- Jungwirth A, Diemer T, Kopa Z, Krausz C, Mihas S, Tournaye H. EAU guidelines on male infertility. 2018. [Electronic resource] URL: https://uroweb.org/guideline/male-infertility/#.
- Рутинский А.И. Особенности диагностики идиопатического мужского бесплодия (обзор литературы). Медико-сощальш проблеми родини 2013;18(1):116-21. [Rutinskii A.I. Features of diagnosis of idiopathic male infertility (literature review). Mediko-sotsialnye problemy sem'i= Medical and social problems of family 2013;18 (1):116-21. (In Russian)].
- Sabanegh EJ, Agarwal A. Male infertility. In: Campbell-Walsh urology. 10th ed. Eds.: M.E. Campbell, P.C. Walsh, A.J. Wein. Philadelphia: Saunders Elsevier, 2012. P. 616-647.
- El-Bahrawy K, El-Hassanein ES, Kamel YM. Comparison of gentamycin and ciprofloxacin in dromedary camels' semen extender. World J Agric Sci 2010;6:419-24.
- Fernández-Gonzalez R, Moreira PN, Pérez-Crespo M, Sánchez-Martín M, Ramirez MA, Pericuesta E, et al. Long-term effects of mouse intra-cytoplas-mic sperm injection with DNA-fragmented sperm on health and behavior of adult offspring. Biol Reprod 2008;78(4):761-72. https://doi.org/10.1095/ biolreprod.107.065623.
- Simon L, Liu L, Murphy K, Ge S, Hotaling J, Aston KI, et al. Comparative analysis of three sperm DNA damage assays and sperm nuclear protein content in couples undergoing assisted reproduction treatment. Hum Reprod 2014;29(5):904-17. https://doi.org/10.1093/humrep/deu040.
- Wong WY, Thomas CM, Merkus JM, Zielhuis GA, Steegers-Theunissen RP. Male factor subfertility: possible causes and the impact of nutritional factors. Fertil Steril 2000;73(3):435-42.
- Феськов А.М., Феськова И.А., Жилкова Е.С., Чумакова Н.А., Сомова Е.В. Исследование фрагментации ДНК сперматозоидов у мужчин с повышенным содержанием незрелых спермиев в эякуляте. Ceim медицины та бюлогй 2012;8(1):179-182. [Feskov O.M., Feskova I.A., Zhylkova I.S., Chumakova N.O., Somova O.V. Examination of sperm DNA fragmentation for patients with high content of immature form of spermatozoa in ejaculate. Mir meditsiny i biologii = World of Medicine and Biology 2012;8(1):179-182. (In Russian)].
- Simon L, Castillo J, Oliva R, Lewis SE. Relationships between human sperm protamines, DNA damage and assisted reproduction outcomes. Reprod Biomed Online 2011;23(6):724-34. https://doi.org/10.1016/ j.rbmo.2011.08.010.
- Dada R, Mahfouz RZ, Kumar R, Venkatesh S, Shamsi MB, Agarwal A, et al. A comprehensive work up for an asthenozoospermic man with repeated in-tracytoplasmic sperm injection (ICSI) failure. Andrologia 2011;43:5:368-372. https://doi.org/10.1111/j.1439-0272.2010.01045.x.
- WHO laboratory manual for the examination of human sperm and semen-cervical mucus interaction. 4nd ed. Cambridge: The Press Syndicate of the University of Cambridge, 1999.
- Маркова Е.В., Замай А.С. Фрагментация ДНК в сперматозоидах человека. Проблемы репродукции 2006;(4):42-50. [Markova Ye.V., Zamay A.S. DNA fragmentation in human spermatozoa. Problemy reproduktsii= Russian Journal of Human Reproduction 2006;(4):42-50. (In Russian)].
- Асфандияров Ф.Р., Абдулхакимов Э.Р., Абдулхакимова Ф.К., Выбор-нов С.В., Курбангалиева Н.Р., Новоженова Н.А. Опыт применения ан-тиоксидантов для улучшения показателей спермограммы при идиопатическом бесплодии у мужчин. Экспериментальная и клиническая урология 2019;(2):116-21. [Asfandiyarov F.R., Abdulkhakimov E.R., Abdulkhakimovа F.K, Vybornov S.V., Kurbangaliyeva N.R., Novozhenova N.A. Experience of using antioxidants to improve semen parameters in males with idiopathic infertility Eksperimentalnaya i klinicheskaya urologiya = Experimental and Clinical Urology 2019;(2):116-21 (In Russian)]. https://doi.org/10.29188/2222-8543-2019-11-2-116-120.
- Comhaire FH, Christophe AB, Zalata AA, Dhooge WS, Mahmoud AM, Depuydt CE. The effects of combined conventional treatment, oral antioxidants and essential fatty acids on sperm biology in subfertile men. Prostaglandins Leukot Essent Fatty Acids 2000;63(3):159-65. https://doi.org/1054/plef.2000.0174.
- Boissonneault G. Chromatin remodeling during spermiogenesis: a possible role for the transition proteins in DNA strand break repair. FEBS Letters 2002;514(2-3):111-4. https://doi.org/10.1016/s0014-5793(02)02380-3.
- Bench GS, Friz AM, Corzett MH, Morse DH, Balhorn R. DNA and total protamine masses in individual sperm from fertile mammalian subjects. Cytometry 1996;23(4):263-271. https://doi.org/10.1002/(SICI)1097-0320 (19960401)23:4<263::AID-CYT01-3.0.C0;2-I.
- Govin J, Caron C, Lestrat C, Rousseaux S, Khochbin S. The role of histones in chromatin remodelling during mammalian spermiogenesis. Eur J Biochem 2004;271(17):3459-3469. https://doi.org/10.1111/ j.1432-1033.2004.04266.x.
- Martínez-Soto JC, Domingo JC, Cordobilla B, Nicolás M, Fernández L, Albero P, et al. Dietary supplementation with docosahexaenoic acid (DHA) improves seminal antioxidant status and decreases sperm DNA fragmentation. Syst Biol Reprod Med 2016;62(6):387-95. https://doi.org/10.1080/19396368.2016.1246623.
- Kim Y.J., Chung H.Y. Antioxidative and anti-inflammatory actions of do-cosahe-xaenoic acid and eicosapentaenoic acid in renal epithelial cells and macrophages. J Med Food 2007;10(2):225-31. https://doi.org/10.1089/ jmf.2006.092.
- Oldereid NB, Angelis PD, Wiger R, Clausen OP. Expression of Bcl-2 family proteins and spontaneous apoptosis in normal human testis. Mol Hum Reprod 2001;7(5):403-8. https://doi.org/10.1093/molehr/7.5.403.
- Plante M, de Lamirande E, Gagnon C. Reactive oxygen species released by activated neutrophils, but not by deficient spermatozoa, are sufficient to affect normal sperm motility. Fertil Steril 1994;62(2):387-393. https://doi.org/10.1016/s0015-0282(16)56895-2.
- Nadjarzadeh A, Shidfar F, Amirjannati N, Vafa MR, Motevalian SA, Gohari MR, et al. Effect of Coenzyme Q10 supplementation on antioxidant enzymes activity and oxidative stress of seminal plasma: a double-blind randomised clinical trial. Andrologia 2014;46(2):177-83. https://doi.org/10.1111/and.12062.
- Lafuente R, Gonzalez-Comadran M, Solà I, Lopez G, Brassesco M, Carreras R, Checa MA. Coenzyme Q10 and male infertility: a meta-analysis. J Assist Reprod Genet 2013;30(9):1147-56. https://doi.org/10.1007/ s10815-013-0047-5.
- Ma L, Sun Y. Comparison of L-Carnitine vs. Coq10 and Vitamin E for idiopathic male infertility: a randomized controlled trial. Eur Rev Med Pharmacol Sci. 2022;26(13):4698-4704. https://doi.org/10.26355/ eurrev_202207_29194.
- Zhao J, Dong X, Hu X, Long Z, Wang L, Liu Q, Sun B, et al. Zinc levels in seminal plasma and their correlation with male infertility: A systematic review and meta-analysis. Sci Rep 2016;6:22386. https://doi.org/10.1038/ srep22386.


